
mesoblast 炎症性疾病异体细胞药物全球领导者 2023 年 8 月澳大利亚证券交易所:MSB;纳斯达克:截至2023年6月30日止年度的MESO财务业绩和运营更新

关于前瞻性陈述的警示说明本演示文稿包括与未来事件或我们未来财务业绩相关的前瞻性陈述,涉及已知和未知的风险、不确定性和其他因素,这些因素可能导致我们的实际业绩、活动水平、业绩或成就与这些前瞻性陈述所表达或暗示的任何未来业绩、活动水平、业绩或成就存在重大差异。我们根据1995年《私人证券诉讼改革法》和其他联邦证券法的安全港条款发表此类前瞻性声明。除本演示文稿中包含的历史事实陈述外,所有陈述均为前瞻性陈述。诸如但不限于 “相信”、“期望”、“预期”、“估计”、“打算”、“计划”、“目标”、“可能”、“可能”、“可能” 之类的词语以及类似的表达方式或短语来标识前瞻性陈述。这些前瞻性陈述主要基于我们当前的预期和未来事件、监管法的最新变化以及我们认为可能影响我们的财务状况、经营业绩、业务战略和财务需求的财务趋势。这些陈述可能涉及但不限于:对Mesoblast成体干细胞技术的安全性、有效性或潜在应用的期望;对Mesoblast知识产权实力的期望、Mesoblast的监管批准程序的时间表以及制造过程的可扩展性和效率;对Mesoblast业务增长能力的期望以及关于其与当前和潜在未来业务合作伙伴的关系以及这些合作伙伴的未来收益的声明关系;有关Mesoblast股价或潜在市值的声明;以及有关Mesoblast资本要求和未来筹集资金能力的声明等。不应将前瞻性陈述视为对未来业绩或业绩的保证,实际结果可能与这些前瞻性陈述中的预期结果有所不同,差异可能是重大的,也是不利的。您应在我们最近向美国证券交易委员会提交的报告中或在我们的网站上阅读本演示文稿以及我们的财务报表和相关附注以及风险因素。可能导致Mesoblast的实际结果、业绩或成就与此类陈述可能表达或暗示的结果、业绩或成就存在重大差异的不确定性和风险包括但不限于:潜在产品的开发和商业化固有的风险;临床试验结果或监管部门批准或许可的不确定性;政府监管;对未来资本的需求;对合作者的依赖;以及对我们知识产权的保护等。因此,您不应过分依赖这些前瞻性陈述。我们不承担任何义务公开更新或修改任何前瞻性陈述,无论是由于新信息、未来发展还是其他原因。

我们的使命 Mesoblast 致力于将创新的细胞药物推向市场,以治疗严重和危及生命的疾病
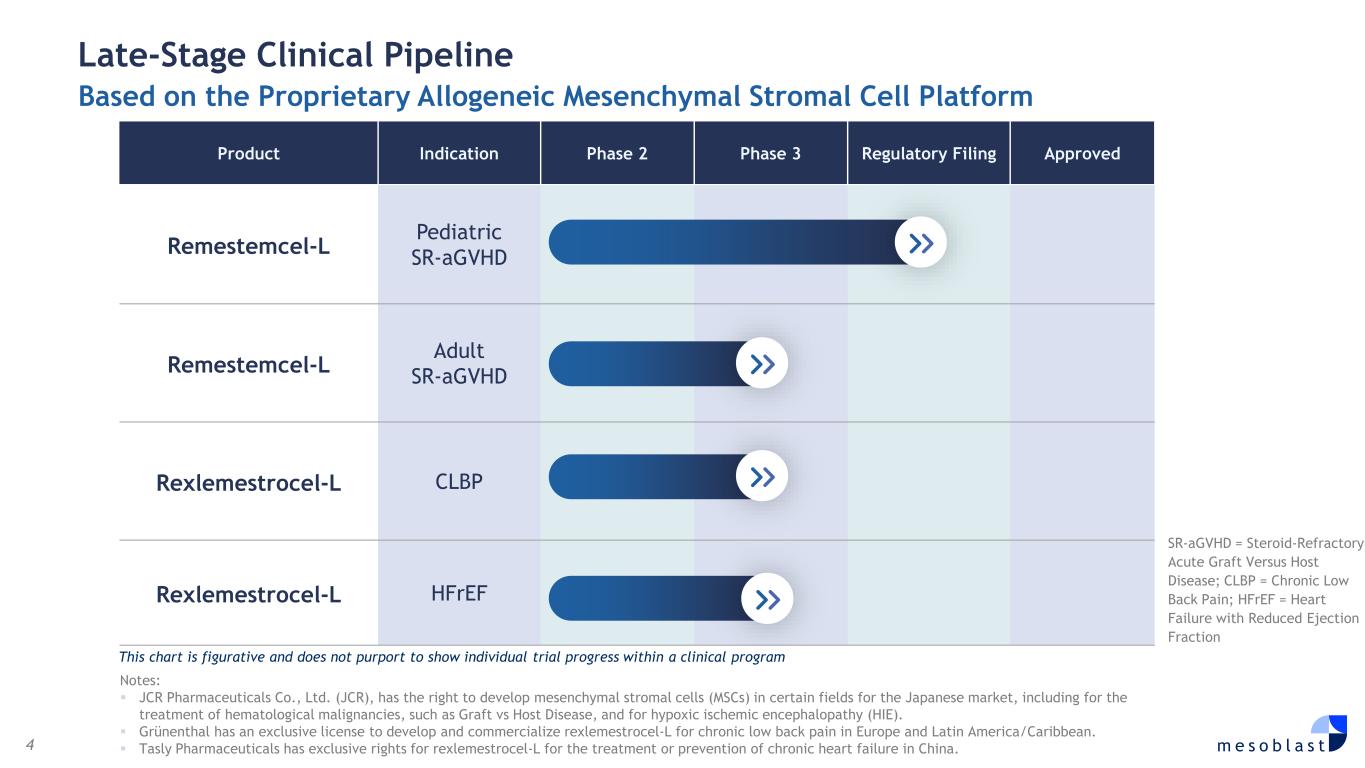
4 m e s o b l a s t 基于专有的同种异体间充质基质细胞平台的后期临床管线产品适应症 2 期 3 期监管备案获批 remestemcel-L 儿科 sr-agvHD rexlemestemcel-L 成人 sr-agvHD Rexlemestrocel-L CLBP Rexlemestrocel-L hfref sr-agvHD = 类固醇难治急性 GravHD = 类固醇难治性急性 GravHD 对比宿主病;CLBP = 慢性腰痛;hfreF = 心力衰竭伴射血分数减少此图表具有比喻性,并不旨在显示临床项目中的个别试验进展注意:JCR Pharmicals有限公司(JCR)有权在某些领域为日本市场开发间充质基质细胞(MSC),包括用于治疗血液系统恶性肿瘤,例如移植物抗宿主病和缺氧缺血性脑病(HIE)。Grünenthal拥有开发和商业化治疗慢性腰背的Rexlemestrocel-L的独家许可欧洲和拉丁美洲/加勒比地区的疼痛。天士力制药拥有Rexlemestrocel-L在中国治疗或预防慢性心力衰竭的专有权。

5 m e s o b l a s t 投资亮点 remestemcel-L for sr-AgvHD Rexlemestrocel-L for CLBP 新型异体细胞疗法平台财务正在为类固醇难治性急性移植物抗宿主病(sr-AGVHD)儿童开发领先适应症即将与美国食品药品管理局举行A型会议,讨论产品批准策略椎间盘源性慢性腰痛(CLBP)的第一阶段3已完成。美国食品药品管理局批准的 RMAT。启动第二阶段3期研究开发基于专有间充质基质细胞(MSC)技术平台的现成异体细胞药物,无需捐赠者配对或免疫抑制即可进行治疗过去12个月的750万美元特许权使用费收入为7,130万美元。截至2023年6月30日,HFREF的Rexlemestrocel-L为7,130万美元。f) 二级/三级患者。美国食品药品管理局为患有 LVAD 的终末期 hFreF 患者发放的 RMAT BLA = 生物制剂许可证申请 FDA = 美国食品药品监督管理局 PDUFA = 处方药使用者费用法 RMAT = 再生医学高级疗法 LVAD = 左心室辅助设备

6 m e s o b l a s t 在为期六个月的BLA审查中,我们在将这种尖端产品推向市场方面取得了实质性进展,完成了美国食品药品管理局对我们制造过程的全面检查。2023年8月,美国食品药品管理局对重新提交的用于治疗儿科sr-AgvHD的remestemcel-L的生物制剂许可证申请(BLA)做出了完整的回应。美国食品和药物管理局提供了完整的回应,要求Mesoblast证明在3期试验中使用的产品与计划商业发布的产品相似,根据标准化效力测定,美国食品药品管理局表示,如果该公司无法通过额外的效力测定工作来建立这种联系,则需要进行额外的临床试验来建立这种联系。定于9月中旬与美国食品药品管理局举行的A型会议提议向美国食品药品管理局提供额外的效力测定数据,以提供两者之间的联系第 3 阶段产品和商业库存 Mesoblast提议向美国食品药品管理局提供新的成人临床试验数据,这也可能支持Remestemcel-L在SR-AgvHD小儿A型患者中的儿科适应症监管状况美国食品药品管理局会议定于9月中旬举行的FDA会议

7 m e s o b l a s t 根据我们向成人患者群体(其人数约为儿童多5倍)的总体商业战略,Mesoblast 打算对死亡风险高的成年人进行有针对性的对照研究 sr-AgvHD 患者中至少一种药物(例如鲁索利替尼)失效的成年人的存活率在 100 天之前仍低至 20-30% 1,2 相比之下,100-100 71名年龄在12岁及以上的sr-AgvHD患者中,使用remestemcel-L治疗后,日存活率为63%,但未获得回应至少另一种药物,例如ruxolitinib Mesoblast正在与负责美国所有移植手术80%的血液和骨髓临床试验网络(BM CTN)的世界领先研究人员讨论开展这项新的临床试验。这项有针对性的研究的费用预计将由财务部分 “Remestemcel-L在srag患者中的监管状况” 中概述的计划削减支出来支付 vHD 在成人中生成新的临床数据 1.Jagasia M 等人鲁索利替尼用于治疗类固醇难治性急性移植物抗宿主病(REACH1):一项多中心、开放标签的2期试验。Blood。2020 年 5 月 14 日;135 (20):1739—1749 2.Abedin S 等人鲁索利替尼在类固醇难治性急性移植物抗宿主病中的耐药性或不耐受性——一项真实世界的结果分析。《英国血液学杂志》,2021 年;195:429 —43。

8 m e s o b l a s t© Lonza,经许可转载截至 2023 年 6 月 30 日的期间制造业 Remestemcel-L

9 m e s o b l a s t 第一年的财务摘要。TEMCELL® HS Inj. 是 JCR Pharmicals Co. 的注册商标Ltd. 2.为了计算支付给Mesoblast的特许权使用费,我们的被许可方的TEMCELL销售额以日元记录,然后再折算成美元。业绩已根据美元兑日元汇率从截至2022年6月30日止年度的1美元:122.14日元至截至2023年6月30日年度的1美元:139.76日元的变动进行了调整。FY2023 中经营活动的净现金使用量为6,330万美元;与 FY2021 相比,减少了37%,与2022财年相比减少了4%。截至2023年6月30日止年度,Cash Burn特许权使用费收入为750万美元。按固定货币计算,截至2023年6月30日止年度,我们的被许可方在日本销售TEMCELL® HS Inj.1的特许权使用费为812万美元,而截至2022年6月30日的年度为870万美元。截至2023年6月30日,手头现金为7,130万美元,从我们现有的融资机制中再增加4,000万美元,这取决于某些里程碑和可用性的延期。现金储备

10 m e s o b l a s t 减少研发支出,改善税前亏损:收入主要来自我们的被许可方在日本销售的 TEMCELL® HS Inj.1 的特许权使用费。研发支出减少:截至2023年6月30日的年度减少了560万美元(17%),降至2720万美元。研发费用主要用于支持重新提交remestemcel-L BLA的准备工作以及Rexlemestrocel-L关键研究的准备工作。减少制造业支出:减少300万美元(10%),至截至2023年6月30日止年度的2770万美元。在截至2023年6月30日的一年中,我们继续进行上市前的制造活动。财务成本包括截至2023年6月30日止年度的1,520万美元非现金支出,包括应计利息和借款成本。截至2023年6月30日的季度损益(百万美元)2022年6月30日总收入 7.5 10.2 研发(27.2)(32.8)制造业(27.7)(30.8)管理与行政(25.4)(27.2)或有对价的重估 8.8 0.9 重估认股权证负债(2.2)5.9 其他营业收入和支出 4.2(0.5)财务成本(20.1)(17.3)税前亏损 (82.1) (91.6) 所得税优惠 0.2 0.2 税后亏损 (81.9) (91.4) 数字已四舍五入。1.TEMCELL® HS Inj. 是 JCR Pharmicals Co. 的注册商标有限公司

1100 万 e s o b l a s t FY2023 的净运营现金使用量与 FY2021 相比减少了 37%,与 FY2022 相比减少了 4%。此外,通过减少研究、销售和营销、商业库存和薪资方面的支出,将 FY2024 的年度净运营现金支出从 FY2023 的 6,330 万美元减少到 4,830 万美元,这将部分被我们对 sr-AGVHD 第三阶段计划的投资所抵消到2024年2月,CLBP的工资按年计算减少40%,其中包括基本工资、STI补助金和承包商费 o 首席执行官和首席营销官已推迟了整个2023财年的短期激励措施(STI),自愿将24财年的基本工资降低了30%以保留现金,而是将获得长期非现金激励(LTI)以进一步与股东保持一致 o 2023财年所有员工的短期激励措施(STI)已完全延期 o 管理层有资格获得LTI以代替工资减少30%非执行董事自愿推迟了100%的现金支付并同意收取其价值的50%长期非现金激励措施中的薪酬 (LTI) 财务报表从 FY2024 的季度报告转为半年报告以及持续的季度附录 4C 现金和运营报告,符合澳大利亚证券交易所上市实体未来 12 个月的成本控制计划减少运营活动和薪资支出

12 m e s o b l a s t 类固醇难治性急性移植物抗宿主病 (sr-agvHD)

13 m e s o b l a s t 急性移植物抗宿主病 (AgvHD) 同种异体骨髓移植 (BMT) 的严重和致命并发症 1 期 BMT 调理引起的宿主组织损伤第 2 阶段免疫细胞激活和细胞因子风暴第 3 阶段炎症和终末器官损伤调理方案、化疗或放射性组织损伤 CD4 和 CD8 T 细胞激活 TNF、IL-1 6 ifnγ、IL-2、IL-12、IL-21、IL-22、IL-23 巨噬细胞输入细胞因子风暴 Macrophage 改自 Blazar 等人,《自然评论》免疫学 12:443 — 458

14 m e s o b l a s t 1。Westin,J.,Saliba,RM.,Lima,M.(2011)类固醇难治性急性 GVHD:预测因子和结果。血液学的进展。2.Anthem-Healthcore/Mesoblast 索赔分析(2016 年)。存档数据 3.Niederwieser D、Baldomero H、Szer J.(2016)2012 年全球造血干细胞移植活动以及包括全球调查在内的全球血液和骨髓移植网络集团的 SWOT 分析。4.HRSA 移植活动报告,CIBMTR,2020 年 5.Axt L、Naumann A、Toennies J(2019)对异基因造血细胞移植后类固醇难治性移植物抗宿主病的预后、危险因素和治疗的回顾性单中心分析。骨髓移植。每年在全球范围内进行3万多例异基因骨髓移植(>2万例美国/欧盟),约20%儿科3,4 每年在美国进行约9,000-10,000例异基因骨髓移植在美国的儿童和青少年中约有1,500例异体骨髓移植4 Remestemcel-L:类固醇难治性急性移植物抗宿主病(sr-AgvHD)sr-agvHD 与死亡率有关高达 90% 急性 GVHD 是一种危及生命的并发症,在接受异体骨髓移植 (BMT) 的患者中,约有 50% 会出现 1 急性 GVHD 主要影响皮肤、胃肠道和肝脏类固醇难治性AgvHD 与高达 90% 的死亡率相关 1,5 以及显著的延长住院费用2 治疗选择疾病负担市场机会皮质类固醇是 AgvHD 的一线疗法。只有一种经批准的类固醇难治性疾病治疗药物,美国没有批准的 12 岁以下儿童的治疗方法在日本,Mesoblast 的被许可方获得了儿童和成人 sr-AgvHD 的唯一产品批准

15 m e s o b l a s t 1。GVHD001 有 55 名随机患者,但是有一名患者在接受任何剂量的 remestemcel-L 之前就退出了;2.西奈山急性移植物抗宿主病国际联盟(MAGIC)——由遍布美国和欧洲的十个骨髓移植中心组成的小组,其目的是对移植物抗宿主病进行开创性的临床试验,包括开发信息丰富的生物储存库,以帮助开发可以指导移植物抗宿主病治疗的治疗方法;3.MAGIC 队列中有两名受试者进行了随访
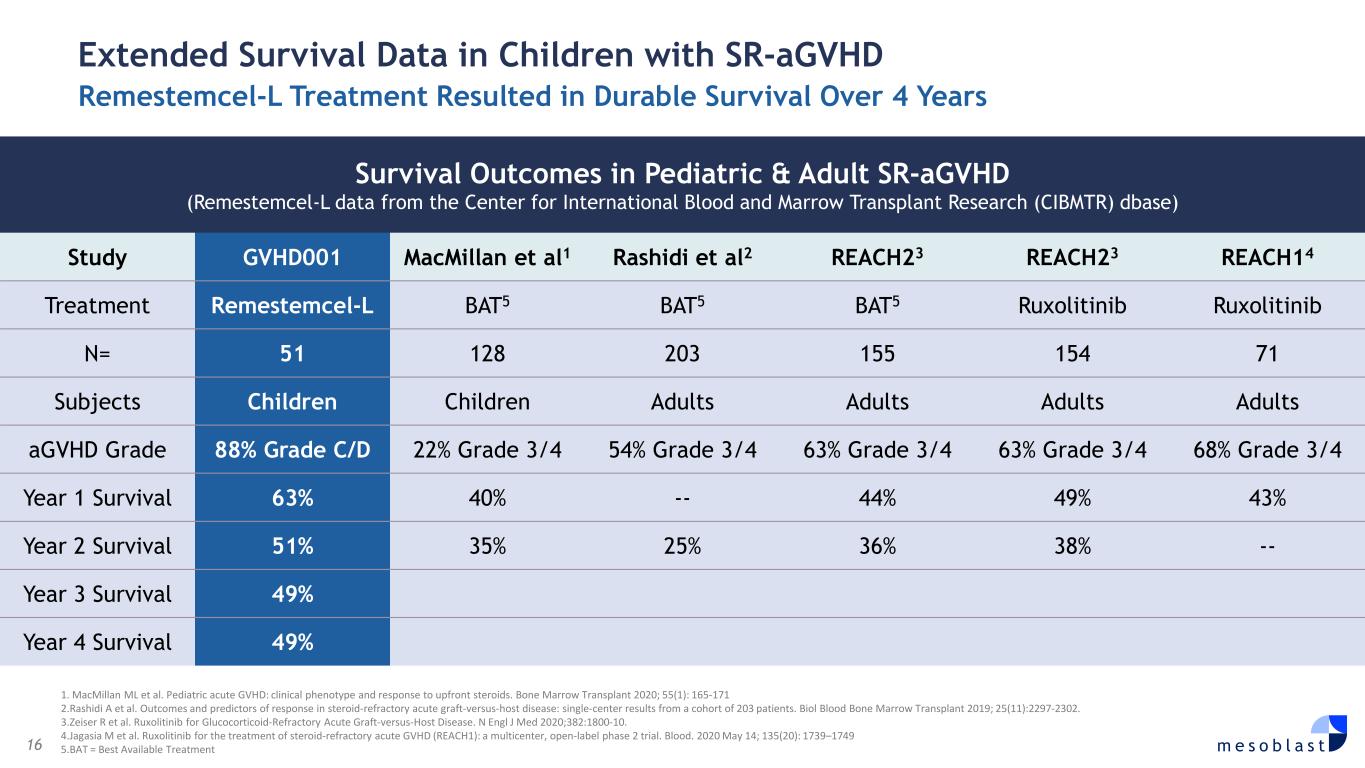
16 m e s o b l a s t 1。MacMillan ML 等人小儿急性 GVHD:临床表型和对预付类固醇的反应。2020 年骨髓移植;55 (1):165-171 2.Rashidi A 等人类固醇难治性急性移植物抗宿主病的结果和反应预测指标:来自203名患者的单中心结果。2019 年 Biol Blood 骨髓移植;25 (11): 2297-2302。3.Zeiser R 等人Ruxolitinib 治疗糖皮质激素难治性急性移植物抗宿主病。N Engl J Med 2020;382:1800-10。4.Jagasia M 等人鲁索利替尼用于治疗类固醇难治性急性移植物抗宿主病(REACH1):一项多中心、开放标签的2期试验。血液。2020 年 5 月 14 日;135 (20):1739—1749 5.BAT = 最佳可用疗法 sr-AGVHD Remestemcel-L 治疗儿童延长存活率数据,儿童和成人 sr-AGVHD(来自国际血液与骨髓移植研究中心 (CIBMTR) dbase 的 Remestemcel-L 数据)研究 GVHD001 MacMillan 等人 1 Rashidi et al2 REACH23 REACH23 REACH14 治疗 remestemcel-L BAT5 BAT5 BAT5 ruxolitinib ruxolitinib Ruxolitinib N= 51 128 203 155 154 71 71 个受试者儿童成人成人成人 agvHD 等级 88%C/D 级 22% 3/4 年级 54% 3/4 年级 63% 3/4 年级 63% 3/4 年级 68% 3/4 年级 1 生存率 63% 40% — 44% 49% 43% 二年级存活率 51% 35% 25% 36% 38% — 三年级生存率 49% 四年级生存率 49%

17 m e s o b l a s t 商业策略是发展类固醇失败的成年人和一线药物,包括鲁索利替尼的市场机会大约是儿科的五倍。大约 45% 的鲁索利替尼患者没有反应 1 在至少一种额外药物(例如鲁索利替尼)中失效的 sr-agvHD 成人存活率为 20-30% 1,2 相比之下,71名12岁及以上的sr-AgvHD患者在富有同情心的护理下使用remestemcel-L治疗后,100天存活率为63%,但对以下患者没有反应至少还有一种药物,例如ruxolitinib Mesoblast,正在与负责美国所有移植手术80%的血液和骨髓临床试验网络(BM CTN)的世界领先研究人员讨论进行这项新的临床试验。这项有针对性的研究的费用预计将由财务部分Remestemcel-L针对sr-AgvHD的成年人所概述的削减支出中概述的计划支出削减支出 1。Jagasia M 等人鲁索利替尼用于治疗类固醇难治性急性移植物抗宿主病(REACH1):一项多中心、开放标签的2期试验。Blood。2020 年 5 月 14 日;135 (20):1739—1749 2.Abedin S 等人鲁索利替尼在类固醇难治性急性移植物抗宿主病中的耐药性或不耐受性——一项真实世界的结果分析。《英国血液学杂志》,2021 年;195:429 —43。
18 m e s o b l a s t 椎间盘退行性疾病 (CLBP) 引起的慢性腰痛

19 m e s o b l a s t 1。Williams、J.、NG、Nawi、Pelzter、K.(2015)低收入和中等收入国家老年人腰痛相关的危险因素和残疾。世卫组织全球老龄化与成人健康研究(SAGE)的结果。PloS One。2015;10 (6):e0127880。,2.决策资源:慢性疼痛 2015 年 12 月。,3.LEK 和 NCI 意见领袖访谈和二次分析。,4.Navigant:美国和欧盟三国基于细胞的专有DD疗法的商业评估——2014年8月。椎间盘退行性疾病(CLBP)引起的慢性腰痛影响 7M+ Rexlemestrocel-L 代表了治疗慢性腰痛的潜在新模式。据估计,美国和欧盟各有超过700万患者因椎间盘退行性疾病(DDD)而患有 CLBP 和欧盟5 2-4 保守治疗失败的慢性腰痛(CLBP)患者的最低治疗选择包括阿片类药物和手术 50% 的阿片类药物和手术类药物处方适用于 CLBP2 持续改善疼痛有可能减少阿片类药物的使用并防止手术干预疾病负担治疗选择市场机会背痛造成的残疾比任何其他疾病都要多1 给医疗保健系统带来可观的直接和间接成本,1 包括该患者群体中过度使用阿片类药物
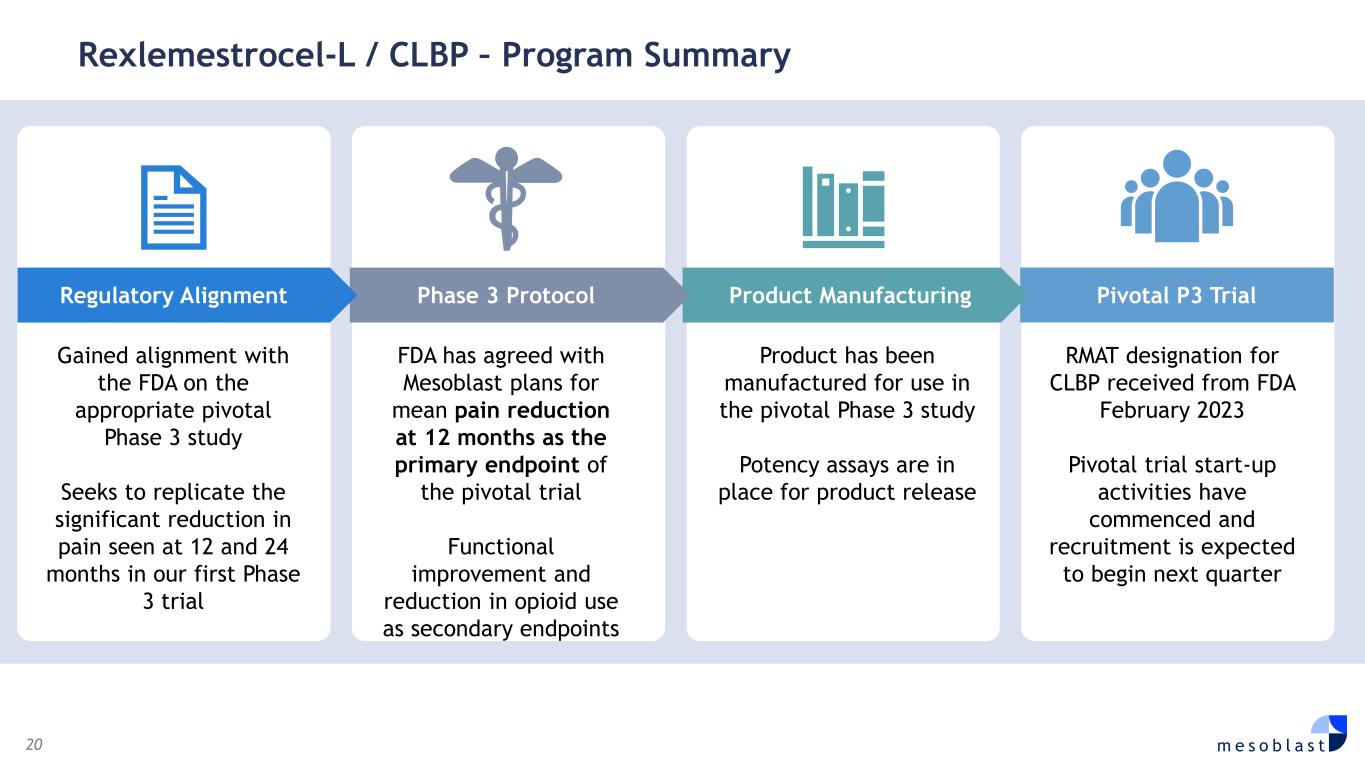
20 m e s o b l a s t Rexlemestrocel-L/CLBP — 项目摘要在适当的关键性 3 期研究上与美国食品药品管理局保持一致寻求复制我们的第一项 3 期试验中 12 个月和 24 个月时疼痛的显著减轻 FDA 已同意 Mesoblast 的计划,将在 12 个月时平均减轻疼痛作为关键试验的主要终点功能改善和减少阿片类药物的使用作为次要终点产品是为之制造的在关键的 3 期研究中使用效能测定法可用于产品发布 RMAT 指定为CLBP 于 2023 年 2 月从 FDA 收到的 Pivotal 试验启动活动已经开始,预计将在下个季度开始招聘 Pivotal P3 试用产品制造第 3 阶段协议监管调整

21 m e s o b l a s t RMAT 认证提供了突破和快速通道认定的所有好处,包括滚动审查和提交生物制剂许可申请 (BLA) 时获得优先审查的资格。试验结果显示:与所有受试者在12个月和24个月时的盐水控制相比,在腰椎间盘中单次注射Rexlemestrocel-l+HA可显著减轻疼痛(n=400 4) 在基线使用阿片类药物(n=168)并使用rexlemestrocel-l+HA的患者中,疼痛在36个月内得到缓解与生理盐水对照组相比,所有时间点的减少幅度都要大得多在基线服用阿片类药物的患者中,尽管有指示在整个试验期间维持现有疗法,但接受Rexlemestrocel-l+HA治疗的患者中,有28%没有服用阿片类药物,而接受Rexlemestrocel-L+HA治疗CLBP的对照组为8% 的再生医学高级疗法(RMAT)被美国食品药品管理局授予Rexlemestrocel-L治疗CLBP的称号

22 m e s o b l a s t LS LS 下背痛与基线相比的平均值 VAS 变化——持续时间 CLBP

23 m e s o b l a s t 慢性心力衰竭减少射精分数 (hfreF)
24 m e s o b l a s t Rexlemestrocel-L/hfref — 项目摘要定义美国食品药品管理局批准的监管途径心血管疾病仍然是美国的主要死因 CHF 是一种进行性疾病,5 年时死亡率高达 50%,首次住院后死亡率至少为 75% DREAM-HF P3 试验的最新数据显示,在所有接受治疗的 MACE 事件长期减少之前,LVEF 在 12 个月内有所改善患者 LVEF 是一个潜在的早期替代终点,活跃患者对 LVEF 和 MACE 结局的影响会增强从 II 类到终末期 hfreF 的炎症试验结果现在支持 Rexlemestrocel-L 逆转炎症相关内皮功能障碍的 MoA Mesoblast 计划与其 RMAT 指定的 FDA CY2023 会面,讨论潜在的批准途径美国食品药品管理局会议瞄准炎症有希望的数据重要需求

25 m e s o b l a s t 患者出现进行性血管功能障碍和心力衰竭 Rexlemestrocel-L 有可能改善 II 类至 IV 类患者的内皮功能障碍早期死亡 • 他汀类药物 • β受体阻滞剂 • 再血管化或瓣膜手术 • RAAS 拮抗剂 • 用于液体滞留的利尿剂 • 肼屈嗪/二硝酸异山梨酯 • Digitalis NYHA I 级 NYHA IIIB/IVNYHA II 级 NYHA IIB/IIIA 级 NYHA IIIB/IIA 级 Pts 带末期 hfreF • 最佳医疗管理 • LVAD 植入 • 心脏移植 • 人造心脏NYHA IIB 或 IIIA 类持续性 hFreF 患者 • 心律复律除颤器 (ICD) +/-• CRT-D 或可穿戴心脏复律除颤器(如果需要的话)HFREF DREAM HF-1 试验 537 名患者最近针对失代偿 hfreF 住院和体液超负荷的新口服疗法 • sacubitril /valsartan • SGLT2 抑制剂 • Vericiguat 指导指南药物疗法 (GDMT) LVAD MPC 研究 189 名患者心血管疾病风险连续性 Mesoblast 的发展计划
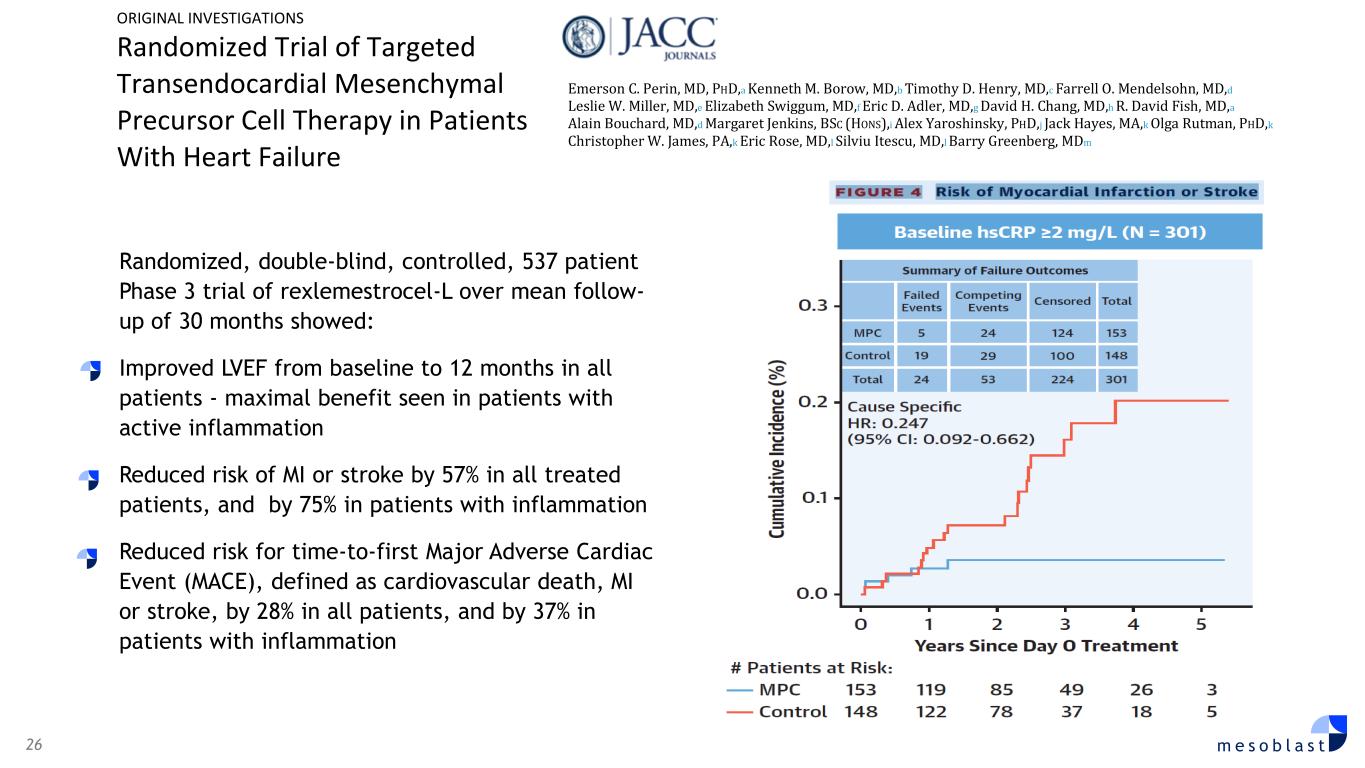
26 m e s o b l a s t 537 名患者 Rexlemestrocel-L 的随机、双盲、对照 3 期试验显示,平均随访时间为 30 个月:所有患者 LVEF 从基线改善至 12 个月——活动性炎症患者获得最大益处所有接受治疗的患者心肌梗死或中风的风险降低 57%,炎症患者发生心肌梗死或中风的风险降低 75% 降低首次发生重大心脏不良事件的风险(MACE),定义为心血管死亡、心肌梗死或中风,所有患者中下降28%,炎症患者下降37%原始调查心力衰竭患者靶向经心脏间充质前体细胞疗法的随机试验艾默生 C. Perin,医学博士,a Kenneth M. Borow,医学博士,b Timothy D. Henry,医学博士,c Farrell O. Mendelson,医学博士,d Leslie W. Miller,医学博士,e Eric D. Adler,医学博士,g David H. Chang,医学博士,h R. David Fish,医学博士,a Alain Bouchard,医学博士,d 玛格丽特·詹金斯,理学士(荣誉),i 亚历克斯·雅罗辛斯基,博士,j Jack Hayes,MD,k Christopher W. James,k Eric Rose,医学博士,l Silviu Itescu,医学博士,l Barry Greenberg,mdM
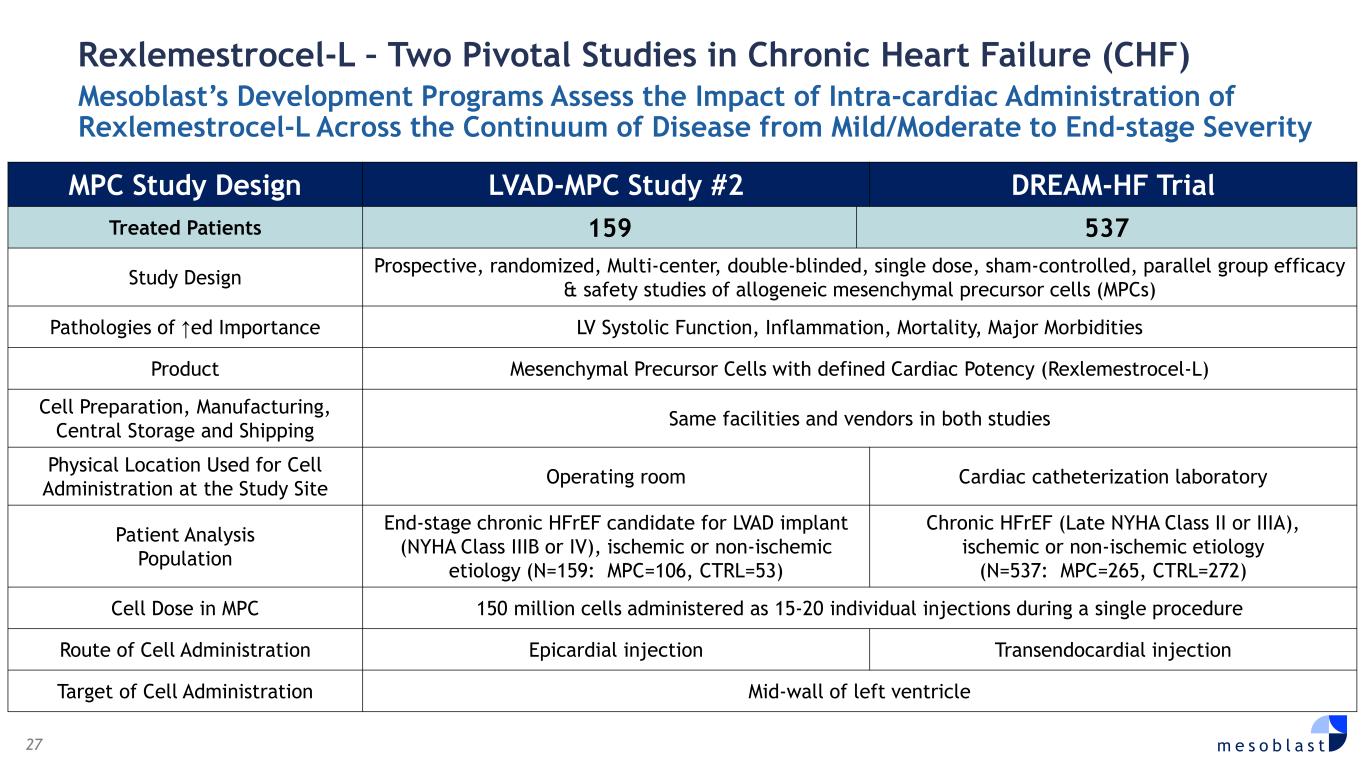
27 m e s o b l a s t Rexlemestrocel-L — 两项关于慢性心力衰竭 (CHF) 的关键研究 Mesoblast 的开发项目评估了心内给药瑞克美曲赛-L 对从轻度/中度到终末严重程度的疾病过程的影响 MPC 研究设计 LVAD-MPC 研究 #2 DREAM-HF 试验治疗患者 159 537 研究设计前瞻性、随机、多中心、双盲同种异体间充质前体细胞 (MPC) 的单剂量、sham 对照、平行组疗效和安全性研究 ↑ed 病理学重要性 LV收缩功能、炎症、死亡率、主要发病率产品具有明确心脏效力的间充质前体细胞(Rexlemestrocel-L)细胞制备、制造、中央存储和运输两项研究中相同的设施和供应商两项研究中用于细胞给药的物理位置手术室心导管检查实验室患者分析人群终末期慢性 hfref 候选人群 LVAD 植入物(NYHA IIIB 或 IV 级),缺血缺血性或非缺血性病因(N=159:MPC=106,CTRL=53)慢性 hfreF(晚期 NYHA II 类或IIIA),缺血性或非缺血性病因(N=537:MPC=265,CTRL=272)MPC 中的细胞剂量 MPC 中的细胞剂量 1.5 亿个细胞在单次手术中以 15-20 次单独注射方式进行细胞给药途径心外侧注射经心内注射细胞给药靶左心室中壁

28 m e s o b l a s t mesoblast 谢谢