
MESOBLAST公布了截至2023年6月30日的澳大利亚墨尔本;8月31日和美国纽约;2023年8月30日的财务业绩和运营最新情况:炎症性疾病异体细胞药物领域的全球领导者Mesoblast Limited(澳大利亚证券交易所股票代码:MSB;纳斯达克股票代码:MESO)今天公布了截至2023年6月30日的财务业绩和运营最新情况,并概述了即将到来的里程碑。Mesoblast首席执行官西尔维乌·伊特斯库说:“我们原本预计remestemcel-L将获得美国食品药品监督管理局(FDA)的批准,用于治疗小儿类固醇难治性急性移植物抗宿主病(sr-AgvHD),这种疾病的死亡率很高,没有针对12岁以下儿童的批准疗法。在为期六个月的BLA审查中,我们在将这种尖端产品推向市场方面取得了实质性进展,完成了美国食品药品管理局对我们制造过程的全面检查。在得到完整的答复之后,计划于9月中旬与美国食品药品管理局举行A型会议,我们将讨论通过额外的效力测定数据或新的成人临床数据获得批准的潜在途径。我们仍然致力于为患有这种毁灭性疾病的患者提供这种挽救生命的疗法。”Itescu博士继续说:“我们已经实施了重大的成本控制战略,并颁布了大幅削减工资的措施,以保护我们的现金储备并确保我们在财政上谨慎行事。以身作则,我推迟了整个短期激励措施(STI),并将年薪降低了30%,我们的首席营销官埃里克·罗斯博士也同意了同样的举措。我也很高兴我们的非执行董事同意推迟所有现金薪酬。”“这些降低成本的策略加上运营精简将使公司能够节省现金,同时在我们推进针对患有SR-AGVHD的成年人和慢性炎症性腰痛患者的第三阶段计划的同时,提高价值。”截至2023年6月30日的财务业绩 (FY2023) • 截至2023年6月30日的现金储备为7,130万美元,现有融资机制最多可额外增加4000万美元,前提是某些里程碑的实现以及实现这些里程碑的时间表是否延长。• FY2023 的经营活动净现金使用量为6,330万美元,与 FY2021 相比减少了37%,与 FY2022 相比减少了4%。• FY2022 降至1,020万美元,减少的主要原因是一次性的里程碑 FY2023武田为日本批准在 FY2022 中治疗肛周瘘管的 Alofisel®(darvadstrocel)提供的 120 万美元。• 按固定货币计算,我们的被许可方在日本出售的 TEMCELL® HS Inj.1 的特许权使用费为 810 万美元,而 2022 财年为870万美元。2 未来12个月的成本控制计划以及运营活动和薪资支出减少净额 • FY2023 的运营现金使用量与 FY2021 相比减少了37%,与 FY2022 相比减少了4%。• 进一步目标是从63.3美元减少23%(1500万美元)FY2023通过减少研究、销售和营销、商业库存和薪资方面的支出,FY2023 中的预计年度净运营现金支出为4,830万美元,这将部分被我们对SR-AGVHD和CLBP第三阶段计划的投资所抵消。• 目标是到2024年2月将工资按年计算减少40%,其中包括基本工资、短期激励措施(STI)付款和承包商费用。• 首席执行官和首席营销官已推迟了整个 23 财年的工资。• 首席执行官和首席营销官已推迟整个 2013 财年短期激励措施(STI)自愿将其24财年的基本工资降低了30%至 FY2024保留现金,改为获得长期非现金激励(LTI),以进一步与股东保持一致,但须经股东批准。

• 2023财年所有员工的短期激励措施(STI)已完全延期。• 管理层有资格获得LTI以代替工资减少30%。• 非执行董事自愿推迟了100%的董事费现金支付,并同意在LTI中获得50%的费用,但须经股东批准。REMESTEMCEL-L 战略更新 • 美国食品和药物管理局提供了完整的回应,要求Mesoblast证明在3期试验中使用的产品与以标准化效力测定法衡量的商业化产品相似。• 美国食品药品管理局表示,如果该公司无法通过额外的效力测定工作来建立这种联系,则需要进行额外的临床试验来建立这种联系。• 定于9月中旬与美国食品药品管理局举行的SR-A型会议定于9月中旬举行 AgvHD 适应症。• Mesoblast 提议向 FDA 提供额外的效力测定数据以提供3 期产品与商业库存之间的联系。• Mesoblast 提议向美国食品药品管理局提供新的成人临床试验数据,这也可能支持儿科适应症。• 根据我们向成人患者群体(其人数约为儿童多 5 倍)的总体商业战略,3 Mesoblast 打算对死亡风险高的成年人进行有针对性的对照研究。• 至少另一种药物失败的 sr-AGVHD 成人的存活率,例如鲁索利替尼,在100天后仍低至20-30%。4,5 • 相比之下,在71名12岁及以上的sr-AgvHD患者中,使用remestemcel-L治疗后的100天存活率为63%,这些患者对至少一种额外的药物(例如ruxolitinib)没有反应。• Mesoblast正在与血液和骨髓临床试验网络(BM CTN)的世界领先研究人员进行讨论,该机构负责美国所有移植的80%,进行新的临床试验。• 这项有针对性的研究的费用预计将通过上述支出削减来支付。REXLEMESTROCEL-L 策略更新 • 该产品已用于一项关键研究,该研究在美国各地招募患者,以支持Rexlemestrocel-L在治疗椎间盘退行性疾病引起的慢性腰痛(CLBP)中的潜在上市批准。• 关键试验启动活动已经开始,预计将于下个季度开始招募。• 主要终点是与安慰剂相比,12个月后疼痛减轻。• Rexlemestrocel-L 有获得了 CLBP 的再生医学高级疗法 (RMAT) 称号。• Rexlemestrocel-L 有此外还获得了 RMAT 认证,用于治疗左心室辅助设备(LVAD)患者的心力衰竭。• Mesoblast 将与美国食品药品管理局会面,寻求根据共同的作用机制和潜在的上市批准途径,将 RMAT 扩大到没有 LVAD 的 hfREF 患者。截至2023年6月30日的财务业绩详情 (FY2023) • FY2023 的研发费用减少了560万美元(17%),降至2720万美元,而 FY2022 的研发费用为3,280万美元。研发费用主要用于支持重新提交remestemcel-L BLA的准备工作以及Rexlemestrocel-L关键研究的准备工作,因为临床试验招募和数据分析现已完成,我们的候选产品的临床试验活动减少了。

• FY2023 的制造支出减少了300万美元(10%),降至2770万美元,而 FY2022 的制造支出为3,070万美元。在这一年中,我们继续进行 remestemcel-L 的发布前制造活动和产品测试。• FY2023 的管理和行政费用减少了180万美元(7%),降至2540万美元,而 FY2022 的管理和行政费用为2720万美元,这主要是由于对 FY2023 中的法律费用进行了一次性调整以及与 FY2022 发生的一次性公司活动相关的专业费用增加。• 重新衡量或有对价确认的收益为880万美元,反映了 FY2023 的减少在未来的第三方付款中,与 a 相比FY2022 的收益为90万美元,这主要是由于重估了未来的第三方付款。• 认股权证的公允价值变动确认了 FY2023 亏损220万美元,而 FY2022 的收益为590万美元。• FY2023 中的其他营业收入包括350万美元的研发税收优惠收入。该期间记录的收入与截至2021年6月30日、2022年6月30日和2023年6月30日的年度根据澳大利亚政府激励计划应退还的符合条件的支出有关。• 借款安排的财务成本包括 FY2023 的1,520万美元非现金支出,包括应计利息和借款成本。FY2023 的税后亏损为8190万美元,而 FY2022 的税后亏损为9,130万美元。FY2023 归属于普通股股东的净亏损为每股11.08美分,而 FY2022 的净亏损为每股14.08美分。电话会议今天将进行网络直播,从美国东部标准时间上午8点30分(8月31日星期四)和美国东部时间下午6点30分(8月30日星期三)开始。可通过以下方式访问:https://webcast.openbriefing.com/msb-fyr-2023/ 存档的网络直播将在公司网站的投资者页面上播出:www.mesoblast.com 关于Mesoblast Mesoblast(该公司)是开发用于治疗严重和危及生命的炎症性疾病的同种异体(现货)细胞药物的全球领导者。该公司利用其专有的间充质谱系细胞疗法技术平台建立了广泛的后期候选产品组合,这些候选产品通过释放抗炎因子来应对严重炎症,这些因子可以对抗和调节免疫系统的多个效应分支,从而显著减少破坏性的炎症过程。Mesoblast拥有强大而广泛的全球知识产权组合,所有主要市场的保护范围至少延续到2041年。该公司的专有制造工艺生产出工业规模、低温保存、现成的细胞药物。这些细胞疗法具有明确的药物释放标准,计划随时可供全球患者使用。Mesoblast正在基于其remestemcel-L和Rexlemestrocel-L同种异体基质细胞技术平台开发针对不同适应症的候选产品。Remestemcel-L正在开发用于儿童和成人的炎症性疾病,包括类固醇难治性急性移植物抗宿主病、耐生物性炎症性肠病和急性呼吸窘迫综合征。Rexlemestrocel-L正在开发用于治疗晚期慢性心力衰竭和慢性腰痛。Mesoblast的被许可方已在日本和欧洲将两种产品商业化,该公司已在欧洲和中国就某些第三阶段资产建立了商业合作伙伴关系。Mesoblast在澳大利亚、美国和新加坡设有分支机构,并在澳大利亚证券交易所(MSB)和纳斯达克(MESO)上市。欲了解更多信息,请参阅 www.mesoblast.com、LinkedIn:Mesoblast Limited 和 Twitter:@Mesoblast 参考文献/脚注 1。TEMCELL® HS Inj. 是 JCR Pharmicals Co. 的注册商标有限公司

2。为了计算支付给Mesoblast的特许权使用费,我们的被许可方的TEMCELL销售额以日元记录,然后再折算成美元。业绩已根据美元兑日元汇率从截至2022年6月30日止年度的1美元:122.14日元至截至2023年6月30日年度的1美元:139.76日元的变动进行了调整。3.HRSA 移植活动报告,CIBMTR,2020 年 4.Jagasia M 等人鲁索利替尼用于治疗类固醇难治性急性移植物抗宿主病(REACH1):一项多中心、开放标签的2期试验。Blood。2020 年 5 月 14 日;135 (20):1739—1749 5.Abedin S 等人鲁索利替尼在类固醇难治性急性移植物抗宿主病中的耐药性或不耐受性——一项真实世界的结果分析。《英国血液学杂志》,2021 年;195:429 —43。前瞻性陈述本新闻稿包括与未来事件或我们未来财务业绩相关的前瞻性陈述,涉及已知和未知的风险、不确定性和其他因素,这些因素可能导致我们的实际业绩、活动水平、业绩或成就与这些前瞻性陈述所表达或暗示的任何未来业绩、活动水平、业绩或成就存在重大差异。我们根据1995年《私人证券诉讼改革法》和其他联邦证券法的安全港条款做出此类前瞻性陈述。不应将前瞻性陈述视为对未来业绩或业绩的保证,实际结果可能与这些前瞻性陈述中的预期结果有所不同,差异可能是重大的,也是不利的。前瞻性陈述包括但不限于以下方面的陈述:Mesoblast的临床前和临床研究的启动、时间、进展和结果,以及Mesoblast的研发计划;Mesoblast推动候选产品进入、注册并成功完成临床研究(包括跨国临床试验)的能力;Mesoblast提高其制造能力的能力;监管部门申报和批准的时间或可能性(包括我们提出的申请与美国食品和药物管理局举行的 A 型会议,结果此类会议,以及美国食品和药物管理局未来可能就针对SR-AgvHD儿科患者Remestemcel-L的BLA做出的任何决定)、制造活动和产品营销活动(如果有的话);Mesoblast候选产品的商业化(如果获得批准);监管或公众对使用干细胞疗法的看法和市场接受度;Mesoblast的候选产品(如果有的话)被撤回的可能性由于患者不良事件或死亡而从市场上消失;战略合作的潜在好处协议以及Mesoblast建立和维持既定战略合作的能力;Mesoblast建立和维护其候选产品的知识产权的能力,以及Mesoblast在涉嫌侵权的情况下成功为这些候选产品进行辩护的能力;Mesoblast能够建立和维护涵盖其候选产品和技术的知识产权的保护范围;对Mesoblast支出、未来收入、资本需求及其额外融资需求的估计;Mesoblast 的支出、未来收入、资本需求及其对额外融资的需求;Mesoblast 能够建立和维护的保护范围;的财务业绩;与Mesoblast的竞争对手和行业相关的发展;以及Mesoblast候选产品的定价和报销(如果获得批准)。您应该在我们最近向美国证券交易委员会提交的报告中或在我们的网站上阅读本新闻稿以及我们的风险因素。可能导致Mesoblast的实际业绩、业绩或成就与此类陈述可能表达或暗示的业绩、业绩或成就存在重大差异的不确定性和风险,因此,您不应过分依赖这些前瞻性陈述。我们不承担任何义务公开更新或修改任何前瞻性陈述,无论是由于新信息、未来发展还是其他原因。由行政长官授权发布。欲了解更多信息,请联系:企业传播/投资者媒体 Paul Hughes BlueDot Media T:+61 3 9639 6036 Steve Dabkowski E:investors@mesoblast.com T:+61 419 880 486 E:steve@bluedot.net.au
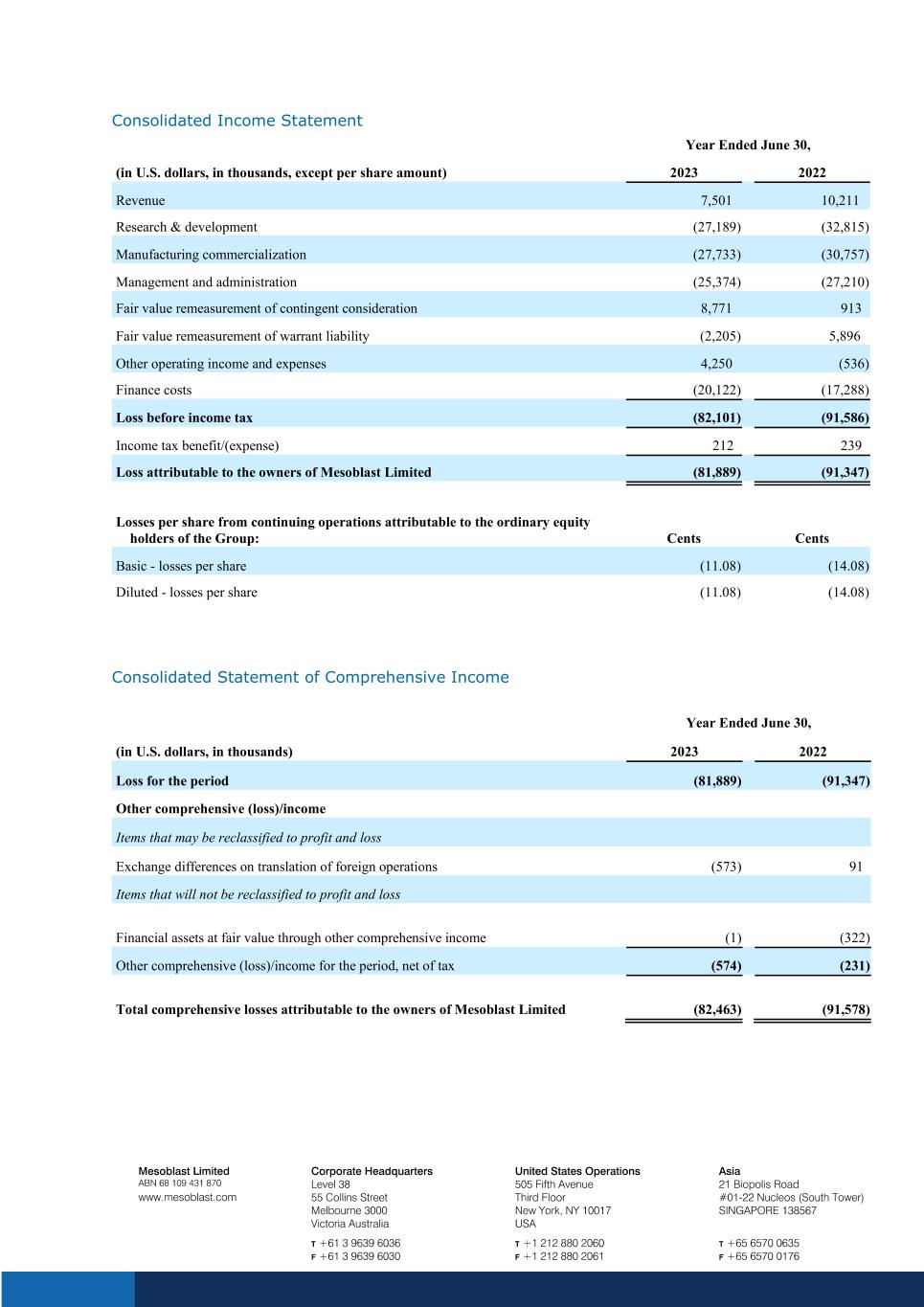
截至6月30日的合并损益表年度(以千美元计,每股金额除外)2023 年收入 7,501 10,211 研发(27,189)(32,815)制造业商业化(27,733)(30,757)管理和行政(25,374)(27,210)或有对价的公允价值调整 8,771 913 认股权证负债的公允价值调整(2,205)5,887 96 其他营业收入和支出 4,250 (536) 财务成本 (20,122) (17,288) 所得税前亏损 (82,101) (91,586) 所得税优惠/ (支出) 212 239 亏损归属于Mesoblast Limited(81,889)(91,347)集团普通股持有人的持续经营每股亏损:美分基本亏损(11.08)(14.08)摊薄后——每股亏损(11.08)(14.08)截至6月30日的合并综合收益表,(以千美元计)2023年同期亏损(81,889)) (91,347) 其他可重新归类为损益的综合(亏损)/收益项目国外业务折算后的汇兑差额 (573) 91 项目不会重新归类为损益通过其他综合收益按公允价值计算的金融资产 (1) (322) 该期间扣除税款的其他综合(亏损)/收益(574)(231)归属于Mesoblast Limited所有者的综合亏损总额(82,463)(91,578)
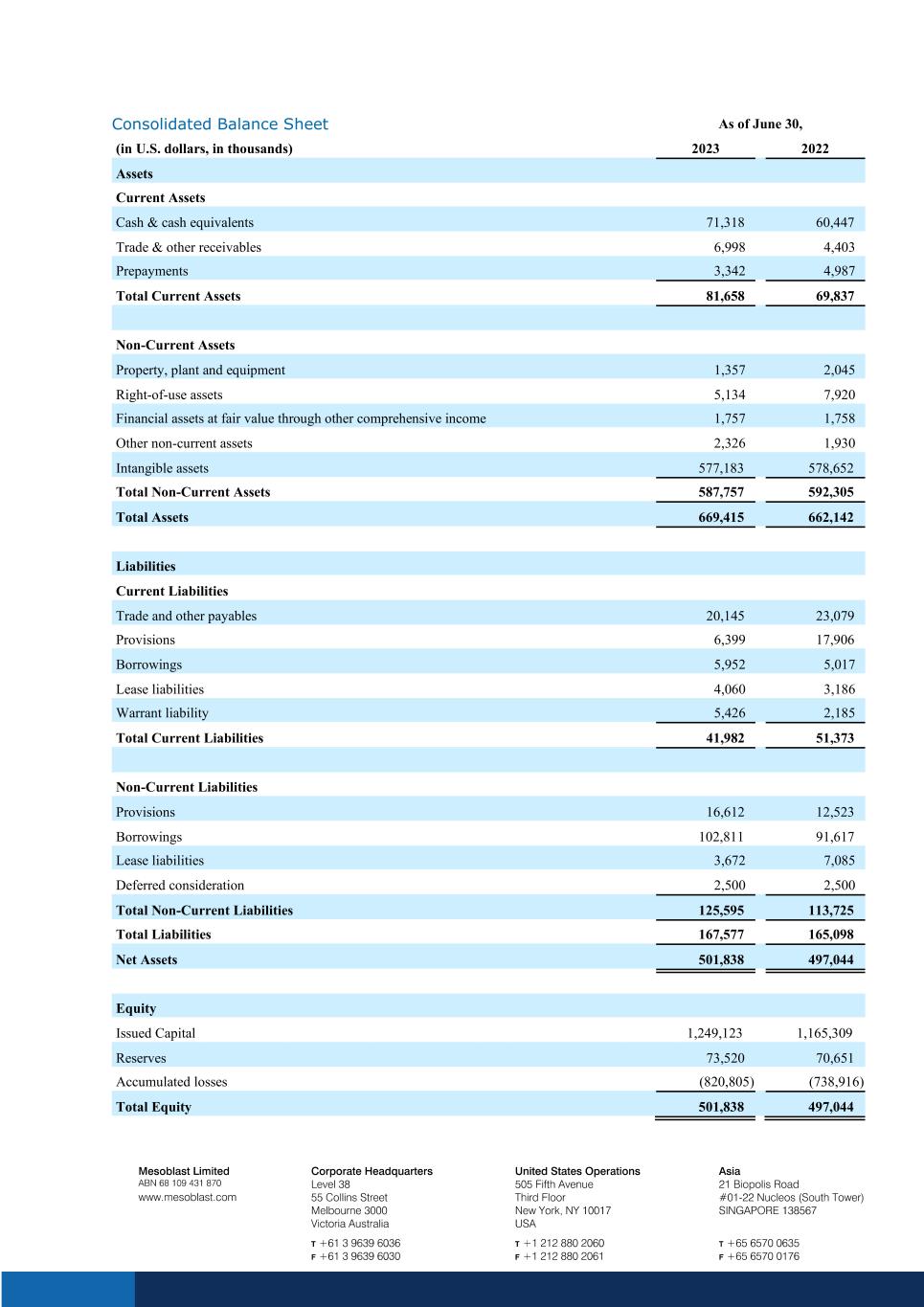
截至6月30日的合并资产负债表(以千美元计)2023年资产流动资产现金及现金等价物 71,318 60,447 贸易和其他应收账款 6,998 4,403 预付款 3,342 4,987 流动资产总额 81,658 69,837 非流动资产不动产、厂房和设备 1,357 2,045 使用权资产 5,134 7,920 通过其他方式按公允价值计算的金融资产 5,134 7,920 按公允价值计算的金融资产综合收益 1,757 1,758 其他非流动资产 2,326 1,930 无形资产 577,183 578,652 非流动资产总额 587,757 592,305 总资产 669,415 662,142 负债流动负债贸易和其他应付账款 20,145 23,079 准备金 6,399 17,906 借款 5,952 5,017 租赁负债 4,060 3,186 认股权证负债 5,426 2,185 流动负债总额 41,982 51,373 非流动负债准备金 16,612 12,523 借款 102,811 91,617 租赁负债 3,672 7,085 递延对价 2,500 非流动负债总额 125,595 113,725 总负债 167,577 165,098 净资产 501,838 497,044 股票发行资本 1,249,123 1,165,309 储备 73,520 70,651 累计亏损 (820,805) (738,916) 总权益501,838 497,044

截至6月30日的合并现金流量表(以千美元计)2023 年经营活动现金流商业化收入收到7,480 980笔政府补助金和税收优惠收到1,118 24 向供应商和员工付款(包括商品和服务税)(72,683) (75,769) 已收利息 796 7 已收所得税/ (已支付) 20 (24) 经营活动净现金(流出)(63,269) (65,782) 来自投资活动的现金流固定资产投资 (264) (157) 转租投资收入 120— 许可证付款 (50) (75) 投资活动中的净现金(流出)(194)(232)融资活动现金流借款收益 — 51,919 借款还款 —(55,458)借款交易成本支付(574)(5,527)支付的利息和其他财务成本(6,014)(6,084)股票发行收益 88,635 收益来自发行认股权证 — 8,081 支付股票发行成本 (4,889) (222) 租赁负债付款 (2,656) (2,788) 按融资活动划分的净现金流入/ (流出) 74,502 (9,870) 净增长/ (现金及现金等价物减少)11,039(75,884)期初现金及现金等价物 60,447 136,881 外国银行账户折算后的外汇(亏损)/收益(168)(550)期末现金及现金等价物 71,318 60,447