

附录 99.1 FTX-6058 f o r S i c k l e c e l l d i s e a s e program 更新

F U L C R U M T H E R A P E U T I C S 免责声明和通知本 演示文稿包含1995年《私人证券诉讼改革法》所指的 “前瞻性陈述”,涉及重大风险和不确定性。除历史事实陈述外,本演示文稿中包含的所有陈述 均为前瞻性陈述,包括关于恢复 FTX-6058 临床开发的明示或暗示陈述;1b 期临床试验设计和每个队列中的受试者数量以及 群组数量;以及修订后的纳入和排除标准的影响;以及此类试验的注册等。“预期”、“相信”、“继续”、“可以”、 “估计”、“预期”、“打算”、“可能”、“计划”、“潜在”、“预测”、“项目”、“应该”、“目标”、“将”、 “将” 等词语旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别词。任何前瞻性陈述均基于管理层当前 对未来事件的预期,并且存在许多风险和不确定性,这些风险和不确定性可能导致实际业绩与此类前瞻性陈述中或暗示的结果存在重大和不利差异。这些风险和 不确定性包括但不限于与进行临床试验相关的风险;Fulcrum 在临床试验中继续推进其候选产品的能力;按预期或完全按时启动和注册临床试验;获得并维持美国食品药品管理局和其他监管机构的必要批准;在临床试验中复制临床前研究和/或早期临床试验中发现的积极结果;获得、 维护或保护与之相关的知识产权其候选产品;管理开支;管理高管和员工流失,包括整合新的首席执行官和首席财务官;以及筹集 实现其业务目标所需的大量额外资金等。有关其他风险和不确定性以及其他重要因素的讨论,其中任何一个因素都可能导致Fulcrum的实际业绩与前瞻性陈述中包含的结果不同, 请参阅Fulcrum最近向美国证券交易委员会提交的文件中的 “风险因素” 部分,以及对潜在风险、不确定性和其他重要因素的讨论。此外,本演示文稿中包含的前瞻性 陈述代表了Fulcrum截至本文发布之日的观点,不应将其视为Fulcrum在本文发布之日之后的任何日期的观点。Fulcrum预计,随后的 事件和事态发展将导致Fulcrum的观点发生变化。但是,尽管Fulcrum可能会选择在未来的某个时候更新这些前瞻性陈述,但Fulcrum明确表示不承担任何这样做的义务。2
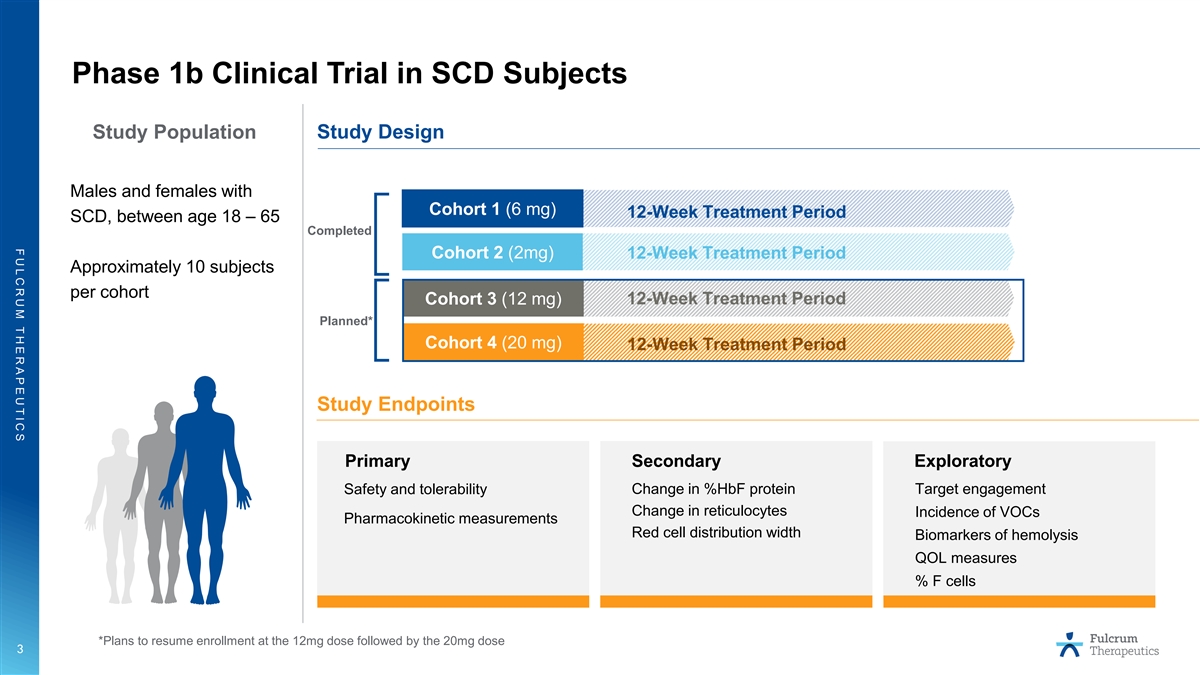
F U L C R U M T H E R A P E U T I C S 1b 期 SCD 临床试验 受试者研究人群研究设计第 1 组 (6 mg) 12 周治疗期 SCD 的男性和女性,年龄在 18 至 65 岁之间,已完成第 2 组 (2mg) 12 周治疗期每组大约 10 名受试者队列 3 (12 mg) 12 周 计划治疗期* 队列 4 (20 mg) 12 周治疗期研究终点 %hbF 蛋白的主要次要探索性变化靶点参与度安全性和耐受性网织红细胞变化挥发性有机化合物发生率药代动力学测量 红细胞分布宽度溶血生物标志物 QOL 可测量 F 细胞百分比 *计划在 12 毫克剂量后恢复入组 20 毫克剂量 3

F U L C R U M T H E R A P E U T I C S 初始 FTX-6058 数据表明 HbF 绝对百分比变化与基线安全随访相比的剂量依赖性增加 12 2mg FTX-6058 10 6mg FTX-6058 8 12mg FTX-6058 6 4 2 0 0 14 28 42 56 70 84 98 112 Day 美国食品药品管理局于 2023 年 2 月 23 日发布了 FTX-6058 的全面临床搁置。Safety 数据收集仍在继续,数据截止日期为2023年3月3日。4 注意:汇总数据包括羟基脲开启和关闭的受试者;受试者 15 在第 22 天停止给药,因此仅包含在第 14 天之前的分析中。与基线平均值 (+/-SE) 相比,绝对的 %hbF 变化

F U L C R U M T H E R A P E U T I C S 关键收录内容和 排除标准概述关键纳入标准关键排除标准患者严重程度排除目前在开始 FTX-6058 前 60 天内曾接受过以下羟基脲疗法的受试者:以及以前 使用过稳定的羟基脲和 voxelotor 或剂量 voxelotor 或 crizanlizumab 或 L-glugludar 的经历 tamine crizanlizumab 或 L-glustamine 或者无法获得这些先进疗法我们估计 {中大约有 7,500 到 10,000 名患者br} 符合修订后议定书纳入和排除标准的美国 5

F U L C R U M T H E R A P E U T I C S 关键收录内容概述 标准:患者严重程度其他严重程度衡量标准 12 个月内挥发性有机化合物 ≥ 2 慢性肾脏 ≥ 2 其他 ≥ 4 12 种疾病或至少一种月份或 ≥ 2 种其他衡量标准 6 个月以上肺动脉严重程度月份 6

F U L C R U M T H E R A P E U T I C S 关键收录内容概述 标准:以前使用过羟基脲和其他一种批准的疗法 • 持续使用挥发性有机化合物或急性胸部综合征发作 • 药物相互作用在最大耐受剂量下至少 6 个月难以控制 • 患者拒绝 • 无法耐受治疗的不良反应以及 • 持续的疼痛危机和其他挥发性有机化合物处于稳定状态时 • 无法耐受 Voxelotor 或 crizanlizumab 剂量至少 6 个月或左旋谷氨酰胺的不良反应或 l-谷氨酰胺 •难以控制的药物相互作用 • 未能将 Hb 提高 1 g/dL(vox.)或持续 • 患者拒绝 VOC 发作(criz. 或 L-glutamine)或 • 缺乏可用性 无法获得 • 缺乏保险覆盖高级疗法 7

FTX-6058 f o r S i c k l e c e c e l l d i s e a s e 补充详情

F U L C R U M T H E R A P E U T I C S 关键收录内容的修改 标准:患者严重程度 ▪ 筛查前 12 个月内超过 4 次 SCD 疼痛危机发作或在筛查前 6 个月内发生 ≥2 次 SCD 疼痛危机发作,再加上过去 12 个月中至少一次发作:• 急性胸部综合征 (ACS) • 肝脏或脾脏封存 • 阴茎异常勃起 ▪ 在过去 12 个月中发生的以下事件中超过 2 个:• ACS • 肝脏或脾脏封存 • 阴茎异常勃起 ▪ Tricuspid regurgitant 喷射速度 (TRV) ≥ 3.0 m/s 或 TRV ≥ 2.5 m/s + N 末端 pro b 型 ▪利钠肽 (nt-proBNP) 血浆水平 ≥ 160 pg/mL 或者记录了通过先前的超声心动图或 右侧心脏导管插入术诊断出持续的肺动脉高压,平均肺动脉压 > 25 mm Hg ▪ SCD 相关慢性肾脏病 (CKD) 由以下至少一个标准定义,分别连续测量:2 • 估计肾小球滤过率 (eGFR):2 • 估计肾小球滤过率 (eGFR) ≥ 30 和 300 mg/g 或蛋白质与肌酐的比例 >30 mg/mmol ▪ 符合接受的医疗标准(例如 脑血管事故后)但是禁用于慢性输血(例如异体免疫、输血反应)9

F U L C R U M T H E R A P E U T I C S 对关键内含物的修改 标准:以前使用过羟基脲和另一种批准的疗法以前使用过羟基尿素(HU)至少 6 个月的经历之前使用过稳定剂量的 voxelotor crizanlizumab(最大耐受剂量)但已证明 无反应或左旋谷氨酰胺在至少 6 个月但根据以下标准之一,至少基于以下一项无回应和/或不容忍或不符合资格:标准:▪ 对于 voxelotor,未能将血红蛋白 (Hb) 增加至少 1 ▪ 与基线相比,在HU服用稳定剂量至少6种和/或其他挥发性有机化合物后,疼痛危机次数 g/dL 与基线相比相同或更高,▪ ACS 发作至少 6 个月 ,与基线相比,crizanlizumab 或 L-Glutamine 与基线相比,ACS 发作在疼痛危象和/或其他挥发性有机化合物数量相同或更高的情况下服用 HU 至少 6 个月,而在稳定剂量的治疗下,最大耐受 剂量至少 6 个月 ▪ 无法耐受 HU 为 ▪定义为 ▪ 无法耐受以下治疗的不良反应中的至少一个:▪ 药物相互作用难以控制 • 严重的过敏反应 ▪ 无法获得治疗 • 血液学毒性定义为红细胞、白细胞或血小板的临床显著减少 ▪ 患者拒绝 • 无法耐受 胃肠道副作用,例如恶心、呕吐、腹泻或腹痛 • 无法耐受副作用包括疲劳、头晕、头痛、发烧、腿部溃疡和/或皮肤变化 ▪难以控制的药物相互作用 ▪ 患者拒绝 10

F U L C R U M T H E R A P E U T I C S 排除标准摘要 ▪ 在开始研究药物前 14 天内进行重大手术、严重疾病、感染、发烧、严重出血、脑血管意外或癫痫发作;计划在试验期间进行选择性手术 ▪ 镰状细胞 并发症在开始研究药物前 14 天内需要医疗提供者护理 ▪ 抗药的使用诱导或抑制细胞色素 P450 (CYP) 3A4、抑制 P 糖蛋白、乳腺癌耐药蛋白、 或多种药物和毒素的凝固剂或药物挤压蛋白 2-K,或者在第一剂研究药物或研究期间预计需要任何这些药物之前 14 天内成为 CYP2B6 的底物。▪ 在入组后的过去 60 天内使用 研究人员参与任何其他研究 ▪ 骨髓移植、人类干细胞移植或基因疗法史 ▪ 在开始研究药物前的 7 天内接种过丙氨酸 氨基转移酶 ≥ 3× 正常 (ULN)、白蛋白 1.5mg/dL 或凝血酶原时间上限 >1.5 ULN ▪ 有以下病史的受试者 ▪定义为 eGFR 的严重肾脏疾病

F U L C R U M T H E R A P E U T I C S 排除标准摘要 (续)▪ 定期接受输血的受试者或任何在开始研究药物前 60 天内输血的受试者 ▪ 经临床诊断的酒精或其他非法药物滥用药物的药物滥用障碍 ▪ 尿液药物筛查呈阳性,非法滥用药物(阿片类药物和大麻除外/四氢大麻除外)氢化大麻酚 [四氢大麻酚]/大麻二酚 [CBD]) 是排他性的 ▪ 孕妇或哺乳期女性;或者育龄女性无法或 不愿在研究期间遵守节育措施或禁欲,受试者是调查现场工作人员或其直系亲属(配偶、父母、子女或兄弟姐妹,无论是亲生还是合法收养)▪ 心率校正 QT interval-Fridericia 的方法 (qtCF) >450 msec(男性)或 >470 msec(女性)▪ 受试者有活动性恶性肿瘤或癌症史(鳞状细胞皮肤癌、基底细胞皮肤癌或 {0 期宫颈癌除外)br} situ,过去 5 年内没有复发)或直系亲属患有已知或疑似家族癌症综合征。已知存在染色体异常或基因突变,可能使受试者患上 骨髓增生异常综合征 (MDS) 或急性髓系白血病 (AML) 的风险增加 ▪ 受试者目前正在接受HU、voxelotor、crizanlizumab 和/或 Lglutamine 或者已经接受了 HU、voxelotor、crizanlizumab 和/或 Lgrutamine 或者已经接受了 HU、voxelotor、crizanlizumab 和/或 L-谷氨酰胺在开始研究前 60 天内 药物 12