附录 99.2

Eblasakimab Phase 2b Trek-AD Topline 读数
2023 年 7 月 6 日
重述 2023 年 8 月 18 日
纳斯达克:ASLN
Eblasakimab Phase 2b Trek-AD Topline 读数
2023 年 7 月 6 日
重述 2023 年 8 月 18 日
纳斯达克:ASLN
附录 99.2

Eblasakimab Phase 2b Trek-AD Topline 读数
2023 年 7 月 6 日
重述 2023 年 8 月 18 日
纳斯达克:ASLN
Eblasakimab Phase 2b Trek-AD Topline 读数
2023 年 7 月 6 日
重述 2023 年 8 月 18 日
纳斯达克:ASLN

法律免责声明
此
演示文稿包含前瞻性陈述。这些声明基于ASLAN Pharmicals Limited(以下简称 “公司”)管理层当前的信念和期望。这些前瞻性陈述可能包括但不限于有关以下内容的陈述
公司的业务战略、公司开发和商业化候选产品的计划、公司候选产品的安全性
和有效性,包括其成为同类最佳产品的潜力、公司在临床试验、临床试验注册和临床试验结果方面的计划和预期时机
候选产品的临床试验、临床试验注册和临床试验结果、公司的计划和监管申请和批准方面的预期时机、公司市场的规模和增长潜力的候选产品,以及其潜力eblasakimab 可治疗
特应性皮炎。公司的估计、预测和其他前瞻性陈述基于管理层对未来事件和趋势的当前假设和预期,这些事件和趋势会影响或可能影响公司的业务、战略、运营或财务业绩,本质上涉及已知和未知的重大风险和不确定性,包括在临床前或临床研究中观察到的意外安全性或有效性数据;早期研究和试验的
结果可能无法预测未来的试验结果;临床网站激活低于预期的比率或临床试验注册率;COVID-19 疫情对公司业务
和全球经济的影响;总体市场状况;竞争格局的变化;以及公司获得足够融资为其战略和临床开发计划提供资金的能力。由于这些风险和不确定性,实际业绩和事件发生时间
可能与此类前瞻性陈述中的预期存在重大差异,其中包括但不限于公司向美国证券交易委员会
提交的文件和报告(委员会文件编号001-38475)中描述的风险因素,包括公司于2023年3月24日向美国证券交易委员会(SEC)提交的20-F表格。本演示文稿讨论了正在进行
临床研究但尚未获得美国食品药品监督管理局批准上市的候选产品。对于正在研究的候选产品
的用途,未就这些候选产品的安全性或有效性作出任何陈述。在比较不同产品和候选产品的试验数据时,应谨慎行事。试验设计与患者群体和特征之间存在差异。此类试验的结果可能对我们现有或未来的结果没有解释价值。除历史事实陈述以外的所有陈述均为前瞻性陈述。这些术语中的相信、观点、可能、可能、
可以、目标、估计、继续、预期、预期、打算、预期、计划或否定词以及传达
未来事件或结果不确定性的类似表述旨在识别估计、预测和其他前瞻性陈述。估计、预测和其他前瞻性陈述仅代表截至其发表之日,而且,除非法律要求
,否则公司没有义务更新或审查任何估计、预测或前瞻性陈述。2

在特应性
皮炎 (AD) 的 2b 期阳性研究中,Eblasakimab 每月给药显示出一流疗法的潜力
第一个具有竞争疗效和安全性的月度给药方案
如果获得批准,有可能成为治疗过敏性疾病的领先疗法
Eblasakimab
每 4 周给药一次 600 毫克,在 TREK-AD 中达到主要终点,EASI-75 为 52.0%,EASI-90 为 27.6%,Viga-ad 0/1 为 31.2%,每两周给药一次 Eblasakimab 也达到了具有统计学意义的主要终点,并且
达到关键次要终点独特的剂量加载方案起效迅速,EASI 有统计学上的显著改善在第 4 周之前降低分数通常在所有剂量水平下耐受性良好,结膜炎发生率低和
注射部位反应支持这种潜力为了实现差异化的安全概况数据支持在2024年进入第三阶段
中度至重度 AD 中度至重度 AD 中首款表现出竞争疗效的生物制剂,从一开始就每月给药一次,相当于每两周给药一次。通过提供 IL-4 和 IL-13 信号传导的双重阻断,有可能在
其他主要疾病(例如慢性阻塞性肺病和哮喘)中表现出令人信服的特征
3
EASI-75 和 EASI-90 数据
已于 2023 年 8 月 18 日重报

尽管已有且即将获得批准的疗法,但仍存在大量未得到满足的需求
与之相关的属性
功效
安全
剂量和便利性
治疗合并症
理想的
dupilumab Tralokinumab Lebrikizumab1 Oral jaKi 属性
疗效概况与 dupilumab2 相当或
好于 dupilumab2 疾病发作迅速改善3?在不影响 1 型受体的情况下完全抑制 2 型受体 4 被证明可以阻断人类瘙痒神经元对 IL-13 和 IL-45 的敏化无盒装警告或监测 6 × 结膜炎发生率低
和 1 型驱动效应7 便捷给药:从治疗开始或口服开始每月注射8 灵活给药的可能性9 在室温下稳定(无需冷藏)10?
对其他过敏性疾病有效11
1。Lebrikizumab 是一种候选药物,未获准用于
AD
2。基于单一疗法 3 期研究的 EASI-75 和 IGA 终点
3。
对于已批准的药物,标签是否声称对疾病严重程度有任何形式的快速或快速影响(EASI-75 或 IGA)。候选药物的批准标签声明尚不清楚。
4。基于已发布的临床前和机制数据。
5。基于已公布的临床前
数据。
6。对于已批准的药物,根据标签。对于候选药物,基于第三阶段药物相关SAE的监测要求和报告
7。对于已批准的药物,根据显示单一疗法结膜炎发病率低于 5% 的标签。对于候选药物,基于单一疗法第三阶段显示结膜炎发病率低于 5%
8。对于已批准的药物,基于批准的给药方案。对于候选药物,基于开始治疗时(在
加载剂量之后)在第三阶段计划中测试的方案
9。对于批准的药物,基于成人给药时间表,可以根据反应、安全性或其他患者特征进行调整。对于
候选药物,基于单一疗法第 3 阶段测试的剂量调整 10。对于已批准的药物,根据标签上的建议储存期为一个月或更长时间。候选药物的储存要求尚不清楚。
11。基于已提供积极数据的临床试验。
仅用于
说明目的。不是正面交锋的比较。在比较不同产品和候选产品的试验数据时,应谨慎行事。试验设计与患者群体和
特征之间存在差异。此类试验的结果可能对我们现有或未来的结果没有解释价值。
4

Eblasakimab 是临床上唯一靶向 的单克隆抗体IL-13 受体 IL-4 IL-13 Eblasakimab IL-4R 13R 1 2 型受体过敏性炎症 IL-4 和 IL-13 是引发过敏和特应性皮炎症状的核心 eblasakimabs 新方法通过靶向 IL-13 受体,阻断 2 型受体,阻止通过 IL-4 和 IL-13 进行信号传导,同时保护 1 型受体最近发表的翻译数据 显示了对受体的阻断 IL-13 与阻断 IL-4 相比,可以在不增加 Th1 细胞因子的情况下更有效地减少 Th2 细胞因子受体 5
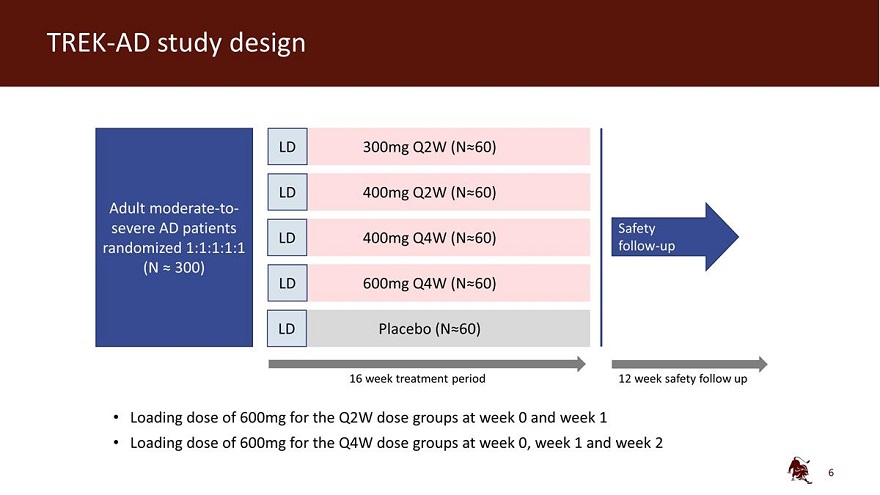
TREK-AD 研究设计 LD 300mg Q2W (N 60) LD 400mg Q2W (N 60) 成人 中度至重度AD 患者 Safety LD 400mg Q4W (N 60) 随机 1:1:1:1 随访 (N 300) LD 600mg Q4W (N 60) LD 安慰剂 (N 60) 16 周治疗期 12 周安全随访第 0 周和第 1 周 Q2W 剂量组加载 600 毫克剂量组第 0 周、第 1 周和第 2 周的剂量为 600 毫克

TREK-AD 研究设计主要终点:EASI 研究终点中与 基线相比的变化百分比次要终点:EASI-75、EASI-90、viga-AD 0/1、pros、BSA、SCORAD EASI 16 viga-AD 3 关键纳入标准 BSA 10% 对 TCS/TCI 的反应不足或禁忌症试验能够证明主要终点在双面 5% 显著性水平上的统计学意义由 MMRM 分析的连续终点(主要 分析)和带有 MCMC-MI 的 ANCOVA 用于处理缺失数据(灵敏度分析)。开始救援后的数据统计方法药物治疗或停药后的数据均设置为缺失 通过CMH方法分析的二进制终点,缺少使用MCMC-MI估算的数据,但服用救援药物或因缺乏疗效而停药的患者除外,他们被视为无反应者 BSA:体表面积,EASI:湿疹面积和严重程度指数,Viga-ad:研究人员验证的全球评估特应性皮炎,TCS:外用皮质类固醇,TCI:局部钙调神经素抑制剂, MMRM:混合模型重复测量,MCMC:马尔可夫链蒙特卡洛,密歇根州:多重归因,CMH:Cochran-Mantel-Haenszel 7
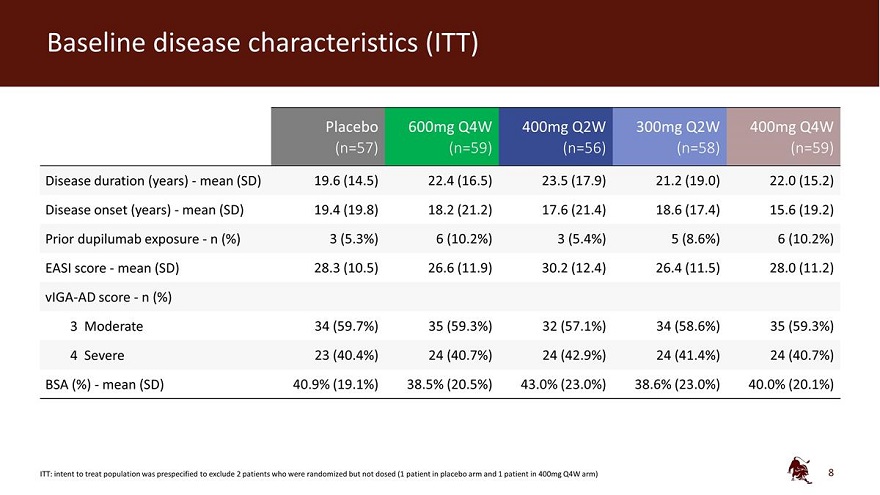
基线疾病特征 (ITT) 安慰剂 600mg Q4W 400mg Q2W 300mg Q2W 400mg Q2W 400mg Q4W (n=57) (n=59) (n=58) (n=59) 疾病持续时间(年)——平均值(SD)19.6(14.5)22.4(16.5)23.5(17.9)21.2(19.0)22.0(15.2)) 疾病发作(年份)——平均值(SD)19.4(19.8)18.2(21.2)17.6(21.4)18.6(17.4)15.6(19.2)先前接触杜皮卢单抗——n(%)3(10.2%)3(10.2%)3(5.4%)5(8.6%)6(10.2%)EASI 分数——平均值(SD)28.3(26.5)(11.9) 30.2 (12.4) 26.4 (11.5) 28.0 (11.2) Viga-AD 分数——n (%) 3 中度 34 (59.7%) 35 (59.3%) 32 (57.1%) 34 (58.6%) 35 (59.3%) 4严重 23 (40.4%) 24 (40.7%) 24 (42.9%) 24 (41.4%) 24 (41.4%) 24 (40.7%) BSA (%)-平均值 (SD) 40.9% (19.1%) 38.0% (23.0%) 38.6% (23.0%) 40.0% (20.1%) ITT:预先指定意向排除 2 名随机患者已服用但未给药(安慰剂组有 1 名患者,400 毫克 Q4W 组中有 1 名患者)8
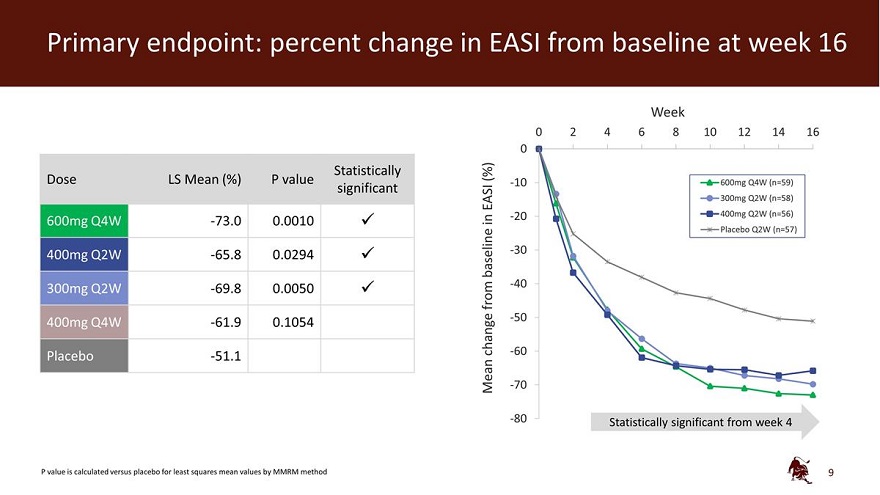
主要终点:第 16 周 EASI 与基线相比的变化百分比 0 周 2 4 6 8 10 12 14 16 0 统计学上 (%) 剂量 LS 平均值 (%) P 值 -10 600mg Q4W (n=59) 在-20 中显著 EASI 300mg Q2W (n=58) 400mg Q2W (n=56) 600mg Q4W -73.0 0.0010 安慰剂 Q2W (n=57) 400mg Q2W -65.8 0.0294 基线 -30 -40 300mg Q2W -69.8 0.0050 来自 -50 400mg Q4W W -61.9 0.1054-change -60 安慰剂 -51.1-Mean -70 -80 Mean -70 -80 使用 MMRM 方法 9 计算出与安慰剂相比的最小二乘均值 P 值具有统计学意义
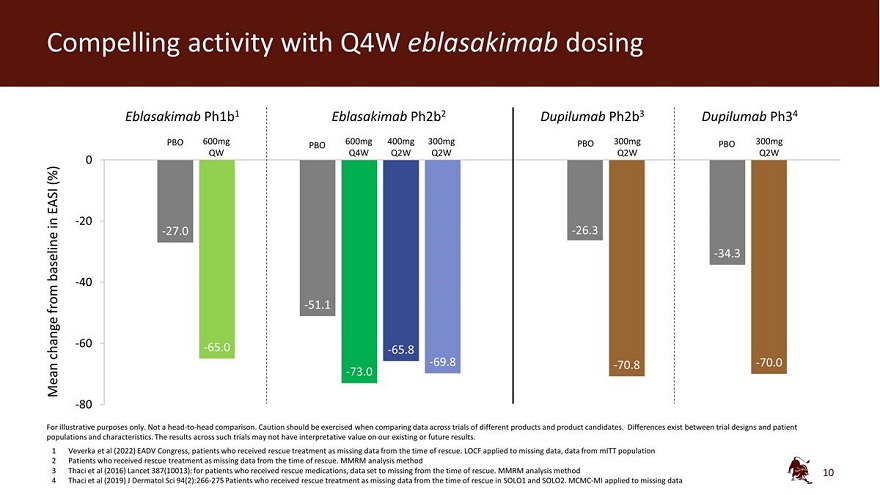
Q4W eblasakimab 给药 Eblasakimab ph1b1 Eblasakimab ph1b1 Eblasakimab ph2b2 dupilumab ph2b3 dupilumab ph34 PBO 600mg 400mg 300mg PBO 300mg PBO 300mg QBO 300mg QBO 300mg QBO 300mg QBO 300mg QBO Q4W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W -20 -27.0 -26.3 基线 -34.3 -40 从 -51.1 -60 -65.0 变动 -65.8 -69.8 -70.8 -70.8 -70.0 Mean -73.0 -73.0 -80 仅用于说明目的。不是 正面交锋比较。在比较 不同产品和候选产品的试验数据时,应谨慎行事。试验设计与患者群体和特征之间存在差异。此类试验的结果可能对我们现有或未来的结果没有解释价值。1 Veverka等人 (2022)EADV国会,因抢救时缺少数据而接受救援治疗的患者。LOCF 应用于缺失的数据,即来自 MitT 人群的数据 2 接受救援治疗的患者,因为抢救时的数据缺失。MMRM 分析方法 3 Thaci 等人(2016)《柳叶刀》387(10013):对于接受救援药物的患者,从救援时起数据集就会丢失。MMRM 分析方法 4 Thaci 等人(2019)J Dermatol Sci 94 (2): 266-275 因缺少 SOLO1 和 SOLO2 救援时的数据而接受救援治疗的患者。MCMC-MI 应用于缺失的数据 10
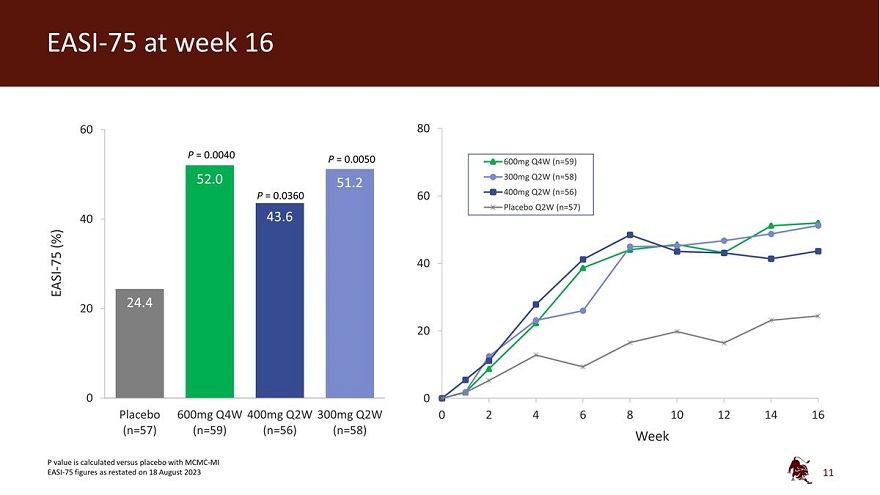
60 80 P = 0.0040 P = 0.0050 600mg Q4W (n=59) 300mg Q2W (n=58) P = 0.0360 60 400mg Q2W (n=56) 安慰剂 Q2W (n=57) 40 (%) -75 40 EASI 20 0 0 安慰剂 600mg Q4W 400mg Q2W 0 2 4 6 8 10 12 14 16 (n=57) (n=59) (n=56) (n=58) Week P 值是与安慰剂相比计算的 2023 年 8 月 18 日重报的 MCMC-MI EASI-75 数字 11
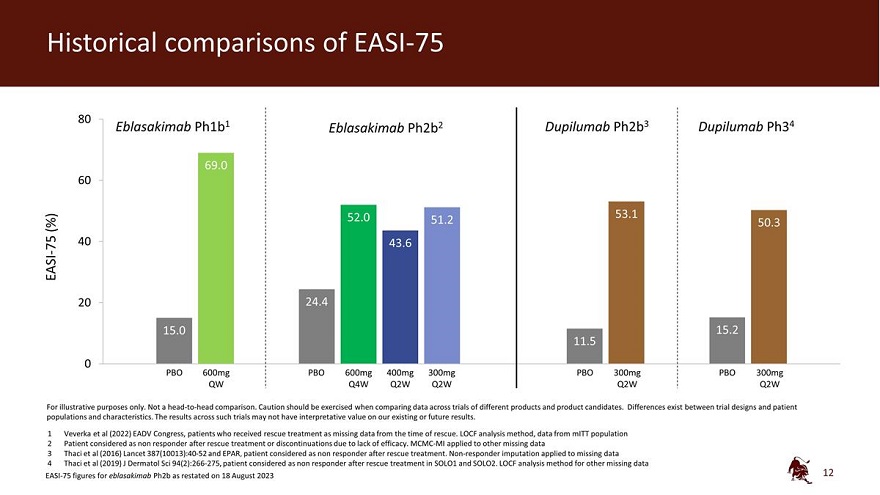
EASI-75 80 Eblasakimab ph1b1 Eblasakimab ph2b2 dupilumab ph2b3 dupilumab ph34 69.0 60 52.0 53.1 (%) 51.2 50.3 40 75 43.6 EASI-20 24.4 15.0 15.2 11.5 0 PBO 600mg PBO 600mg 300mg PBO 300mg Q4W Q4W 2W Q2W Q2W Q2W Q2W 仅用于说明目的。不是 正面交锋比较。在比较不同产品和候选产品的试验数据时,应谨慎行事。试验 设计与患者群体和特征之间存在差异。此类试验的结果可能对我们现有或未来的结果没有解释价值。1 Veverka等人(2022年)EADV国会,因抢救时缺少 数据而接受救援治疗的患者。LOCF 分析方法,来自 MitT 人群的数据 2 患者在抢救治疗或因缺乏疗效而停药后被视为无反应者。MCMC-MI 适用于其他 缺失的数据 3 Thaci 等人(2016)《柳叶刀》387(10013): 40-52 和 EPAR,患者在抢救治疗后被视为无反应者。无反应者归咎于 缺失数据 4 Thaci 等人(2019)J Dermatol Sci 94 (2): 266-275,患者在 SOLO1 和 SOLO2 中接受救援治疗后被视为无反应者。其他缺失数据的 LOCF 分析方法 2023 年 8 月 18 日重述的 eblasakimab ph2b 的 EASI-75 数据 12
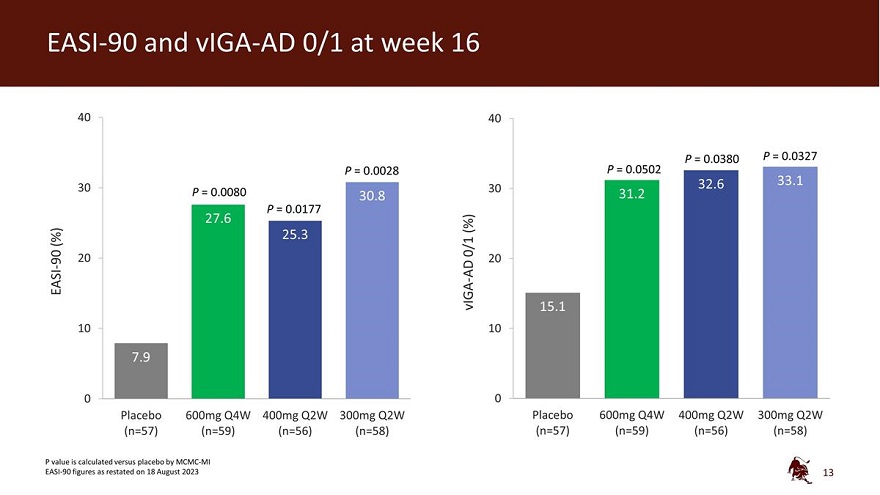
EASI-90 和 viga-ad 0/1 第 16 周 40 40 P = 0.0380 P = 0.0327 P = 0.0028 P = 0.0502 32.6 33.1 30 P = 0.0080 30 30.8 31.2 P = 0.0177 27.6 (%) (%) 25.3 0/1 90 20 20-AD EASI viga-15.1 10 7.9 0 0 安慰剂 600mg Q4W 400mg Q2MG W 300mg Q2W 安慰剂 600mg Q4W 400mg Q2W 300mg Q2W (n=57) (n=59) (n=59) (n=56) (n=58) (n=57) (n=59) (n=59) (n=56) (n=58) P值是根据2023年8月18日公布的 MCMC-MI EASI-90 数据与安慰剂对比计算的

EASI-90 Eblasakimab ph1b1 Eblasakimab ph2b2 dupilumab ph2b3 dupilumab ph2b3 dupilumab ph34 40 38.0 30 32.8 30.8 29.7 (%) 27.6 90 25.3 Elbasakimab ph2b2 dupilumab ph2b3 dupilumab ph2b3 dupilumab ph2b3 dupilumab ph34 40 38.0 30.8 30.8 29.7 (%) 27.6 90 25.3 Esi-20 15.0 10 7.9 7.9 7.4 3.3 Q2W Q2W Q2W Q2W 仅用于说明目的。不是 正面交锋比较。在比较不同产品和候选产品的试验数据时,应谨慎行事。试验 设计与患者群体和特征之间存在差异。此类试验的结果可能对我们现有或未来的结果没有解释价值。1 Veverka等人(2022年)EADV国会,因抢救时缺少 数据而接受救援治疗的患者。LOCF 分析方法,来自 MitT 人群的数据 2 患者在抢救治疗或因缺乏疗效而停药后被视为无反应者。MCMC-MI 适用于其他 缺失的数据 3 Thaci 等人(2016)《柳叶刀》387(10013): 40-52 和 EPAR,患者在抢救治疗后被视为无反应者。将无反应者归因应用于 缺失的数据。4 Thaci 等人(2019)J Dermatol Sci 94(2): 266-275,无反应者归咎于:在 2023 年 8 月 18 日重报的 eblasakimab ph2b 的 SOLO1 和 SOLO2 EASI-90 数据中,经抢救治疗或退出研究的患者被视为非反应者 14
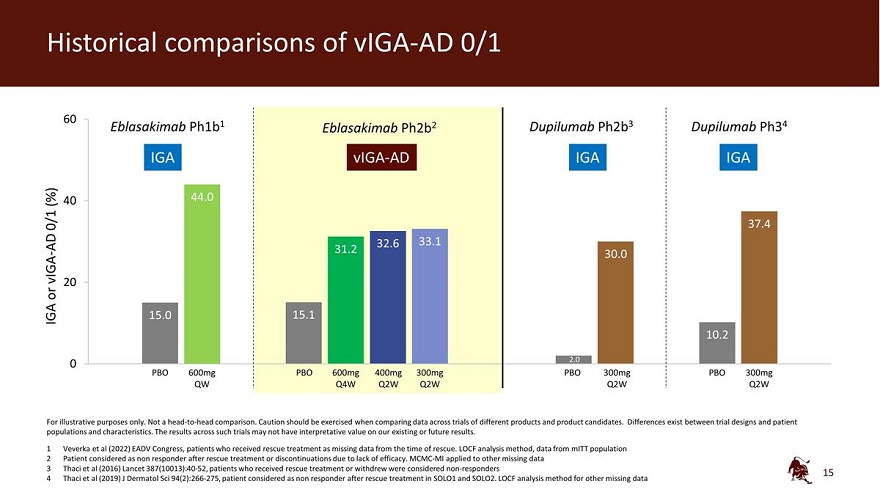
viga-ad 0/1 60 Eblasakimab ph1b1 Eblasakimab ph2b2 dupilumab ph2b3 dupilumab ph34 IGA viga-ad IGA IGA (%) 40 44.0 0/1 37.4 AD 32.6 33.1 31.2 viga-30.0 20 或 IGA 15.0 10.2 0 600mg PBO 600mg 400mg 300mg PBO 300mg PBO 300mg QBO 300mg Q4W Q2W Q2W Q2W Q2W Q2W Q2W 仅用于说明目的。不是 正面交锋比较。在比较不同产品和候选产品的试验数据时,应谨慎行事。试验设计与患者群体和 特征之间存在差异。此类试验的结果可能对我们现有或未来的结果没有解释价值。1 Veverka等人(2022年)EADV国会,因抢救时缺少数据而接受救援治疗的患者。LOCF 分析方法,来自 MitT 人群的数据 2 患者在抢救治疗后或因缺乏疗效而停药后被视为无反应者。MCMC-MI 适用于其他缺失的数据 3 Thaci 等人 (2016)《柳叶刀》387 (10013): 40-52,接受救援治疗或退出的患者被视为无反应者 4 Thaci 等人 (2019) J Dermatol Sci 94 (2): 266-275,患者在 SOLO1 和 SOLO2 中进行抢救治疗后被视为无反应者。其他缺失数据的LOCF分析方法 15
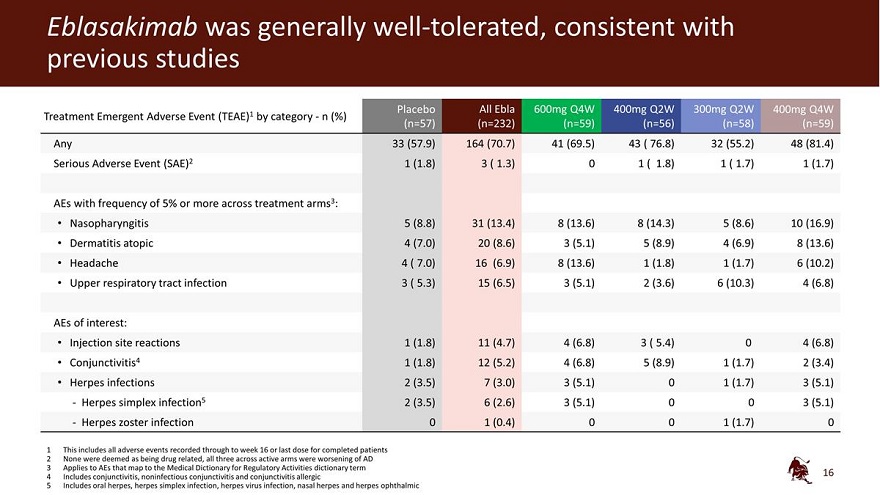
Eblasakimab 总体耐受性良好,与先前的研究一致 Analebo All Ebla 600mg Q4W 400mg Q2W 300mg Q2W 400mg Q4W 治疗紧急不良事件 (TEAE) 1 按类别划分——n (%) (n=57) (n=57) (n=232) (n=59) (n=59) 任何 33 (57.5) 9) 164 (70.7) 41 (69.5) 43 (76.8) 32 (55.2) 48 (81.4) 严重不良事件 (81.4) 严重不良事件 (SAE) 2 1 (1.8) 3 (1.3) 0 1 (1.8) 1 (1.7) 各治疗组频率为 5% 或更高的 AE 3:鼻咽炎 5 (8.8) 31 (13.4) 8 (14.3) 5 (8.6) 10 (16.9) 特应性皮炎 4 (7.0) 20 (8.6) 3 (5.1) 5 (8.9) 4 (6.9) 8 (13).6) 头痛 4 (7.0) 16 (6.9) 8 (13.6) 1 (1.8) 1 (1.8) 1 (1.7) 6 (10.2) 上呼吸道感染 3 (5.3) 15 (6.5) 3 (5.1) 2 (3.6) 6 (10.3) 4 (6.8) 感兴趣的 AE:注射部位反应 1 (1.8) 11 (4.7) 4 (6.8) 4 (6.8) 4 (6.8) 结膜 tis4 1 (1.8) 12 (5.2) 4 (6.8) 5 (8.9) 1 (1.7) 2 (3.4) 疱疹感染 2 (3.5) 7 (3.0) 3 (5.1) 0 1 (1.7) 3 (5.1)-单纯疱疹感染 5 2 (3.5) 6 (2.6) 3 (5.1) 0 3 (5.1) 0 3 (5.1)-带状疱疹感染 0 1 (0.4) 0 1 (1.7) 0 (1.7) 0 0 (1.7) 0 0 0 (1.7) 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 这包括在 16 周之前记录的所有不良事件或已完成的最后一剂剂量患者 2 没有人被视为与药物有关,所有三名活跃组均在 AD 恶化 3 适用于映射到《监管活动医学词典》词典术语的 AE 4 包括 结膜炎、非感染性结膜炎和结膜炎过敏性 5 包括口腔疱疹、单纯疱疹感染、疱疹病毒感染、鼻疱疹和眼部疱疹 16
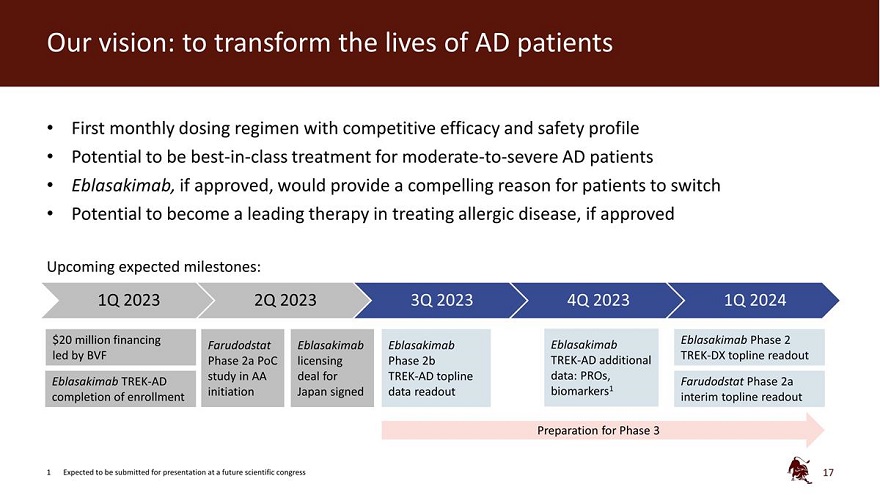
我们的愿景:改变 AD 患者的生活第一个具有竞争疗效和 安全特征的每月给药方案有潜力 一流的治疗 中度至重度AD患者 Eblasakimab 如果获得批准,将为患者提供一个令人信服的理由,如果获得批准,有可能成为治疗过敏性疾病的领先疗法即将到来的预期里程碑:2023年第一季度2023年第二季度2023年第四季度2024年第一季度2000万美元 融资 Eblasakimab 2期 Farudodstat Eblasakimab Eblasakimab Eblasakimab 由 BVF TREASAKIMAB 牵头 K-DX topline readout 第 2a 阶段 PoC 许可 2b 阶段 TREK-AD 附加研究 在 TREK-AD Topline 数据协议中:Pros、Eblasakimab TREK-AD Farudodstat 第 2a 阶段完成入学启动日本签署data readout biomarkers1 临时 topline 读出第 3 阶段的准备工作 1 预计将在未来的科学大会上提交演讲 17

问答 18
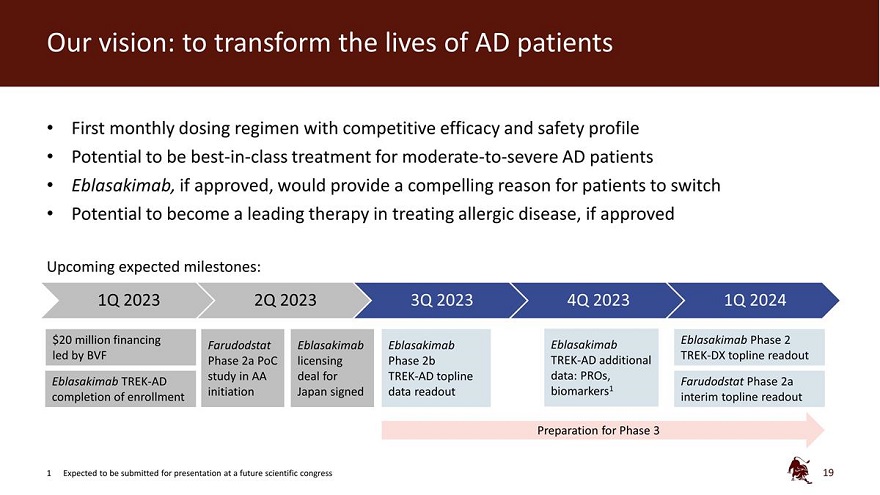
我们的愿景:改变 AD 患者的生活第一个具有竞争疗效和 安全特征的每月给药方案有潜力 一流的治疗 中度至重度AD患者 Eblasakimab 如果获得批准,将为患者提供一个令人信服的理由,如果获得批准,有可能成为治疗过敏性疾病的领先疗法即将到来的预期里程碑:2023年第一季度2023年第二季度2023年第四季度2024年第一季度2000万美元 融资 Eblasakimab 2期 Farudodstat Eblasakimab Eblasakimab Eblasakimab 由 BVF TREASAKIMAB 牵头 K-DX topline readout 第 2a 阶段 PoC 许可 2b 阶段 TREK-AD 附加研究 在 TREK-AD Topline 数据协议中:Pros、Eblasakimab TREK-AD Farudodstat 第 2a 阶段完成入学启动日本签署data readout biomarkers1 临时 topline 读出第 3 阶段的准备工作 1 预计将在未来的科学大会上提交演讲 19

Eblasakimab 2b 期 TREK-AD Topline 读数 2023 年 7 月 6 日重述 2023 年 8 月 18 日纳斯达克:ASLN ASLAN PHARMICALS