附录 99.1

新闻稿
(重报于 2023 年 8 月 18 日)
EBLASAKIMAB 的每月给药量显示出潜力 同类最佳治疗特应性皮炎 2B 期阳性研究
| • | Eblasakimab是第一个生物制剂 中度至重度特应性皮炎表现出竞争疗效,从一开始就每月给药一次,相当于每两周给药一次,支持进入第三阶段。 |
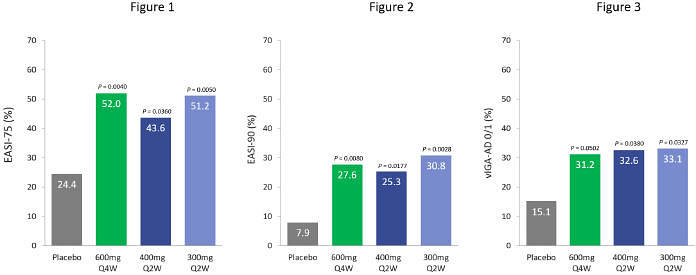
| • | 600 毫克 eblasakimab 剂量 在 TREK-AD 研究中,每四周一次达到具有统计学意义的主要终点,其中 52.0% 的患者达到 EASI-75,27.6% 的患者达到 EASI-90,31.2% 的患者达到 Viga-AD 为 0 或 1。 |
| • | 每两周给药一次的方案也满足了具有统计学意义的主要终点,并且 满足关键的次要终点。 |
| • | 观察到独特的负荷剂量方案可以快速起作用,到第 4 周,EASI 评分有统计学上的显著提高 。 |
| • | Eblasakimab 总的来说 在所有剂量水平下都具有良好的耐受性,结膜炎和注射部位反应的发生率低 ,这为差异化安全特征提供了可能性。 |
| • | 管理层将于今天,即美国东部时间7月6日上午 8:30 /新加坡标准时间晚上 8:30 主持网络直播。 |
加利福尼亚州圣马特奥和新加坡,2023年7月6日,ASLAN Pharmicals(纳斯达克股票代码:ASLN)是一家处于临床阶段、以免疫学为重点的生物制药公司,正在开发改变患者生活的创新疗法。该公司今天宣布了其2b期剂量范围研究的积极顶线数据 eblasakimab在患有 的成年患者中中度至重度特应性皮炎(AD),TREK-AD(使用eblasakimab治疗特应性皮炎的试验)研究。 Eblasakimab 在三个给药组中,湿疹区域和严重程度指数(EASI)评分在第16周达到与基线相比变化百分比的主要终点,安慰剂具有统计学意义:每4周给药600mg(600mg Q4W),从数字上讲,这是 表现最好的组,每2周给药400mg(400mg Q2W),每2周给药300mg(300mg Q2W),每2周给药300mg(300mg Q2W)W)。
Eblasakimab是一种靶向 2 型受体的 IL-13 受体亚基的新型单克隆抗体,这是 驱动几种过敏性炎症性疾病的关键途径。Eblasakimab已观察到一种独特的作用机制,可以对2型受体进行特异性阻断,防止通过白细胞介素4(IL-4)和白细胞介素13(IL-13)传导信号,这两者是AD炎症的关键驱动因素,同时避免了1型受体。
这是我们第一次看到 每月一次俄勒冈健康与科学大学弗朗西斯·斯托尔斯医学皮肤病学教授、TREK-AD研究首席研究员埃里克·辛普森医学博士说,治疗方案 提供了具有竞争力的疗效数据,这将改变AD患者的游戏规则。自推出以来,我们在进步方面还没有看到太多进展 dupilumab,而且患者所承受的疾病负担仍然很大,尚未得到满足。这些结果支持 eblasakimab如果获得批准,有可能成为治疗AD的领先疗法。
我们很高兴地宣布来自 TREK-AD 研究的这些积极的 topline 数据,这些数据支持了我们最近发表的转化研究 eblasakimabs独特的作用机制可以为阻断导致过敏性炎症的2型信号传导提供更有效、更有针对性的方法 。基于这些结果,我们认为 eblasakimabASLAN Pharmicals首席执行官Carl Firth博士说,如果获得批准,可以让更多的患者服用 EASI-75 或 EASI-90,不良副作用更少,起效迅速,而且每月给药一次的便利性独一无二。我们期待迅速进入AD 3期项目,并探索我们期望这种候选药物取得成功的广泛适应症。我们感谢 为发展做出如此重要贡献的患者、研究人员和我们的团队 eblasakimab.”