

2023 年 8 月 Larimar Therapeutics 公司介绍附录 99.1

本演示文稿包含基于Larimar Therapeutics, Inc.(“公司”)的信念和假设以及管理层目前获得的信息的前瞻性陈述。除历史事实陈述外,本演示文稿中包含的所有陈述均为前瞻性陈述,包括但不限于 Larimar 开发和商业化 CTI-1601 和其他计划中的候选产品的能力、Larimar 计划中的研发工作,包括其 CTI-1601 临床试验和总体开发计划的时机,以及与 Larimar 的业务战略、筹集资金的能力、资本使用、运营业绩和财务状况以及未来运营计划和目标有关的其他事项。在某些情况下,你可以用 “可能”、“将”、“可以”、“将”、“应该”、“期望”、“打算”、“计划”、“预期”、“相信”、“估计”、“预测”、“项目”、“潜力”、“继续”、“持续” 或这些术语或其他类似术语的负面词来识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些词语。这些陈述涉及风险、不确定性和其他因素,这些因素可能导致实际业绩、业绩或成就与这些前瞻性陈述所表达或暗示的信息存在重大差异。这些风险、不确定性和其他因素包括 Larimar 产品开发活动的成功、成本和时机、非临床研究和临床试验,包括 CTI-1601 临床里程碑以及就部分临床暂停与美国食品药品管理局的持续互动;初步的临床试验结果可能与最终的临床试验结果不同;CTI-1601 的早期非临床和临床数据以及测试可能无法预测后来的临床试验的结果或成功以及评估;潜在的影响Larimar 未来的临床试验、制造、监管、非临床研究时间表和运营以及总体经济状况的公共卫生危机;Larimar 和第三方制造商 Larimar 参与、优化和扩展 CTI-1601 制造流程的能力;Larimar 获得 CTI-1601 和未来候选产品的监管部门批准的能力;Larimar 有能力单独或与潜在的未来合作者一起发展销售和营销能力,以及成功商业化任何经批准的产品候选人;Larimar为开展产品开发活动筹集必要资金的能力;以及Larimar向美国证券交易委员会(SEC)提交的文件中描述的其他风险,包括但不限于拉里玛的定期报告,包括10-K表的年度报告、10-Q表的季度报告和8-K表的最新报告,这些报告已提交给美国证券交易委员会或提供给美国证券交易委员会,可在www.sec.gov上查阅。这些前瞻性陈述基于Larimar目前已知的事实和因素及其对未来的预测,对此尚不确定。因此,前瞻性陈述可能不准确。本演示文稿中的前瞻性陈述仅代表拉里玛管理层截至本文发布之日的观点。除非法律要求,否则Larimar没有义务出于任何原因更新任何前瞻性陈述。前瞻性陈述

投资亮点临床阶段的生物技术公司专注于满足弗里德赖希共济失调(FA)和其他潜在的复杂罕见疾病中未满足的需求,其基础是强大的知识产权组合支持的平台技术。主要候选药物 CTI-1601 是一种重组融合蛋白,旨在通过将蛋白输送到线粒体来直接解决弗雷他辛缺乏的问题。CTI-1601 已获得孤儿药(美国和欧盟)、罕见儿科疾病(美国)、Fast Track(美国)和 PRIME(欧盟)称号 FA 两项双盲、安慰剂对照的 1 期试验表明 CTI-1601 在每天给药长达 13 天时耐受性总体良好;在所有评估的组织中,观察到 frataxin (FXN) 水平与安慰剂相比的剂量依赖性增加。正在进行中的第 2 阶段,安慰剂对照,4 周 FA 的剂量探索研究;25 mg 队列数据显示 CTI-1601 总体耐受性良好,与安慰剂相比,皮肤中的 FXN 水平比基线高还有口腔细胞;试验推进到50毫克队列,预计数据将在2024年上半年公布;每日剂量为25毫克的OLE试验将于2024年第一季度获准启动。为了可能进一步提高2期研究或OLE研究的剂量,请向FDA提交来自50毫克队列的2期数据,因为临床持续停滞不前。1.042亿美元的现金余额(2023年6月30日),预计现金流将持续到2024年第四季度新型蛋白质替代疗法平台有史以来第一个提高frataxin水平的疗法已完成第一阶段概念验证2期和OLE研究的财务基础雄厚的财务基础

最新进展进展 CTI-1601 的长期给药开放标签延长和第 2 阶段剂量递增第二组在 2 期试验中评估 50 mg 的 FA 评估长期安全性、PK、frataxin 水平、疗效结果和自我给药能够将临床功能与弗里德赖希共济失调临床结果测量研究 (FACOMS) 数据库中匹配的一组未经治疗的患者进行比较 FDA Clearance* 评估安全性、药代动力学 (PK),Afetaxin 水平和剂量反应为增强 pk/frataxin 建模提供数据 Safety、PK 和frataxin 水平将为可能增加队列提供信息,每日剂量为 25 毫克的开放标签延期 (OLE) 试验 FDA Clearance * 预计在 2024 年上半年公布的顶级数据。预计在 2024 年第四季度公布初步中期数据 * 启动更多美国临床试验或这些试验可能进一步增加剂量取决于美国食品药品管理局对来自 50 毫克队列的第 2 阶段数据的审查,以及 OLE 由于部分临床搁置而获得的任何可用数据
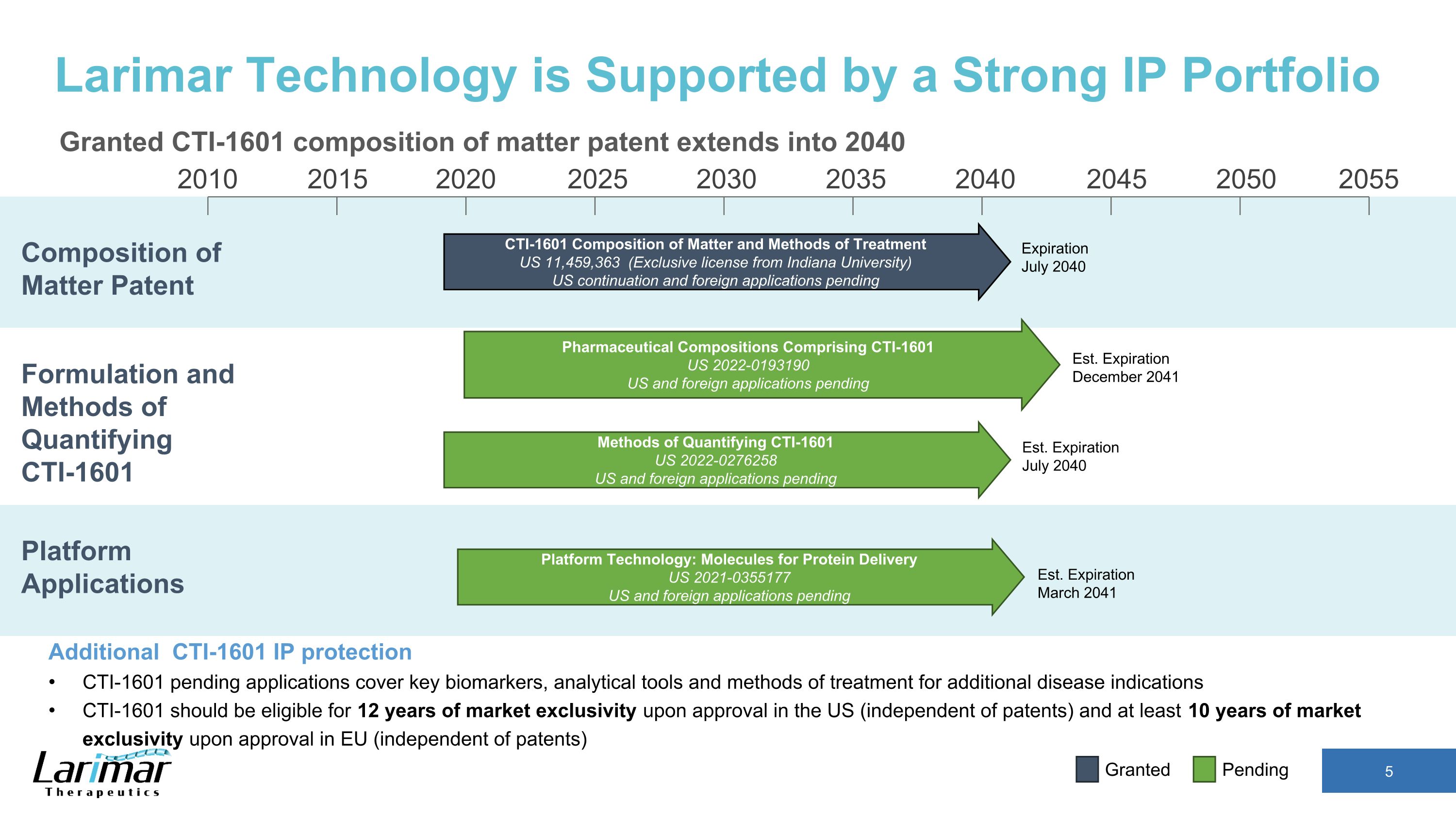
2015 2020 2030 2035 2040 2045 2050 2055 2010 2025 美国东部标准时间2041 年 3 月到期 CTI-1601 物质成分和治疗方法美国 11,459,363(印第安纳大学的独家许可)美国延续和外国申请待定 2040 年 7 月到期 Larimar Technology 由强大的知识产权组合支持 CTI-1601 物质成分专利延期至 2040 年其他 CTI-1601 知识产权保护 CTI-1601 待审申请涵盖关键生物标志物、分析工具和其他疾病适应症的治疗方法 CTI-1601 应有资格进入市场 12 年在美国获得批准后即具有排他性(独立于专利),在欧盟获得批准后拥有至少 10 年的市场独家经营权(独立于专利)待批准的平台申请配方和量化 CTI-1601 平台技术:用于蛋白质输送的分子美国 2021-0355177 美国和外国申请待批药物成分包括 CTI-1601 US 2022-0193190 美国和外国申请的量化方法 CTI-1601 美国 2022-0276258 美国和外国申请美国东部标准时间待定美国东部标准时间 2041 年 12 月到期2040 年 7 月到期

由导致弗拉他辛水平低的遗传缺陷引起 FA 患者产生的弗拉他辛水平仅为正常水平的 20-40% 左右,具体取决于组织、采样技术和所考虑的测定。1 影响全球约 20,000 名患者,美国约有 5,000 名患者,其余大多数患者在欧盟 14 岁之前出现初始症状可能包括姿势不稳定、经常跌倒和行走困难。当症状出现时,可能已经发生心脏损伤。进行性疾病:症状恶化,患者最终只能坐在轮椅上,言语变得犹豫不决和生涩(通常被称为 “扫描语音”)预期寿命为30-50岁通常由心脏病引起的早期死亡没有可用的疗法会增加弗雷他辛水平只有批准用于FA的治疗无法解决弗雷他辛缺乏症弗雷德赖希的共济失调(FA)罕见和进行性疾病 6 1.E.C. Deutsch 等人分子遗传学与代谢 101 (2010) 238—245 LRMR 继续与弗里德赖希的共济失调研究联盟保持着密切的关系,专注于 FA 治疗的 FA 患者倡导小组
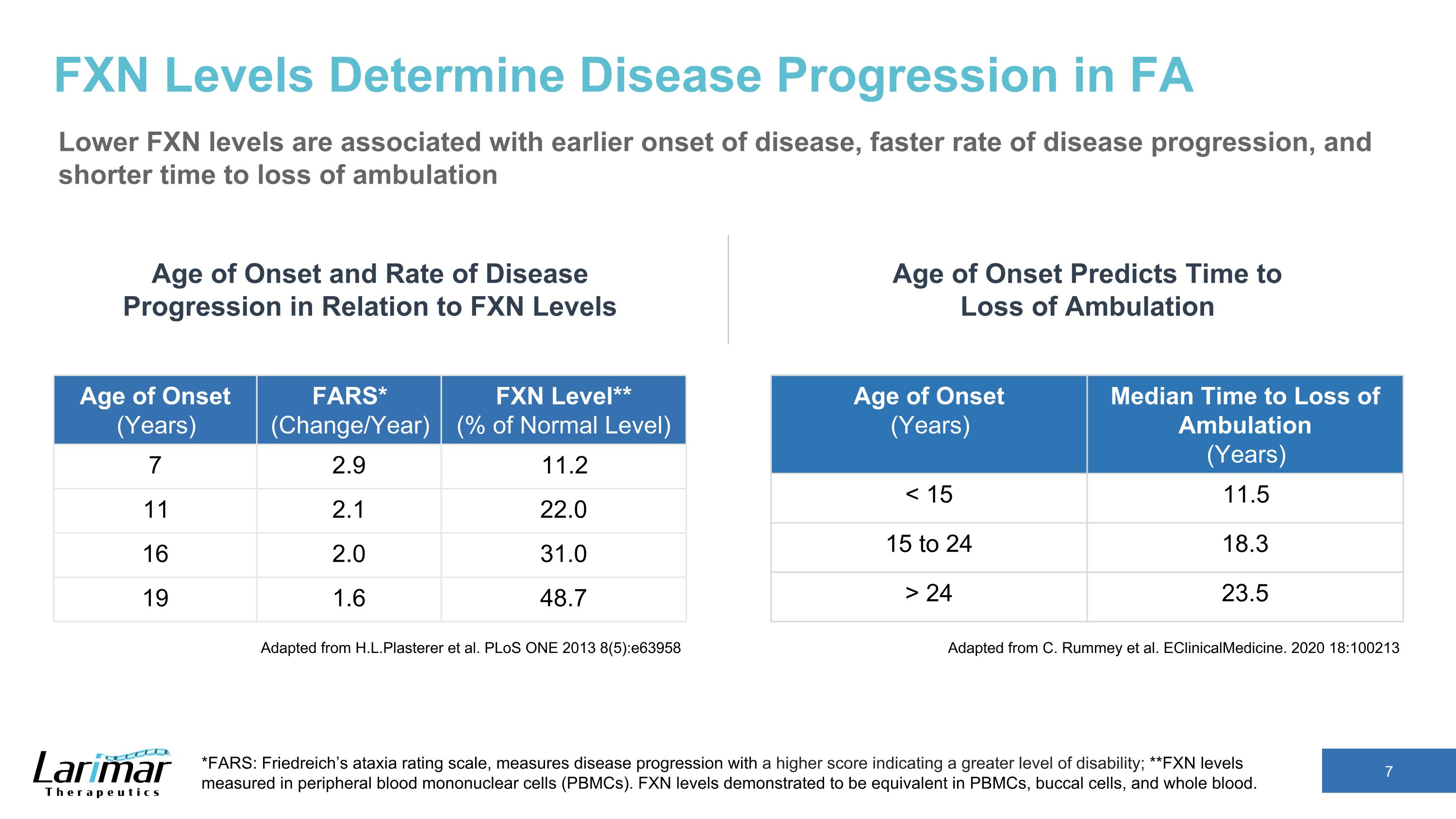
FXN 水平决定了 FA 中的疾病进展较低 FXN 水平与疾病发作较早、疾病进展速度更快以及行走损失时间缩短有关。改编自 H.L.Plasterer 等人PLoS ONE 2013 8 (5): e63958 发病年龄(年)行走中位时间(年)24 23.5 发病年龄和疾病进展率与 FXN 水平的关系 *FARS:弗里德赖希的共济失调评级量表,以更高的分数衡量疾病进展,表示残疾程度更高;**在外周血单核细胞(PBMC)中测得的 FXN 水平。事实证明,PBMC、颊细胞和全血中的 FXN 水平相当。发病年龄(年)FARS*(变化/年)FXN 等级**(正常水平的百分比)7 2.9 11.2 11 2.1 2 11 2.0 16 2.0 16 2.0 31.0 19 1.6 48.7 改编自 C. Rummey 等人eclinicalMedicine。2020 18:100213 发病年龄预测行走中断的时间
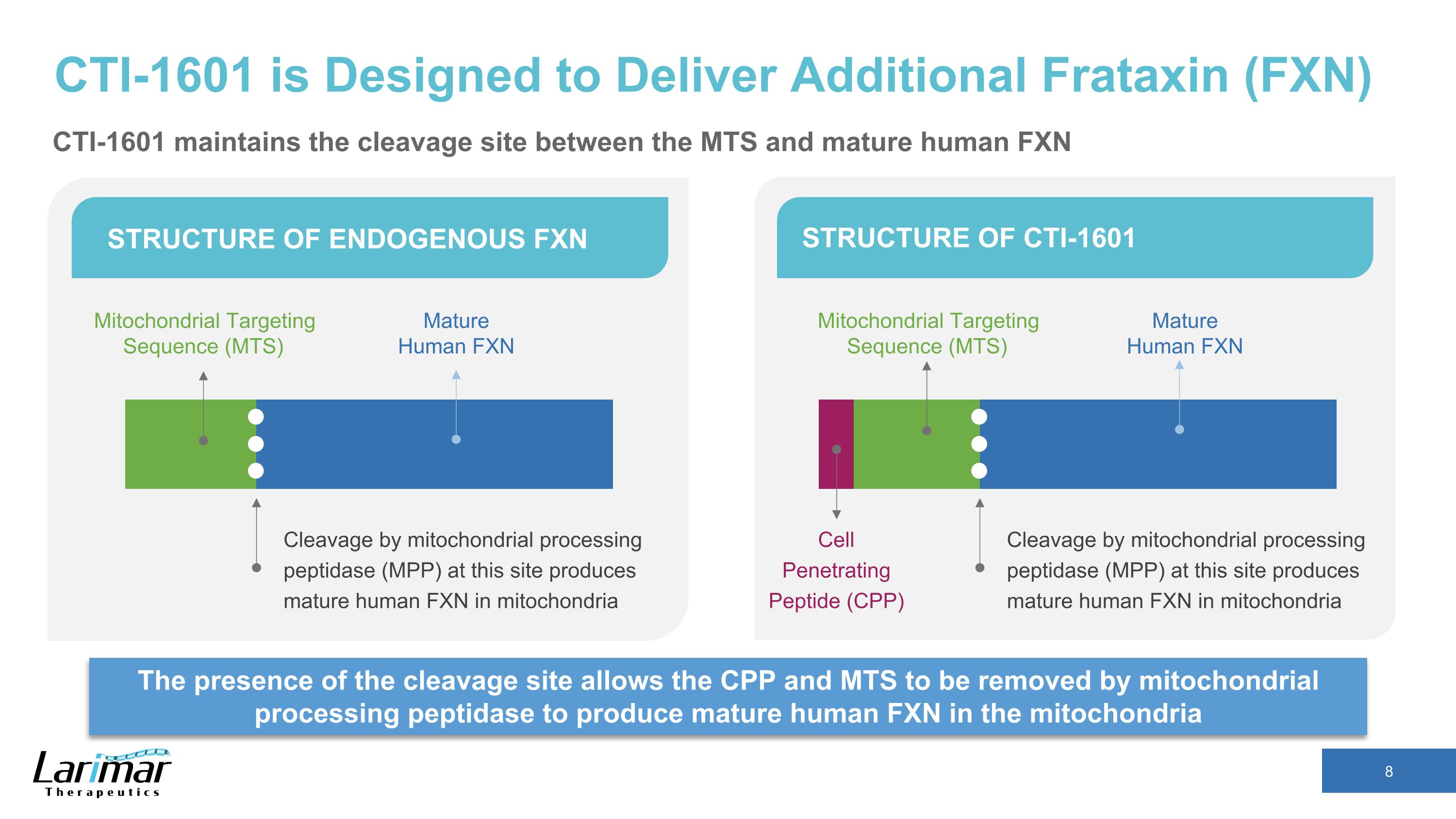
CTI-1601 旨在提供额外的 FRATAXIN (FXN) 裂解位点的存在允许线粒体处理肽酶去除 CPP 和 MTS,从而在线粒体中产生成熟的人类 FXN 的内源性 FXN 结构 CTI-1601 的结构 cleavage 通过线粒体处理肽酶 (MPP) 在该位点产生成熟的人类 FXN 线粒体处理肽酶 (MPP) 线粒体靶向序列 (MTS) 成熟人类 FXN 裂解线粒体中成熟的人类 FXN 成熟人类 FXN 细胞穿透肽 (CPP) 线粒体靶向序列 (MTS) CTI-1601 维持 MTS 和成熟人类 FXN 之间的裂解位点
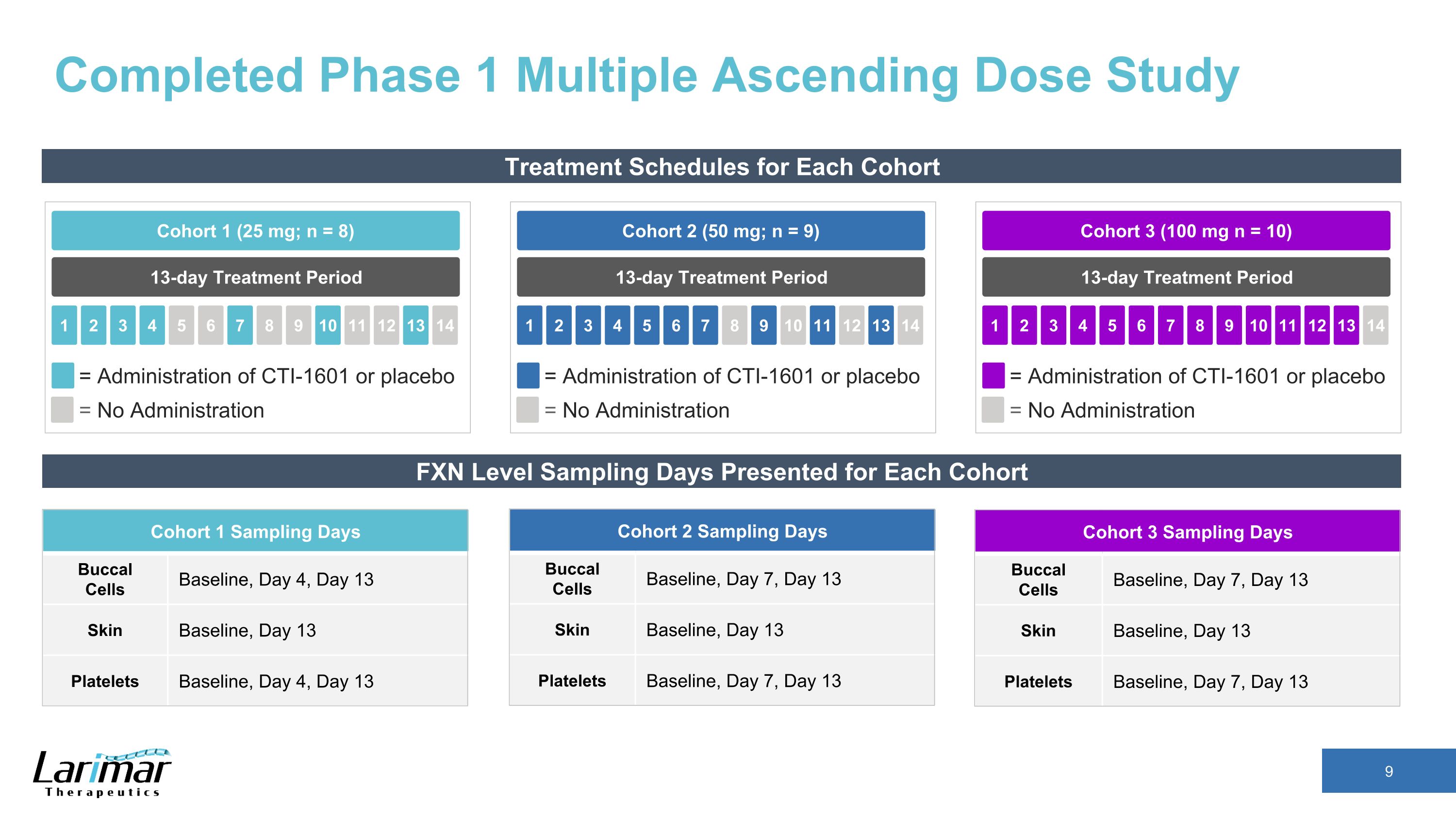
已完成每个队列 13 天治疗期队列 2(50 mg;n = 9)2 3 4 5 1 6 7 8 9 10 11 13 14 = 服用 CTI-1601 或安慰剂 = 不给药 13 天治疗期队列 1(25 mg;n = 8)2 3 4 5 1 6 7 8 9 10 11 13 14 = 不给药 CTI-1601 或安慰剂 13 天治疗周期队列 3 (100 mg n = 10) 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = 给药 CTI-1601 或安慰剂 = 未给药 FXN 水平抽样天数 1采样天口腔细胞基线、第 4 天、第 13 天皮肤基线、第 13 天血小板基线、第 4 天、第 13 天队列 2 采样天口腔细胞基线、第 7 天、第 13 天皮肤基线、第 13 天血小板基线、第 7 天、第 13 天皮肤基线、第 7 天、第 13 天血小板基线、第 7 天、第 13 天
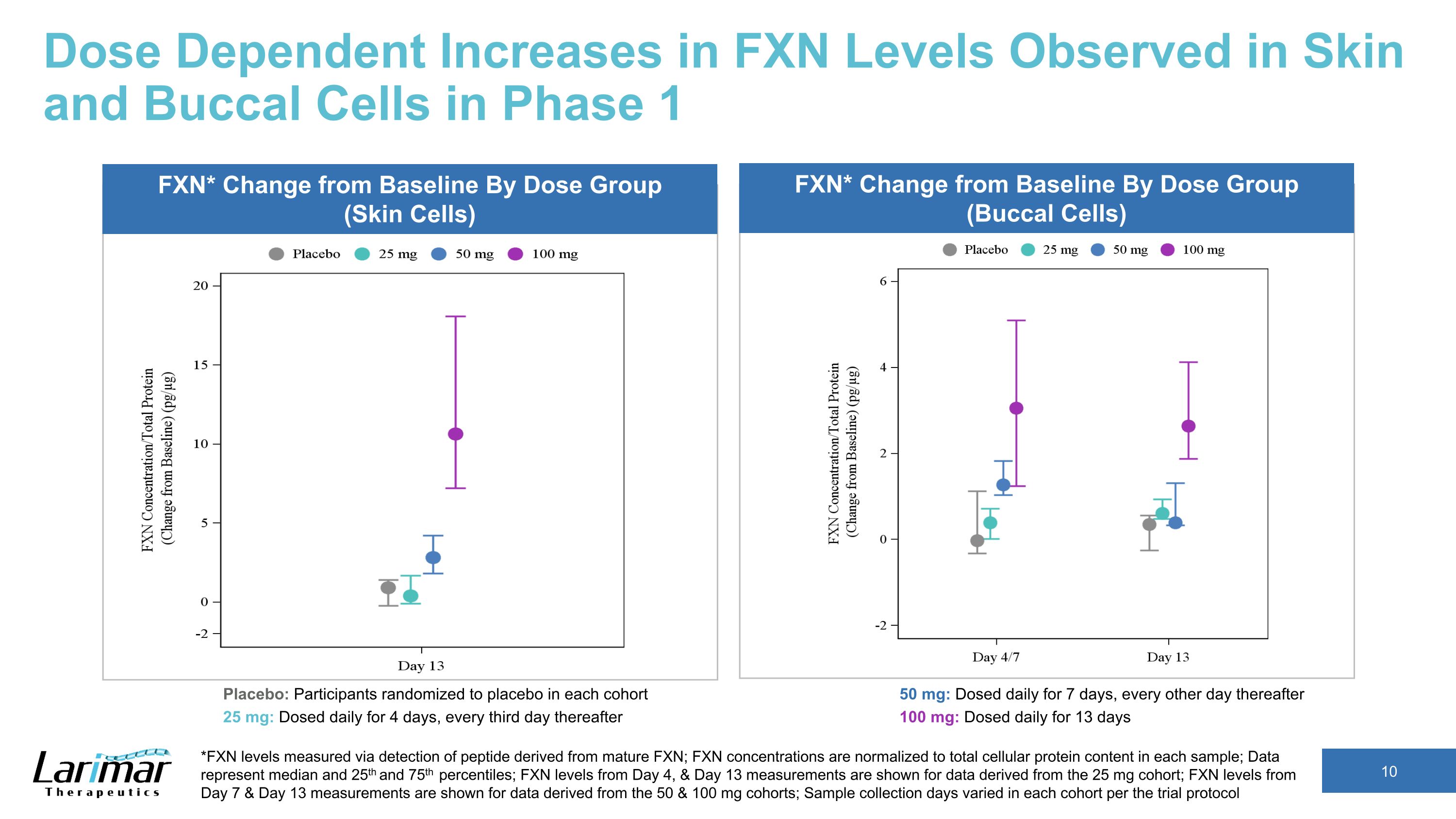
第 1 阶段在皮肤和颊细胞中观察到的 FXN 水平的剂量依赖性增加 *FXN 水平通过检测来自成熟 FXN 的肽来测量;FXN 浓度归一化为每个样本中的细胞蛋白总含量;数据代表中位数以及第 25 个和第 75 个百分位数;显示了从 25 mg 队列中得出的第 4 天和第 13 天的FXN水平;显示了数据中第7天和第13天的FXN水平源自 50 和 100 毫克队列;根据试验方案,每个队列的样本采集天数各不相同 FXN* Change从基线按剂量组(皮肤细胞)FXN* 与基线的变化按剂量组(口腔细胞)安慰剂:每个队列中随机分配到安慰剂的参与者 25 mg:每天给药 4 天,之后每三天给药 50 mg:每天给药 7 天,之后每隔一天 100 mg:每天给药,持续 13 天

第 2 阶段剂量探索研究推进到 50 mg 队列目标:进一步表征 PK/PD 并评估安全性,以告知长期剂量和剂量方案治疗时间表 28 天治疗期 16 17 18 19 15 21 22 23 24 25 27 28 2 3 4 5 1 6 7 8 9 10 11 13 14 = 服用 CTI-1601 或安慰剂 = 无给药研究详情人群流动和非活动性弗里德赖希共济失调患者 ≥ 18 岁年龄。CTI-1601 治疗天真或参与了之前的 Larimar 研究(如果符合条件)。剂量队列 1:25 mg 队列 2:50 mg 关键终点外周组织中的 Frataxin 水平、PK、安全性和耐受性。其他终点包括脂质谱和基因表达数据。患者人数队列 1:入组 13 名参与者(9 人服用 CTI-1601;4 人服用安慰剂)。群组 2:旨在招收大约 12-15 名参与者,随机分配 2:1 接受 CTI-1601 或安慰剂。第 1 组的定时给药已完成。第 2 组已获准启动。预计将于 2024 年上半年发布第 2 期群组的顶级数据。
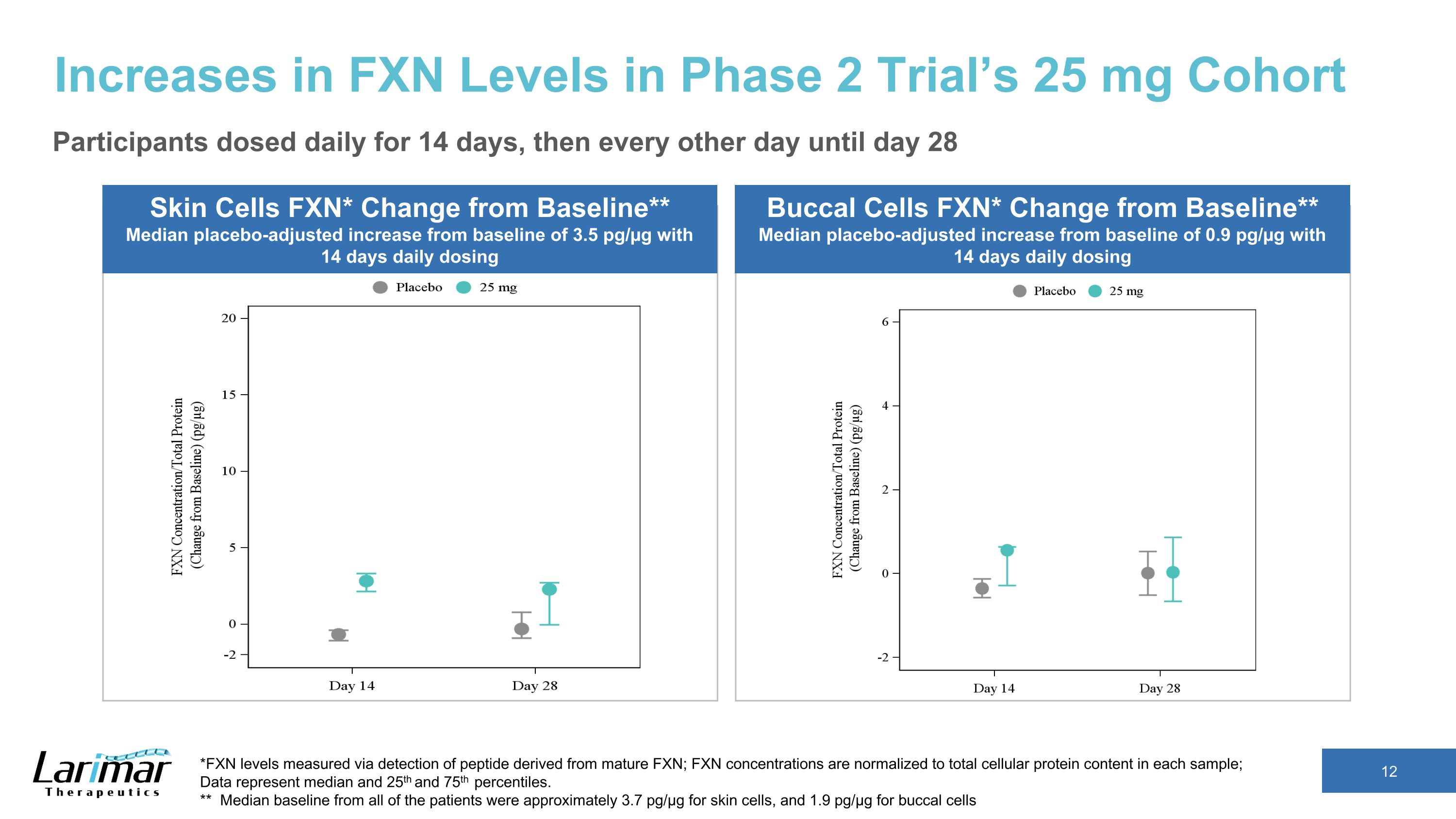
第 2 期试验的 25 mg 队列皮肤细胞 FXN 水平升高 FXN* 与基线相比的变化** 安慰剂调整后的平均增幅比基线为 3.5 pg/µg,每日给药 14 天 *通过检测源自成熟 FXN 的肽测得的 FXN 水平;FXN 浓度归一化为每个样本中的细胞蛋白总含量;数据代表中位数,第 25 和第 75 个百分位数。** 所有患者的基线中位数约为 3.7 pg/µg。皮肤细胞为 µg,颊细胞 1.9 pg/µg buccal Cells FXN* 与基线相比的变化** 安慰剂中位数-调整后的基线增加量为0.9 pg/µg,每天给药 14 天,参与者每天服药 14 天,然后每隔一天服药一次,直到第 28 天
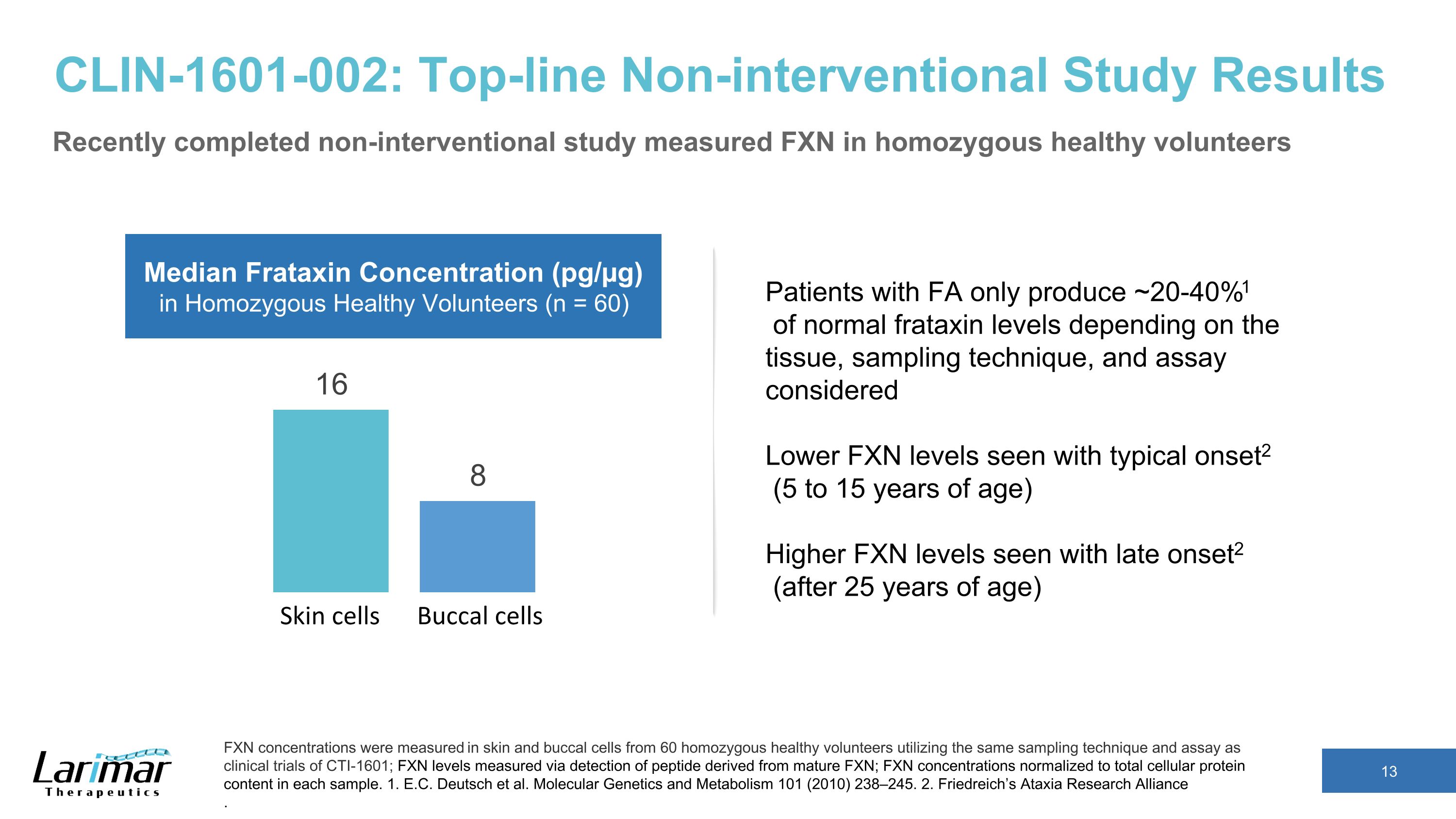
CLIN-1601-002:顶级非干预研究结果最近完成的非干预研究测量了纯合健康志愿者中的 FXN,使用与 CTI-1601 临床试验相同的采样技术和测定方法测量了 60 名纯合健康志愿者的皮肤和颊细胞中的 FXN 浓度;FXN 水平通过检测源自成熟 FXN 的肽来测量;FXN 浓度标准化为每个样本中的细胞蛋白总含量。1.E.C. Deutsch 等人分子遗传学和新陈代谢 101 (2010) 238—245。2.弗里德赖希的共济失调研究联盟。皮肤细胞 buccal 细胞 Homozygous Healthy 志愿者(n = 60)FA 患者产生的弗拉他辛浓度中位数(pg/µg)仅为正常的 20-40% 1,具体取决于组织、采样技术和所考虑的测定,典型 onset2(5 至 15 岁)出现的 FXN 水平较高 2(25 岁后)

临床数据表明 CTI-1601 的耐受性总体良好 CTI-1601 在多项研究中向 37 名不同的 FA 成年人注射 37 名临床试验参与者中,有 35 人完成了各自的研究。一名 2 期参与者因过敏反应通过标准治疗得以缓解而退出 50 mg 队列中的一名 1 期参与者因轻度至中度恶心和呕吐而退出。任何 CTI-1601 临床试验中没有严重的不良事件或重要医学事件一项严重不良事件(过敏反应)消退了 CTI-1601上面提及的标准治疗方法)最常见的不良事件(aE)是轻度和中度注射部位反应(ISR)在所有试验中,100% 接受CTI-1601治疗的参与者和接受安慰剂治疗的参与者中,除ISR外,AE的数量和严重程度没有随着剂量的增加而增加,没有因ISR而终止,所有不良反应的数量和严重程度均未随剂量增加而增加
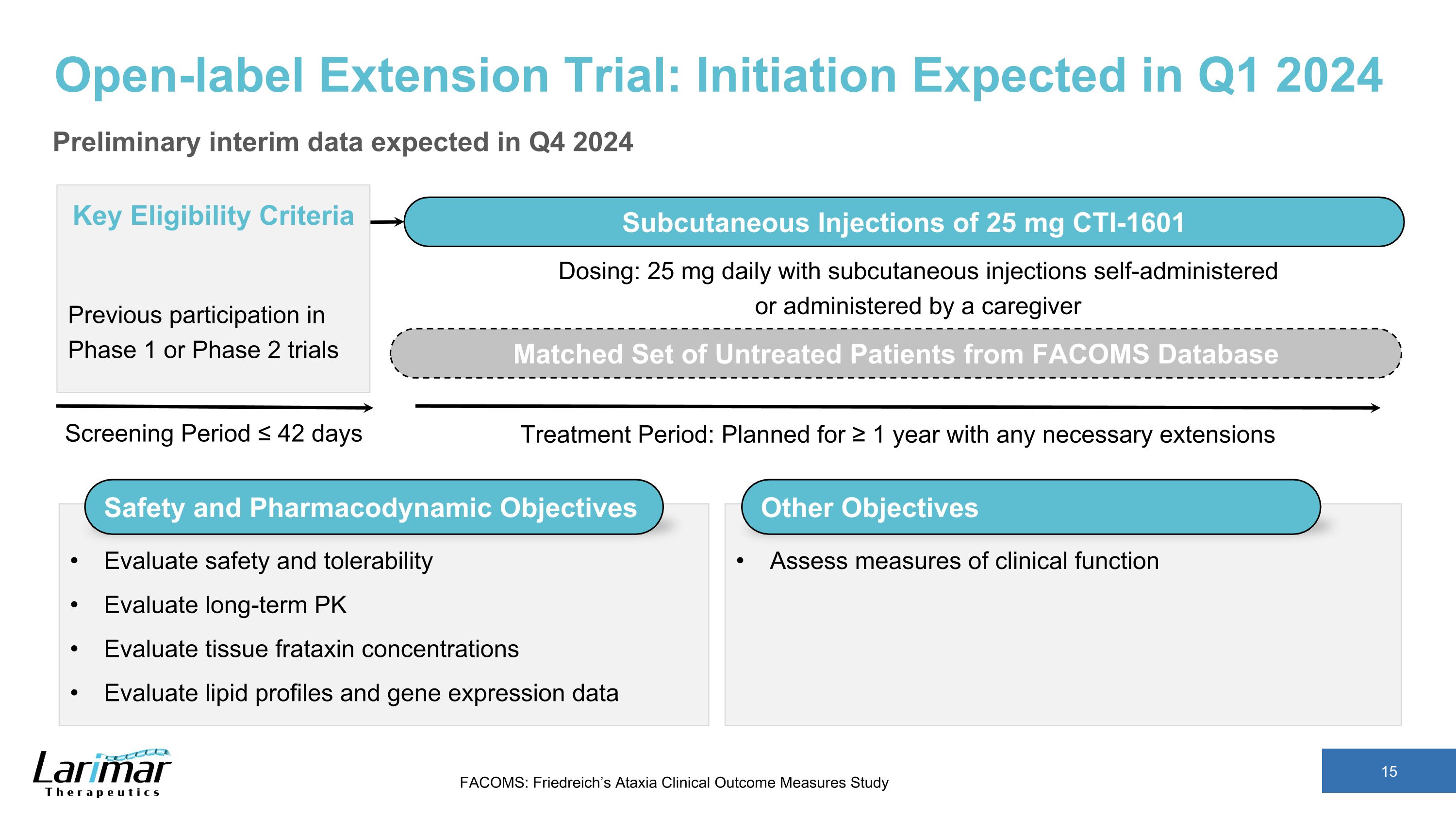
开放标签延期试验:预计于 2024 年第 1 季度启动初步中期数据预计于 2024 年第四季度筛选期 ≤ 42 天关键资格标准先前参与的 1 期或 2 期试验皮下注射 25 mg CTI-1601 治疗期:计划持续 ≥ 1 年,并进行必要的延长 FACOMS 数据库中匹配的一组未经治疗的患者评估安全性和耐受性评估长期 PK 评估组织 frataxin 浓度评估脂质谱和基因表达数据剂量:25 毫克每天皮下注射自行给药或由护理人员给药其他目标评估临床功能的衡量标准 FACOMS:Friedreich 的共济失调临床结果测量研究

CTI-1601 临床开发计划正在进行和计划中的试验* 包括:全球双盲安慰剂对照关键试验*** 开放标签延长试验,对参加 SAD、MAD 和/或为期四周的剂量探索研究的符合条件的患者,每天给药 25 毫克。预计于 2024 年第一季度启动。在 2 至 17 岁患者中进行 MAD 试验**。参与者有资格筛选 OLE 试用。第二阶段,为期四周的剂量探索研究,旨在确定长期研究的剂量和剂量方案。晋升至 50 毫克队列。预计将于2024年上半年进行的50毫克2期剂量探索试验的顶线数据 *在2期或OLE试验中启动更多美国临床试验或可能进一步增加剂量取决于成年患者因部分临床搁置而向美国食品和药物管理局提交的额外数据。**公司正计划与FDA讨论如何最好地将2至17岁的患者纳入临床开发***公司计划与FDA就适当的关键试验终点(包括FXN水平的价值)展开讨论。此外,该公司正计划与美国以外的监管机构和研究人员进行讨论,将临床项目扩展到国际地区。奥莱
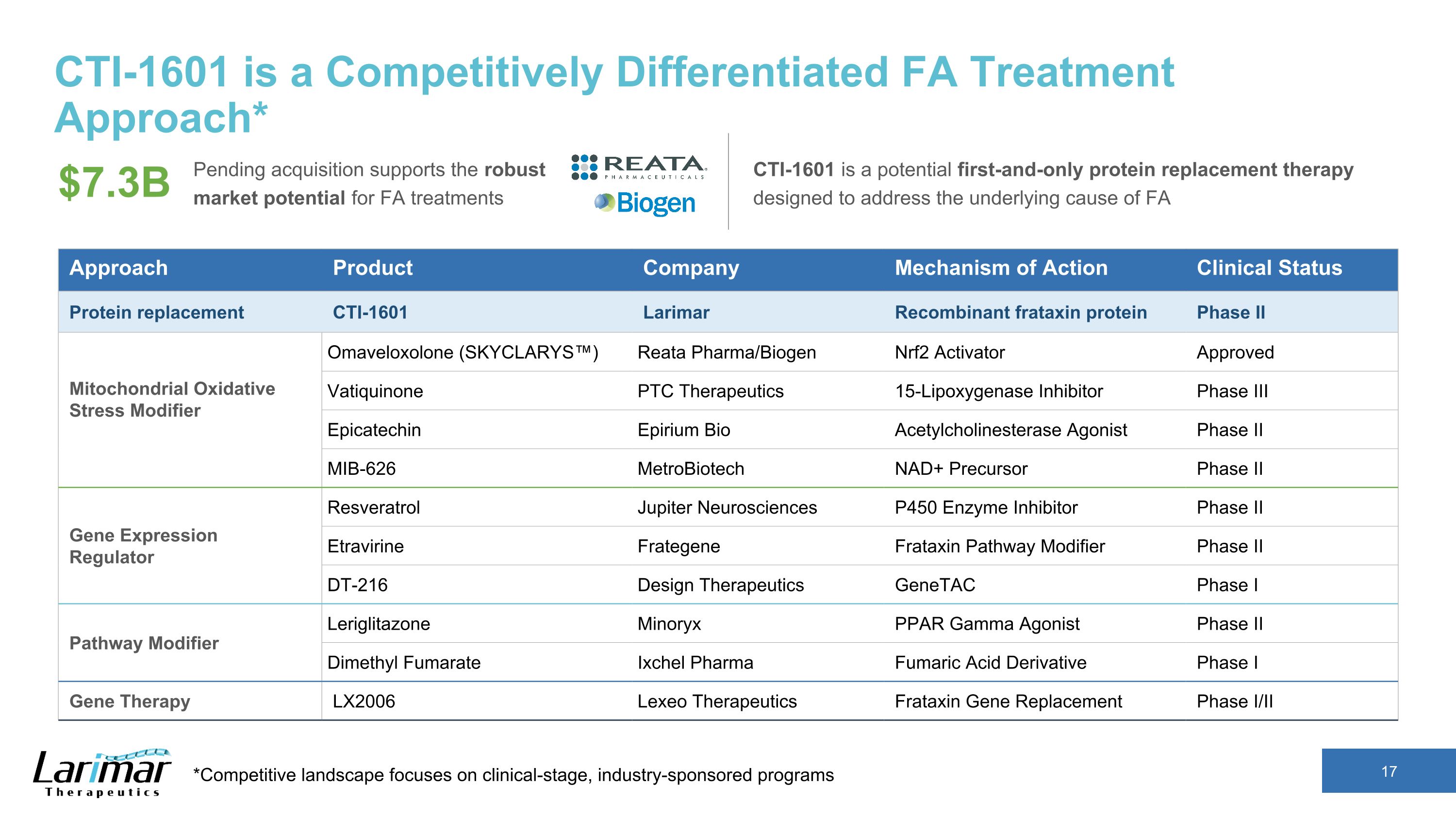
CTI-1601 是一种竞争差异化的 FA 治疗方法* *竞争格局侧重于临床阶段、行业赞助的项目。有待收购支持 FA 治疗的强劲市场潜力 CTI-1601 是一种潜在的首款也是唯一的蛋白质替代疗法,旨在解决 FA 73 亿美元的潜在原因 Approduct Company 作用机制蛋白质替代品 CTI-1601 Larimar 重组 frataxin 蛋白 Phase II 线粒体氧化应激修饰剂 Omaveloxol one (SKYCLARYS) Reata Pharma/Biogen Nrf2Activator 批准的 Vatiquinone PTC Therapeutics 15-Lipoxygenase 抑制剂 III 期 Epicatechin Epirium 生物乙酰胆碱酯酶激动剂 II 期 MIB-626 MetroBiotics NAD+ 前体二期基因表达调节剂 Etravirine Frategene Frategene Fratexin 途径修改剂 Leriglitazone Mini 阶段 DT-216 设计疗法 GenetaC 第一阶段途径修饰剂 Leriglitazone Mini oryx PPAR 伽玛激动剂 II 期富马酸二甲酯 Ixchel Pharma 富马酸衍生物 I 期基因疗法 LX2006 Lexeo Therapeutics Frataxin 基因替换阶段 I/II

2023 年第三季度监管更新:2024 年第 1 季度启动 50 毫克队列 2 期剂量探索试验:2024 年上半年启动开放标签延期试验:2024 年第 4 季度第 2 期试验 50 毫克队列的顶线数据:来自开放标签延期试验的中期数据 FA 的 CTI-1601 第 2 期剂量探索试验获准进入 50 毫克队列开放标签延期试验,每日剂量 25 毫克已获准开始扩大 CTI-1601 临床计划的准备工作至美国以外地区摘要:CTI-1601 已获美国食品药品管理局批准晋级 CTI-1601临床开发总体耐受性良好 1 期所有评估组织中 FXN 水平的剂量依赖性增加 2 期所有评估组织(皮肤和口腔细胞)中与安慰剂相比,FXN 比基线增加

投资亮点临床阶段的生物技术公司专注于满足弗里德赖希共济失调(FA)和其他潜在的复杂罕见疾病中未满足的需求,其基础是强大的知识产权组合支持的平台技术。主要候选药物 CTI-1601 是一种重组融合蛋白,旨在通过将蛋白输送到线粒体来直接解决弗雷他辛缺乏的问题。CTI-1601 已获得孤儿药(美国和欧盟)、罕见儿科疾病(美国)、Fast Track(美国)和 PRIME(欧盟)称号 FA 两项双盲、安慰剂对照的 1 期试验表明 CTI-1601 在每天给药长达 13 天时耐受性总体良好;在所有评估的组织中,观察到 frataxin (FXN) 水平与安慰剂相比的剂量依赖性增加。正在进行中的第 2 阶段,安慰剂对照,4 周 FA 的剂量探索研究;25 mg 队列数据显示 CTI-1601 总体耐受性良好,与安慰剂相比,皮肤中的 FXN 水平比基线高还有口腔细胞;试验推进到50毫克队列,预计数据将在2024年上半年公布;每日剂量为25毫克的OLE试验将于2024年第一季度获准启动。为了可能进一步提高2期研究或OLE研究的剂量,请向FDA提交来自50毫克队列的2期数据,因为临床持续停滞不前。1.042亿美元的现金余额(2023年6月30日),预计现金流将持续到2024年第四季度新型蛋白质替代疗法平台有史以来第一个提高frataxin水平的疗法已完成第一阶段概念验证2期和OLE研究的财务基础雄厚的财务基础

谢谢 Larimar Therapeutics 2023 年 8 月公司最新消息

附录拉里玛疗法

Chondrial Therapeutics的科学顾问委员会联合创始人,后来成为Larimar Therapeutics, Inc. 印第安纳大学医学院儿科教授 Mark Payne,医学博士费城儿童医院(CHOP)线粒体医学前沿项目执行董事,宾夕法尼亚大学佩雷尔曼医学院儿科系人类遗传学系教授 Marni J. Falk 医学博士加州大学旧金山分校 (UCSF) 运动障碍和神经调节中心。卡林和艾伦·维格纳捐赠了神经病学教授吉尔·奥斯特雷姆、医学博士乔瓦尼·曼弗雷迪、医学博士、芬巴博士和威尔康奈尔医学院临床与研究神经病学玛丽安·肯尼教授。威尔康奈尔医学院神经科学教授。

公司与弗里德赖希的共济失调研究联盟 (FARA) National 有着牢固的关系,该非营利组织致力于追求科学研究,从而为FA的治疗和治疗提供FA的治疗和治疗方法 FARA为业界提供多个关键项目访问全球患者登记处提供1,000多名FA患者的人口统计和临床信息 2017 年赞助了一次以患者为中心的药物开发会议,最终出版了一份名为《患者之声》的出版物,与 FARA 的密切关系

第 1 阶段的其他数据

CTI-1601:FA 患者 1 期临床项目 1 期发展计划两项针对 FA 患者给药患者的双盲、安慰剂对照剂量试验 2019 年 12 月开始安全审查委员会评估了每个队列之间的所有失明数据,以确保患者安全受试者人数:28 剂量水平:25 mg、50 mg、75 mg 和 100 mg(皮下给药)治疗持续时间:1 天 1° 终点:安全性和耐受性 2° 终点:PK;;FXN 等级;多重探索状态:完成单剂量递增剂量 (SAD) 受试者人数:27 剂量范围:25 mg、50 mg、100 mg(皮下给药)治疗方案:在 13 天内增加多次皮下给药 1° 终点:安全性和耐受性 2° 终点:PK;PD;FXN 水平(口腔细胞、血小板、可选皮肤活检);多项探索状态:完成多剂量递增剂量 (MAD) SAD 试验中符合条件的患者可以报名参加 MAD 试验计划包括双盲、安慰剂对照单剂量和多剂量递增试验
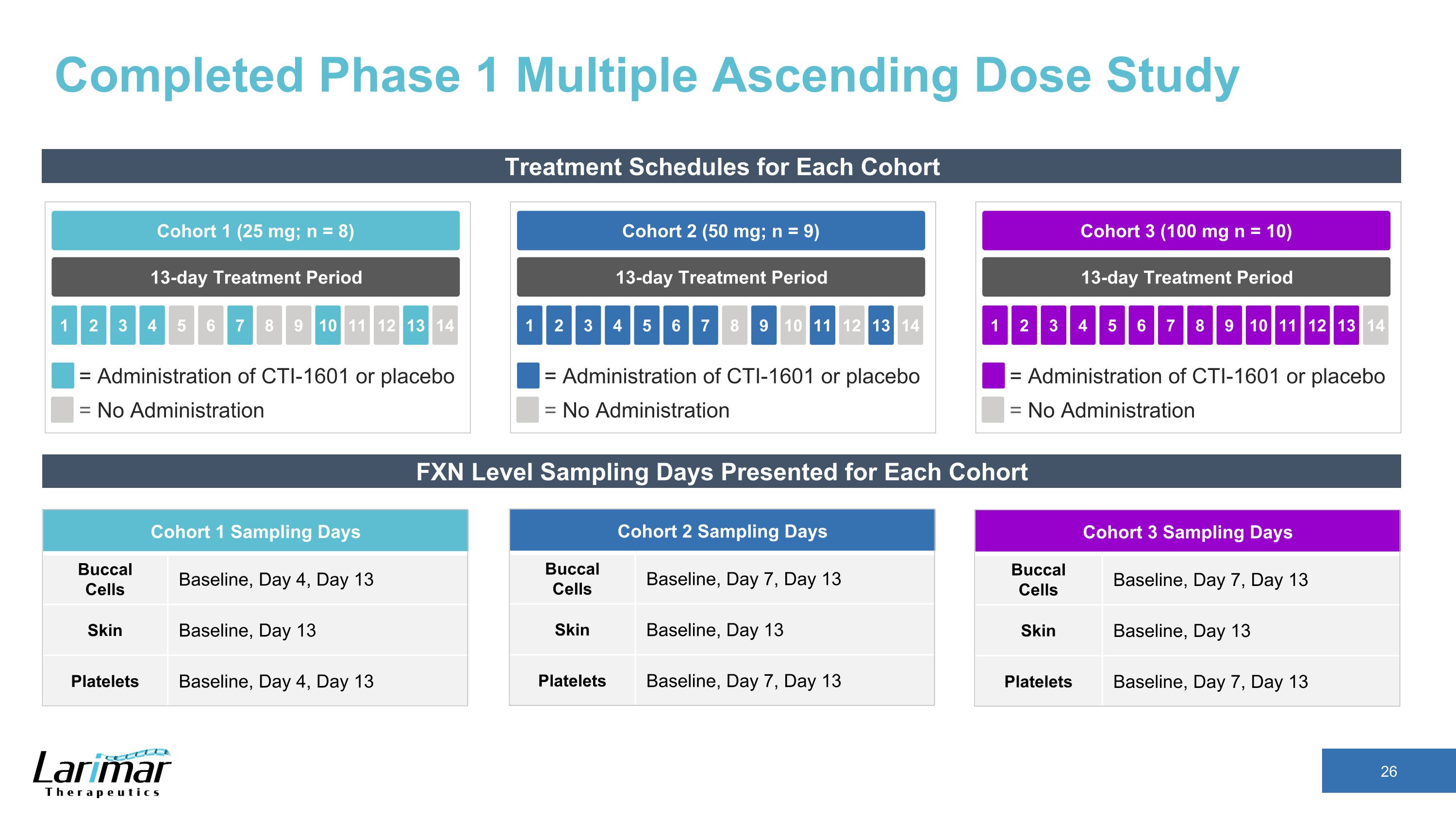
已完成每个队列 13 天治疗期队列 2(50 mg;n = 9)2 3 4 5 1 6 7 8 9 10 11 13 14 = 服用 CTI-1601 或安慰剂 = 不给药 13 天治疗期队列 1(25 mg;n = 8)2 3 4 5 1 6 7 8 9 10 11 13 14 = 不给药 CTI-1601 或安慰剂 13 天治疗周期队列 3 (100 mg n = 10) 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = 给药 CTI-1601 或安慰剂 = 未给药 FXN 水平抽样天数 1采样天口腔细胞基线、第 4 天、第 13 天皮肤基线、第 13 天血小板基线、第 4 天、第 13 天队列 2 采样天口腔细胞基线、第 7 天、第 13 天皮肤基线、第 13 天血小板基线、第 7 天、第 13 天皮肤基线、第 7 天、第 13 天血小板基线、第 7 天、第 13 天
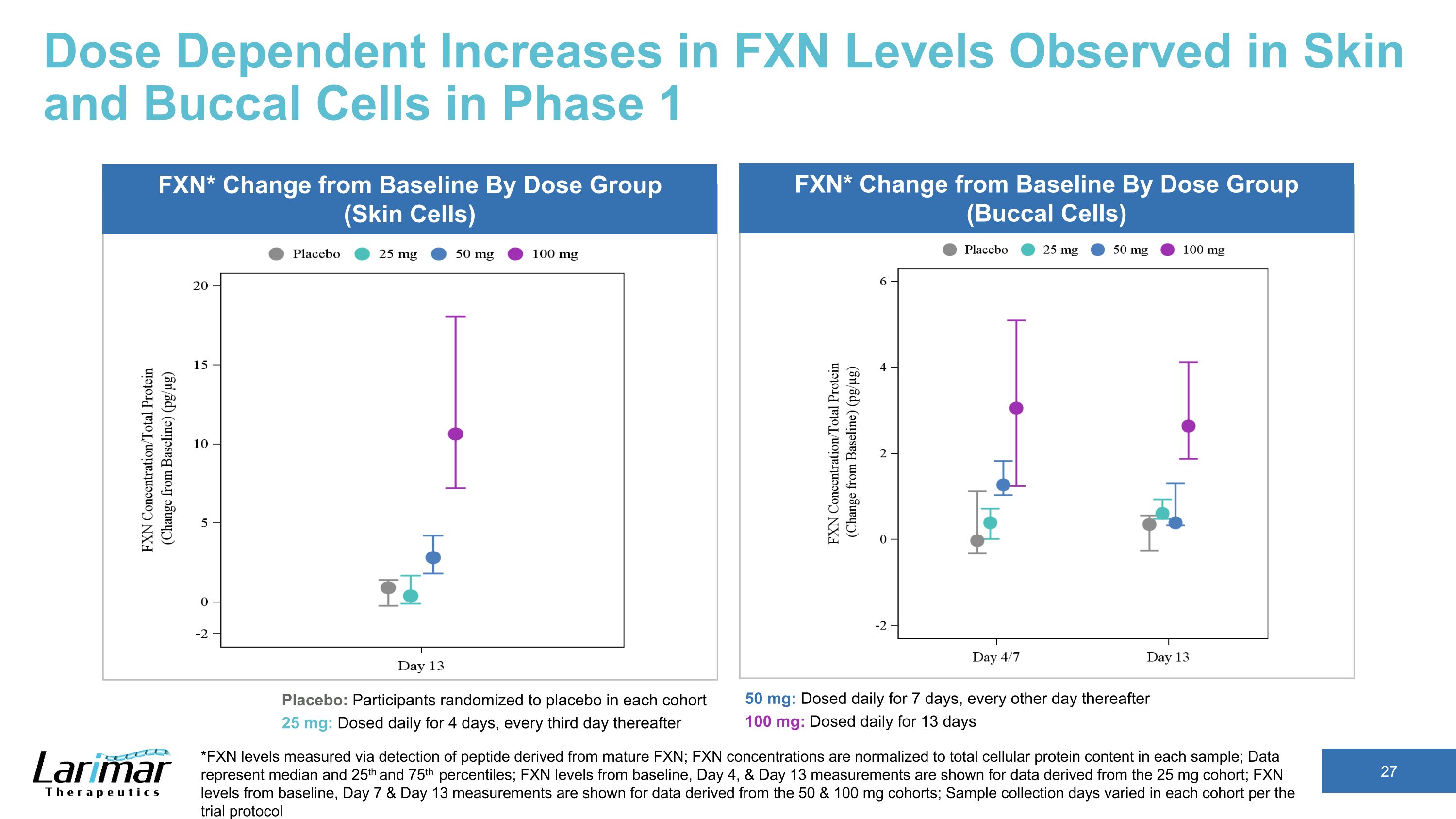
第 1 阶段在皮肤和口腔细胞中观察到的 FXN 水平的剂量依赖性增加 *FXN 水平通过检测来自成熟 FXN 的肽来测量;FXN 浓度归一化为每个样本中的细胞蛋白总含量;数据代表中位数以及第 25 个和第 75 个百分位数;显示了基线、第 4 天和第 13 天测量得出的基线、第 4 天和第 13 天测量值的 FXN 水平;来自基线、第 7 天和第 13 天测量值的 FXN 水平显示的是从 50 和 100 毫克队列中得出的数据;每项试验每个群组的样本采集天数各不相同协议安慰剂:参与者在每个队列中随机使用安慰剂 25 mg:每天给药 4 天,之后每三天给药 50 mg:每天给药 7 天,之后每隔一天 100 mg:每日给药 13 天 FXN* 按剂量组(皮肤细胞)与基线的变化 FXN* 按剂量组划分的基线变化(口腔细胞)
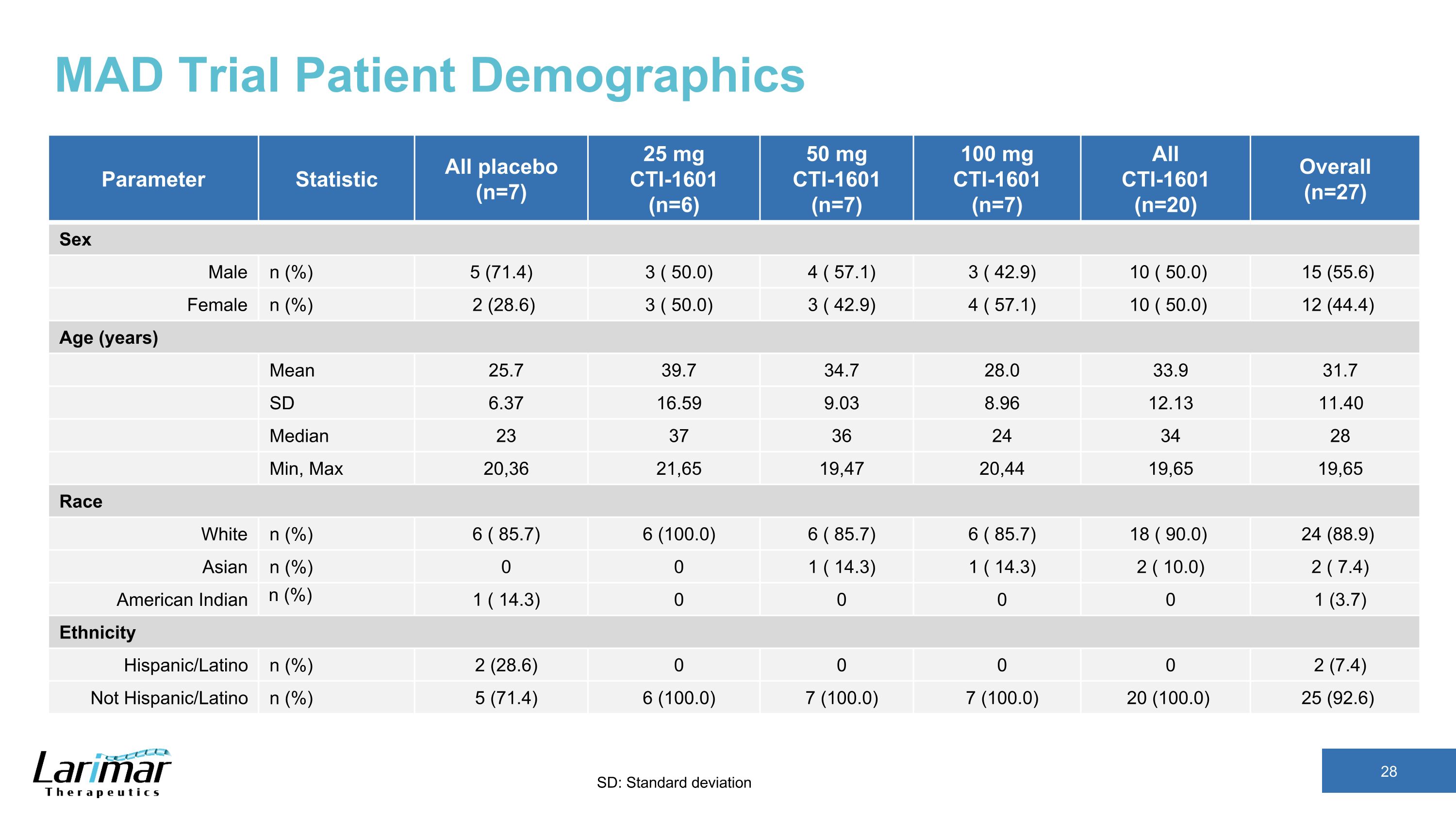
MAD 试验患者人口统计参数统计所有安慰剂 (n=7) 25 mg CTI-1601 (n=6) 50 mg CTI-1601 (n=7) 100 mg CTI-1601 (n=7) 所有 CTI-1601 (n=20) 总体 (n=27) 性别男性 n (%) 5 (71.4) 3 (50.0) 3 (42.9) 10 (50.0) 15 (55.6) 女 n (%) 2 (28.0) 6) 3 (50.0) 3 (42.9) 4 (57.1) 10 (50.0) 12 (44.4) 年龄 (岁) 平均值 25.7 39.7 34.7 28.0 33.9 SD 6.37 16.59 8.96 12.40 中位数 23 37 36 24 34 28 分钟,最大 20,36 21,65 19,47 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,65 19,) 6 (100.0) 6 (85.7) 6 (85.7) 18 (90.0) 24 (88.9) Asian n (%) 0 0 1 (14.3) 1 (14.3) 2 (10.0) 2 (7.4) 美洲印第安人 n (%) 1 (14.3) 0 0 0 0 1 (3.7) 种族西班牙裔/拉丁裔 n (%) 2 (28.6) 0 0 0 0 2 (7.4) 不是西班牙裔/拉丁裔 n (%) 5 (71.4) 6 (100.0) 7 (100.0) 7 (100.0) 20 (100.0) 25 (92.6)) SD:标准差
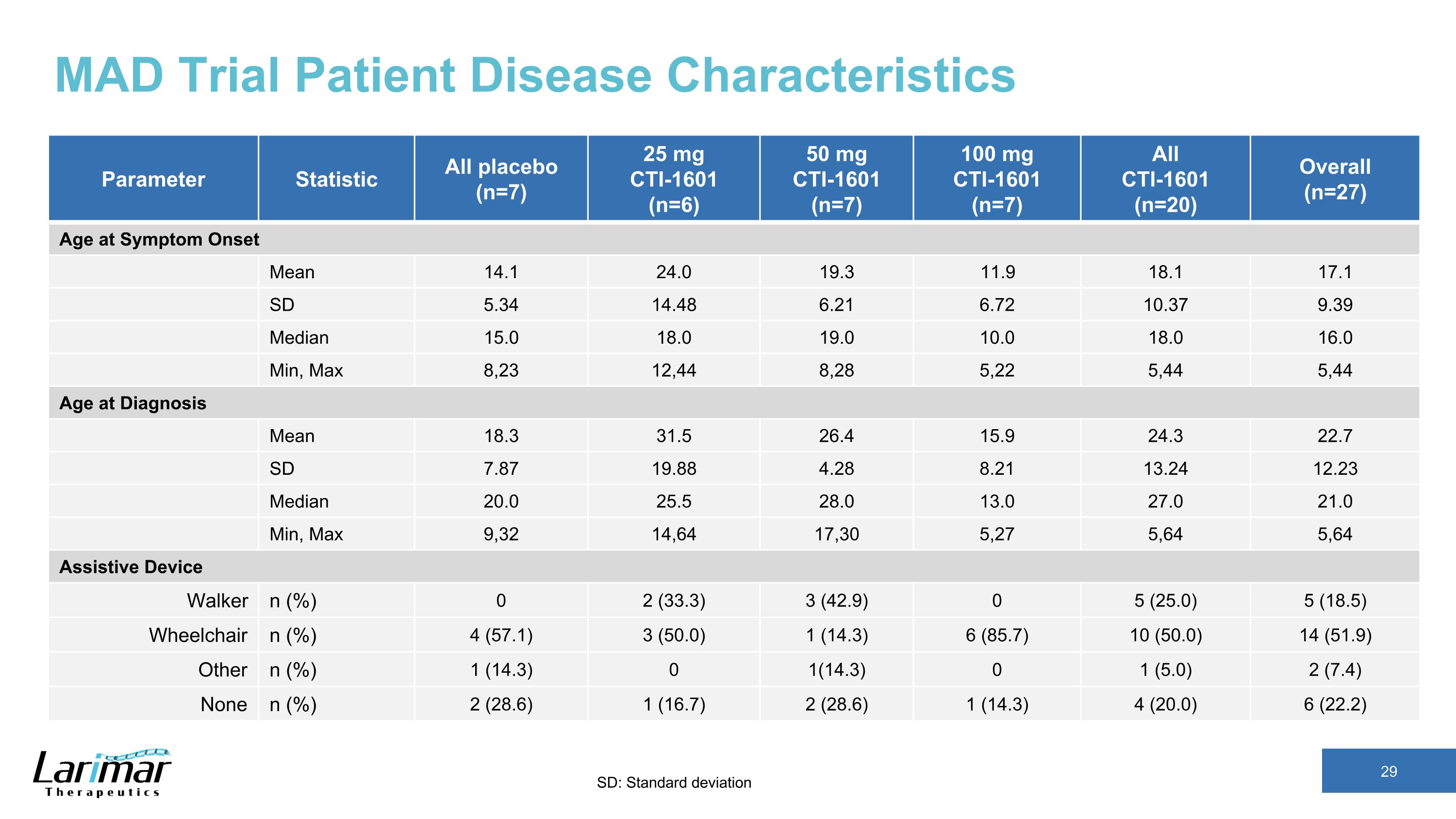
MAD 试验患者疾病特征参数统计数据所有安慰剂 (n=7) 25 mg CTI-1601 (n=6) 50 mg CTI-1601 (n=7) 100 mg CTI-1601 (n=7) 所有 CTI-1601 (n=20) 症状发作时的总年龄 14.1 24.0 19.3 11.9 18.1 17.1 SD 5.34 6.48 6.21 10.37 9.39 中位数 15.0 18.0 18.0 最小,最大 8,23 12,44 8,28 5,22 5,44 5,44 诊断年龄平均值 18.3 31.5 26.4 15.9 24.3 SD 7.87 19.88 4.28 13.24 12.23 中位数 20.5 28.0 13.0 21.0 分钟,最大 9,32 14,64 17,30 5,64 5,64 5,64 辅助设备 Walker n (%) 0 2 (33.3) 3 (42.9) 0 5 (25).0) 5 (18.5) 轮椅 n (%) 4 (57.1) 3 (50.0) 1 (14.3) 6 (85.7) 10 (50.0) 14 (51.9) 其他 n (%) 1 (14.3) 0 (5.0) 2 (7.4) 无 n (%) 2 (28.6) 1 (28.7) 2 (28.6) 1 (14.3) 4 20.0) 6 (22.2) SD:标准差

在 1 期 MAD 试验中,重复皮下注射 CTI-1601 的耐受性通常良好 MAD 试验安全性数据摘要:重复剂量(25 mg、50 mg 和 100 mg)的 CTI-1601 或安慰剂是皮下给药。未观察到严重不良事件 (SAE)、重要医学事件或与治疗相关的严重不良事件。最常见的不良事件 (AE) 是轻度和中度注射部位反应 (ISR)。在接受安慰剂治疗的患者中,有43%出现了至少一次 ISR,所有接受 CTI-1601 的患者都经历了 ISR。大多数 ISR 在注射后一小时内消退,所有 ISR 都无需干预即可解决。没有因为ISR而终止研究。除ISR外,AE的数量和严重程度没有随着剂量的增加而增加。

MAD 试验 PK 分析摘要 CTI-1601 在皮下给药后迅速被吸收 CTI-1601 剂量的增加观察到暴露量的剂量成比例的增加。在给药 100 mg 13 天后 CTI-1601 似乎处于或接近稳定状态暴露。每日 PK 分析支持评估 CTI-1601 每天一次和每隔一天给药方案 CTI-1601

第 2 阶段群组 1 的其他数据

第 2 阶段剂量探索研究推进到 50 mg 队列目标:进一步表征 PK/PD 并评估安全性,以告知长期剂量和剂量方案治疗时间表 28 天治疗期 16 17 18 19 15 21 22 23 24 25 27 28 2 3 4 5 1 6 7 8 9 10 11 13 14 = 服用 CTI-1601 或安慰剂 = 无给药研究详情人群流动和非活动性弗里德赖希共济失调患者 ≥ 18 岁年龄。CTI-1601 治疗天真或参与了之前的 Larimar 研究(如果符合条件)。剂量队列 1:25 mg 队列 2:50 mg 关键终点外周组织中的 Frataxin 水平、PK、PD、安全性和耐受性。PD 终点包括脂质谱和基因表达数据。患者人数队列 1:入组 13 名参与者(9 人服用 CTI-1601;4 人服用安慰剂)。群组 2:旨在招收大约 12-15 名参与者,随机分配 2:1 接受 CTI-1601 或安慰剂。第 1 组的定时给药已完成。第 2 组已获准启动。预计将于 2024 年上半年发布第 2 期群组的顶级数据。
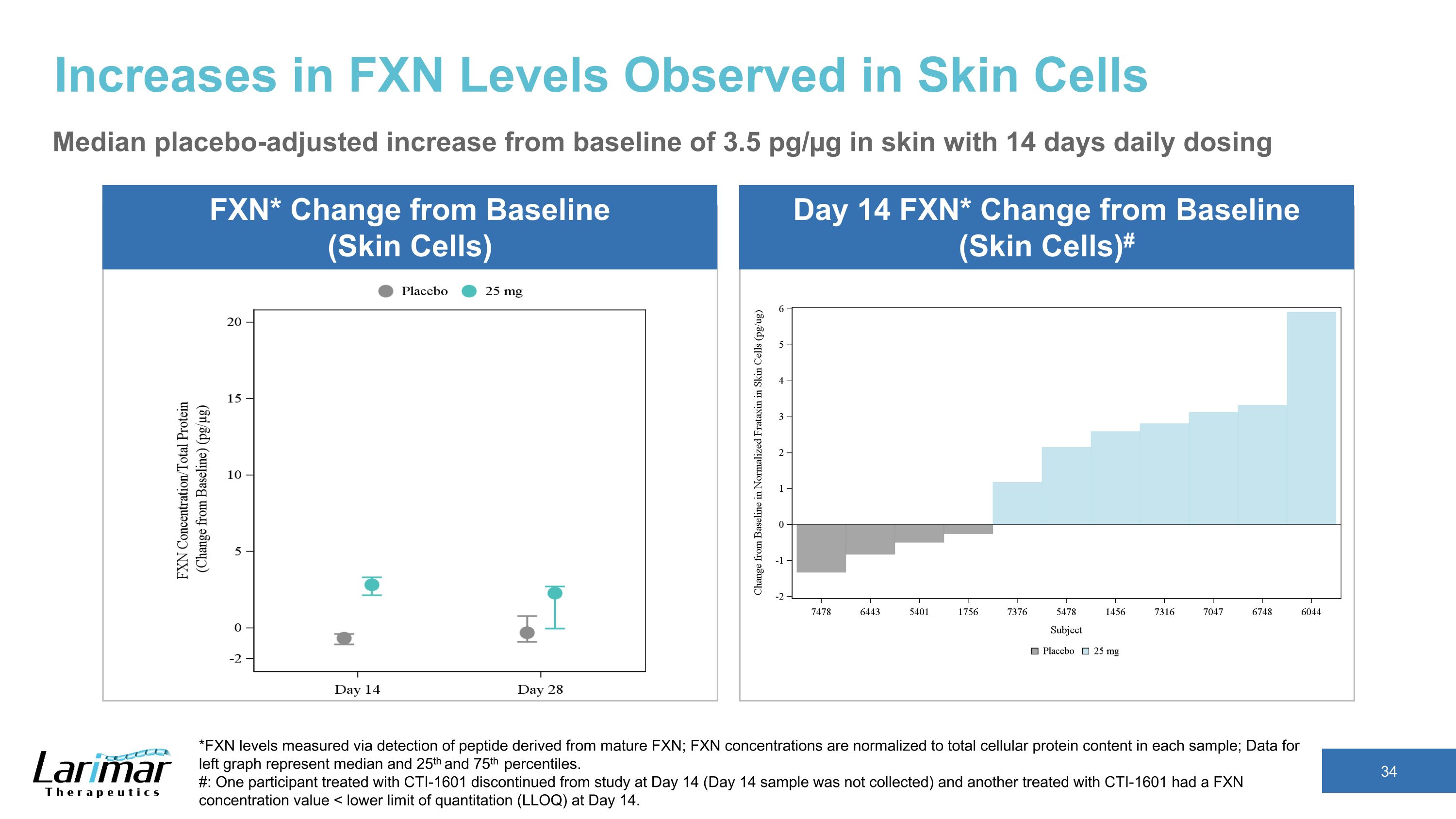
皮肤细胞中观察到的 FXN 水平升高安慰剂调整后的中位数比皮肤基线增加 3.5 pg/µg,每天给药 14 天 *FXN 水平通过检测来自成熟 FXN 的肽来测量;FXN 浓度归一化为每个样本中的细胞蛋白总含量;左图中的数据代表中位数以及第 25 个和第 75 个百分位数。#: 一名接受 CTI-1601 治疗的参与者在第 14 天停止研究(第 14 天样本未收集),另一名用 CTI-1601 治疗的浓度值为 FXN
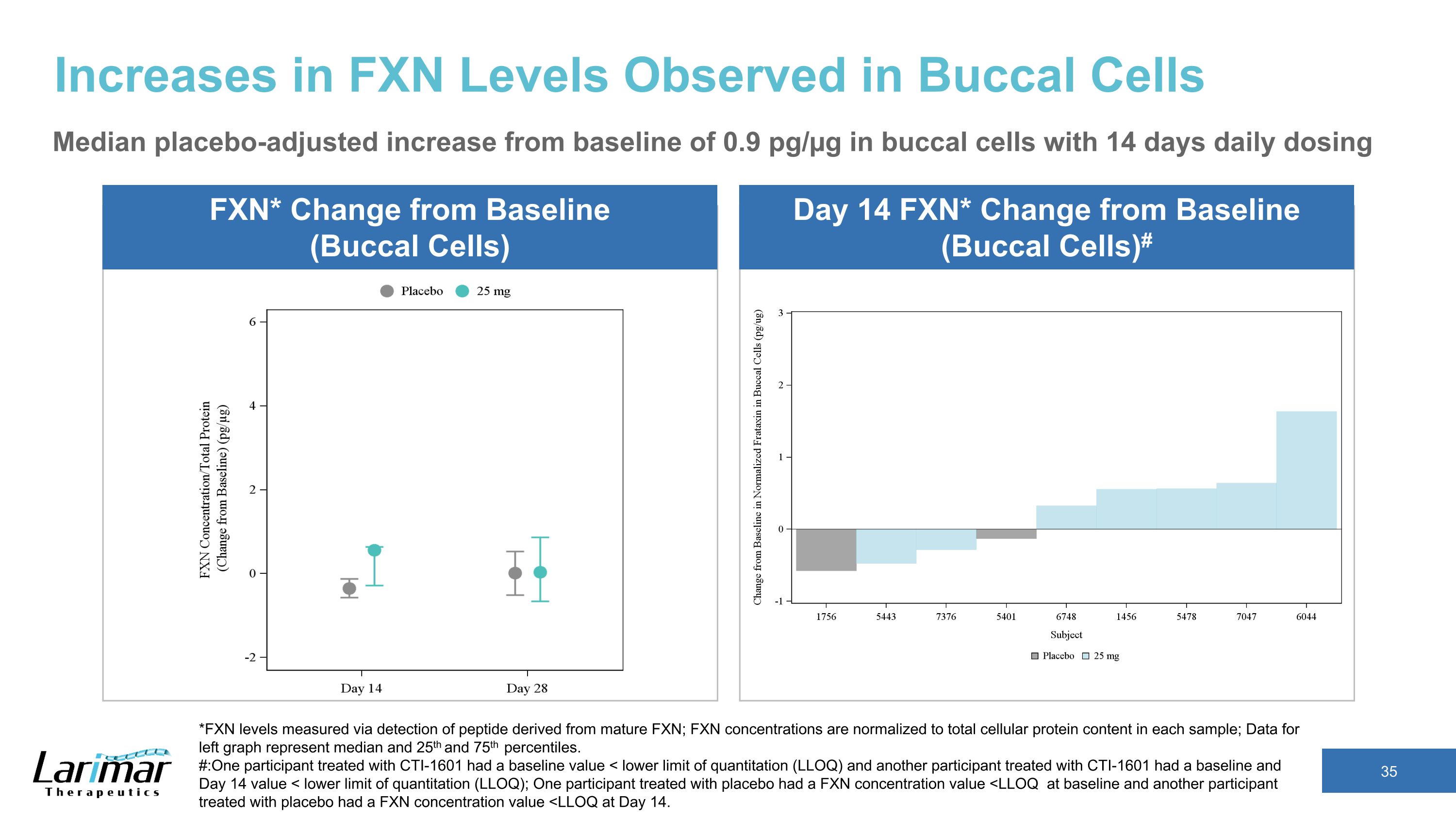
在口腔细胞中观察到的FXN水平升高,安慰剂调整后的口腔细胞从基线0.9 pg/µg升高了中位数,每天给药14天*FXN水平通过检测来自成熟FXN的肽来测量;FXN浓度归一化为每个样本中的细胞蛋白总含量;左图的数据表示中位数以及第25和75个百分位数。#:一位接受 CTI-1601 治疗的参与者的基线值为
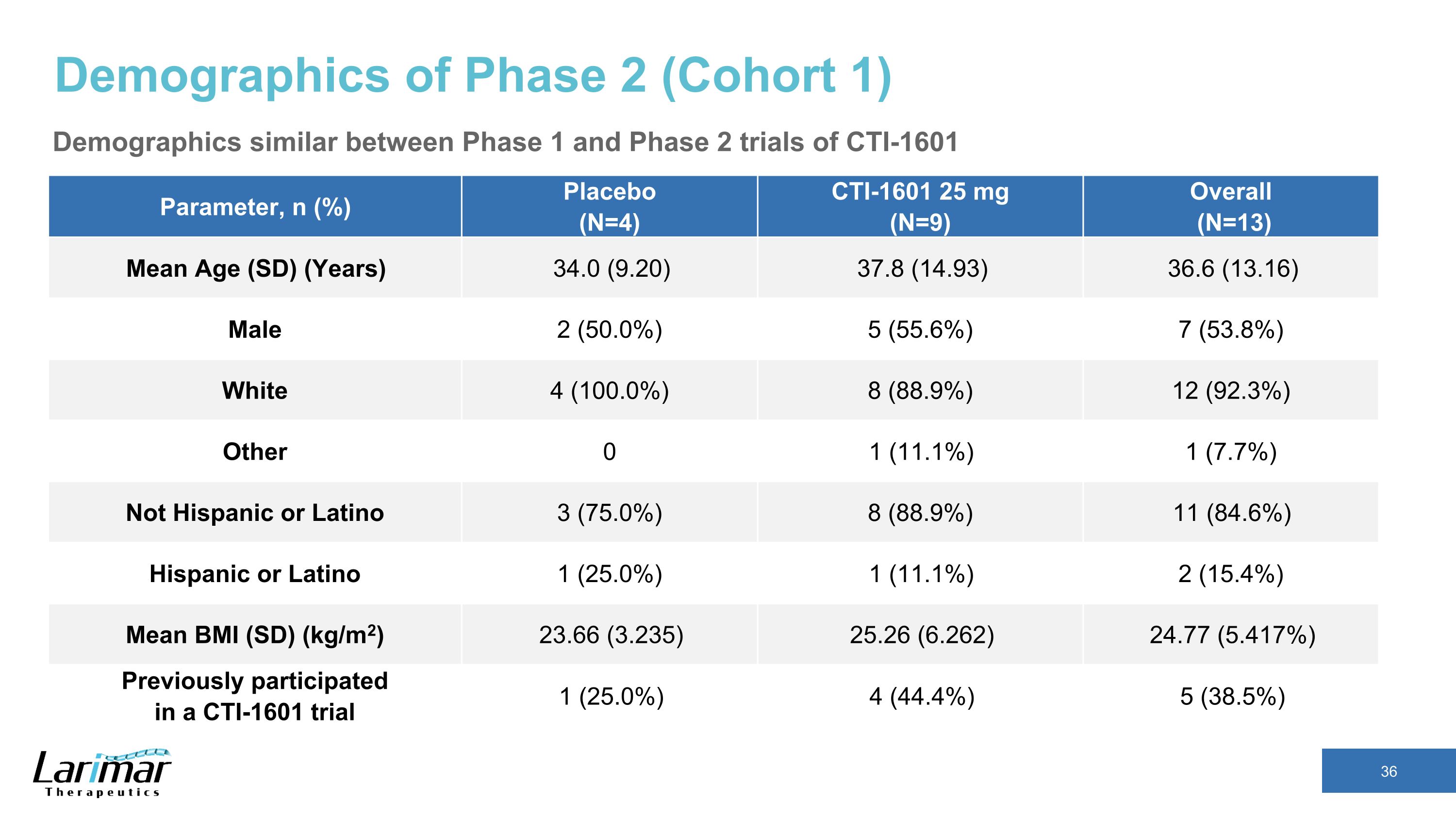
第 2 阶段(群组 1)人口统计学与 CTI-1601 Parameter 的第 1 阶段和第 2 阶段试验相似,n (%) 安慰剂 (N=4) CTI-1601 25 mg (N=9) 总体 (N=13) 平均年龄 (SD) (年) 34.0 (9.20) 37.8 (14.93) 36.6 (13.16) 男性 2 (50.0%) 5 (55.6%) 7 (53.8%) White 4 (100.0%) 8 (88.9%) 12 (92.3%) 其他 0 1 (11.1%) 1 (7.7%) 不是西班牙裔或拉丁裔 3 (75.0%) 8 (88.9%) 11 (84.6%) 西班牙裔或拉丁裔 1 (25.0%) 1 (11.1%) 2 (15.4%) 平均体重指数 (SD) (kg/m2) 23.66 (3.235) 25.26 (6.262) 24.77 (5.47) 17%) 之前参与过 CTI-1601 试验 1 (25.0%) 4 (44.4%) 5 (38.5%)
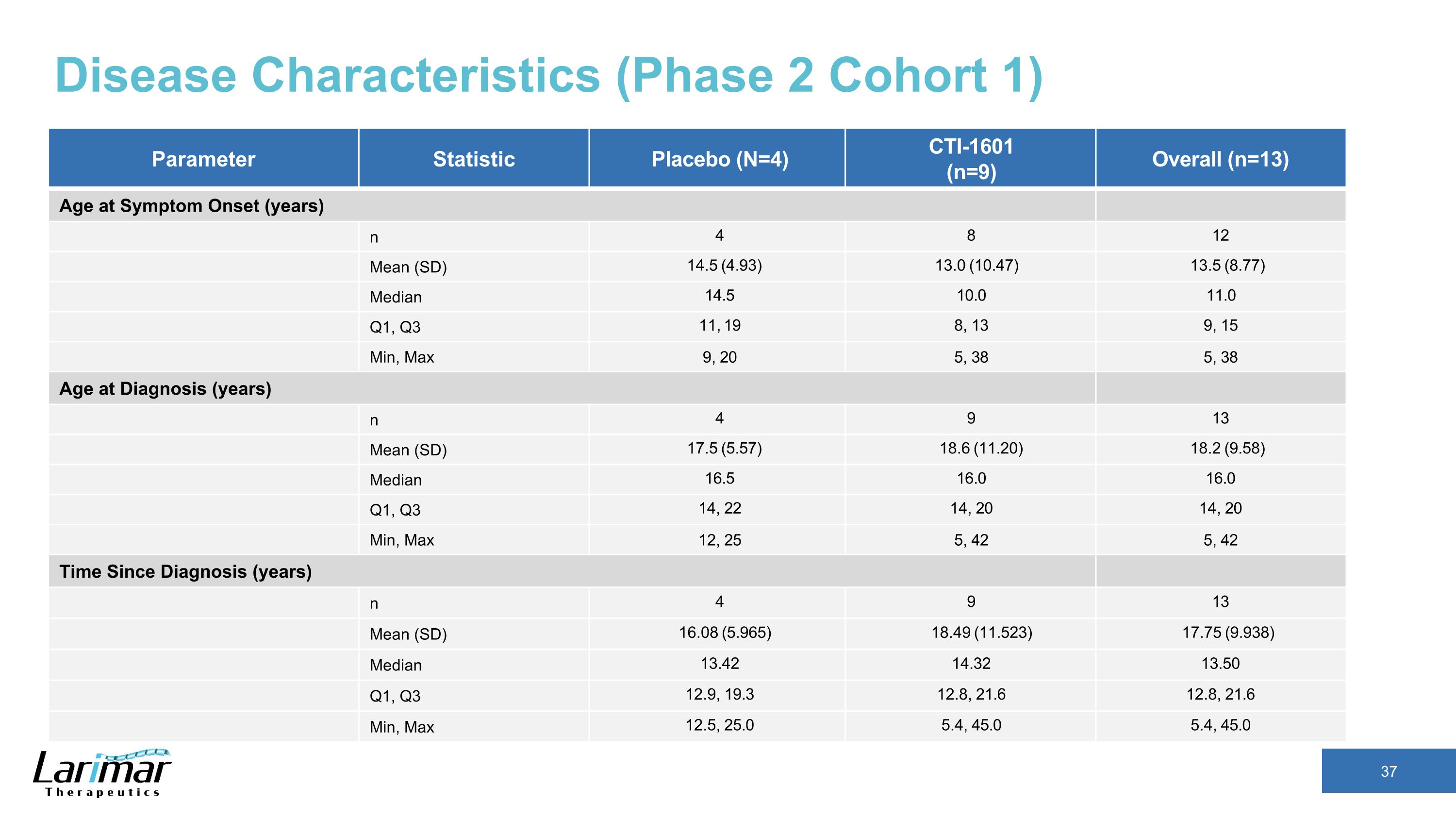
疾病特征(第 2 阶段队列 1)参数统计安慰剂(N=4)CTI-1601(n=9)总体(n=13)症状发作时年龄(年)n 4 8 12 Mean (SD) 14.5 (4.93) 13.5 (10.47) 13.5 (8.77) 中位数 14.5 10.0 11.0 Q1、11、19 8、13 9、15 分钟、Max 9、20 5、38 38、诊断年龄(岁)n 4 9 13 平均值(SD)17.5 (5.57) 18.6 (11.20) 18.2 (9.58) 中位数 16.5 16.0 Q1、Q3 14、22 14、20 14、20 min、Max 12、25 5、42 自诊断以来的时间(年)n 4 9 13 Mean (SD) 16.08 (5.965) 18.49 (11.523) 17.75 (9.938) 中位数 13.42 14.32 13.50 第一季度、第三季度 12.9、19.3 12.8、21.612.8、21.6 Min、Max 12.5、25.0 5.0 5.4、45.0、45.0

第 2 阶段试验安全性数据摘要(25 mg 队列):每天皮下给药 25 mg CTI-1601 或安慰剂,持续 14 天,然后每隔一天给药,直到第 28 天。试验中给了 13 名参与者(9 名活跃患者,4 名安慰剂)。在9名接受CTI-1601治疗的参与者中,有8名完成了试验,其中1人因对研究药物的过敏反应而退出,标准治疗可以解决这个问题。数据表明,CTI-1601 的耐受性总体上良好,没有严重的不良事件。无重要医疗事件。1 起严重不良事件(如上所述,通过标准治疗消退的过敏反应)。最常见的不良事件是轻度和中度注射部位反应(50% 的安慰剂参与者和 100% 的 CTI-1601 参与者中至少出现过一次注射部位反应)CTI-1601 在 2 期试验的 25 mg 队列药代动力学数据建议第 14 天之前达到稳定状态,似乎耐受性良好

临床前数据
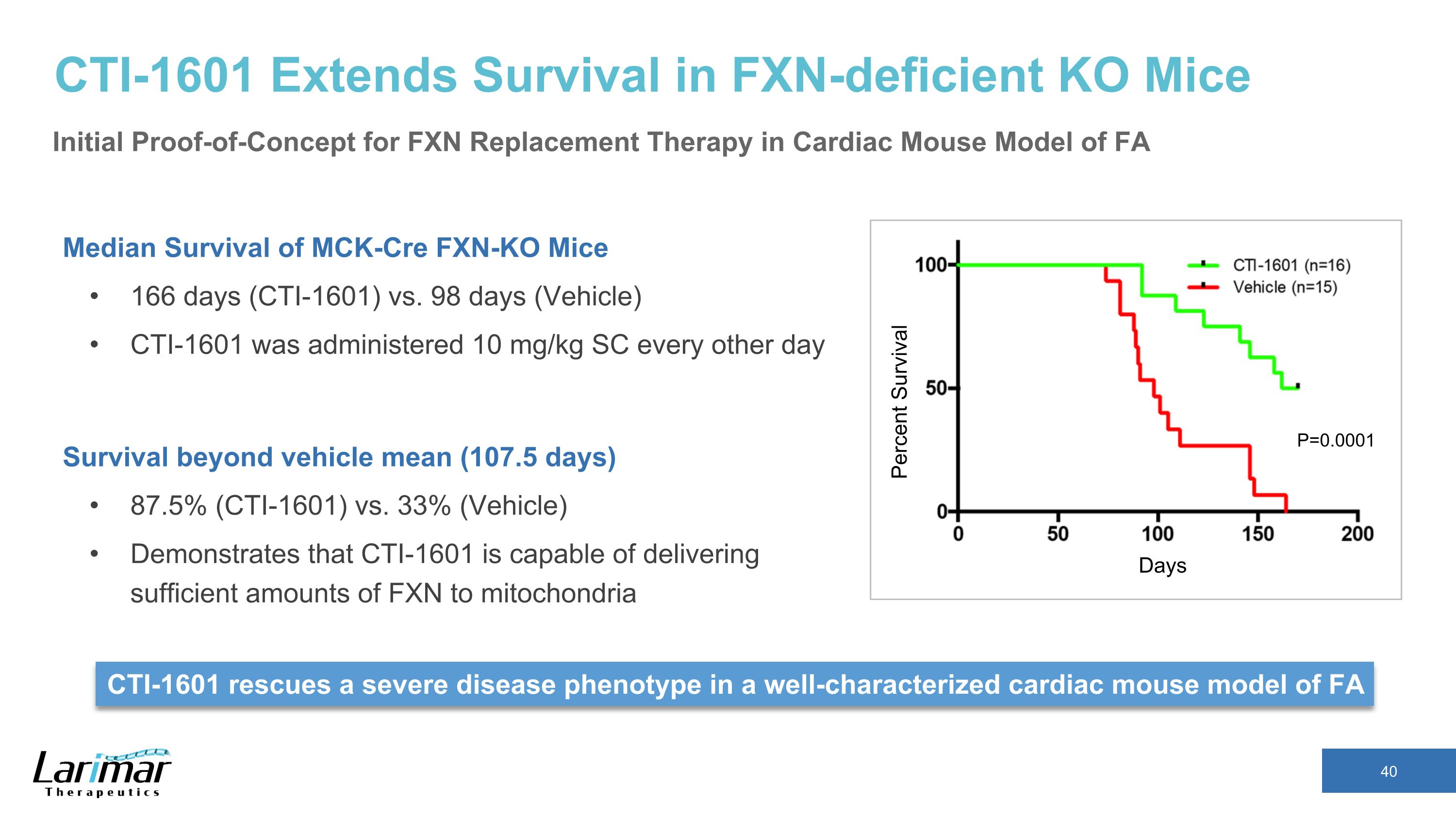
CTI-1601 延长 FXN 缺乏 KO 小鼠的存活期 mcK-cre FXN-KO 小鼠的中位存活期 166 天(CTI-1601)比 98 天(车辆)CTI-1601 每隔一天给药 10 mg/kg SC 超出载体平均值(107.5 天)87.5%(CTI-1601)对比 33%(车辆)表明 CTI-1601 能够向线粒体输送足够量的 FXN 天数存活百分比 CTI-1601 在井中拯救严重疾病表型 FA P=0.0001 FA 心脏小鼠模型的特征性心脏小鼠模型 FXN 替代疗法的初始概念验证

Pvalb-Cre FXN-KO 鼠标单剂量水平:10 mg/kg CTI-1601 或每周腹腔注射三次的载体 HfxN 替换 CTI-1601 可防止共济失调步态的发展 CTI-1601 治疗的小鼠比未经治疗的小鼠存活更长的人类 frataxin 存在于大脑、背根神经节和脊髓中的人类 frataxin 证明中枢神经系统穿透 CTI-1601 防止 KO 小鼠出现共济失调步态 In-Vivo 功效数据神经学 KO 小鼠模型
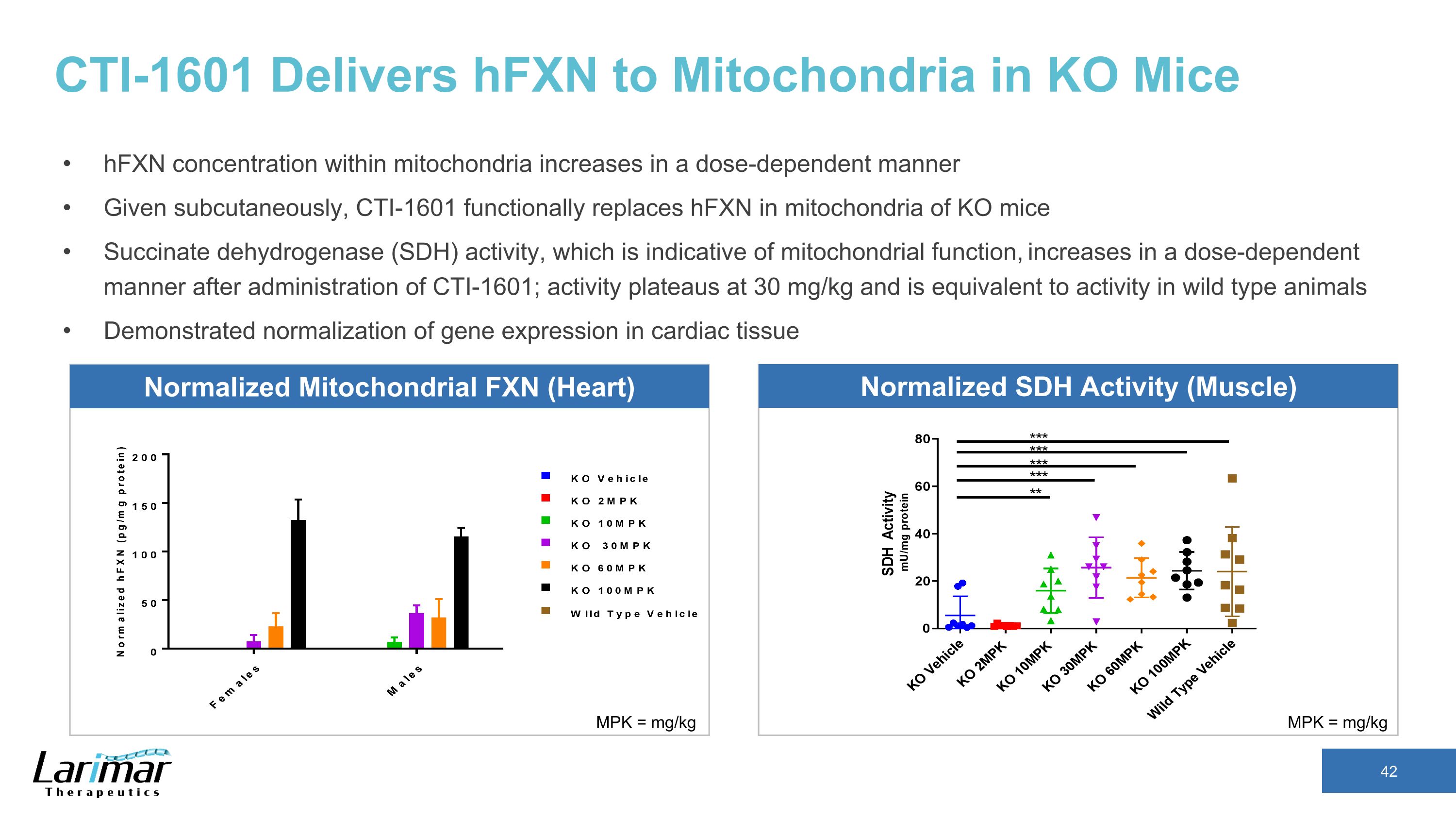
CTI-1601 向 KO 小鼠线粒体输送 HfxN 线粒体内的 hfxN 浓度以剂量依赖性方式增加给定皮下,CTI-1601 在功能上取代了 KO 小鼠线粒体中的 hfxN 琥珀酸脱氢酶 (SDH) 活性,这表明线粒体功能,在给药 CTI-1601 后以剂量依赖性方式增加;活性在 30 mg/kg 时趋于稳定等同于野生型动物的活性 MPK = mg/kg MPK = mg/kg 标准化线粒体 FXN (心脏) 正常化 SDH 活动(肌肉)
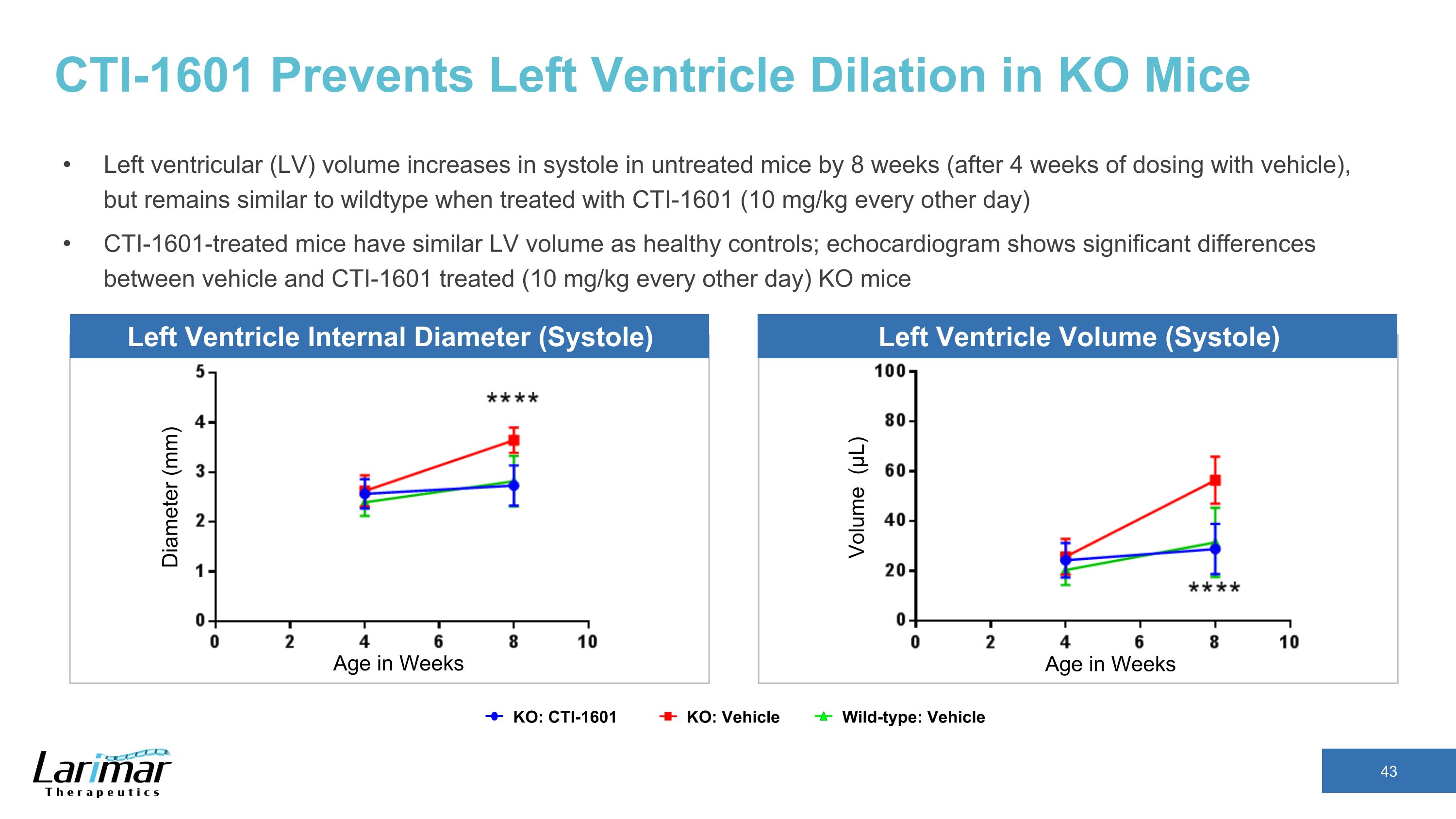
CTI-1601 可防止 KO 小鼠左心室扩张未经治疗的小鼠的左心室 (LV) 体积增加 8 周(用载体给药 4 周后),但使用 CTI-1601 治疗后仍与野型相似(每隔一天 10 mg/kg)经过 CTI-1601 的小鼠的左心室体积与健康对照组相似;超声心动图显示接受过的载体和 CTI-1601 治疗的小鼠之间存在显著差异(每隔一天 10 mg/kg)直径 (mm) 周龄周龄体积 (μL) KO: CTI-1601 Wild-type: 车辆 KO: 车辆左心室内径(收缩)左心室容积(收缩)
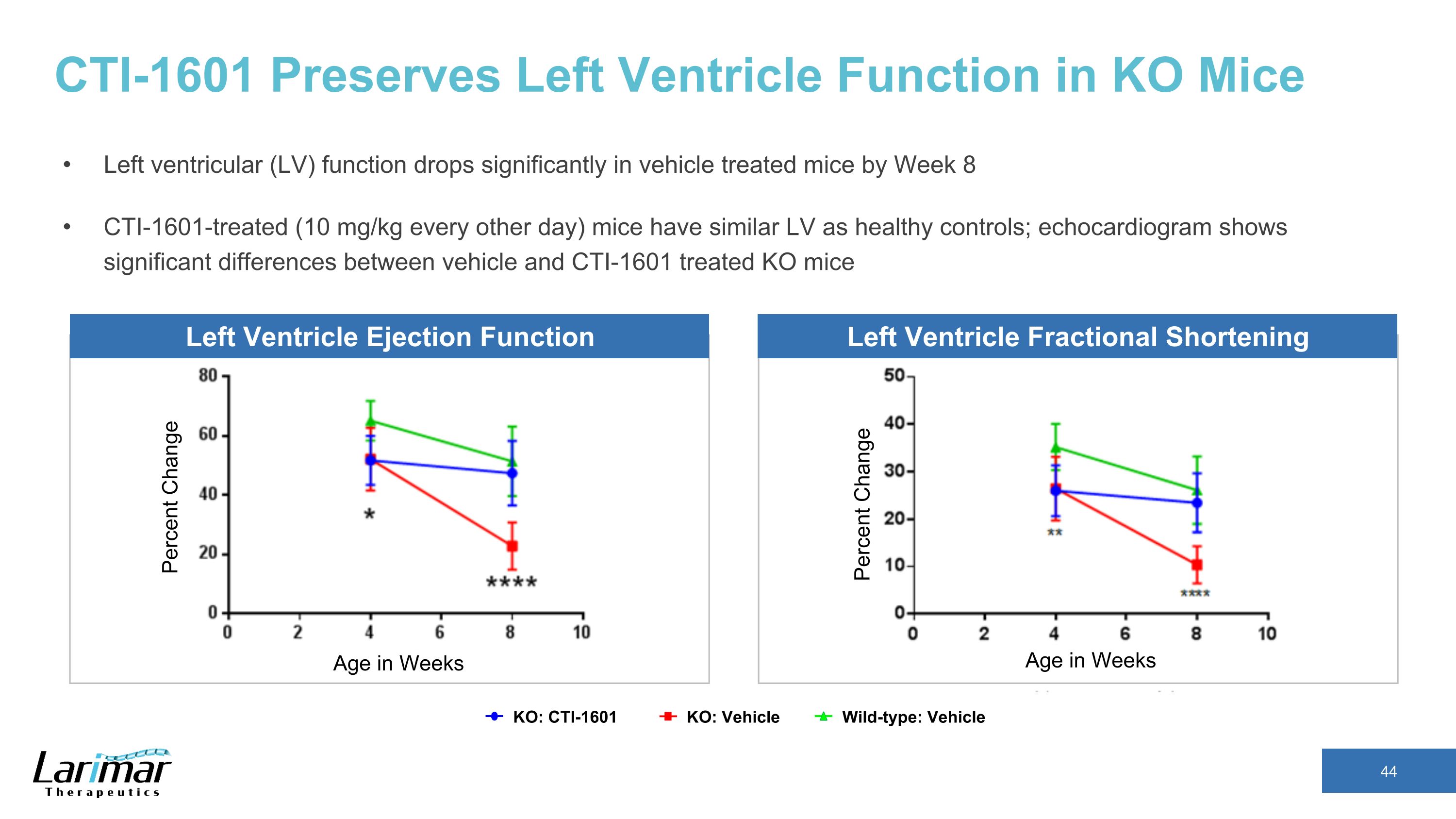
CTI-1601 保持 KO 小鼠的左心室功能到第 8 周 cti-1601 治疗小鼠的左心室 (LV) 功能显著下降 cti-1601 治疗(每隔一天 10 mg/kg)小鼠的左心室(LV)功能与健康对照组相似;超声心动图显示经过载具治疗的 KO 小鼠之间存在显著差异 KO:Vehicle KO:车辆左心室射出功能左心室缩短百分比以周为单位更改年龄 CTI-1601 CTI-1601