目录
下表汇总了我们的项目渠道,全部处于临床前开发阶段:
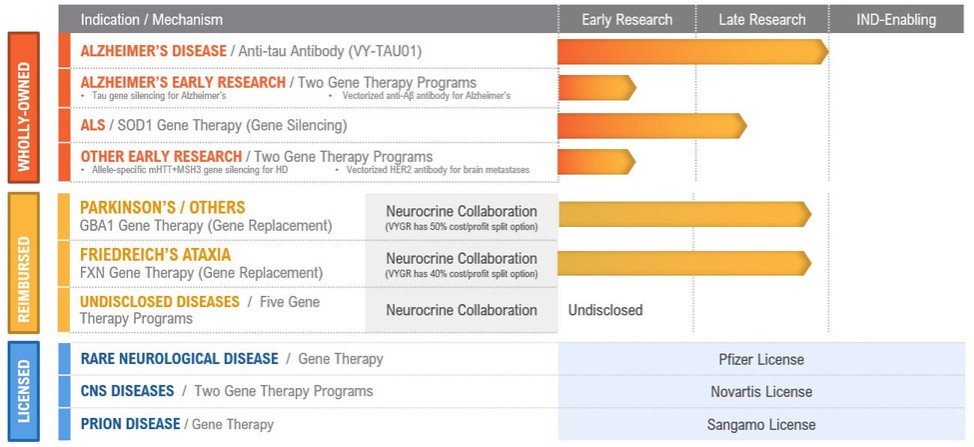
全资项目
用于治疗 AD 的抗 Tau 抗体项目
疾病概述
我们正在开发专有抗体,这些抗体可以选择性地靶向和减少病理性tau的传播,用于治疗tauopathes,我们的主要适应症是AD。tau病理学的传播与AD的疾病进展和认知能力下降密切相关,AD影响了美国约600万人,是社会的医疗保健负担越来越大。最近,抗淀粉样蛋白抗体已获准用于治疗AD,但仍有大量医疗需求未得到满足。
我们的治疗方法
长期以来,我们一直专注于开发专有和互补的方法来阻断 tau 病理的进展,tau 病理被认为是 AD 和其他牛皮病的核心。减少有毒的 tau 聚集体可能会减缓这些疾病的疾病进展和认知能力下降。我们正在探索抗tau抗体的被动给药。我们的抗tau抗体具有差异化的特性,包括改善对tau蛋白特定区域的靶向,与第一代方法相比,可以提供更好的特征。我们认为,我们的靶向 C 末端的抗体与其他方法有很大的区别。此外,我们认为,在IND申请获得批准后,利用人类tau的正电子发射断层扫描(PET)成像以及测量血浆和脑脊液生物标志物的临床评估有可能使人类生物学证明的有效和加速演示成为可能。
临床前研究
在2022年8月的阿尔茨海默氏症协会国际会议上,我们公布了我们专有的抗tau抗体的数据,这些抗体以高亲和力靶向中结构域和C端,在小鼠模型的临床前研究中表现出良好的生物物理特征和强劲的活性。在 P301S 种子繁殖 tauotha 小鼠模型中,我们的 C 末端靶向抗 tau 抗体阻断了丝状 tau 的播种/繁殖
31