

附录 99.2 FORTE BIOSCIENCES 企业概述公司演示文稿 2023 年 8 月 1 日

关于前瞻性陈述的警示说明... 本演示文稿中包含的关于非历史事实的某些 陈述是经修订的1934年《证券交易法》第21E条和1995年《私人证券诉讼法 法》(PSLRA)所指的前瞻性陈述。其中包括有关管理层意图、计划、信念、期望或对未来的预测的陈述,因此,提醒您不要过度依赖这些陈述。无法保证任何前瞻性 陈述,实际结果可能与预期的结果存在重大差异。除非法律要求,否则Forte Biosciences, Inc.(“我们”、“公司” 或 “Forte”)没有义务公开更新任何前瞻性 声明,无论是由于新信息、未来事件还是其他原因。我们使用诸如 “预期”、“相信”、“计划”、“期望”、 “项目”、“打算”、“可能”、“将”、“应该”、“可能”、“估计”、“预测”、“潜力”、“继续”、 “指导” 之类的词语来识别这些前瞻性陈述,这些前瞻性陈述本应由PF安全港条款涵盖 SLRA。... 此类前瞻性陈述基于我们的预期,涉及 风险和不确定性;因此,由于多种因素,实际业绩可能与陈述中表达或暗示的结果存在重大差异,包括但不限于与公司业务和前景相关的风险; Forte 计划开发其候选产品并可能将其商业化,包括 FB-102;早期临床前研究的结果可能无法预测后期研究或临床试验的结果; 启动 Forte 计划中的临床试验的时机;Forte 临床试验数据可用性的时间;任何临床试验的数据发布时间计划中的研究性新药申请或新药申请;Forte 的研究计划, 开发和商业化其当前和未来的候选产品;Forte 对 FB-102 市场规模的预测;Forte 成功开展合作并履行任何此类 合作协议规定的义务的能力;Forte 候选产品的临床效用、潜在收益和市场接受度;Forte 的商业化、营销和制造能力和战略;与 Forte 竞争对手及其行业相关的发展和预测 ; 政府法律和规章的影响;Forte 保护其知识产权地位的能力;Forte 对未来收入、支出、资本 需求和额外融资需求的估计;以及全球事件对公司、公司行业或总体经济的影响。” 我们的这些前瞻性陈述主要基于我们当前的预期和 对我们认为可能影响我们的财务状况、运营业绩、业务战略和财务需求的未来事件和趋势的预测,以及这些报表代表我们截至目前的观点本次演讲的日期。我们可能无法真正实现这些前瞻性陈述中披露的计划、意图或预期,您不应过分依赖这些前瞻性陈述。前瞻性陈述本质上会受到风险和 不确定性的影响,其中一些无法预测或量化。有关某些风险、不确定性和假设的信息可以在我们向美国证券交易委员会提交的文件中找到,包括 “风险 因素” 标题下的其他内容,也可以在截至2022年12月31日的10-K表年度报告以及随后向美国证券交易委员会提交的文件中找到。新的风险因素不时出现,我们的 管理团队无法预测所有风险因素或评估所有因素对业务的影响,也无法评估任何因素或因素组合在多大程度上可能导致实际业绩与任何 前瞻性陈述中包含或暗示的业绩存在重大差异。虽然我们可能会选择在未来的某个时候更新这些前瞻性陈述,但我们明确表示不承担任何这样做的义务。截至本演示文稿发布之日之后的任何日期,不应依赖这些前瞻性陈述来代表我们 的观点。2

经验丰富的管理 Forte 的管理层在制造、质量、监管和临床开发方面拥有丰富的经验 Paul Wagner,博士,CFA — 首席执行官休伯特·陈,医学博士 — 首席科学官 Tony Riley — 首席财务官 Chris Roenfeldt,PMP — 首席运营官 Steven Ruhl — 首席技术官 5

FB-102 计划概述

FB-102 概述 + • CD122 是 IL-2/IL-15 受体 的亚单位,它们是 NK、CD 8 T 细胞和 Treg 的关键调节剂 + • FB-102(Forte 的抗 CD122 抗体)专为介导 NK 和 CD 8 T 细胞而设计 • 大量 PoC 临床前数据支持 CD-122 阻断活性,包括在 gvHD 和白癜风中 • FB-102 在经过验证的 gvHD 模型中表现出显著的临床前活性 • 预计 FB-102 将在 2024 年初进入诊所 • 我们相信 FB-102 用于治疗 gvHD 地址 未满足的需求,可以缩写发展路径 5

ANTI-CD122:临床前数据的亮点

ANTI-CD122 BLOCKED 已在多种动物模型中显示出功效 疾病物种结果参考 GVHD 小鼠延长存活率 JN Bio 专利,2015 年白癜风小鼠增强色素再沉着 Sci Transl Med,2018 年 1 型糖尿病小鼠延迟发病 JCI Insight,2018 年乳糜泻小鼠改善 IL-15 诱导的 PNAS,2009 年粘膜损伤皮肤和肾脏移植老鼠/猴子长时间移植在 J Clin Invest 中生存,2018 年拒绝组合与 CTLA-4 7

ANTI-CD122 在急性 GVHD 的人源化小鼠模型中:改善身体 体重减轻和延长存活率移植物与宿主疾病的人性化小鼠模型攻击性、快速发作 GVHD:2 周内体重明显减轻和死亡外周 (NOG) 小鼠血液单核细胞免疫缺陷转移第 10 天抗 CD122 控制结果存活率 66% 0% US9,028,830 8

CD-122 BLOCKED 会使小鼠白癜风出现明显的色素再沉着 MODEL Richmond 等Sci Transl Med. 2018 年 7 月 18 日;10 (450) 经过为期 8 周的抗 CD122 治疗(第 12-20 周),白癜风小鼠的尾巴色素沉着发生了统计学上的显著变化(p=0.0001)
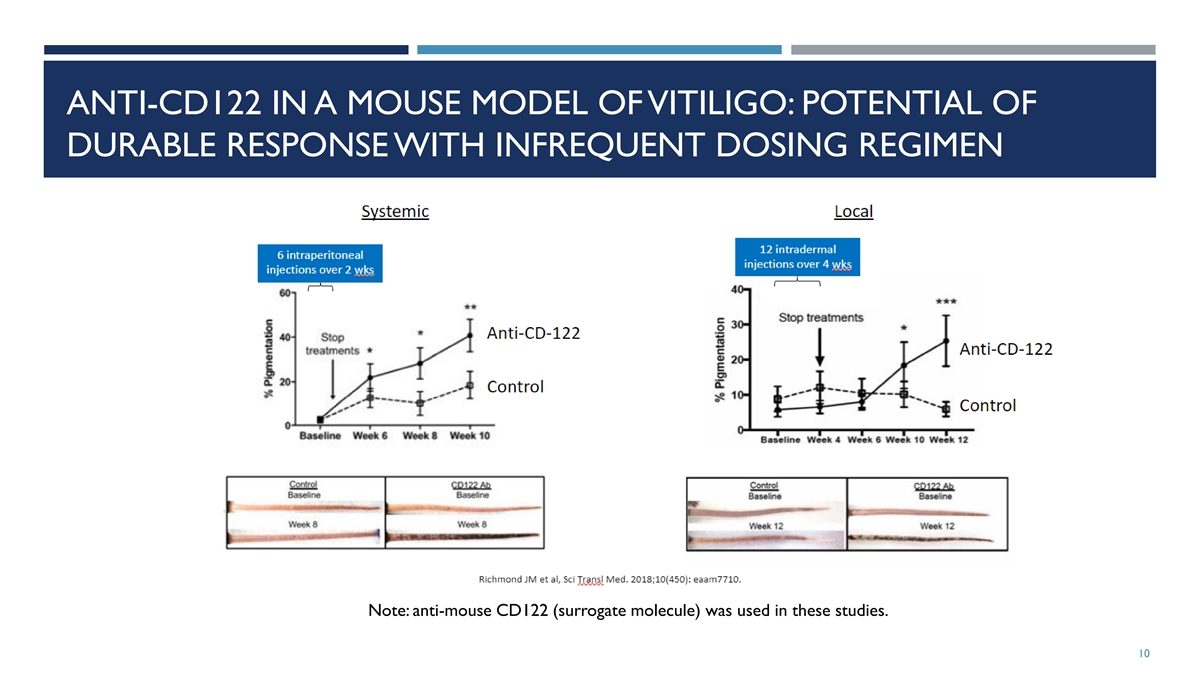
白癜风小鼠模型中的 ANTI-CD122:不经常给药方案可能产生持久反应 注意:这些研究中使用了抗老鼠 CD122(替代分子)。10

ANTI-CD122 作为预防小鼠毛发流失的有效预防方法 型号的脱发抗CD122 c3H/HEJ 小鼠从移植抗CD122时起就接受了全身治疗。Xing 等人Nature Medicine 第 20 卷,第 9 期,第 1043 页注意:这些研究中使用了抗老鼠 CD122(替代分子)。

FB-102 发展战略:对适应症进行优先排序

ANTI-CD122 的潜在适应症:GRAFT-VS-HOST 病 (GVHD) 和 白癜风作为第一线选择现有数据和时间线/商业机会资源与总体分数患者作用验证的适应机制预计目标产品概况(3 个子分数的乘积)急性 GVHD 3 2 12 慢性 GVHD 2 2 8 慢性 GVHD 2 2 8 肾移植排斥反应 3 1 2 6 Alepecec areata 1 3 1 3 乳糜泻(难治性)1 1 2 2 1 型 1 糖尿病 2 1 1 2 嗜酸性食管炎 1 1 2 2 IBD 1 2 2(溃疡性结肠炎)NASH 1 1 11 每个类别的得分从 1(低)到 3(高)不等 13

移植物与宿主病 (GVHD):异基因干细胞移植的严重并发症原因:供体免疫细胞攻击宿主组织分类急性(~5K 美国患病率——美国国立卫生研究院)——发生在多达 50% 的受者身上。-通常在移植后 3 个月内发作-通常为合并或受累器官:皮肤 (皮疹)、胃肠道(呕吐、腹泻)、肝脏(黄疸)慢性(~14K)美国患病率——美国国立卫生研究院)——多达40%的受试者发病。-除皮肤、胃肠道和肝脏外,还可能累及肺部、粘膜表面(眼睛、嘴巴、胃肠道)、肌肉,joints (结缔组织)https://www.lls.org/booklet/graft-versus-host-disease 14

急性 GVHD 发病机制中的 CD8 和 NK 细胞: ANTI-CD122 与 FB102 抗 CD122 的潜在拮抗作用:阻断 GVHD ifnG IL-2 炎症与凋亡的关键细胞介质 Devetten MP,Biol 血髓移植。2004;10:815。Simonetta F,Front Immunol。2017;8:465。Khandelwal P,Biol Blood 骨髓移植。2020;26:1. 15

白癜风和斑秃的大量需求未得到满足(到2026年市场总额为60亿美元 )白癜风白癜风是一种皮肤自身免疫性疾病,主要由杀死黑素细胞并产生白斑的NK和CD8+ T细胞介导。在美国,大约有200万白癜风患者。2018年,全球白癜风治疗 的市场规模为12亿美元,预计到2026年将达到19亿美元,复合年增长率为5.8%(《财富商业洞察》)AAA是一种自身免疫性疾病,免疫细胞攻击和损害毛发 毛囊,主要由CD8+ T细胞和NK细胞介导。全球脱发治疗市场的估值为 2018年为27亿美元,预计到2026年将达到39亿美元,从2019年到2026年的复合年增长率为4.6%(Allied Mkt Research)而JAK抑制剂有在AA和白癜风中表现出疗效,监管部门对JAK类别的审查,包括黑匣子警告,抑制了人们对该类别的热情,因此,对治疗AA和白癜风的安全 和有效疗法的需求仍未得到满足

FB-102 在移植物对抗宿主病时

急性 GVHD:治疗范式和开发管道 https://www.lls.org/booklet/graft-versus-host-disease https://www.jakafi.com/pdf/prescribing-information.pdf 18

ANTI-CD122 在 急性 GVHD 皮质类固醇一线目标中的潜在适应症和临床成功标准:改善第 28 天 ORR 与抗二线 CD122 ruxolitinib 单一疗法抗目标:鲁索利替尼失败后实现第 28 天 ORR > 60% 三线 CD122 https://www.lls.org/booklet/graft-versus-host-disease https://www.jakafi.com/pdf/prescribing-information.pdf 19

RUXOLITINIB 在急性 GVHD 中的批准是基于 开放标签、单臂研究的结果。疗效基于 CIBMTR 标准定义的第 28 天总体反应率。https://www.jakafi.com/pdf/prescribing-information.pdf 20

慢性 GVHD:治疗范式和开发管道 https://www.lls.org/booklet/graft-versus-host-disease https://www.rxabbvie.com/pdf/imbruvica_pi.pdf https://www.jakafi.com/pdf/prescribing-information.pdf 21 https://products.sanofi.us/rezurock/rezurock.pdf

ANTI-CD122 在 慢性 GVHD 皮质类固醇中的潜在适应症和临床成功标准:改善 6 个月 ORR 抗体(特别是CR)与护理标准对比。CD122 三线反四线 https://www.lls.org/booklet/graft-versus-host-disease 目标:实现第 6 个月 ORR > 70% CD122 https://www.rxabbvie.com/pdf/imbruvica_pi.pdf https://www.jakafi.com/pdf/prescribing-information.pdf 22 https://products.sanofi.us/rezurock/rezurock.pdf

REZUROCK 在慢性 GVHD 中的批准是基于 开放标签、单臂研究的结果。疗效基于 2014 年美国国立卫生研究院反应标准所定义的治疗 6 个月后的总体反应率。https://products.sanofi.us/rezurock/rezurock.pdf 23

赛诺菲以19亿美元的价格收购了KADMON,以进一步加强 移植业务的增长 24

FB-102 移植物与宿主病临床前数据

使用 ANTI-CD122 和 RUXOLITINIB 进行慢性 GVHD 研究治疗结束 开始研究 40 50 60 天 1 10 20 30 车辆 FB650(每隔一天 100 mpk IP)Ruxolitinib(每两次 60 mpk PO)n=16-18 每组 26

慢性 GVHD 研究结果:GVHD 评分治疗开始 3 车辆 载具 2 抗 CD122 ruxolitinib ruxolitinib 1 0 抗 CD122 30 34 38 46 46 50 58 62 66 天移植后平均值 (SEM),n=16-18 第 60 天结果:P

在 急性 GVHD 人源化小鼠模型中生成临床前疗效数据,移植物抗宿主病 28

在急性 GVHD 的人源化小鼠模型中对 FB102 的剂量范围调查:治疗模式辐照和结束 PBMC 移植治疗 1 2 3 4 5 6 8 10 12 13 14 天 7 9 11 FB102 每天一次 IP 给药,(75、125、175 mpk)每天一次 IP 给药 每天两次口服 Ruxolitinib 在第 5 天开始给药,(60 mpk)每天两次口服给药,每天两次,每组车辆 N=10 29
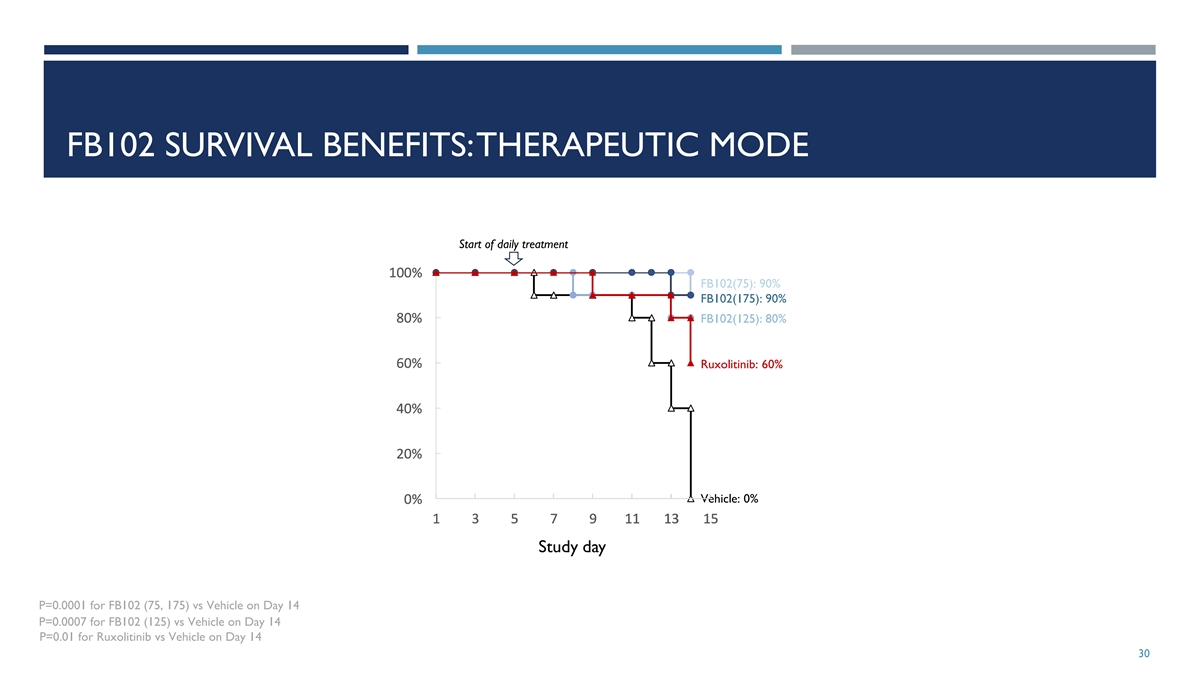
FB102 生存益处:治疗模式开始每日治疗 1 1 1 1 10 0 0 0 0 0 0 0 0 0 0 0%%%% FB102 (75):90% FB102 (175):90% 8 8 8 8 8 80 0 0 0%%% FB102 (125):80% 6 6 6 60 0 0 0%%%%%%% ruxolitinib:60% 4 4 4 40 0 0 0%%%%%%%%%% 2 2 2 2 20 0 0 0 0%%%%%%%%%%%%% 1 1 1 1 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 5 5 5 5 3 3 3 3 3 1 1 1 1 1 1 5 5 5 5 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 第 14 天 FB102 (125) vs 车辆 0.0007 p=0.01 第 14 天 Ruxolitinib vs Vehicle 30 FB102

使用 FB102、RUXOLITINIB 或 皮质类固醇辐照和研究结束注射 (D18) 第 1 天 5 8 12 15 18 Ruxolitinib 每日两次口服 (60 mpk) fb102+ruxolitinib 每日一次 IP + 每日两次口服(75 mpk+60 mpk)安慰剂 IP + 每日两次口服( 辆车的组合)每组 N=10 31

FB102 生存益处:与 RUXOLITINIB 联合使用 VS 单一疗法 开始每日治疗 100% 1 10 00 0%% fb102+rux:90% 8 8 80 0%%% 6 6 60 0 0%%% ruxolitinib:30% 2 2 20 0 0%%%% 1 1 3 3 5 5 7 7 7 9 9 1 1 11 1 1 1 1 1 13 3 3 1 1 15 5 1 1 7 7 7 研究日 p=0.0001 fb102+rux vs vs vs vs VHeicle 第 18 天 p=0.02 fb102+rux vs Ruxolitinib mono 32

将人源化的急性 GVHD 小鼠发现转化为患者 反应:令人鼓舞的 FB102 结果 FB102 临床前疗效的幅度与积极的临床反应相关。临床前数据指示/临床数据公司候选机制(人源化阶段(第 28 天 ORR)GVHD 模型的存活率) 二线/三线 Forte Biosciences FB102 抗 CD122 90%(对照组为 0%)待定临床前二线 1 4 Incyte ruxolitinib JAK 1/2 抑制 90%(对照组为 0%)62% 商用一线 2 5 Equillium/Ono 抗CDlizumab 6 50%(对照组 10% )> 50% 第 3 阶段 3 第一线 3 Incyte Itacitinib JAK 1 抑制 20%(对照组 0%)N.S. vs PBO 终止 1.Huarte E 等人免疫疗法。2021;13:977。2.Ng CT 等人Blood。2019;134(Supp 1): 5063。3.Courtois J 等人Bone 骨髓移植。2021;56:2672。显示第 60 天的结果。4.Zeiser R 等人。N Engl J Med. 2020;382:1800。5.Equillium 企业演讲,2022 年 9 月。6.Zeiser R 等人。Lancet Haematol。2022;9:e14。33

FB-102 概述 + • CD122 是 IL-2/IL-15 受体 的亚单位,它们是 NK、CD 8 T 细胞和 Treg 的关键调节剂 + • FB-102(Forte 的抗 CD122 抗体)专为介导 NK 和 CD 8 T 细胞而设计 • 大量 PoC 临床前数据支持 CD-122 阻断活性,包括在 gvHD 和白癜风中 • FB-102 在经过验证的 gvHD 模型中表现出显著的临床前活性 • 预计 FB-102 将在 2024 年初进入诊所 • 我们相信 FB-102 用于治疗 gvHD 地址 未满足的需求,可以缩写发展路径 34