目录
RAS表达突变,包括KRAS突变和扩增。RAS基因突变的患者比没有这种突变的患者预后更差,目前还没有批准的药物来治疗RAS突变的患者。我们预计这项试验将在美国的三个地点招募35到50名患者。预期的主要终点将是无进展生存。该试验设计目前正在开发中,准备提交给FDA进行审查。这项试验预计将于2017年开始招生,2018年开始提供初步数据。
我们的管道
下表总结了我们产品开发渠道的当前状况。

我们和Nereus制药公司(Nereus PharmPharmticals,Inc.)已向FDA提交了三份研究新药或IND的申请,以供我们的产品候选。2006年1月,Nereus向FDA提交了S用于实体肿瘤患者的普利布林适应症的IND。这个Ind是在2013年7月转让给我们的。2015年6月,我们向美国食品和药物管理局提交了IND,后来修改了Plinumulin的IND,在S的适应症下,用于二线和三线联合紫杉醇治疗晚期非小细胞肺癌患者,并有至少一个可测量的肺部病变。2016年12月,我们向FDA提交了另一份IND,用于普利布林和S适应症,用于预防接受多西紫杉醇单一免疫系统抑制治疗的实体瘤患者严重的中性粒细胞减少症。
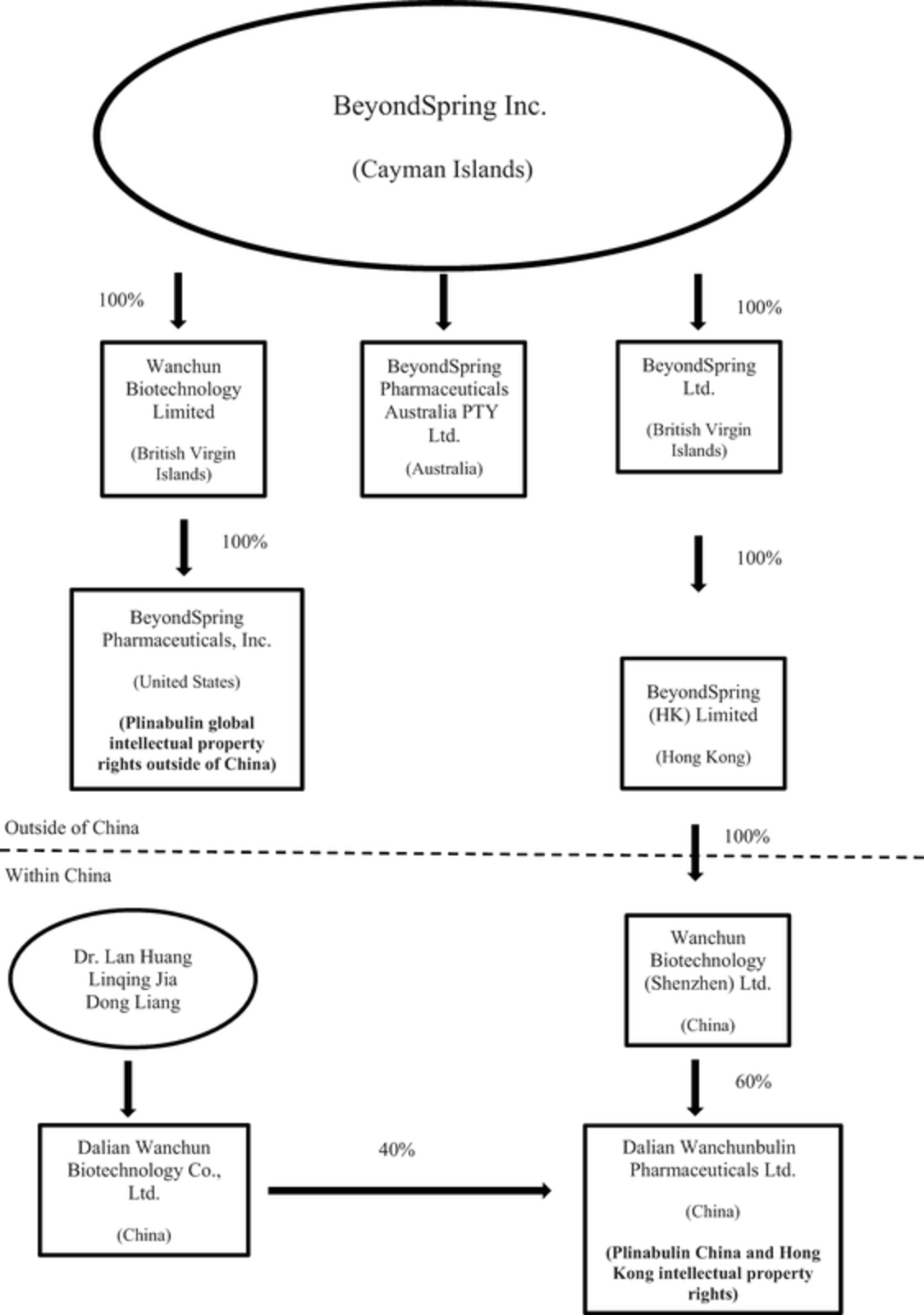
我们的主要执行办公室设在纽约,我们在大连、中国也设有办事处,大连是制药公司的中心。我们在开曼群岛注册成立。我们的管理团队在生物、化学、药物研发、临床开发和监管事务方面拥有丰富的经验和能力。2013年,我们从Nereus手中获得了普利布林的全部全球权利,包括其2期临床试验数据。在获得普利布林后,我们获准在美国、中国和澳大利亚进行3期试验,以研究普利布林与多西紫杉醇联合应用于非小细胞肺癌的抗癌作用。我们预计将在美国、欧洲、以色列、澳大利亚和中国招募患者参加两个2/3期试验,研究普利布林在降低多西紫杉醇化疗引起的严重中性粒细胞减少症、预防非多西紫杉醇化疗引起的严重中性粒细胞减少症方面的作用,并预计在其他适应症方面继续取得进展。
4