

附录 99.1
新闻稿
在特应性皮炎的2B期阳性研究中,EMBLASAKIMAB每月给药显示出同类最佳疗法的潜力
加利福尼亚州圣马特奥和新加坡,2023年7月6日——ASLAN Pharmicals(纳斯达克股票代码:ASLN)是一家专注于临床阶段、以免疫学为重点的生物制药公司,正在开发创新疗法以改变患者生活。该公司今天宣布了其针对中度至重度特应性皮炎(AD)成人患者的依巴拉单抗的2b期剂量范围研究、TREK-AD(trials with eBLA)的正面数据 Asakimab 在特应性皮炎中的应用)研究。与安慰剂相比,Eblasakimab在第16周达到了湿疹区域和严重程度指数(EASI)分数与基线相比变化百分比的主要终点,在三个给药组中具有统计学意义:每 4 周给药一次(600mg Q4W),这是数字上表现最好的手臂,每 2 周给药一次 400 毫克(400mg Q2W),每 2 周给药一次 300mg(300mg Q2W)W)。
Eblasakimab是一种新型的单克隆抗体,靶向2型受体的IL‑13受体亚单位,这是导致多种过敏性炎症性疾病的关键途径。据观察,Eblasakimab的独特作用机制可以对2型受体进行特异性阻断,通过白介素4(IL‑4)和白介素13(IL‑13)(白介素13)(白介素13)(白介素13)(白介素13)进行信号传导,同时保护1型受体。
俄勒冈健康与科学大学弗朗西斯·斯托尔斯医学皮肤病学教授、TREK-AD研究首席研究员埃里克·辛普森医学博士说:“这是我们第一次看到每月一次的治疗方案提供有竞争力的疗效数据,这将改变AD患者的游戏规则。”“自dupilumab推出以来,我们没有看到太多进展,患者所经历的疾病负担仍有巨大的未得到满足。这些结果表明,如果获得批准,依巴沙基单抗有可能成为治疗AD的领先疗法。”
|
|
|

“我们很高兴地宣布来自TREK-AD研究的这些积极的顶线数据,这些数据支持了我们最近发表的转化研究,这些研究表明,eblasakimab的独特作用机制可以为阻断导致过敏性炎症的2型信号传导提供更有效、更有针对性的方法。根据这些结果,我们认为,如果获得批准,eblasakimab可以成为AD的主要治疗方法,它可以让更多的患者服用 EASI-75 或 EASI-90,减少不必要的副作用,快速起作用,而且——独一无二的是——每月一次的给药方便。” ASLAN Pharmicals首席执行官卡尔·菲斯博士说。“我们期待迅速进入AD的第三阶段项目,并探索我们期望这种候选药物取得成功的广泛适应症。我们感谢患者、研究人员和我们的团队,他们为依巴沙基单抗的开发做出了如此重要的贡献。”
主要研究结果
在TREK-AD 2b期研究中,289名患者在意向治疗(ITT)人群中以 1:1:1:1:1 的比例随机分组接受治疗,接受四剂依巴沙基单抗(300mg Q2W、400mg Q2W、400mg Q4W 和 600mg Q4W)或安慰剂中的一剂,持续16周。关键疗效终点,包括 EASI-75 和经过验证的特应性皮炎研究者全球评估 (Viga-ad) 得分 0/1,分别是欧洲和美国监管部门批准的相关终点,如下所示:
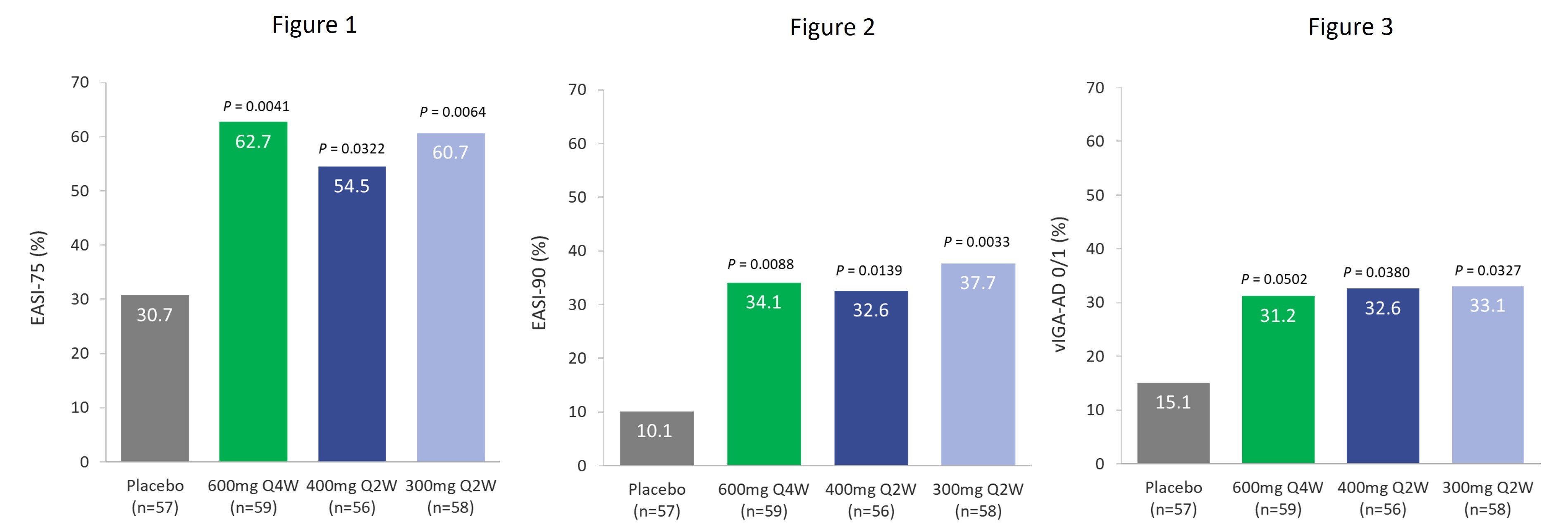
接受依巴沙基单抗600mg Q4W、400mg Q2W和300mg Q2W治疗的患者在治疗的最初几周内反应迅速,到第4周,EASI评分有了统计学上的显著改善。治疗16周后,与安慰剂(n=57)相比,其他关键疗效指标取得了具有临床意义的改善,包括:
Eblasakimab 600mg Q4W (n=59)
|
|
|

Eblasakimab 400mg Q2W (n=56)
Eblasakimab 300mg Q2W (n=58)
Eblasakimab 400mg Q4W (n=59)
eblasakimab 400mg Q4W 给药组未达到具有统计学意义的主要或次要终点。
总体而言,主动治疗组的停药率相当,安慰剂组的停药率更高。没有发现新的安全信号,主动治疗和安慰剂组的不良事件(AE)频率相当。所有活性治疗组中最常观察到的不良反应是鼻咽炎(13.4%,安慰剂为8.8%)、特应性皮炎(8.6%,安慰剂为7.0%)、头痛(6.9%,安慰剂为7.0%)和上呼吸道感染(6.5%,安慰剂为5.3%)。结膜炎(5.2%,安慰剂为1.8%)、注射部位反应(4.7%,安慰剂为1.8%)和疱疹感染(3.0%,安慰剂为3.5%)的发生率都很低。
来自2b期研究的更多数据,包括患者报告的结果和生物标志物数据,预计将于2023年第四季度公布,并提交给未来的科学大会。ASLAN计划与美国食品药品监督管理局会面,举行第二阶段末会议,预计将于2024年启动依巴沙基单抗的3期临床开发计划。该公司还在对有dupilumab经验的AD患者进行Eblasakimab的TREK-DX(Eblasakimab试验)研究,预计将在2024年第一季度公布该研究的头条数据。
|
|
|

关于 2b 期 TREK-AD 研究
TREK-AD(使用Eblasakimab治疗特应性皮炎的试验)研究是一项随机、双盲、安慰剂对照、剂量范围的临床试验,旨在评估eblasakimab作为单一疗法对适合全身治疗的中度至重度AD的生物天真成年患者的疗效和安全性。来自美国、欧洲和亚洲的患者被随机分组,比例相等,分别为四个活跃治疗组和一个安慰剂组:
参与该研究的患者的纳入标准包括至少一年的AD临床诊断,EASI分数大于或等于16,Viga-ad分数大于或等于3,在筛查和基线时体表面积至少为10%。在为期16周的评估期结束后,又对患者进行了12周的随访。
关于依巴沙基单抗
Eblasakimab是一种潜在的同类首创单克隆抗体,靶向2型受体的IL‑13受体亚单位,这是导致多种过敏性炎症性疾病的关键途径。Eblasakimab的独特作用机制能够特异性阻断2型受体,并有可能改进目前用于治疗过敏性疾病的生物制剂。通过阻断2型受体,eblasakimab可防止通过白介素4(IL-4)和白介素13(IL‑13)发出信号传导,白介素是AD 炎症的关键驱动因素。
网络直播
ASLAN的管理层将于美国东部时间今天(2023年7月6日)上午8点30分主持网络直播,讨论这些数据。使用以下链接注册即可观看网络直播: https://lifescievents.com/event/aslan/。网络直播的重播将在2023年10月4日之前播出,直播结束后将使用上述信息。
关于阿斯兰制药
ASLAN Pharmicals(纳斯达克股票代码:ASLN)是一家临床阶段、以免疫学为重点的生物制药公司,开发创新疗法来改变患者的生活。ASLAN 正在开发 eblasakimab,这是一种靶向中度至重度特应性皮炎 (AD) 中 IL-13 受体的潜在同类首创抗体,有可能改进当前用于治疗过敏性疾病的生物制剂,并且最近报告了一项针对中度至重度 AD 的 2b 期剂量范围研究的积极顶线数据。ASLAN还在开发farudodstat,这是一种有效的口服二氢乳酸脱氢酶(DHODH)抑制剂,作为一种潜在的2a期概念验证试验中针对斑秃症(AA)的首创治疗药物,中期读数预计将于2024年第一季度公布。ASLAN 在加利福尼亚州圣马特奥和新加坡都有团队。欲了解更多信息,请访问 网站或者在 ASLAN 上关注 ASLAN 领英.
|
|
|

前瞻性陈述
本新闻稿包含前瞻性陈述。这些陈述基于ASLAN Pharmicals Limited和/或其关联公司(“公司”)管理层当前的信念和期望。这些前瞻性陈述可能包括但不限于关于公司业务战略和临床开发计划的陈述;公司开发和商业化依巴沙基单抗的计划;eblasakimab 的安全性和有效性,包括其成为同类最佳药物的潜力;公司在依巴沙基单抗临床试验、临床试验入组和临床试验结果方面的计划和预期时机;eblasakimab 作为特应性治疗药物的潜力皮炎。公司的估计、预测和其他前瞻性陈述基于管理层对未来事件和趋势的当前假设和预期,这些事件和趋势影响或可能影响公司的业务、战略、运营或财务业绩,并且本质上涉及重大的已知和未知风险和不确定性。由于存在许多风险和不确定性,实际结果和事件发生时间可能与此类前瞻性陈述中的预期存在重大差异,其中包括但不限于在临床前或临床研究中观察到的意外安全性或有效性数据;早期研究和试验的结果可能无法预测未来的试验结果;临床场所激活率或临床试验入组率低于预期;COVID-19 疫情或乌克兰和俄罗斯之间持续冲突的影响公司业务和全球经济的银行倒闭;总体市场状况;竞争格局的变化;以及公司获得足够资金为其战略和临床开发计划提供资金的能力。公司的美国证券交易委员会文件和报告(委员会文件编号001-38475)中描述了可能导致实际业绩与此类前瞻性陈述中明示或暗示的业绩不同的其他因素,包括公司于2023年3月24日向美国证券交易委员会提交的20-F表年度报告。除历史事实陈述外,所有陈述均为前瞻性陈述。“相信”、“可能”、“可能”、“可以”、“将”、“目标”、“估计”、“继续”、“预期”、“打算”、“期望”、“计划” 或这些术语的负面词语,以及表达未来事件或结果不确定性的类似表述旨在确定估计、预测和其他前瞻性陈述。估计、预测和其他前瞻性陈述仅代表其发表之日,除法律要求外,公司没有义务更新或审查任何估计、预测或前瞻性陈述。
结束
媒体和投资者关系联系人
艾玛汤普森 刺激沟通 电话:+65 6206 7350 电子邮件: ASLAN@spurwingcomms.com
|
艾什莉·罗宾逊 LifeSci 顾问有限公司 电话:+1 (617) 430-7577 电子邮件: arr@lifesciadvisors.com |
|
|
|