

VAX-24 第 2 阶段项目结果, 包括 2023 年 4 月 17 日两项研究的 65 岁以上成人数据和完整的六个月安全数据附录 99.2

2023 年 4 月前瞻性陈述 本演示包含 1995 年《私人证券诉讼改革法》所指的前瞻性陈述。这些陈述包括但不限于与Vaxcyte 候选疫苗的潜在益处有关的陈述,包括覆盖范围和可能提供同类最佳肺炎球菌偶联疫苗的能力;对Vaxcyte候选疫苗的需求;未来预期开发的过程和时机;肺炎球菌疫苗市场的增长和扩张;Vaxcyte 疫苗的市场机会;Vaxcyte 对频谱覆盖范围的预期,监管途径、 候选疫苗的采用速度和免疫原性;Vaxcyte 临床前研究、临床试验和研发计划(包括提交 IND 申请 VAX-31 和监管相互作用以及 VAX-24 成人、VAX-24 婴儿和 VAX-31 研究数据的可用性)的启动时间、进展和预期结果;以及其他非历史事实的陈述。“预期”、“相信”、 “继续”、“可能”、“设计”、“估计”、“期望”、“打算”、“可能”、“计划”、“潜在”、“预测”、“项目”、 “应该”、“目标”、“将” 等词语旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别性词语。这些 前瞻性陈述基于Vaxcyte当前的预期,由于风险和不确定性,实际业绩和事件发生时机可能与此类前瞻性陈述中的预期存在重大差异,包括 但不限于与Vaxcyte产品开发计划相关的风险,包括开发时间表、化学、制造和控制及相关制造活动的成功和时机; 获得和维持所需的监管批准的潜在延迟或无法获得和维持所需的监管批准因为它的疫苗候选人;临床前和临床开发过程固有的风险和不确定性;所有开发活动和临床试验的成功、成本和时机; 以及支持Vaxcyte开发计划和其他运营支出的现金和其他资金的充足性,其中任何一项都可能对Vaxcyte的业务和运营产生重大和不利影响。在Vaxcyte向美国证券交易委员会(SEC)提交的文件,包括其于2023年2月27日向美国证券交易委员会(SEC)提交的10-K表年度报告或Vaxcyte随后向美国证券交易委员会(SEC)提交或提供给美国证券交易委员会(SEC)的其他文件中,对这些风险和其他风险进行了更全面的描述。由于新信息、未来事件或预期变化,Vaxcyte没有责任或义务更新本新闻稿中包含的任何前瞻性陈述。

简介和 vax-24 结果 概述 VAX-24 65 岁及以上成年人(65 岁以上)的第 2 阶段研究结果性状和人口统计学安全性和耐受性数据免疫原性数据两项成人研究的预先指定的合并免疫原性分析两项成人研究的完整六个月安全性 数据来自两项成人研究项目结论、现状和后续步骤议程 2023 年 4 月

简介和 VAX-24 结果 2023 年 4 月概述

摘要:VAX-24 65岁以上成人研究结果 确认先前的第 2 阶段结果积极结果支持 VAX-24 具有同类最佳潜力,为 3 阶段的设计和进展奠定了基础 2023 年 4 月安全:来自 65 岁以上成年人的 2 期研究和先前针对 18-64 岁成年人的 1/2 期研究 的完整六个月安全性数据显示 VAX-24 的安全性和耐受性结果与所有研究剂量的 Prevnar 20® (PCV20) 相似免疫原性:65+ 研究实现了靶向反应针对剂量为 2.2mcg 的所有 24 种血清型,表明 VAX-24 有可能扩大覆盖范围和与标准护理标准相比,提高免疫原性 2 期 65 岁以上的研究结果(n~45/arm):VAX-24 符合 PCV20 常见的 18/20 个 ST 的 OPA 反应非劣质标准,并符合所有 VAX-24 VAX-24 特有的所有四个 其他 ST的优越性标准显示,与第 2 阶段的结果相比 PCV20 的免疫反应总体有所改善 VAX-24:与美国食品药品管理局的第二阶段结束会议 2H: 23;2025 年的第 3 阶段关键免疫原性数据婴儿:第 2 阶段 PCV20 VAX-24研究招收受试者,截至 2025 年,来自初级三剂量免疫系列的主要数据 VAX-31 成人:IND 申请 提交 2H: 23;来自 2024 年 1/2 期研究的头条数据:新数据进一步支持了我们保留载体的 PCV 特许经营权和无细胞平台 VAX-24 处于有利于成人 3 期关键研究的最佳剂量 2.2mcg 被证实为进入 3 期关键研究的最佳剂量,其中将包括成人对两项针对 50 岁以上(n~225/组)和 60 岁以上(n~100)的成人 2 期成人研究的 50+ 或 60+ 预先指定的汇总分析 VAX-24/group) 符合所有 20 个常见 ST 的 OPA 反应非自卑性标准,并符合另外四个 ST 的优越性标准,这是 VAX-24 第 2 阶段末与 FDA 会面以确认研究规模和人群(预计 n~750/arm)OPA = Opsonophagocytic 活性;sT = 血清型;GMR = 几何平均比率

2023 年 4 月肺炎链球菌是 导致肺炎球菌病 (PD) 的最常见病原体。仅在美国,每年就有约32万例肺炎球菌肺炎病例,导致约15万人住院。侵入性肺炎球菌病 (IPD) 是 两岁及以下儿童侵袭性疾病的主要原因。在美国和全球流行的PD菌株与高病死率、抗生素耐药性和/或脑膜炎有关。肺炎球菌病的全球影响仍然很显著由当前 PCV 以外的血清型驱动的循环 疾病 Gierke 2015 https://www.cdc.gov/pneumococcal/clinicians/clinical-features.html
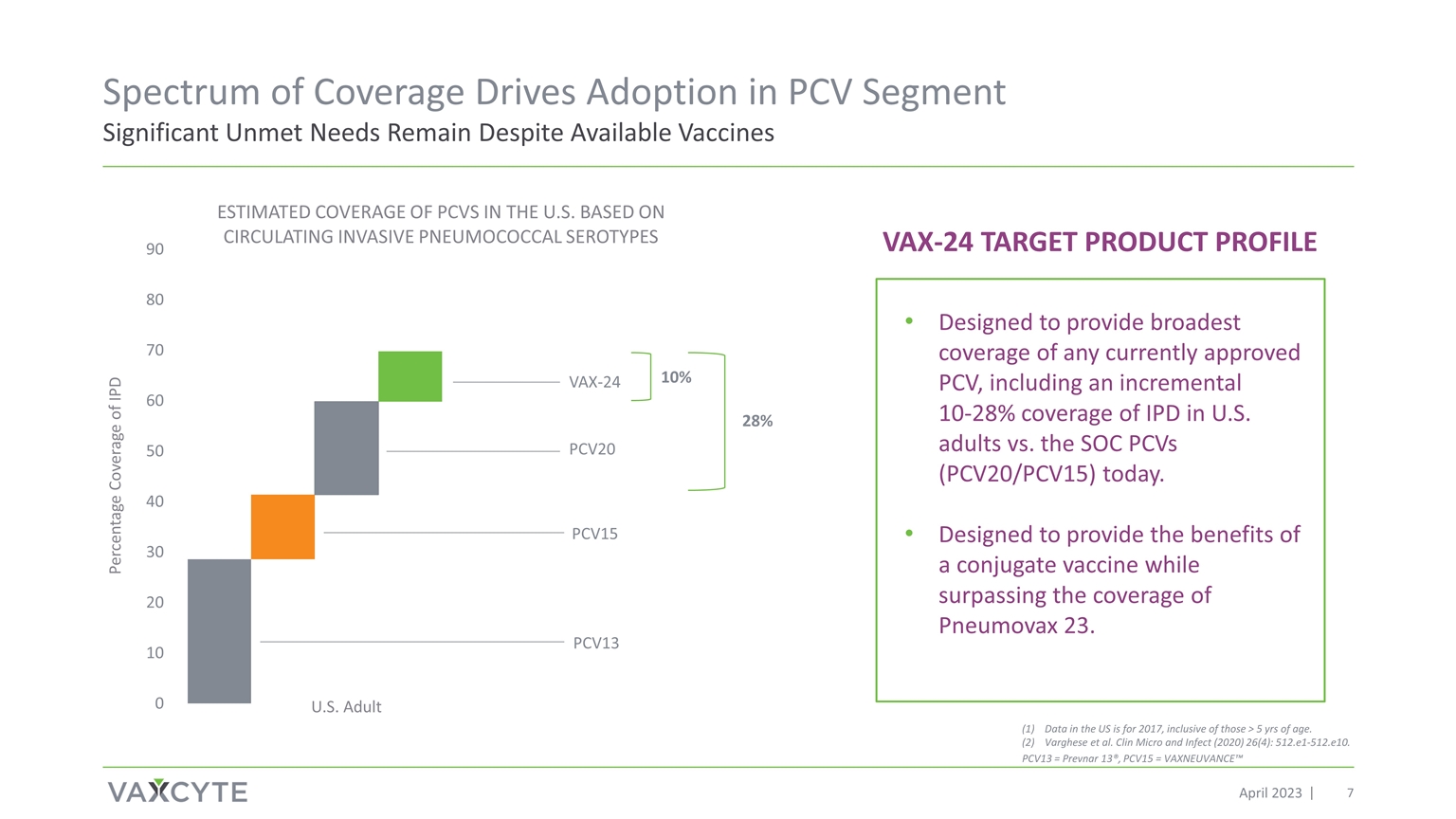
2023年4月覆盖范围推动PCV细分市场采用 尽管有2017年的疫苗数据,但仍有大量未满足的需求,包括5岁以上的疫苗。Varghese 等人。Clin Micro and Infect (2020) 26 (4):512.e1-512.e10。PCV20 PCV15 PCV13 专为 提供目前批准的所有PCV中最广泛的覆盖范围,包括与当今的SOC PCV(PCV20/PCV15)相比,美国成年人IPD的覆盖率增加了10-28%。旨在提供偶联疫苗的好处,同时超过 Pneumovax 23 的覆盖范围。VAX-24 目标产品概况 10% 28% PCV13 = Prevnar 13®,PCV15 = VAXNEUVANCE™
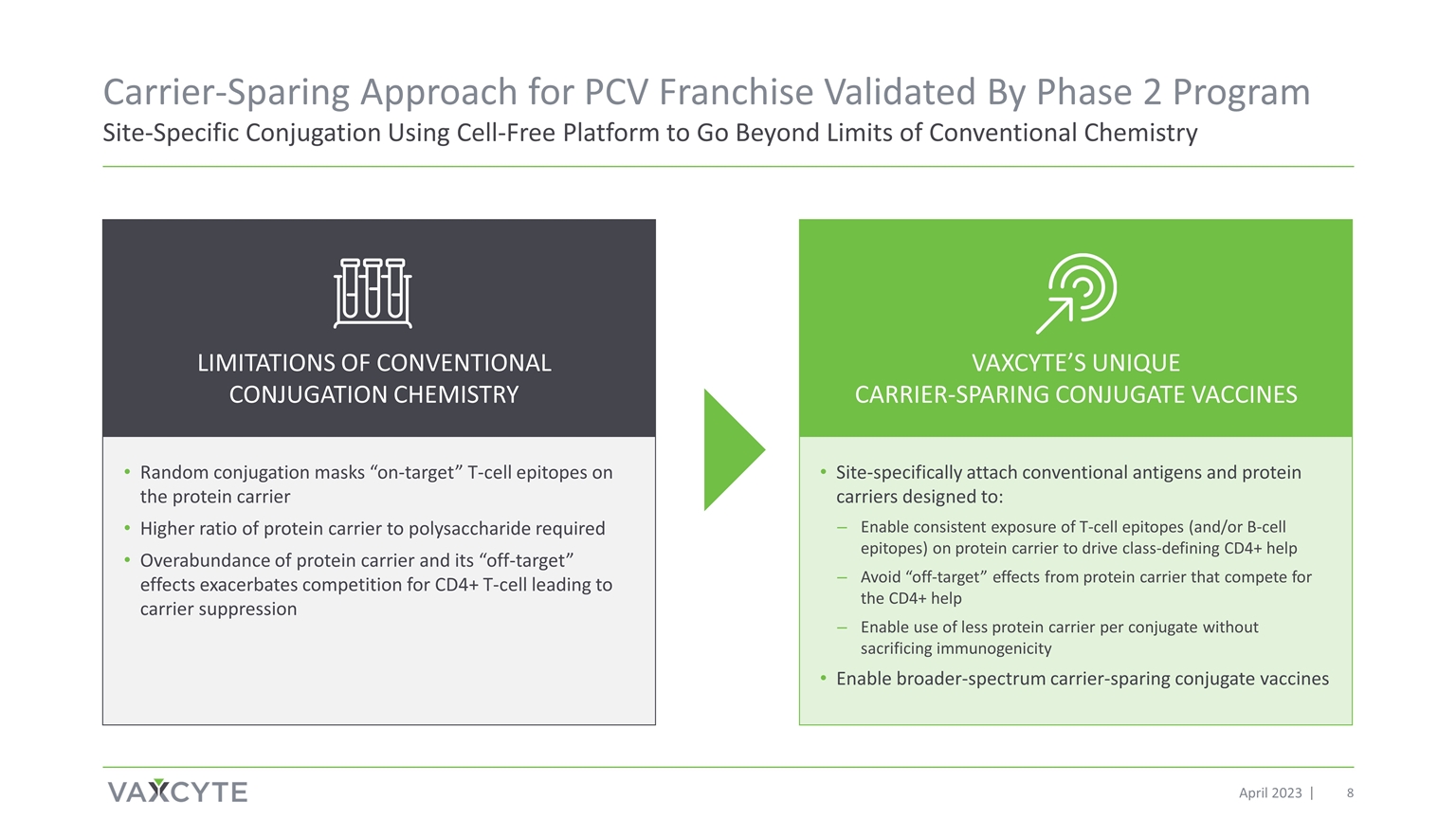
2023 年 4 月 PCV 特许经营的载体保留方法已通过第 2 阶段项目位点特异性偶联使用无细胞平台进行验证随机偶联掩膜蛋白载体上 “靶向” T 细胞表位蛋白载体与多糖的比例越高 蛋白载体与多糖的比率越高蛋白载体和其 “脱离靶标” 效应加剧了对 CD4+ T 细胞的竞争,导致载体抑制局限性常规偶联化学 位点特异性连接常规抗原和蛋白质载体设计用于:支持持续暴露在蛋白质载体上 T 细胞表位(和/或 B 细胞表位)以驱动定义类别的 CD4+ 帮助避免争夺 CD4+ 的 蛋白载体产生的 “脱靶效应” 帮助在不牺牲免疫原性的前提下实现每个偶联物使用更少的蛋白质载体启用更广谱的载体共轭疫苗 VAXCYTE 独特的抗载体 CONCYTE JUGATE 疫苗
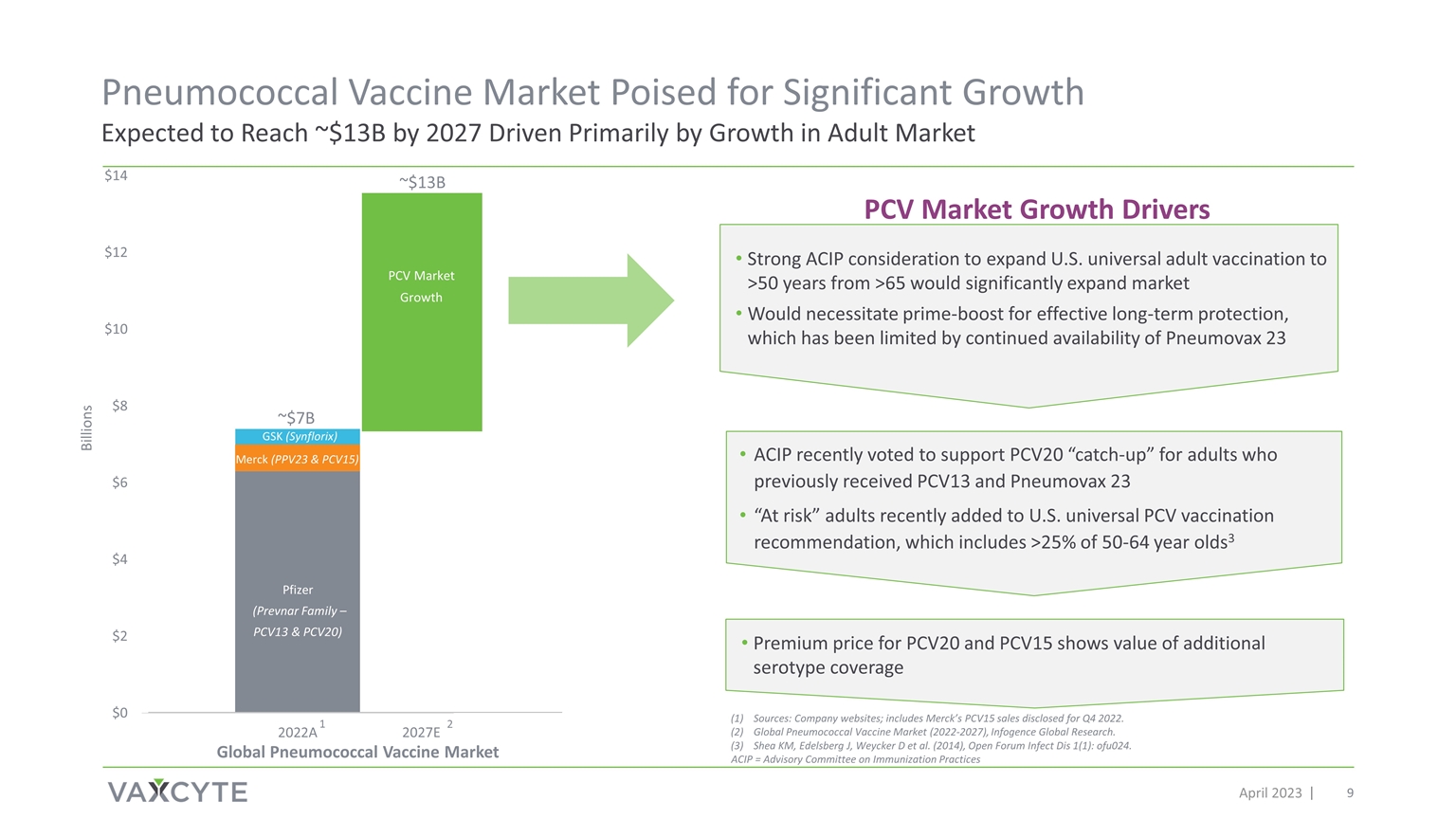
2023年4月约130亿美元约70亿美元市场增长 辉瑞(Prevnar Family — PCV13 和 PCV20)默克(PPV23 和 PCV15)葛兰素史克(Synflorix)Billions 其他来源:公司网站;包括默克披露的2022年第四季度的 PCV15 销售额。全球肺炎球菌疫苗市场(2022-2027),Infogence 全球研究。Shea KM、Edelsberg J、Weycker D 等(2014),Open Forum Infect Dis 1 (1):ofu024。ACIP 最近投票支持 PCV20 对之前接种 PCV13 和 Pneumovax 23 “处境危险” 的成年人 “迎头赶上”。 最近加入了美国通用五氯苯疫苗接种建议,其中包括超过 25% 的 50-64 岁3 1 PCV 市场增长驱动因素 ACIP 强烈考虑将美国的全民成人疫苗接种从 65 岁扩大到 50 岁以上 将市场显著扩张需要主要推动才能获得有效的长期保护,这受到 Pneumovax 23 持续上市的限制 PCV20 的高级价格和 PCV15 显示的价值为额外的血清型覆盖范围 2027E 2 全球肺炎球菌疫苗市场 PCV 市场增长肺炎球菌疫苗市场有望显著增长,预计到 2027 年将达到约 13B 美元,这主要是由成人市场的增长推动的 ACIP = 免疫实践咨询委员会

VAX-24 针对 65 岁以上成年人的 2 期研究 2023 年 4 月

2023 年 4 月的研究设计
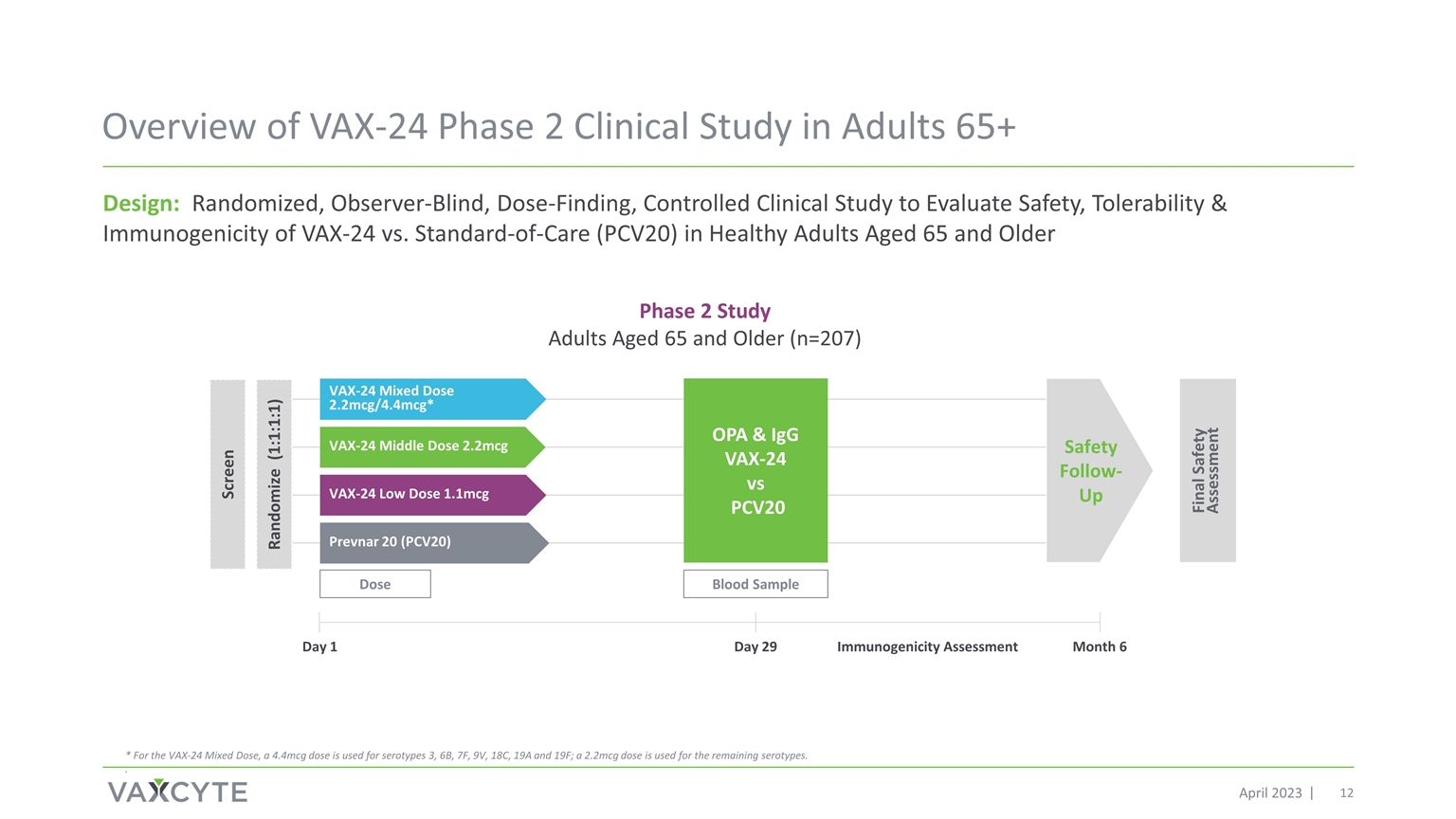
2023 年 4 月 65 岁以上成年人的 VAX-24 第 2 期临床 研究概述设计:随机、观察者失明、剂量发现、对照临床研究,旨在评估 65 岁及以上健康成年人 VAX-24 的安全性、耐受性和免疫原性 1 剂量 血液样本 2 期研究 65 岁及以上成年人 (n=207) prevnar 20 (PCV20) VAX-24 低剂量 1.1mcg VAX-24 Middle Dose 2.2mcg VAX-24 混合剂量 2.2mcg/4.4mcg* OPA & IgG vs SOND 最终安全评估安全随访日 29 月 6 免疫原性评估随机化 (PCV20 VAX-24 PCV201:1:1:1) 筛查 * 对于 VAX-24 混合剂量,4.4mcg 剂量用于血清型 3、6B、7F、9V、18C、19A 和 19F;2.2mcg 剂量用于其余血清型。
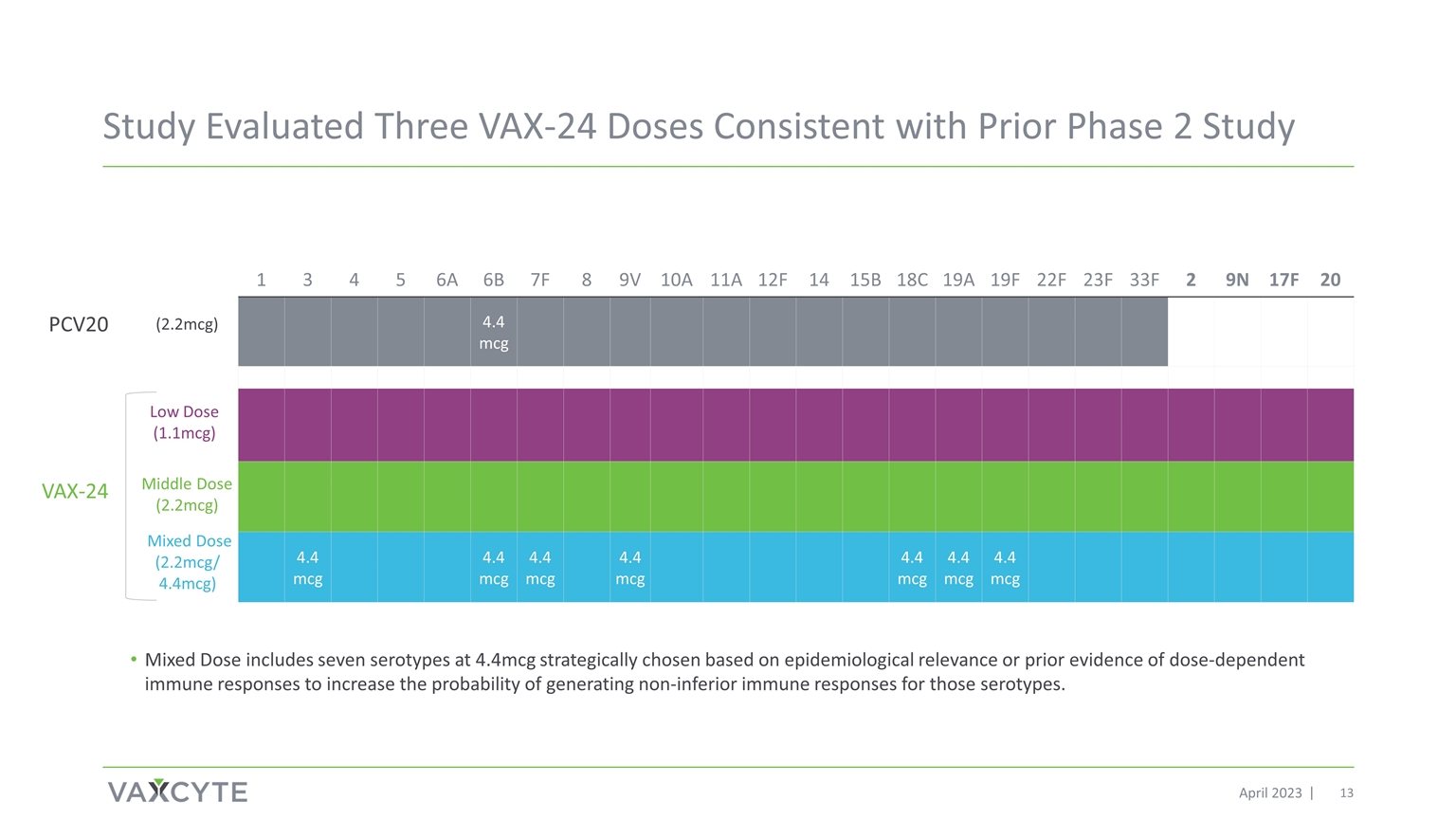
研究评估了三剂 VAX-24 剂量 与之前的 2023 年 4 月第 2 阶段研究一致 1 3 4 5 6A 6B 7F 8 9V 10A 11A 12F 14 15B 18C 19F 22F 23F 2 9N 17F 20 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg) 混合剂量 (2.2mcg/ 4.4mcg) PCV20 VAX-24 (2.2mcg) 混合剂量包括七种 4.4mcg 的血清型,根据流行病学相关性或先前的剂量依赖性免疫反应证据进行战略选择,以增加这些血清型产生非劣质免疫 反应的可能性。
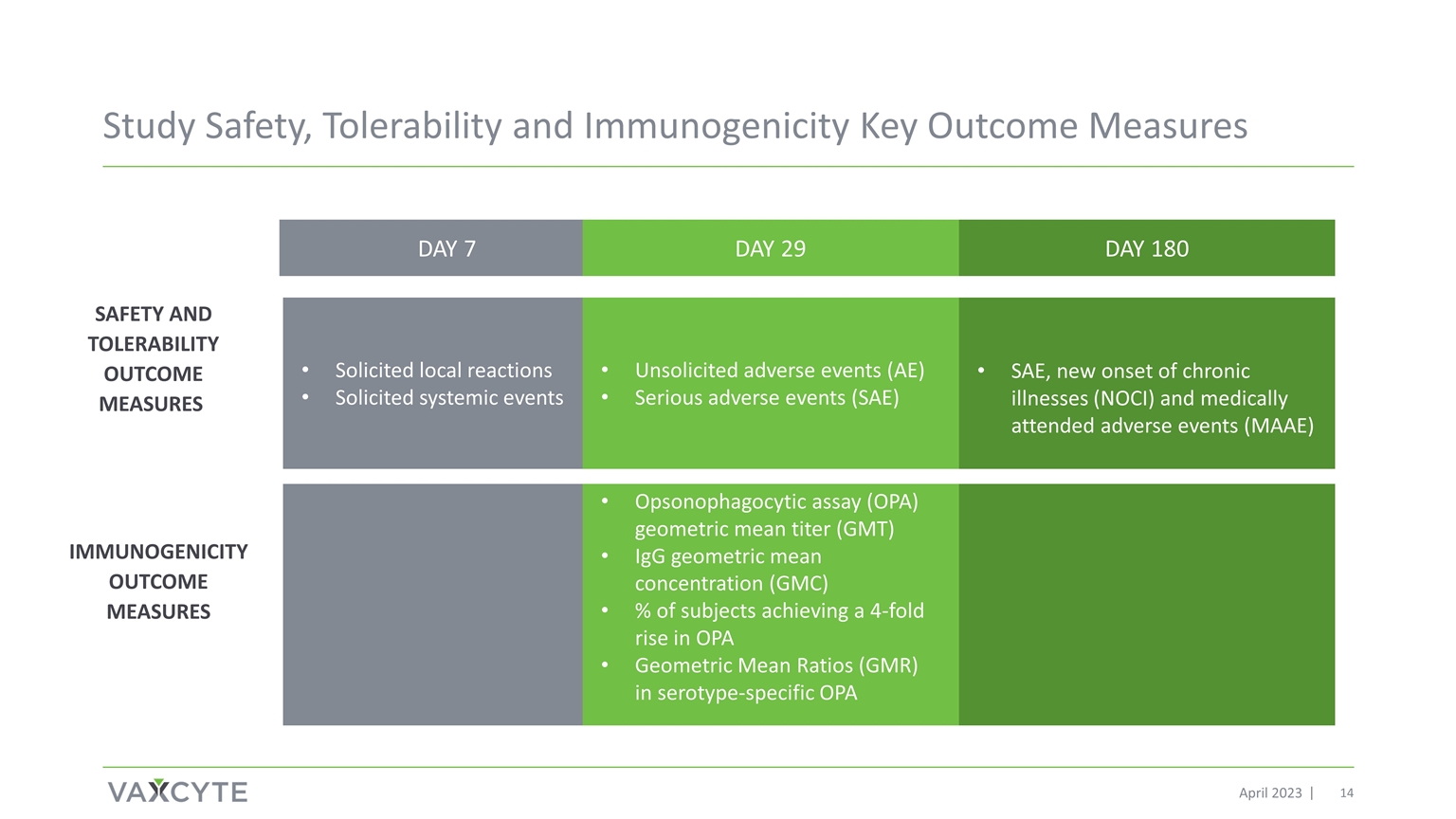
研究安全性、耐受性和 免疫原性关键结果衡量标准 2023 年 4 月安全性和耐受性结果衡量标准第 7 天 29 天第 180 天征集的局部反应征集的全身性事件未经请求的不良事件 (AE) 严重不良事件 (SAE)、慢性病新发 (NOCI) 和医疗辅助不良事件 (MAAE) Opsonophagocytical alsation astry (OPA) 几何平均滴度 (GMT) 血清型特异性 OPA 几何平均比率 (GMR) 提高了 4 倍的受试者的 IgG 几何平均浓度 (GMC) 百分比OPA

2023 年 4 月 的配置和人口统计
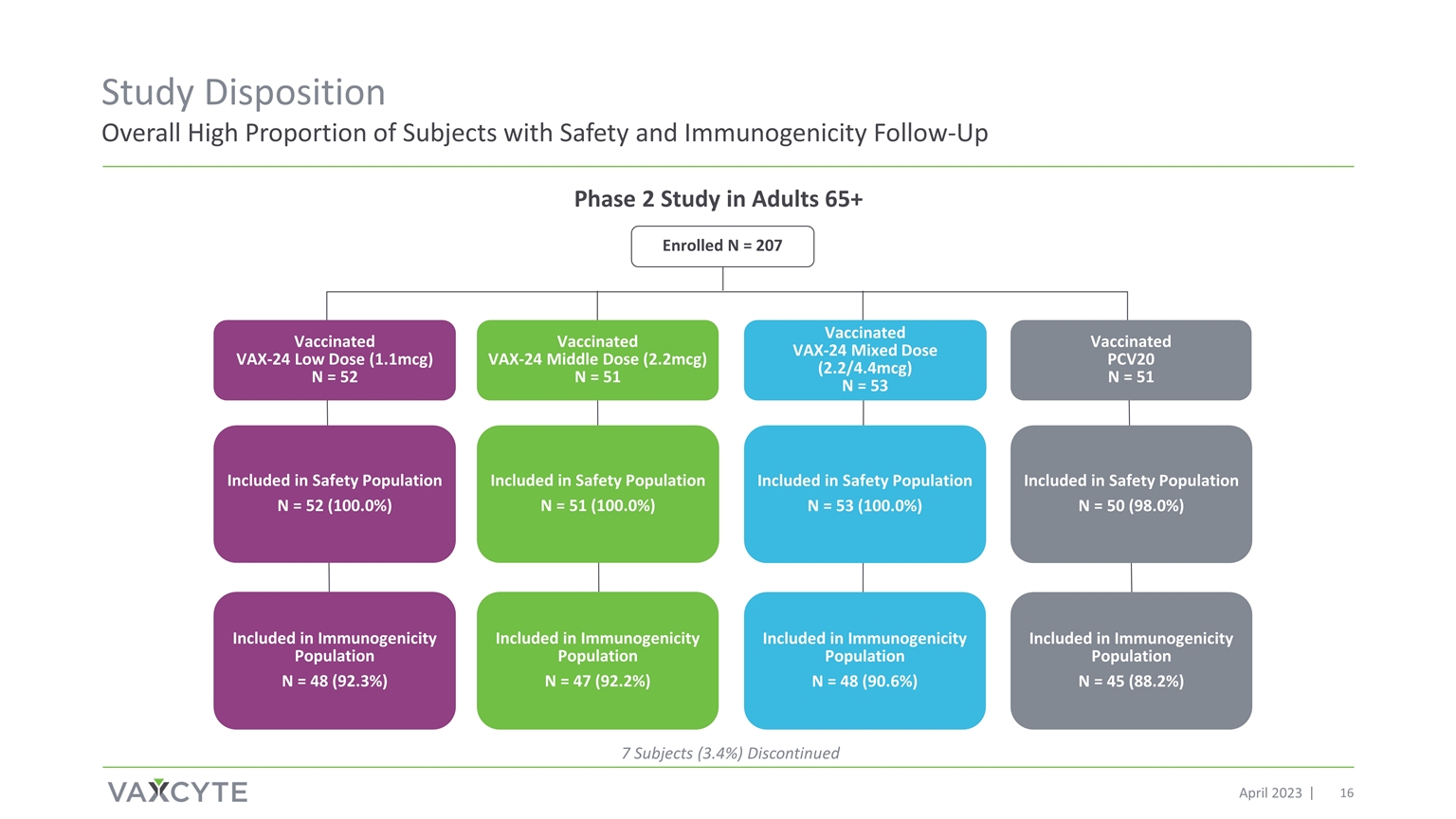
研究倾向总体较高 2023 年 4 月针对成人 65 岁以上 7 名受试者(3.4%)的第 2 阶段研究 2 期研究已停止 N = 207 包含在安全人群中 N = 50 (98.0%) 包含在安全人群中 N = 53 (100.0%) 包含在安全人群中 N = 51 (100.0%) 已接种疫苗 PCV20 N = 51 VAX-24 低剂量 (1.1mcg) N = 52 已接种疫苗 VAX-24 中间剂量 (2.2mcg) N = 51 已接种疫苗 VAX-24 混合剂量 (2.2/4.4mcg) N = 53 包含在免疫原性中免疫原性人群 N = 48 (92.3%) 包含在免疫原性人群 N = 47 (92.2%) 包含在免疫原性人群 N = 48 (90.6%) 中 N = 45 (88.2%)
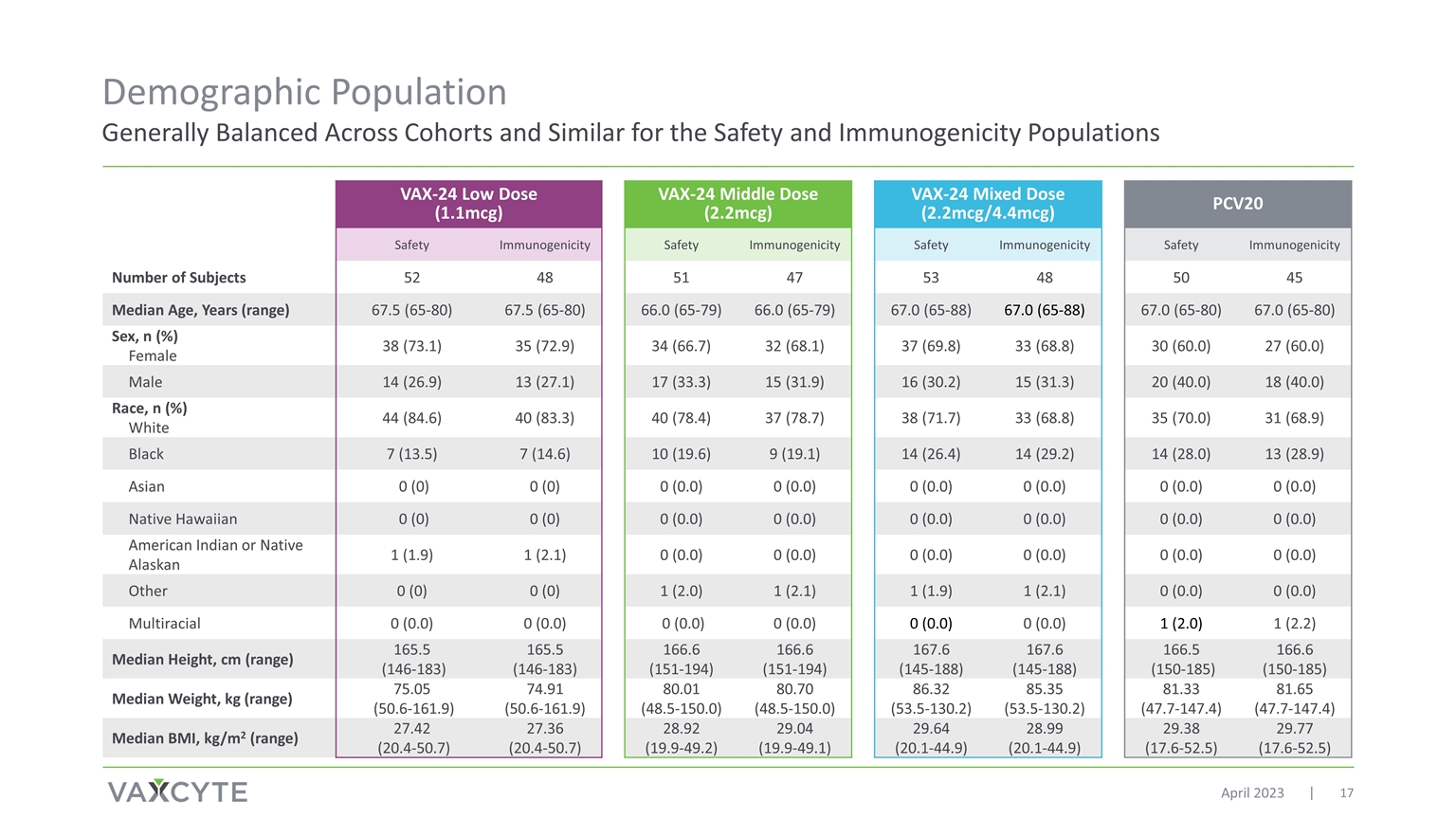
总体而言 安全性和免疫原性人群在各组之间保持平衡 2023 年 4 月 VAX-24 低剂量 (1.1mcg) VAX-24 中剂量 (2.2mcg) VAX-24 混合剂量 (2.2mcg/4.4mcg) PCV20 安全性免疫原性安全性 免疫原性安全免疫原性受试者人数 52 48 51 47 53 48 50 45 中位年龄,岁 (range) 67.5 (65-80) 67.5 (65-80) 66.0 (65-79) 66.0 (65-79) 67.0 (65-88) 67.0 (65-88) 67.0 (65-80) 67.0 (65-80) 性别,n (%) 女 38 (73.1) 35 (72.9) 34 (66.7) 32 (68.1) 37 (69.8) 33 (68.8) 30(60.0) 27 (60.0) 男 14 (26.9) 13 (27.1) 17 (33.3) 15 (31.9) 16 (30.2) 15 (31.3) 20 (40.0) 18 (40.0) 种族,n (%) 白人 44 (84.6) 40 (83.3) 40 (78.4) 37 (78.7) 33 (68.8) 35 (70.0) 31 60 (60.0) 8.9) 黑色 7 (13.5) 7 (14.6) 10 (19.6) 9 (19.1) 14 (26.4) 14 (29.2) 14 (28.0) 13 (28.9) 亚洲人 0 (0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 美洲印第安人或原住民 阿拉斯加人 1 (1.9) 1 (2.1) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 其他 0 (0) 0 (0) 1 (2.0) 1 (1.9)1 (2.1) 0 (0.0) 0 (0.0) 多人种 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 1 (2.2) 中位身高,cm(范围)165.5 (146-183) 165.5 (146-183) 166.6 (151-194) 166.6 (151-194) 167.6 (145-188) 167.6 (145-188) 167.6 (145-188) 167.6 (145-188) 166.5 (150-185) 166.6 (150-185) 中位重量,kg(范围)75.05 (50.6-161.9) 74.91 (50.6-161.9) 80.01 (48.5-150.0) 86.32 (53.5-130.2) 85.35 (53.5-130.2) 81.33 (47.7-147.4) 81.65 (47.7-147.4) 81.65 (47.7-147.4) 81.65 (47.7-147.4) 体重指数中位数,kg/m2(范围)27.42 (20.4-50.7) 27.36 (20.4-50.7) 28.92 (19.9-49.2) 29.64 (20.1-44.9) 28.99 (20.1-44.9) 29。38 (17.6-52.5) 29.77 (17.6-52.5)

2023 年 4 月 安全性和耐受性数据
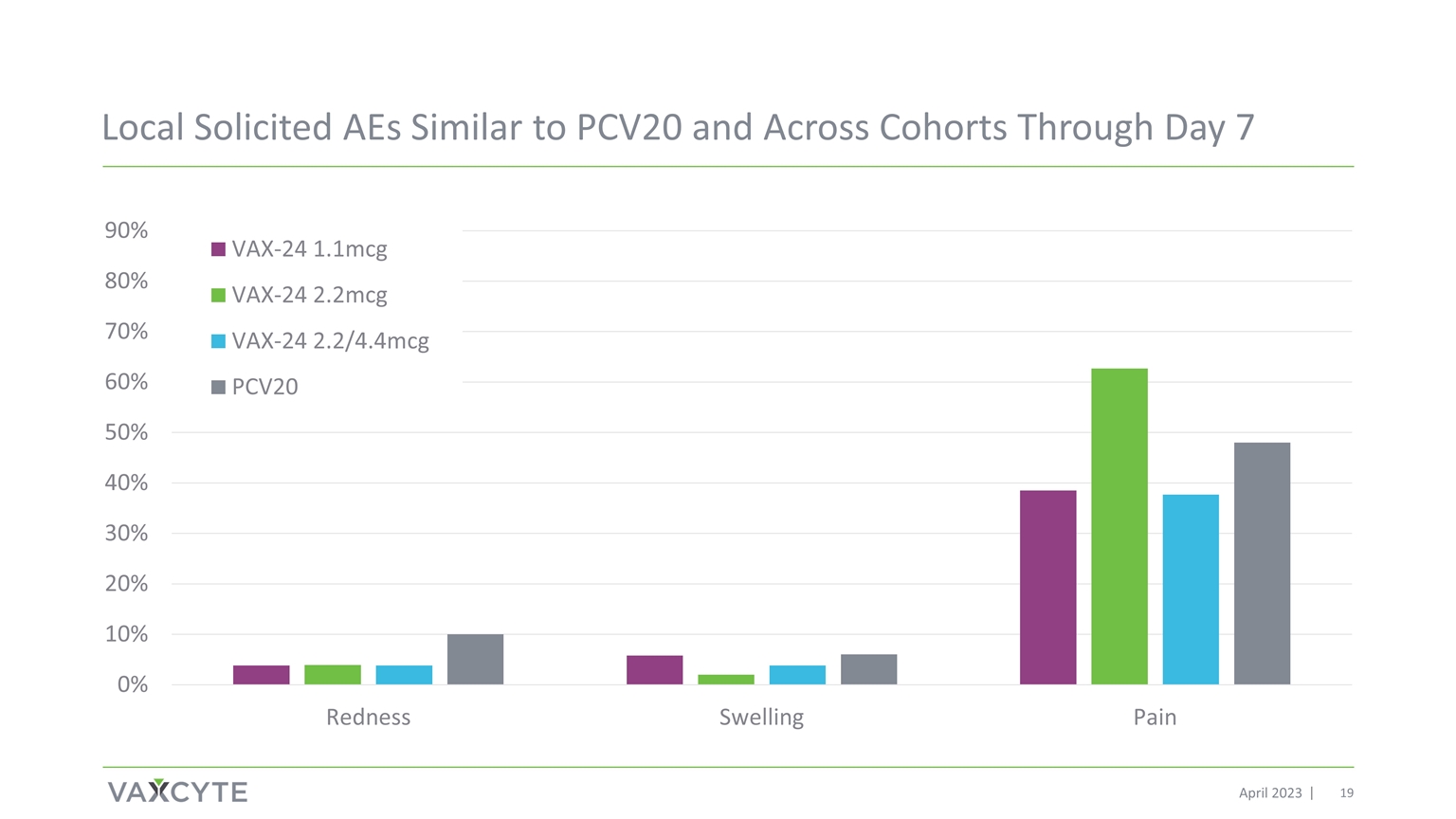
截至 2023 年 4 月 7 日,本地征集的与 PCV20 相似的 AE 以及跨群组的 AE
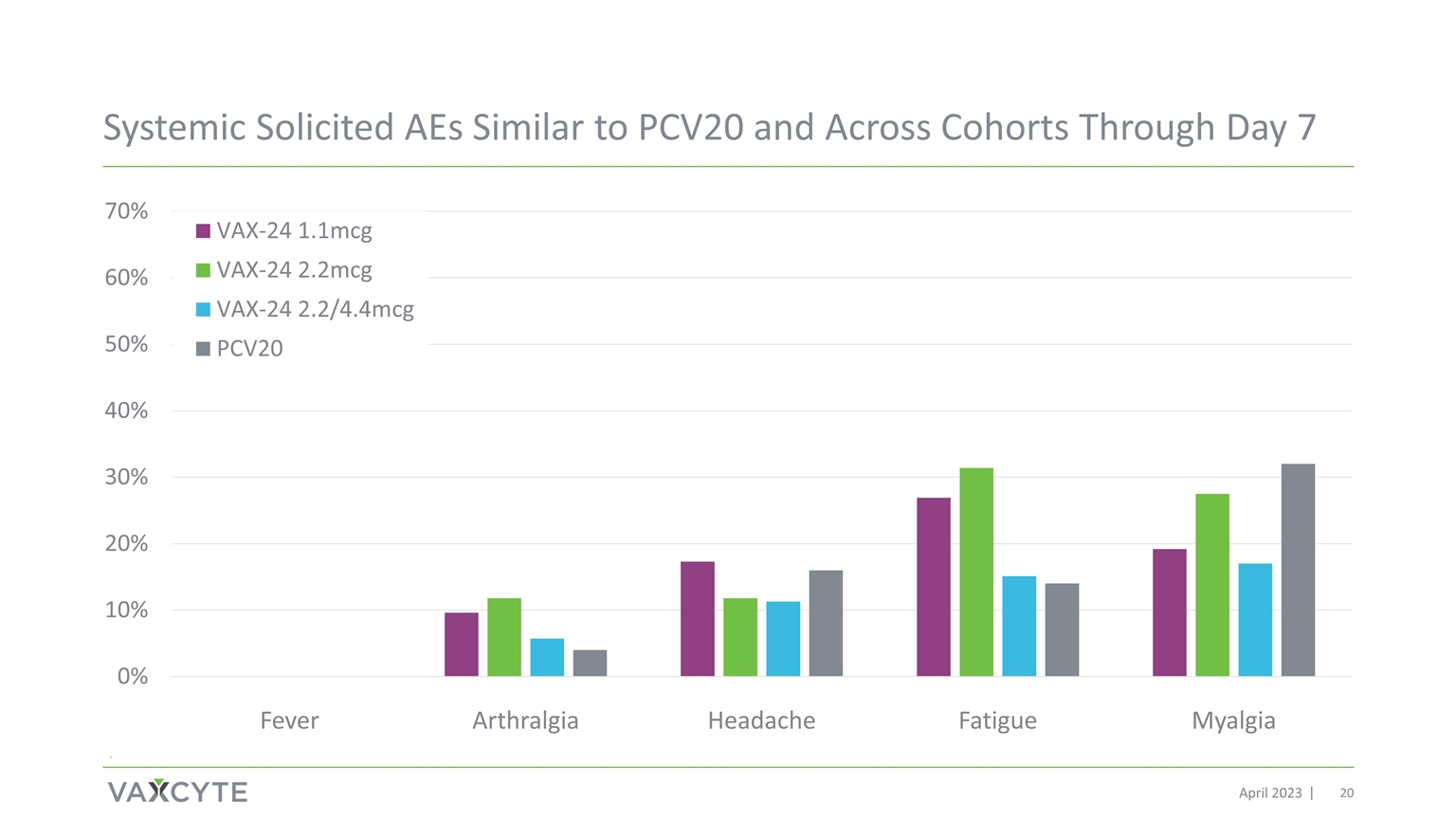
截至 2023 年 4 月 7 日,系统性征集与 PCV20 相似的 AE 和跨群组。

2023 年 4 月 免疫原性数据

VAX-24 中四种增量 血清型的标准:优越性:从第 1 天到第 29 天增加大于 4 倍的参与者比例差异的双侧 95% 置信区间的下限大于 10% OPA 的双面 95% 置信区间的下限 GMR 的下限大于 2.0 对 VAX-24 和 PCV20 常见的 20 种血清型的标准:非低级:双面 95% 置信区间的下限 OPA GMR 大于 0.5 优越性:OPA GMR 的双面 95% 置信区间的下限大于 差值的双面 95% 置信区间的下限从第1天到第29天增加≥4倍的参与者的比例大于02023年4月的第2/3期PCV免疫原性研究的先例监管标准 CI = 置信区间。
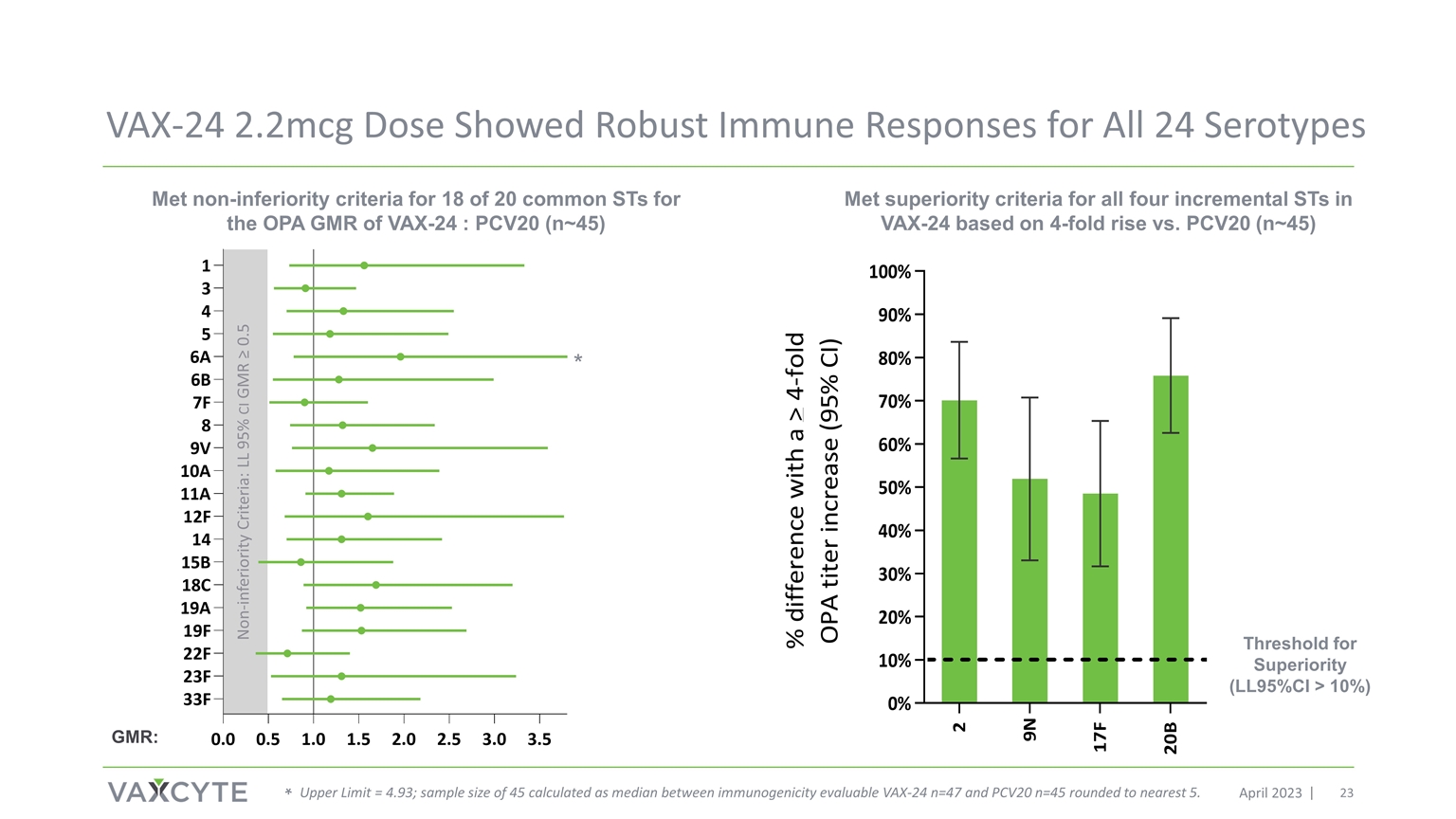
VAX-24 2.2mcg 剂量 2023 年 4 月所有 24 种血清型均显示出强劲 免疫反应 VAX-24 OPA GMR 的 20 个常见 ST 中有 18 个符合非劣等标准:PCV20 (n~45) 与 PCV20 相比上升 4 倍(n~45) 非低级标准:LL 95% 置信区间 GMR ≥ 0.5 优势阈值(LL 95% 置信区间 > 10%) * * 上限 = 4.93;样本量为 45,按可评估的免疫原性 VAX-24 n=47 和 PCV20 n=45 之间的中位数计算,四舍五入到最接近的 5。VAX-24 GMR:
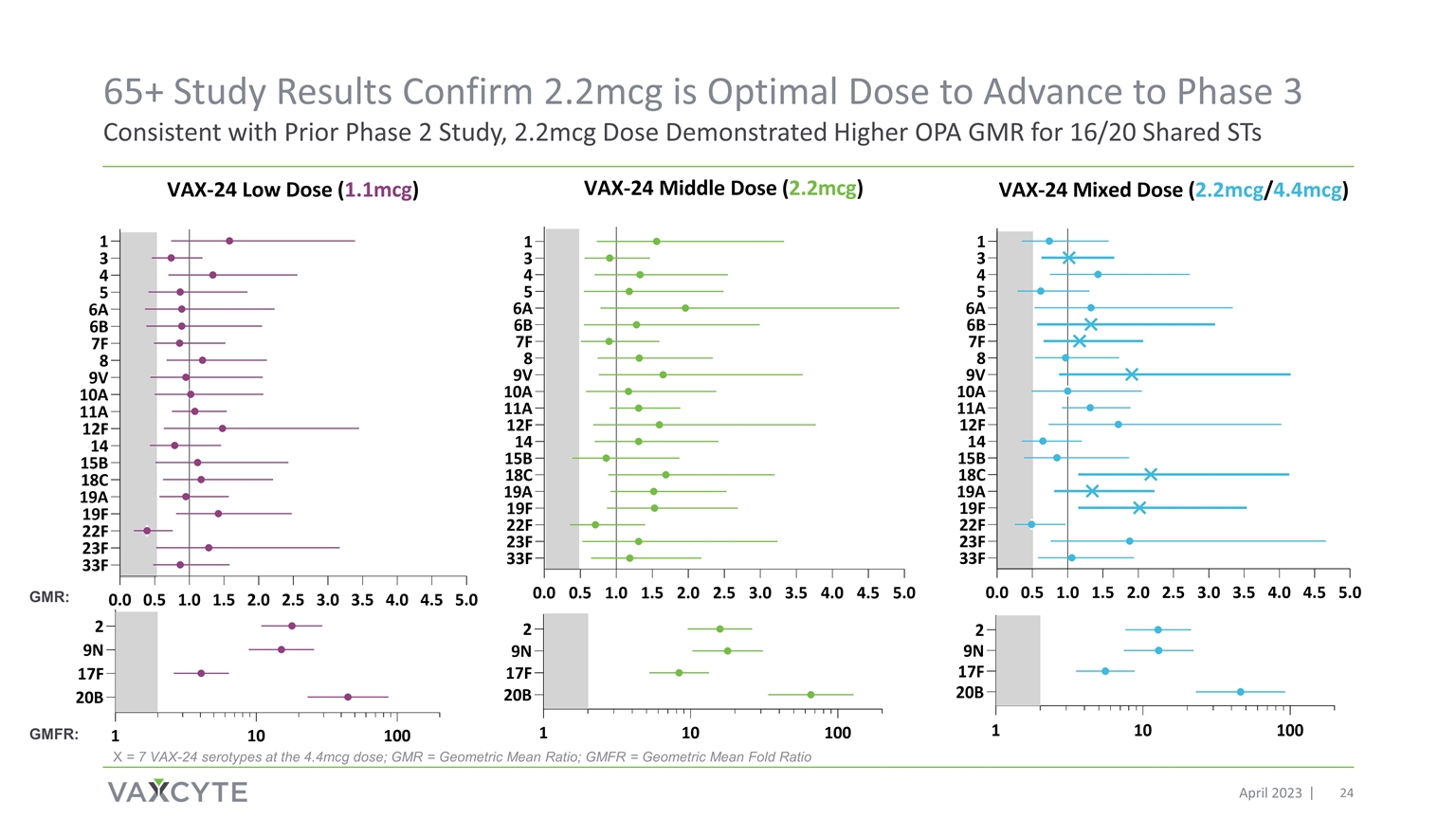
65+ 研究结果证实 2.2mcg 是 进入第 3 阶段的最佳剂量,与之前的 2 期研究一致,2.2mcg 剂量显示出 16/20 个共享 ST 的 OPA GMR 更高 X = 在 4.4mcg 剂量下为 7 个 VAX-24 血清型;GMR = 几何平均折叠比 GMR:GMFR:
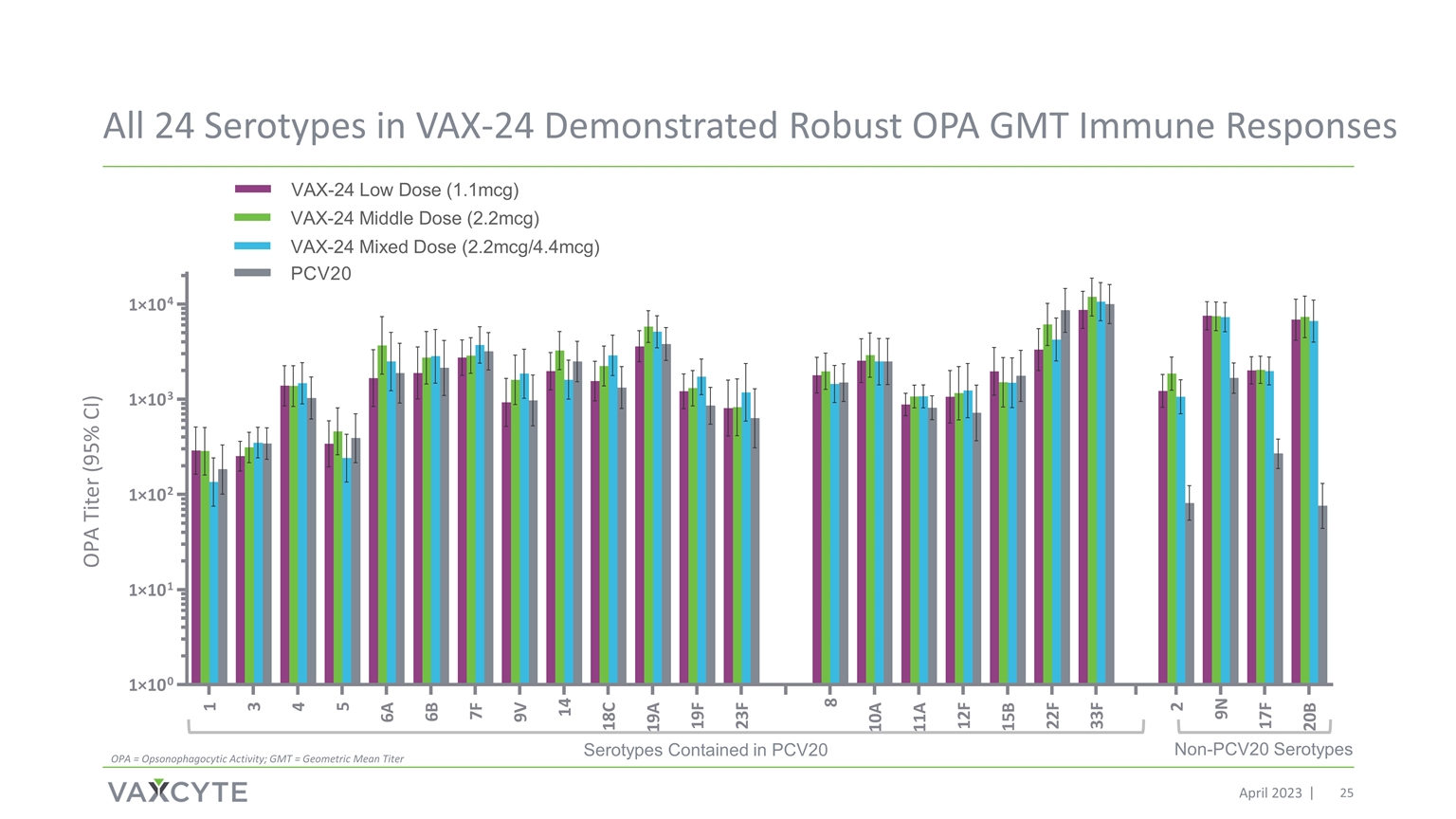
VAX-24 中的所有 24 种血清型都显示出强大的 OPA GMT 免疫反应包含在 PCV20 中的血清型 2023 年 4 月非 PCv20 血清型 OPA = 食道细胞活性;GMT = 几何平均滴度
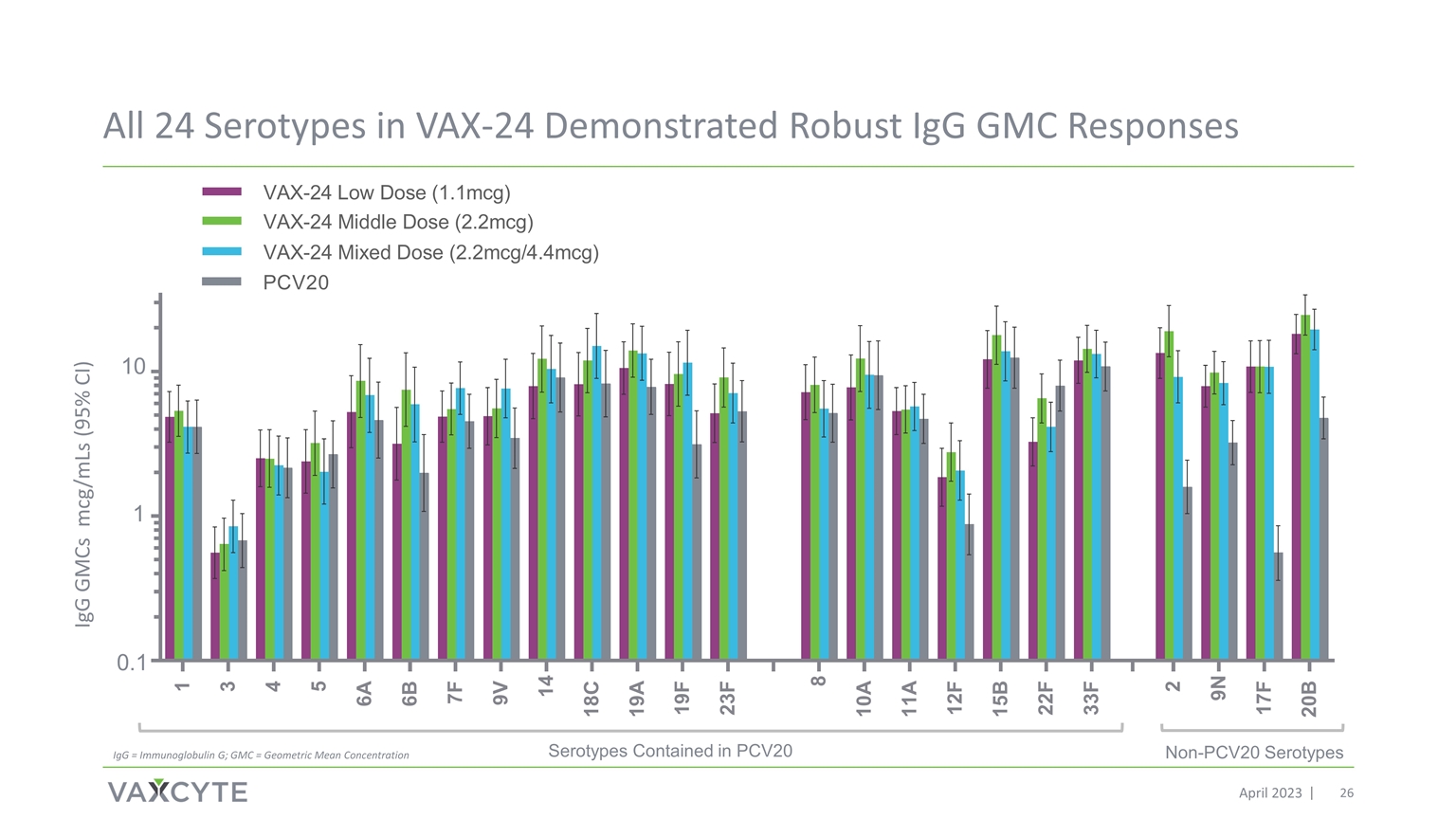
VAX-24 中的所有 24 种血清型都表现出强劲的 IgG GMC 反应 PCV20 中包含的非 PCv20 血清型血清型 2023 年 4 月 0.1 1 10 IgG GMCs mcg/MLS (95% 置信区间) IgG = 免疫球蛋白 G;GMC = 几何平均浓度

2023 年 4 月两项 VAX-24 第 2 期成人研究的预先指定的合并免疫原性 分析
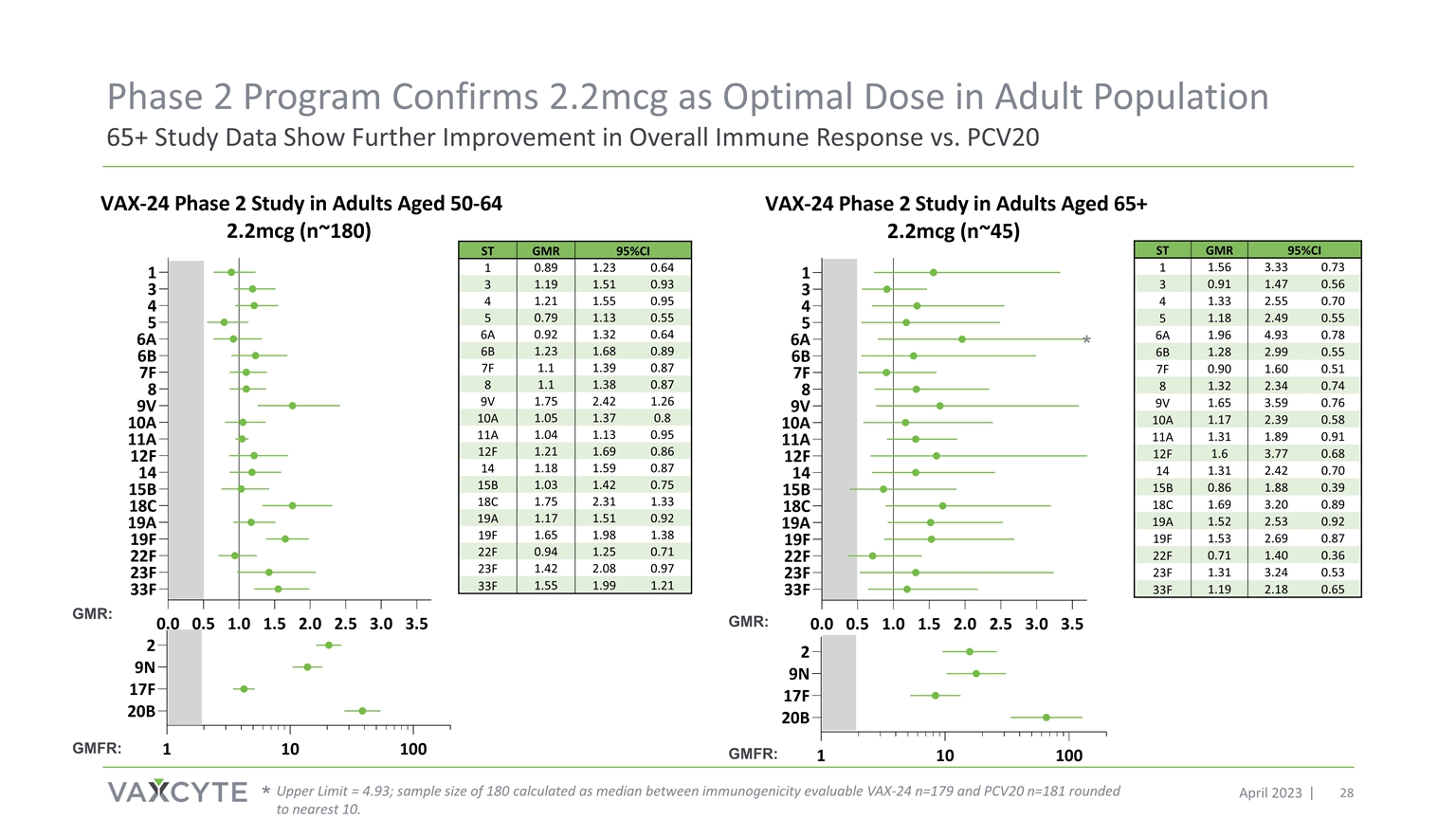
ST GMR 95% 置信区间 1 1.56 3.33 0.73 3 0.91 1.47 0.56 4 1.33 2.55 5 2.49 0.55 6A 1.96 4.93 0.89 0.55 7F 0.90 1.60 0.51 8 1.32 2.34 9V 1.65 3.59 10A 1.17 2.39 0.58 11A 1.31 1.91 12F 1.77 0.68 14 1.31 2.42 0.70 15B 0.86 1.88 0.39 18C 1.69 3.20 0.89 19A 1.53 2.53 0.92 19F 1.53 2.69 0.87 22F 0.71 1.40 0.36 23F 1.31 3.24 0.19 2.18 0.65 第二阶段计划证实 2.2mcg 是成年人群的最佳剂量研究数据显示,与 2023 年 4 月的 PCV20 相比,整体免疫反应进一步改善 * 上限 = 4.93;样本180 的大小按可评估的免疫原性 VAX-24 n=179 和 PCV20 n=181 之间的中位数计算得出,四舍五入到最接近的 10。* ST GMR 95% 置信区 1 0.89 1.23 0.64 1.55 0.95 0.79 1.13 0.55 6A 0.92 0.64 6B 1.23 1.68 1.39 1.39 1.87 1.38 1.38 0.87 9V 1.75 2.42 1.26 10A 1.05 1.37 0.8 11A 1.04 1.13 0.95 12F 1.21 1.69 1.69 14 1.18 1.59 0.87 15B 1.42 0.75 2.33 1.33 1.51 1.92 19F 1.65 1.98 1.38 22F 0.71 23F 1.42 2.08 0.97 1.59 1.21 GMR:GMFR:GMR:GMFR:
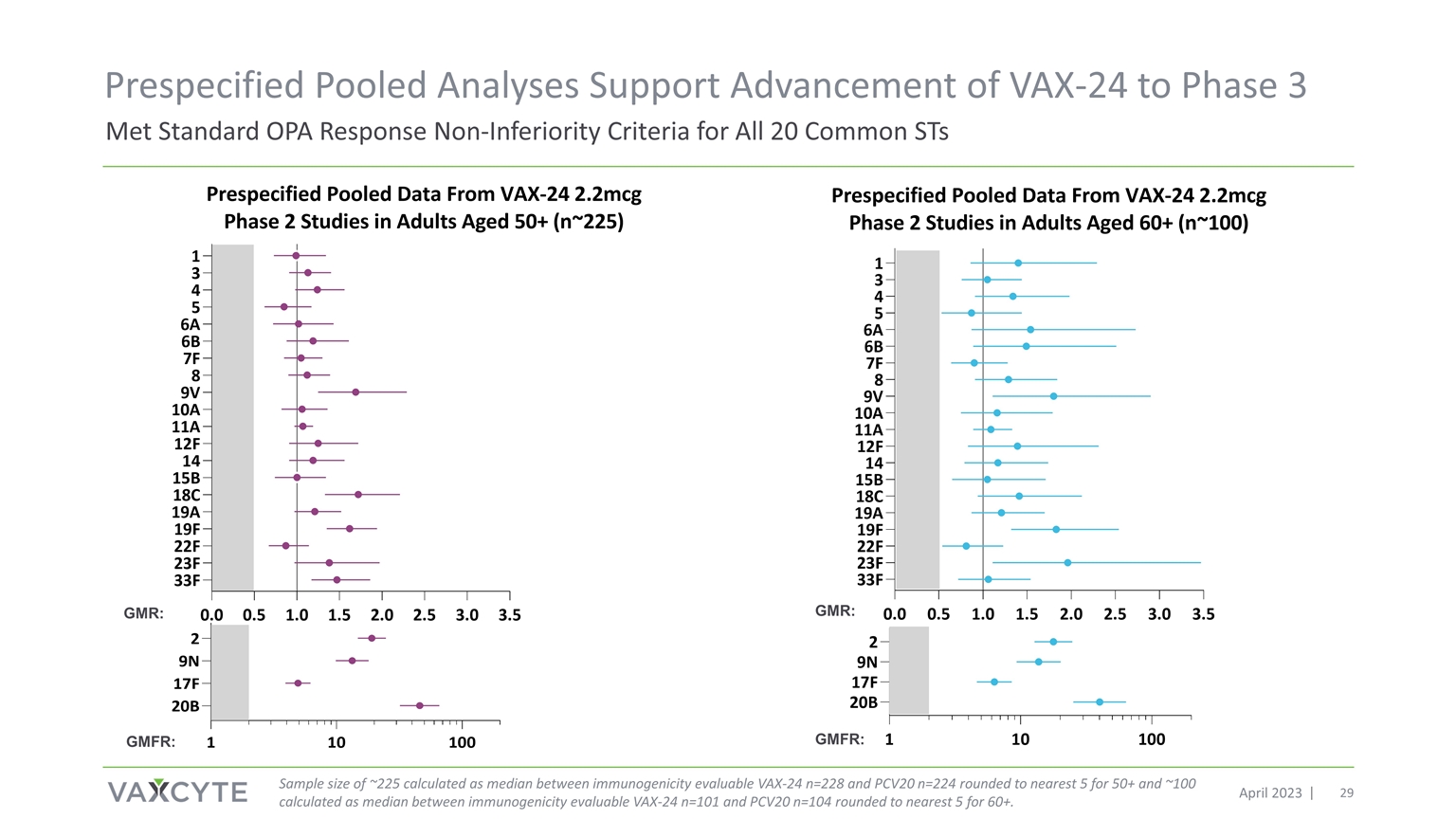
符合标准 OPA 响应 所有 20 个常见 ST 的非劣等标准预先指定的汇总分析支持将 VAX-24 推进到 2023 年 4 月 3 日样本量约 225 的样本量根据免疫原性可评估的 VAX-24 n=228 和 PCV20 n=224 之间的中位数四舍五入到最接近的 5 和 100 之间的中位数计算得出 60+ 的免疫原性可评估值 VAX-24 n=101 和最接近 PCV20 n=104 之间的中位数。GMR: GMFR: GMR: GMFR:

来自 2023 年 4 月两项 VAX-24 成人研究的完整六个月安全性和 耐受性数据
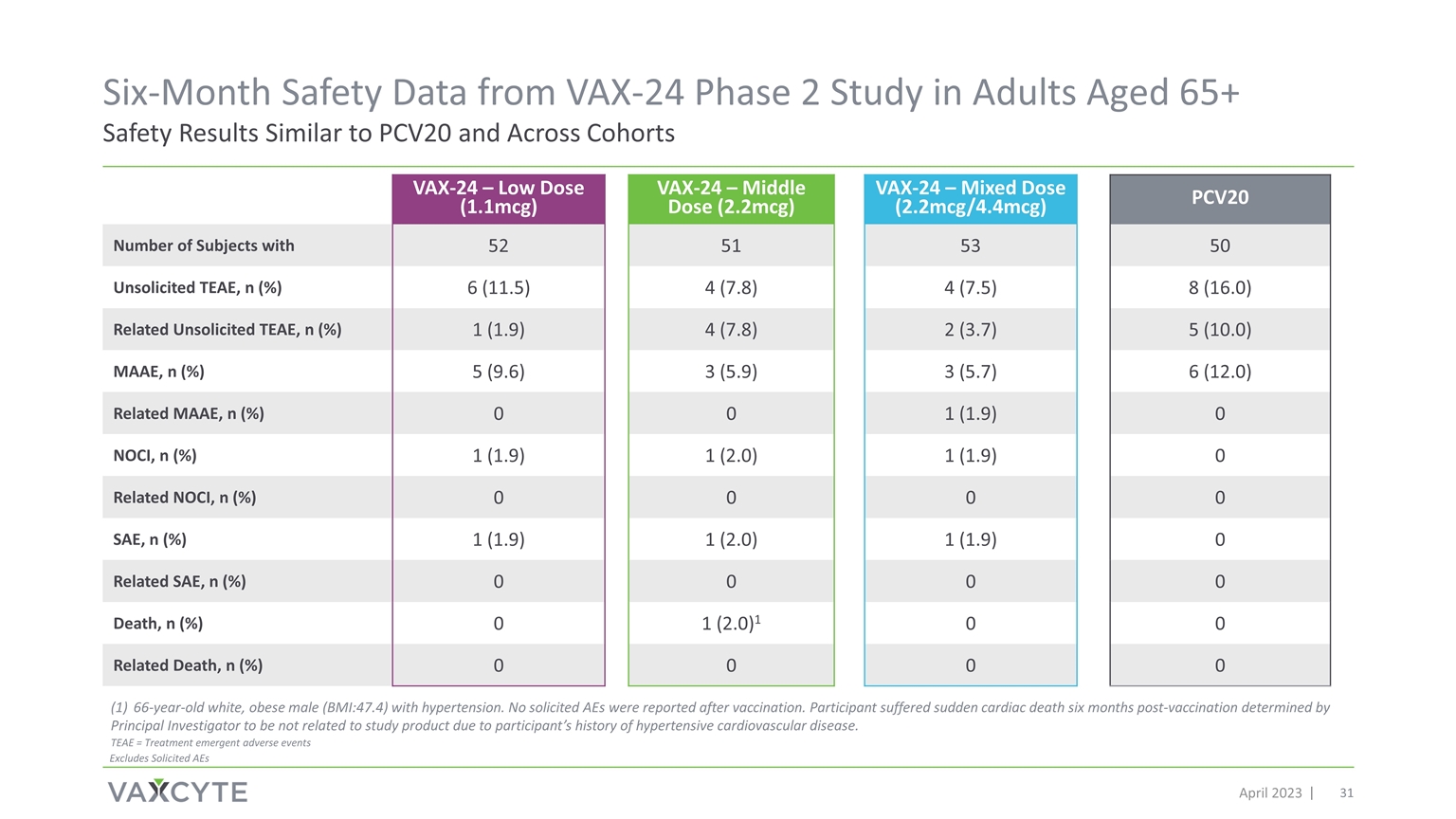
来自 65 岁以上成年人的 VAX-24 第 2 期研究的六个月安全数据 2023 年 4 月安全结果与 PCV20 相似 VAX-24 — 低剂量 (1.1mcg) VAX-24 — 中剂量 (2.2mcg) VAX-24 — 混合剂量 (2.2mcg/4.4mcg) PCV20 拥有 52 51 53 50 未经请求的 TEAE 的受试者人数,n (%) 6 (11.5) 4 (7.8) 4 (7.5) 8 (16.0)) 相关未经请求的 TEAE,n (%) 1 (1.9) 4 (7.8) 2 (3.7) 5 (10.0) MAAE,n (%) 5 (9.6) 3 (5.9) 3 (5.7) 6 (12.0) 相关 MAAE,n (%) 0 1 (1.9) NOCI,n (%) 1 (1.9) 1 (2.0) 1 (1.9) 相关的 NOCI,n (%) 0 0 0 0 SAE,n (%) 1 (1.9) 1 (2.0) 1 (1.9) 1 (1.9)0 相关 SAE,n (%) 0 0 0 死亡,n (%) 0 1 (2.0) 1 0 0 相关死亡,n (%) 0 0 0 66 岁的白人肥胖男性 (BMI: 47.4) 患有 高血压。疫苗接种后未报告任何被征集的 AE。由于参与者有 高血压心血管疾病史,参与者在疫苗接种六个月后心脏性猝死,首席研究员认定该参与者与研究产品无关。TEAE = 治疗紧急不良事件不包括征集的 AE
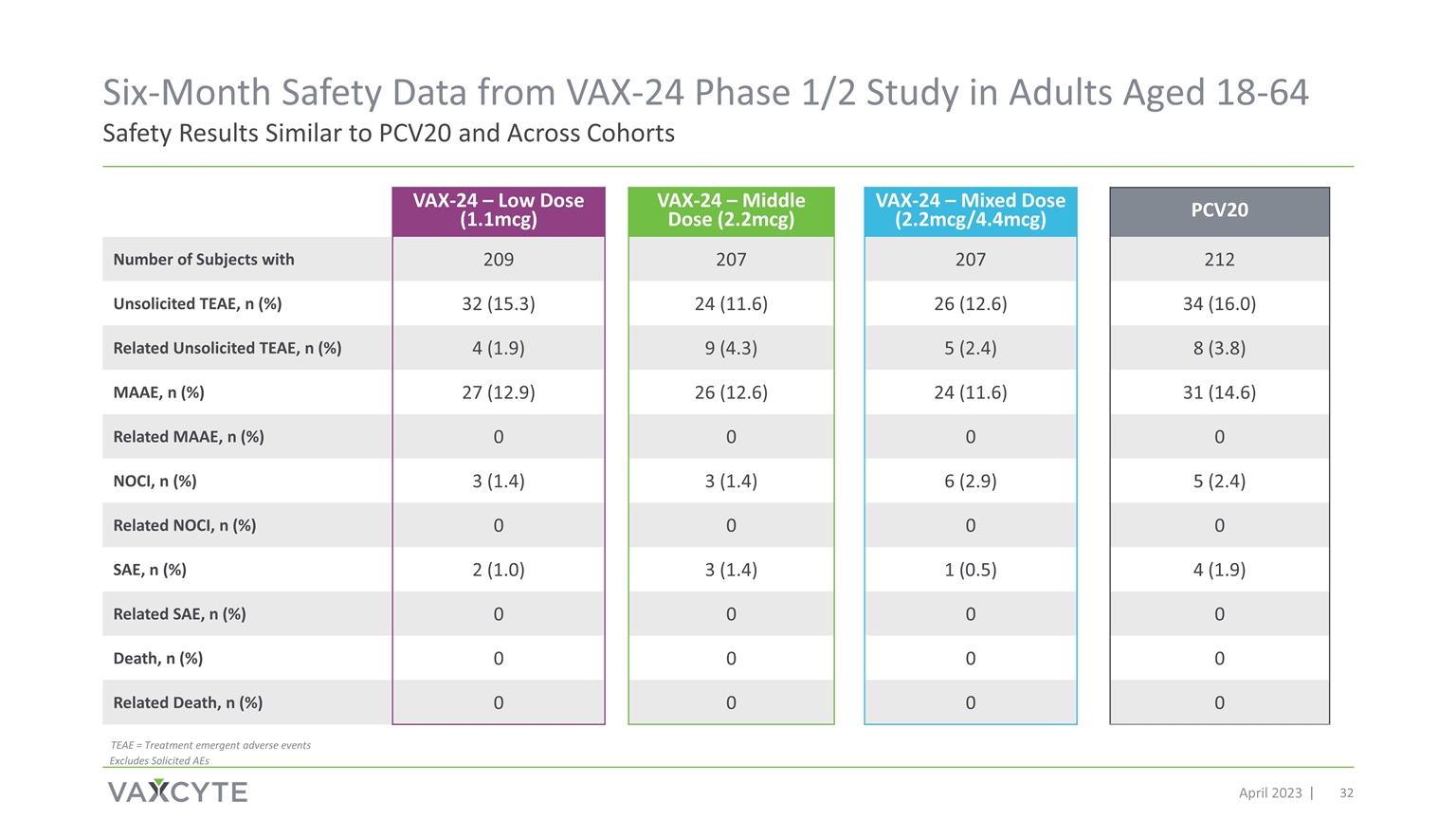
来自 VAX-24 第 1/2 期研究的六个月安全数据 2023 年 4 月针对 18-64 岁成年人的安全结果与 PCV20 相似 VAX-24 — 低剂量 (1.1mcg) VAX-24 — 中剂量 (2.2mcg) VAX-24 — 混合剂量 (2.2mcg/4.4mcg) PCV20 患有 209 207 212 未经请求的 TEAE 的受试者人数,n (%) 32 (15.3) 24 (11.6) 26 (12.6) 34 (12.6) 34 (16.0) 相关未经请求的 TEAE,n (%) 4 (1.9) 9 (4.3) 5 (2.4) 8 (3.8) MAAE,n (%) 27 (12.9) 26 (12.6) 24 (11.6) 31 (14.6) 相关 MAAE,n (%) 0 0 0 NOCI,n (%) 3 (1.4) 3 (1.4) 6 (2.9) 5 (2.4) 相关 NOCI,n (%) 0 0 0 SAE,n (%) 2 (1).0) 3 (1.4) 1 (0.5) 4 (1.9) 相关 SAE,n (%) 0 0 0 0 死亡,n (%) 0 0 0 相关死亡,n (%) 0 0 0 0 TEAE = 治疗急症 不良事件不包括 AE
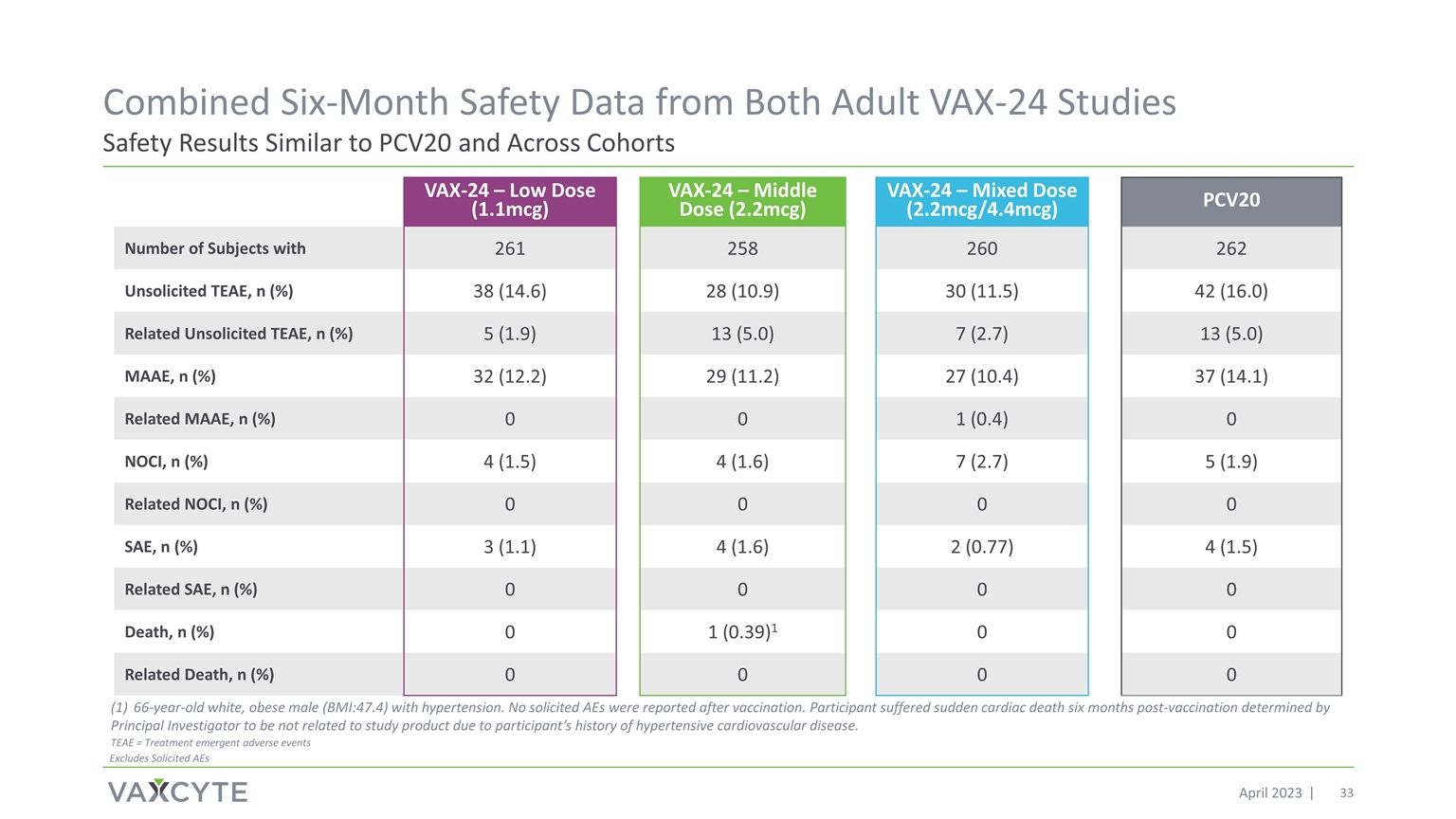
来自 的六个月综合安全数据两项成人 VAX-24 研究的安全结果均与 PCV20 相似 2023 年 4 月 VAX-24 — 低剂量 (1.1mcg) VAX-24 — 中剂量 (2.2mcg) VAX-24 — 混合剂量 (2.2mcg/4.4mcg) PCV20 拥有 261 258 260 262 未经请求的 TEAE 的受试者人数,n (%) 38 (14.6) 28 (10.9) 30 (11.5) 42 (16.0) 相关未经请求的 TEAE,n (%) 5 (1.9) 13 (5.0) 7 (2.7) 13 (5.0) MAAE,n (%) 32 (12.2) 29 (11.2) 27 (10.4) 37 (14.1) 相关 MAAE,n (%) 0 1 (0.4) 0 NOCI,n (%) 4 (1.5) 4 (1.6) 7 (2.7) 5 (1.9) 相关 NOCI,n (%) 0 0 0 SAE,n (%) 3 (1.1) 4 (1.6) 2 (0.77) 4 (1.5) 相关 SAE,n (%) 0 0 0 死亡,n (%) 0 1 (0.39) 1 0 0 相关死亡,n (%) 0 0 0 0 66 岁白人,肥胖男性 (BMI: 47.4) 患有高血压。疫苗接种后未报告任何被征集的 AE。由于参与者 有高血压心血管疾病史,参与者在疫苗接种六个月后心脏性猝死,首席研究员认定该参与者与研究产品无关。TEAE = 治疗紧急不良事件不包括征集的 AE

第 2 阶段项目结论、状态 和后续步骤 2023 年 4 月

完整六个月的 VAX-24 数据 (n=779) 显示安全性和耐受性结果与 PCV20 相似,免疫原性与 PCV20 相比有所改善,没有剂量依赖性安全性和耐受性问题的证实 2.2mcg 是进入 3 期关键研究的最佳剂量在两项 2 期研究中实现了所有 24 个血清型的靶免疫 反应在预先指定的汇总分析中符合所有 24 个 sT 的非劣性标准预计将在第三阶段计划(n~750/arm)中增加完善的监管途径,有 多个批准先例基于替代免疫终点从历史上看,第 2 阶段和关键第 3 阶段项目的一致研究设计和终点先例 3 期项目和 VAX-24 第 2 期数据支持在 终极成人年龄范围内灵活选择关键研究有积极的 2 期数据,Vaxcyte 很高兴推进 VAX-24 进入第 3 阶段 2 阶段项目结果支持 VAX-24 具有同类最佳潜力 2023 年 4 月成功的 VAX-24 第 2 阶段计划实现了所有关键目标 3 关键计划

预期 2023-2025 年 PCV 特许经营里程碑 Vaxcyte 正在推进 VAX-24 和 VAX-31 的临床开发,几个关键里程碑即将到来 2023 年 4 月召开 FDA 第 2 阶段结束会议,在 2025 年完成成人 3 期关键性非自卑研究的顶线安全性、耐受性和 免疫原性数据在 2H: 23 向美国食品药品管理局提交成人 IND 申请宣布安全,来自 2024 年成人 1/2 期研究的耐受性和免疫原性数据 VAX-24 成人 VAX-24 Infant VAX-31 成人宣布截至2023年4月17日提供的2025年2期研究的初级三剂量免疫系列的主要安全性、耐受性和免疫原性数据。

2023 年 4 月 VAXCYTE 使命宣言 我们的全球使命是设计保护人类免受细菌性疾病后果的高保真疫苗。

2023 年 4 月与管理层的问答 Grant Pickering 首席执行官、董事兼创始人吉姆·瓦西尔执行副总裁兼首席运营官 Andrew Guggenhime 总裁兼首席财务官
