

图 99.2 恢复平衡。更新生活。2023 年 6 月 公司演讲

Safe Harbor 和法律免责声明本演示文稿可能包含 Akero Therapeutics, Inc.(“我们”、“我们的”、“我们的”、“Akero” 或 “公司”)的 “前瞻性陈述”,涉及我们的业务、运营和财务状况,包括但不限于当前关于以下方面的明示或暗示信念、预期和假设:我们业务的未来;未来计划和策略,包括我们对治疗潜力和临床益处的 期望efruxifermin(“EFX”),包括与 GLP-1 受体激动剂疗法联合使用;我们的 EFX 开发计划,包括我们对 EFX 作为基础 NASH 疗法的独特潜力的信念;我们的临床前和临床结果,包括我们的 2a 期平衡研究、2b 期 HARMONY 研究的安全性/耐受性、实验室测量和组织学数据,以及 2b 期 br} 的队列 D 扩展 SYMMETRY 研究;EFX 的 PRIME、突破性疗法和快速通道认证所带来的潜在益处;2b 期 SYMMETRY 研究,包括 Cohort D 的扩张和公布初步结果的预期时机以及其他 相关里程碑;SYNCHRONY 第 3 阶段计划,包括 SYNCHRON 组织学和 SYNCHRONY Realogy 研究和试验的设计及其预期时间;支持 3 期临床 试验的新药物配方的问世;与竞争格局相关的风险;监管互动的时机和潜在收益;我们对资本、支出和其他未来财务业绩的使用,包括预期的现金流;以及 COVID-19 对战略、我们的员工、供应链、未来运营和临床试验的潜在影响。诸如但不限于 “期待”、“相信”、“期望”、“预期”、 “估计”、“打算”、“计划”、“将”、“应该” 和 “可以” 等词语以及类似的表达方式或词语均可识别前瞻性陈述。 可能会不时出现新的风险和不确定性,而且不可能预测所有的风险和不确定性。除非法律要求,否则我们没有义务公开更新这些前瞻性陈述,也没有义务更新实际业绩可能与前瞻性陈述中预期的 存在重大差异的原因,即使将来有新的信息。有关这些和其他风险和不确定性以及其他重要因素(其中任何一个都可能导致我们的实际业绩与前瞻性陈述中包含的不同)的讨论,请参阅我们向美国证券交易委员会(“SEC”)提交的最新10-K表年度报告中标题为 “风险因素” 的部分,以及我们随后向美国证券交易委员会提交的其他文件中对潜在风险、不确定性和其他重要因素的讨论。本演示文稿中的所有信息均截至本文发布之日,除非法律要求 ,否则我们没有义务更新此信息。本演示文稿中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及公司自己的内部估计和研究。尽管 公司认为截至本演示之日,这些第三方来源是可靠的,但它尚未独立核实从 第三方来源获得的任何信息的充足性、公平性、准确性或完整性,也不作任何陈述。此外,本演示文稿中包含的所有市场数据都涉及许多假设和限制,无法保证此类假设的准确性或可靠性。最后,尽管我们认为 我们自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。©2023 AKERO THERAPEUTICS。2

企业亮点 1 2 3 有可能建立同类首创的势头 迈向经验丰富、经过验证的团队和拥有大量资源的同类最佳的 NASH 药物第 3 期关键试验 • 潜力巨大 • 两项平行的 2b 期试验正在进行中 • 参与了 20 多项美国食品药品管理局的批准 机会 • HARMONY (F2-F3) • 约6.6亿美元的现金、现金等价物和 • SYMMETRY(F4,补偿)• 针对短期有价证券的差异化行动机制 • 监管机构牵手进行短期有价证券 2023 年 6 月 2 日, 包括 • 报告的最强疗效数据 •突破疗法(美国食品药品管理局)将于4月和5月从FGF21中获得收益,包括:• Fast Track(美国 FDA)自动柜员机和注册直销 • 纤维化改善 • PRIME (欧洲 EMA)产品。• NASH 分辨率 • 改善血糖控制 • Ph3 Ph3 SYNCHROY 计划的商用产品设备宣布 SYMETRY 读数,预计将于 2023 年第 4 季度收益 ©2023 THERAPEUTICS。 3

丰富的开发和商业化经验涉及 20 多项 药品审批 Kitty Yale | 首席开发官 Andrew Cheng,医学博士 | 总裁兼首席执行官 • 在吉利德、罗氏、辉瑞工作超过 25 年 • 首席医学官兼艾滋病毒部门负责人 • 吉利德 全球临床运营副总裁 • 在 11 项 NDA/MAA 批准中担任重要职务 NDA、MAA、JNDA 还有 CFDA Patrick Lamy | 商业战略高级副总裁 Tim Rolph,D.Phil | 联合创始人兼首席科学官 • 在 20 年以上的商业经验吉利德,• 在辉瑞和葛兰素史克艾文斯以及其他小型生物技术公司工作超过 30 年 • 辉瑞心血管和代谢疾病部门的首席科学官 • 最近担任 Iovance 的商业副总裁 • 辉瑞 Groton 和英国探索研究负责人 • 五项产品发布是肝病,包括全球性的 • 吉利德丙型肝炎特许药物的两种上市线索在发现和早期临床评估中发挥了重要作用: Selzentry (HIV) 和 Steglatro(糖尿病)Jonathan Young 博士、法学博士 | 联合创始人兼首席运营官 William White | 首席财务官兼企业发展主管 • 在生物技术领域工作超过 15 年产品开发,• 在高盛法律和监管政策高盛从事生命科学投资 银行业务18年 • Braeburn 总法律顾问兼政策副总裁 • 最近担任德意志银行美国生命科学投资银行业务主管 • FoxKiser 合伙人兼总法律顾问 • 就超过700亿美元的并购和250亿美元的融资交易提供咨询 ©2023 AKERO THERAPEUTICS。4
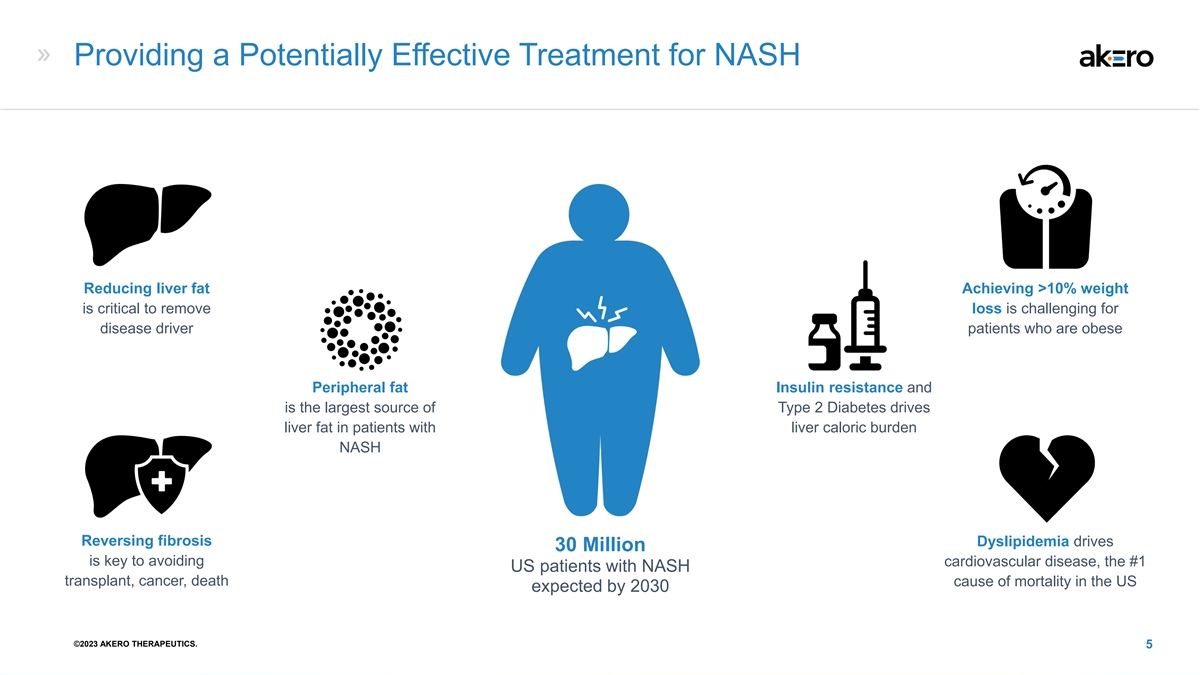
为 NASH 提供潜在的有效治疗减少肝脂肪 体重达到 10% 以上对于消除减肥的疾病驱动因素患者来说是具有挑战性的外周脂肪胰岛素抵抗是 2 型糖尿病会驱动肝脏卡路里负担患者的肝脂肪 NASH 逆转纤维化血脂异常驱动 3000 万是避免心血管疾病的关键 #1 美国 NASH 移植、癌症、死亡原因的患者美国预计到 2030 年 ©2023 年 AKERO THERAPEUTICS。5
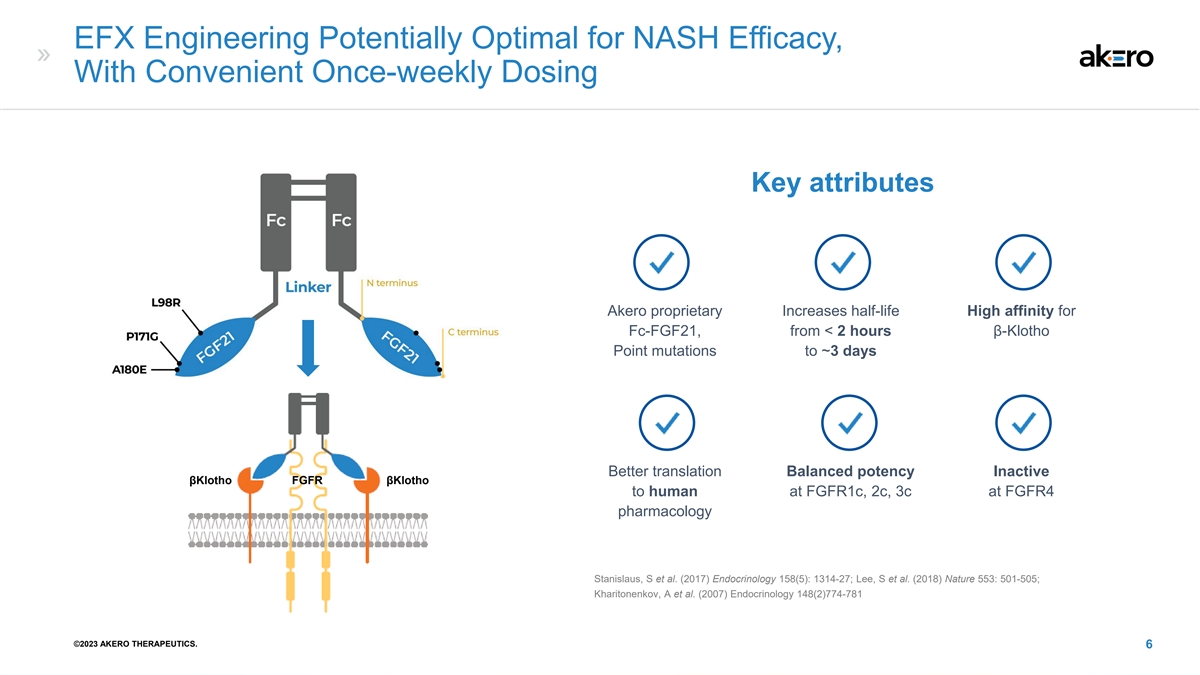
EFX Engineering 可能是 NASH 功效的最佳选择,具有便利 每周一次的剂量关键属性 Akero 专有增加 FC-FGF21 的半衰期高亲和力,来自
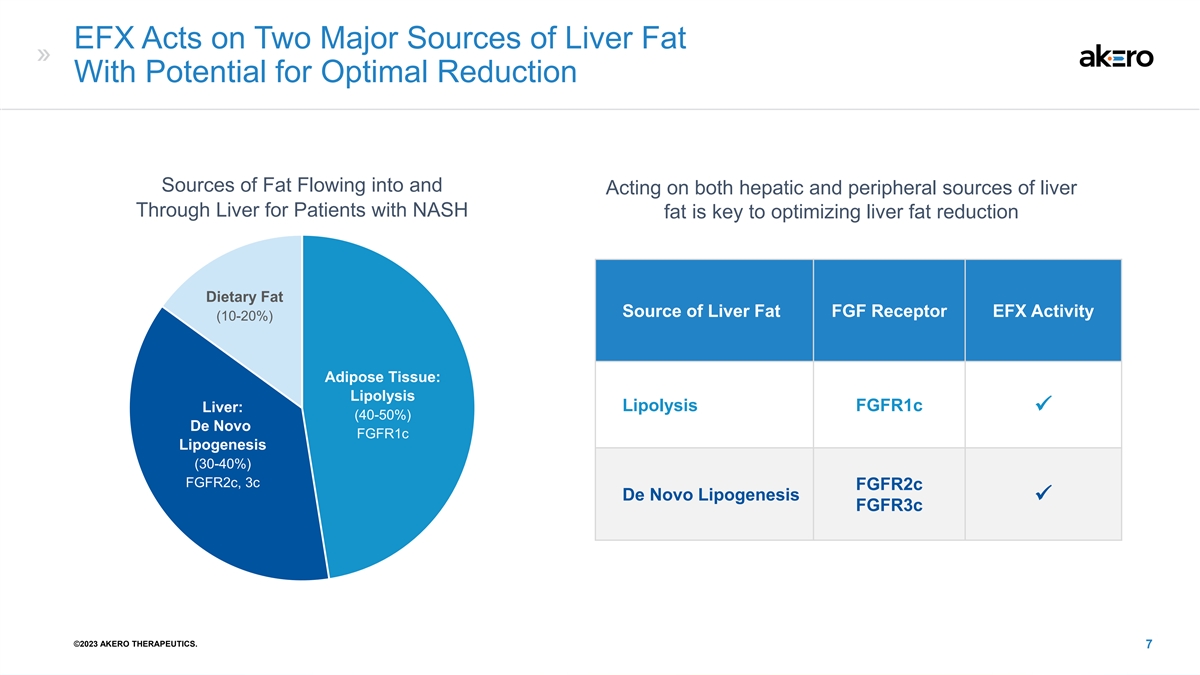
EFX 作用于肝脏脂肪的两个主要来源,有潜力 减少脂肪通过肝脏流入肝脏和外周来源并作用于肝脏的最佳 来源 NASH 脂肪是优化肝脏脂肪减少的关键膳食脂肪来源 FGF 受体 EFX 活性 (10-20%) 脂肪组织:脂肪分解脂肪分解 fgfr1c 肝脏:ü (40-50%) de novo fgG 活性 ffr1c Lipogenesis (30-40%) fgfr2c,3c fgfr2c De Novo Lipogenesis ü fgfr3c ©2023 AKERO THERAPEUTICS。7
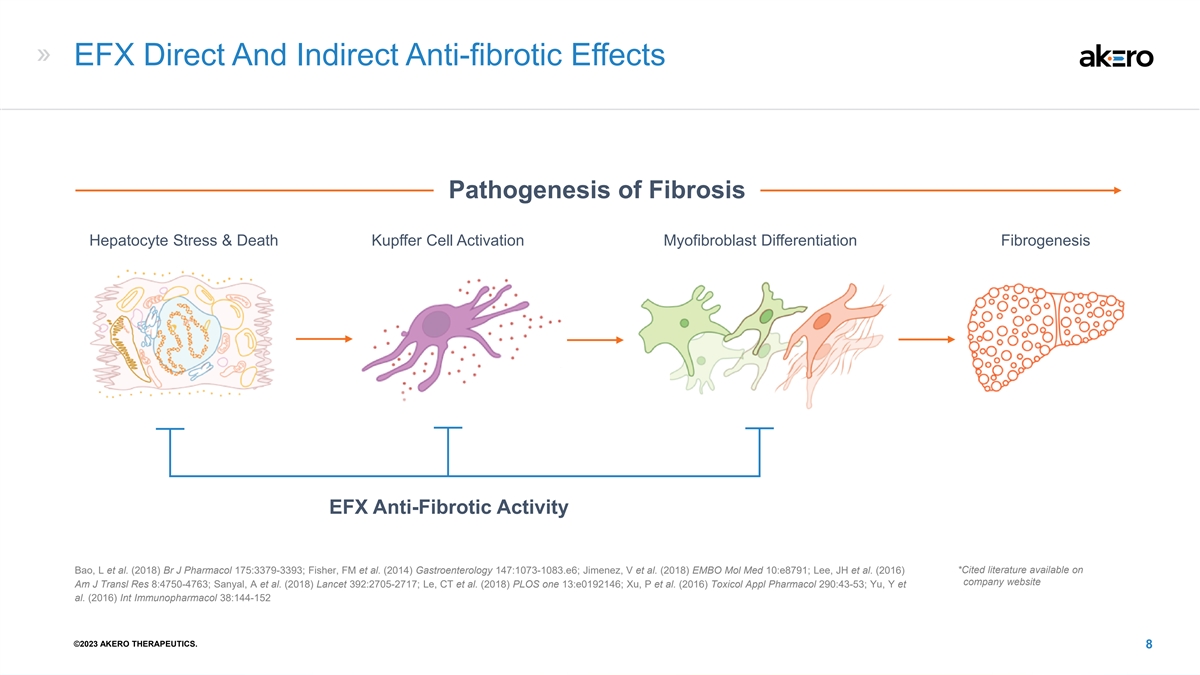
EFX 直接和间接抗纤维化作用纤维化的发病机制 肝细胞压力和死亡 Kupffer 细胞激活肌纤维细胞分化纤维化 EFX 抗纤维化活性 Bao,L 等人(2018)Br J Pharmacol 175:3379-3393;Fisher、FM 等人(2014)胃肠病学 147:1073-1083 .e6;Jimenez,V 等 等。(2018) EMBO Mol Med 10:e8791;Lee、JH 等人(2016)*引文献可在公司网站 Am J Transl Res 8:4750-4763 上查阅;Sanyal、A 等人(2018)Le、CT 等人(2018)PLOS one 13:e0192146;Xu,P 等人(2016)Toxicol Appl Pharmacol 290:43-53;Yu,Y 等人(2016)Int Immunopharmacol 38:144-152 ©2023 AKERO THERAPEUTICS。8

基于 EFX 治疗概况的关键监管名称 Fast Track PRIME 突破疗法(美国 FDA-2021)(EMA-2020)(美国 FDA-2022)• 实现加速 • 支持更频繁 • 表示有潜力 • 表示有潜力 • 表示有可能提供比现有疗法更有资格进行重大治疗优势优先审查 • 挖掘填补空洞的潜力使没有终点的患者受益 • 基于2b期 • 基于2a阶段 • 基于2a期 • 基于2a期HARMONY数据平衡数据 Efruxifermin是第一种获得全部三项认证的 在研NASH药物 FDA,《行业指南:严重疾病加急计划——药物和生物制剂》(2014);©2023 AKERO THERAPEUTICS。9 欧洲药品管理局,关于 提案的反思论文加强早期对话以促进加快对优先药物的评估(PRIME)(2015 年草案)

从统计学角度评估 F2-F3 纤维化患者的 EFX 纤维化 24 周后有显著效果纤维化改善 NASH 和改善分辨率 NASH RESOLUTION ©2023 AKERO THERAPEUTICS。10

HARMONY 试验设计:肝硬化前 (F2-F3) NASH 关键纳入标准 关键次要疗效终点 2b 期主要终点 • F2-F3 NASH • ≥ 1 阶段纤维化改善 • NASH 分辨率和否 • 脂蛋白 • MRI-PDFF 不恶化 • NAS ≥4 纤维化恶化 • 血糖控制 • 肝损伤标志物 (mri-PDFF) ≥ 8% • 体重变化长期安全随访(最长 96 周)24 周安慰剂安慰剂 EFX 28mg EFX 28mg EFX 50mg EFX 50mg 3 期试验的监管要求肝活检 • FDA 接受第 3 阶段注册试验的两个终点之一:(1) 纤维化改善 ≥1 阶段,MRI-PDFF 1 无恶化 NASH 或 (2) NASH 分辨率且纤维化无恶化 2 • EMA 要求满足两个终点才能获得上市批准 1 2 美国食品药品管理局指南草案,非肝硬化非酒精性脂肪性肝炎并发 EMA,关于药品开发 监管要求的反思文件草案 ©AK2023 THERAPEOTICS。11 肝纤维化:开发治疗慢性非传染性肝病(PBC、PSC、NASH)的药物(2018)阶段2b 筛查随机化
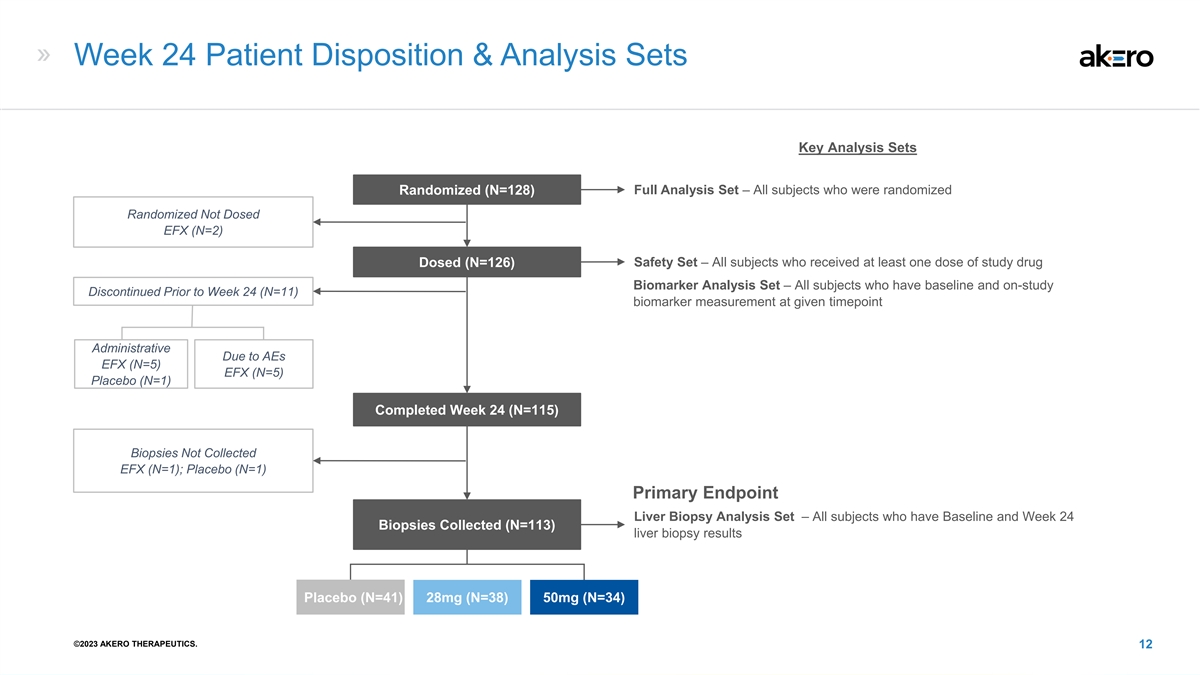
第 24 周患者处置和分析套装关键分析集 随机 (N=128) 完整分析集 — 所有随机随机分配未给药 EFX (N=2) 安全套装的受试者 — 所有接受至少一剂研究药物剂量 (N=126) 生物标志物分析套装的受试者- 在第 24 周 (N=11) 之前已停止研究的所有受试者给定时间点由于 AES EFX (N=5) EFX (N=5) 安慰剂 (N=1) 已完成第 24 周 (N=115) 活检未收集 EFX (N=1);安慰剂 (N=1) 主要 终点肝活检分析集 — 所有收集了基线和第 24 周活检 (N=113) 肝活检结果的受试者安慰剂 (N=41) 28mg (N=38) 50mg (N=34) ©2023 AKERO THERAPEUTICS。12

基线人口统计安慰剂 EFX 28mg EFX 50mg 参数(平均值)(N=43) (N=42)(N=43)年龄(岁)55 57 52 性别(% 女性)63 69 53 体重(kg)108 104 103 2 2 型糖尿病(%)65 76 70 1 纤维化阶段(% F3)70 64 63 增强型肝纤维化(ELF)分数 9.8 9.7 9.8 2 Pro-C3 (μg/L) 16.5 15.3 18.4 3 肝硬度 by VCTE (FibroScan) (kPa) 15 14 16 4 肝脂肪分数 (%) 17.1 18.5 NAFLD 活动评分 (NAS) 5.4 5.1 5.6 丙氨酸氨基转移酶 (ALT) (U/L) 62 50 63 天冬氨酸氨基转移酶 (AST) (U/L) 57 42 52 HbA1c (%) 6.8 6.8 6.7甘油三酯 (mg/dL) 170 158 154 低密度脂蛋白胆固醇 (mg/dL) 94 96 111 1 2 3 4 所有患者要么是纤维化第 2 阶段 (F2) 要么是第 3 阶段 (F3);前胶原蛋白 3 N 末端前肽;振动控制瞬态弹性成像;磁共振成像 质子密度脂肪分数 ©2023 AKERO THERAPEUTICS。13
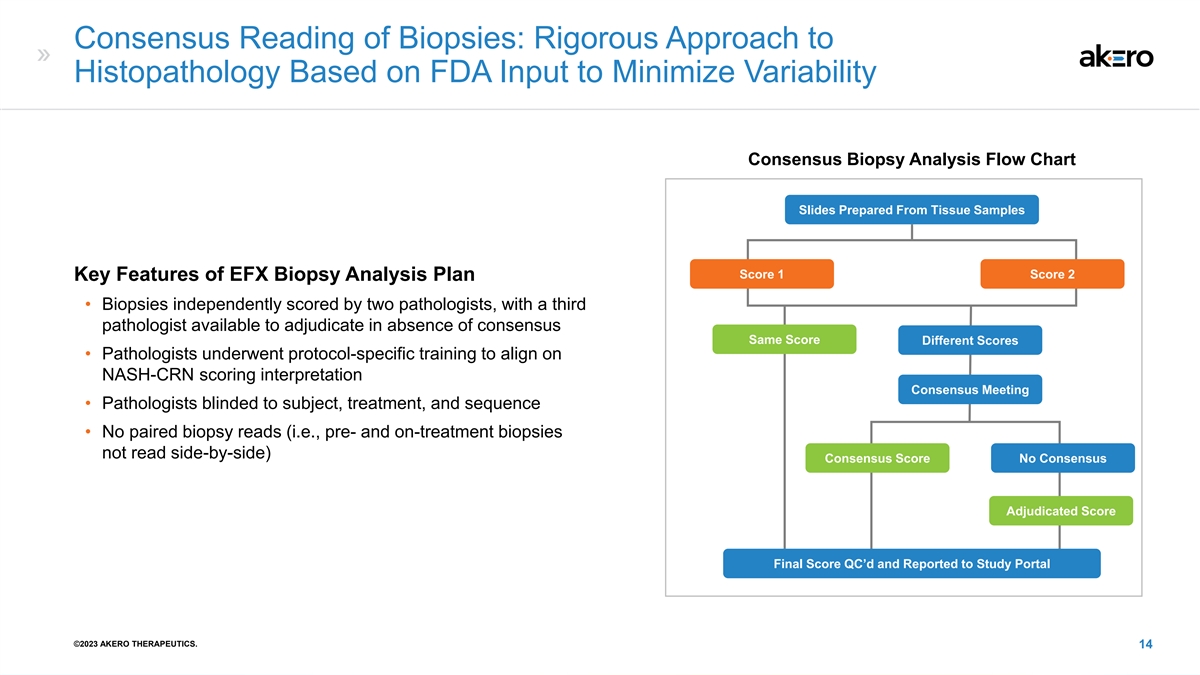
活检共识读法:根据美国食品药品管理局的意见进行组织病理学的严格方法 根据组织样本制备的共识活检分析流程图幻灯片得分 1 分数 2 EFX 活检分析计划的主要特征 • 活检由两名病理学家独立评分,第三名 病理学家可以做出裁决相同分数不同分数 • 病理学家接受了特定方案培训,以协调NASH-CRN评分解释共识会议 • 病理学家对受试者、 治疗视而不见,以及序列 • 没有配对活检读数(即治疗前和治疗中的活检未并排读取)共识分数无共识裁定分数最终分数质量控制并报告给研究门户 ©2023 AKERO THERAPEUTICS。 14
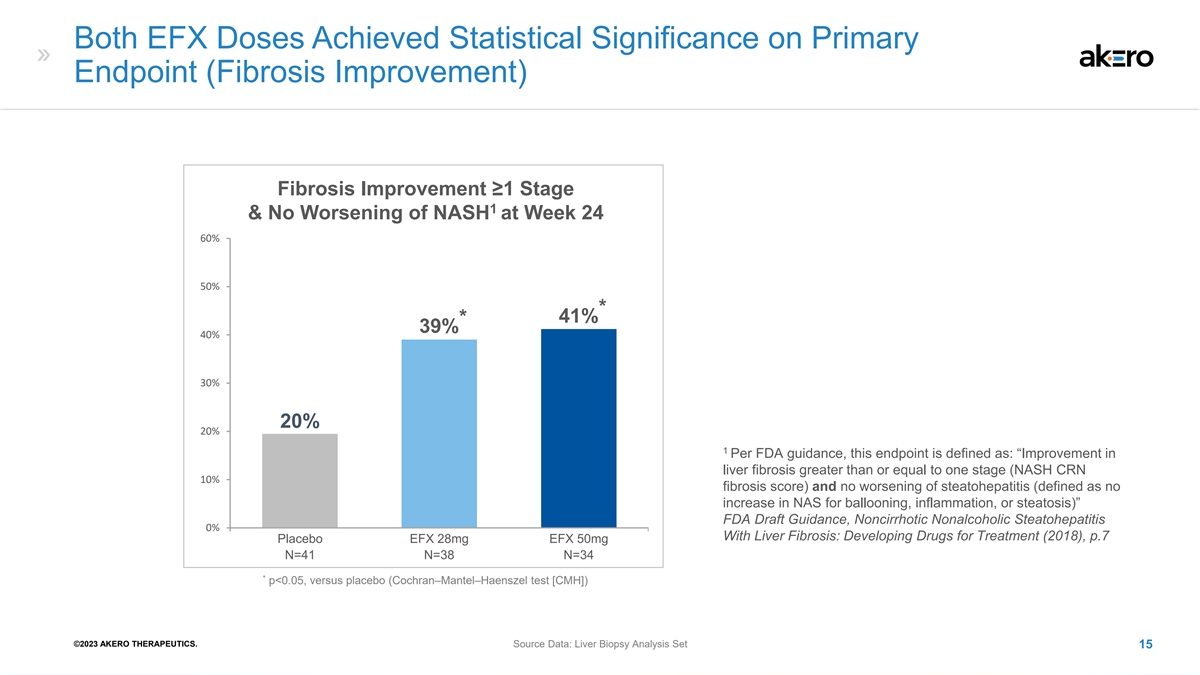
两次 EFX 剂量在主要终点 (纤维化改善)纤维化改善 ≥1 阶段,NASH 在第 24 周没有恶化 60% 50% * 41% * 39% 40% 30% 20% 1 根据美国食品药品管理局的指导意见,该终点定义为:“肝纤维化改善大于 或等于一个阶段(NASH CRN 10% 纤维化评分)且脂肪变性没有恶化肝炎(定义为气球膨胀、炎症或脂肪变性的 NAS 不增加)” FDA 指南草案,非肝硬化非酒精性脂肪性肝炎 0% 伴有肝脏 纤维化:发展中治疗药物(2018),第 7 页安慰剂 EFX 28mg EFX 50mg 1 N=41 N=38 N=34 * p
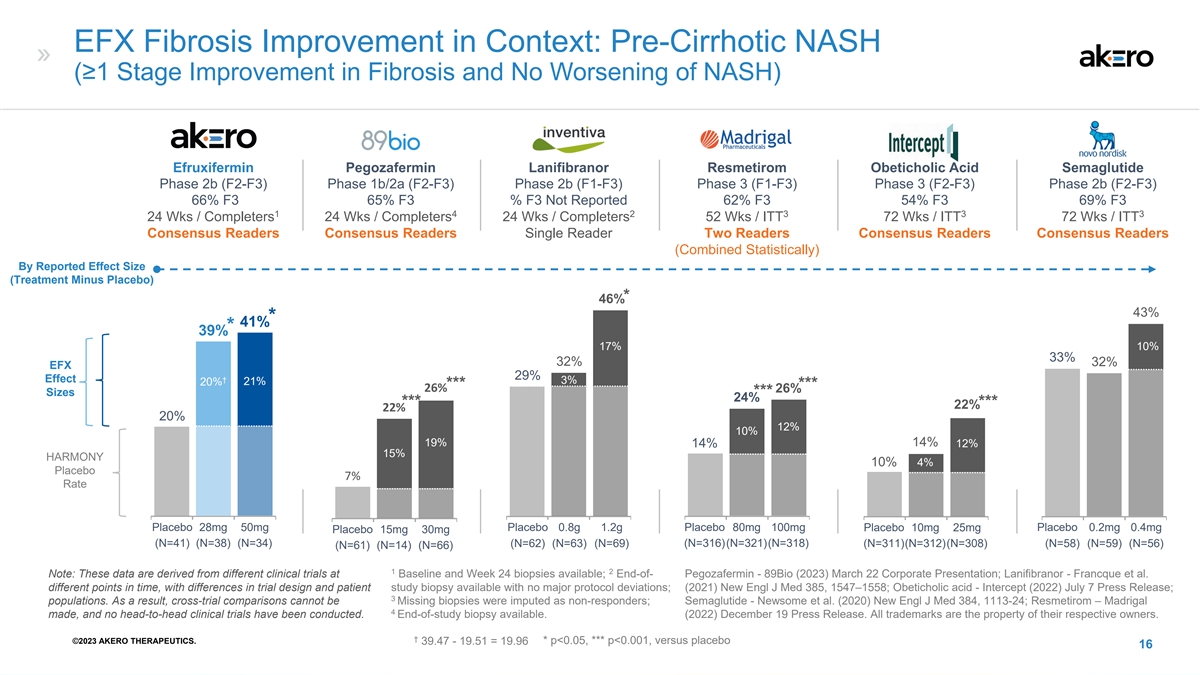
EFX 纤维化改善背景:肝硬化前 NASH(≥1 阶段 纤维化改善且 NASH 没有恶化)Akero Madrigal Inventiva Madrigal Novo Nordisk efruxifermin Lanifibranor Resmetirom Obeticholic acid semaglutide 2b 期 (F2-F3) 1b/2a (F2-F3) 2b 期 (F1-F3) 3 (F1-F3) 第 3 阶段 (F2-F3) 2b 阶段 (F2-F3) 66% F3 65% F3% F3% F3 未报告 62% F3 54% F3 1 4 2 3 3 3 24 Wks /Completers 24 Wks/Completers 24 Wks/Completers 52 Wks /ITT 72 Wks /ITT 72 Wks /ITT 共识读者共识读者 Two Readers 共识读者共识读者(统计学合计)按报告的效果大小(治疗减去安慰剂)* 46% 43% * 41% * 39% 17% 33% 32% EFX 29% 效果† 3% 21% *** 26% 尺寸*** 24% *** 22% 20% 12% 10% 19% 12% HARMONY 10% 41% 安慰剂 28mg 50mg 安慰剂 0.8g 1.2 安慰剂 80mg 100mg 安慰剂 10mg 25mg 安慰剂 0.2mg 0.4mg 安慰剂 15mg 30mg (N=41) (N=38) (N=34) (N=62) (N=63) (N=316) (N=321) (N=318) (N=311) (N=312) (N=308) (N=58) (N=59) (N=56) (N=61) (N=14) (N=66) 1 2 注意:这些数据源自基线和第 24 周可用的不同临床试验;末期——Pegozafermin-89Bio (2023) 3 月 22 日企业演讲; Lanifibranor-Francque 等人。不同的时间点,可用的试验设计和患者研究活检存在差异,没有重大方案偏差;(2021) New Engl J Med 385、1547—1558;Obeticholic acid-Intercept (2022) 7 月 7 日新闻稿;3 个群体。因此,交叉试验比较不可能将缺失的活检归因于无反应者;Semaglutide——Newsome等人(2020)New Engl J Med 384,1113-24;Resmetirom — Madrigal 4制作,尚未进行任何头对头 临床试验。研究结束活检可用。(2022) 12 月 19 日新闻稿。所有商标均为其各自所有者的财产。† ©2023 AKERO THERAPEUTICS。39.47-19.51 = 19.96 * p
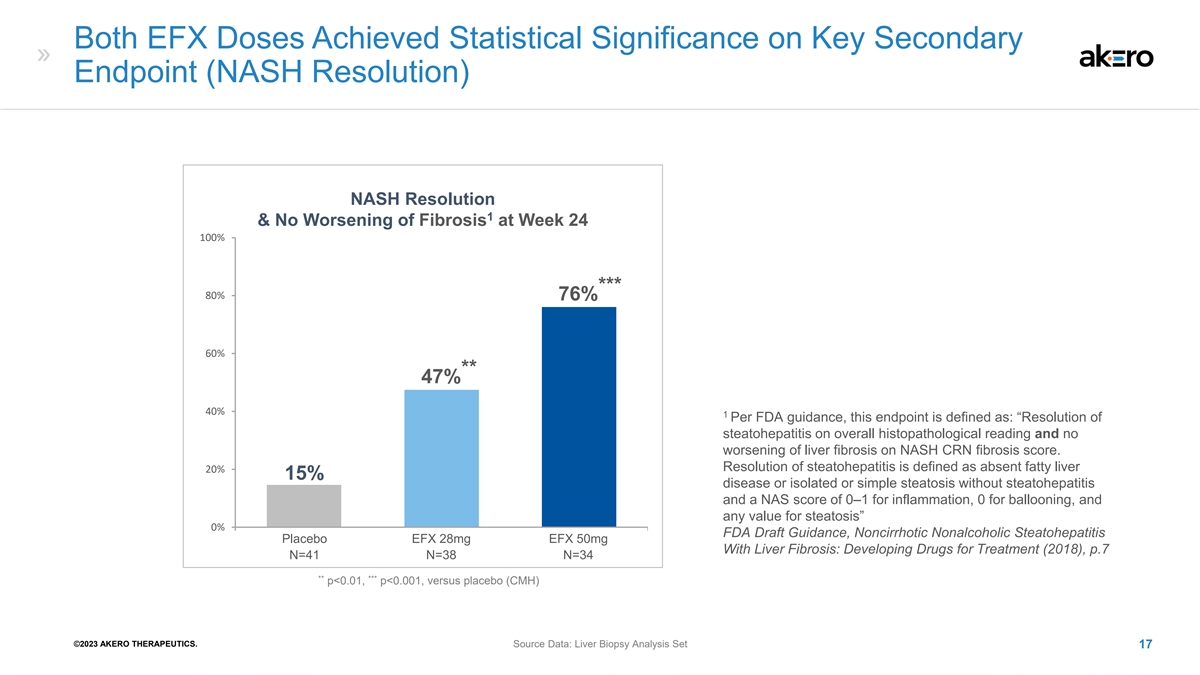
两次 EFX 剂量在关键次级 终点(NASH Resolution)NASH 分辨率 1 上均取得了统计学意义,第 24 周纤维化没有恶化 100% *** 80% 76 76% 60% ** 47% 40% ** 47% 40% 1 根据美国食品药品管理局的指导意见,该终点的定义为:“脂肪性肝炎在组织病理学 读数上得到缓解,NASH CRN 纤维化评分没有恶化。脂肪性肝炎的消退定义为没有脂肪肝 20% 15% 的疾病或没有脂肪性肝炎的孤立或单纯性脂肪变性, 炎症的 NAS 分数为 0—1,气球膨胀的 NAS 分数为 0,脂肪变性的任何值” 0% FDA 指南草案,非肝硬化非酒精性脂肪性肝炎安慰剂 EFX 28mg EFX 50mg 伴有肝纤维化:开发治疗药物(2018),p.7 N=41 =38 N=34 ** *** p
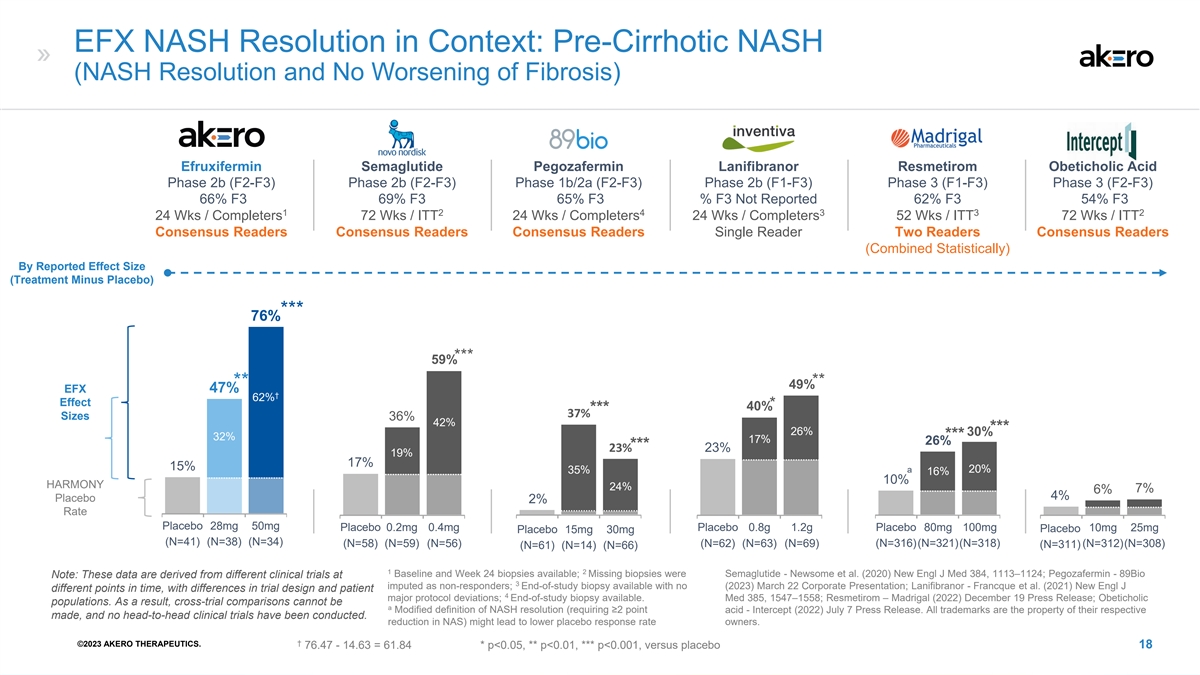
EFX NASH 分辨率:肝硬化前 NASH(NASH 分辨率和 纤维化无恶化)Akero Novo Nordisk Madrigal Inventiva Madrigal efruxifermin semaglutide pegozafermin Lanifibranor Resmetirom Obeticholic acid 2b (F2-F3) 2b 期 (F2-F3) 1b/2a (F2-F3) 2b 期 (F1-F3) 第 3 阶段 (F1-F3) 第 3 阶段 (F2-F3) 66% F3 69% F3 65% F3% F3 未报告 62% F3 54% F3 1 2 2 4 3 2 24 Wks /Completers 72 Wks /itt 24 Wks /Completers 52 Wks /ITT 72 Wks /ITT 共识读者共识读者 Single Readers Two 按报告的效果规模(治疗减去安慰剂)划分的读者共识读者(统计学合计)*** 76% *** 59% ** 49% EFX 47% † 62% 效果 * 40% *** 37% *** 36% *** 32% 17% *** 23% 19% 15% a 20% 35% 16% 10% HARMONY 2476% 4% 安慰剂 28mg 50mg 安慰剂 0.2mg 0.4mg 安慰剂 0.2mg 0.8g 1.2g 安慰剂 80mg 100mg 10mg 25mg 安慰剂 15mg 30mg (N=41) (N=38) (N=34) (N=58) (N=56) (N=62) (N=63) (N=316) (N=321) (N=318) (N=312)) (N=308) (N=61) (N=14) (N=66) (N=311) 1 2 基线和第 24 周活检可用;缺失的活检是 Semaglutide——Newsome 等人(2020)New Engl J Med 384,1113—1124;Pegozafermin-89Bio 注意:这些数据来自不同的 临床试验,3月22日没有(2023)企业简报;Lanifibranor-Francque 等人(2021)全新 Engl J 的时间点不同,试验设计和患者 4 的主要方案偏差存在差异;研究结束时可进行活检。Med 385,1547—1558;Resmetirom — Madrigal(2022)12 月 19 日新闻稿;Obeticholic 人群。因此,交叉试验比较不能成为NASH 分辨率的修改定义(要求≥2点酸)——Intercept (2022) 7月7日新闻稿。所有商标均为各自商标的财产,尚未进行过正面交锋的临床试验。NAS(降低)可能会降低安慰剂 所有者的反应率。† ©2023 AKERO THERAPEUTICS。76.47-14.63 = 61.84 * p
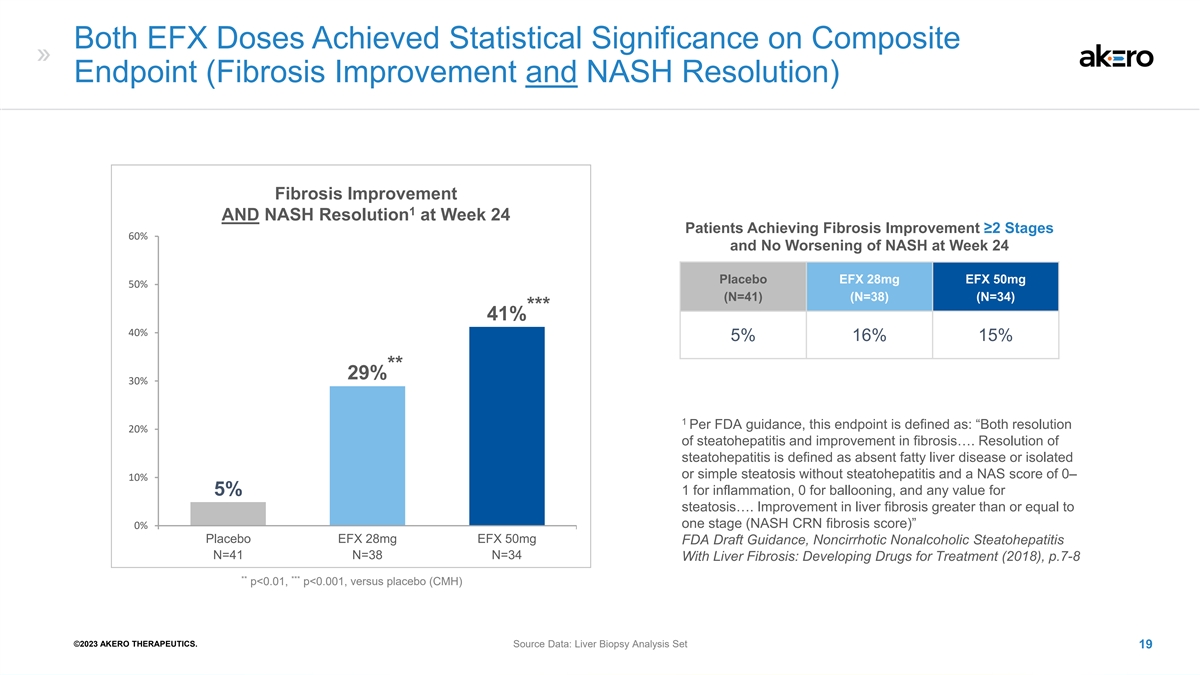
两次 EFX 剂量在复合终点 (纤维化改善和 NASH 消除)纤维化改善 1 和第 24 周纤维化改善 ≥2 阶段的患者的 NASH 分辨率均达到统计学意义安慰剂 EFX 28mg EFX 50mg 50mg (N=38) (N=34) *** *** 41% 40% 15% 15% ** 29%% 30% 1 根据美国食品药品管理局的指导意见,该终点定义为:“既可以缓解脂肪性肝炎的20%,又可以改善纤维化...脂肪性肝炎的消退定义为无脂肪肝疾病 或无脂肪性肝炎的孤立性或单纯性脂肪变性,炎症 NAS 评分为 0— 10% 1,气球膨胀为 0,5% 脂肪变性为任意值...肝纤维化的改善大于或等于一个阶段(NASH CRN 纤维化 分数)” 0% 安慰剂 EFX 28mg EFX 50mg FDA 指南草案,非肝硬化非酒精性脂肪性肝炎 N=41 N=38 N=34 伴有肝纤维化:开发治疗药物(2018),p.7-8 ** p

肝脏脂肪减少和正常化的幅度相当于 2a 期平衡研究第 24 周肝脂肪在第 24 周达到 LS 平均相对减脂阈值的患者比例 0% 安慰剂 EFX 28mg EFX 50mg 终点 -10% (N=42) (N=38) (N=35) -6% -20% 相对 肝脏脂肪减少 -30% -40% *** 50% 2% 63% 77% -50% *** ***--52% 52% 肝脂含量正常化 ***--52% 64% -70% 安慰剂 EFX 28 mg EFX 50mg *** ≤ 5% 34% 51% N=38 N=35 *** p
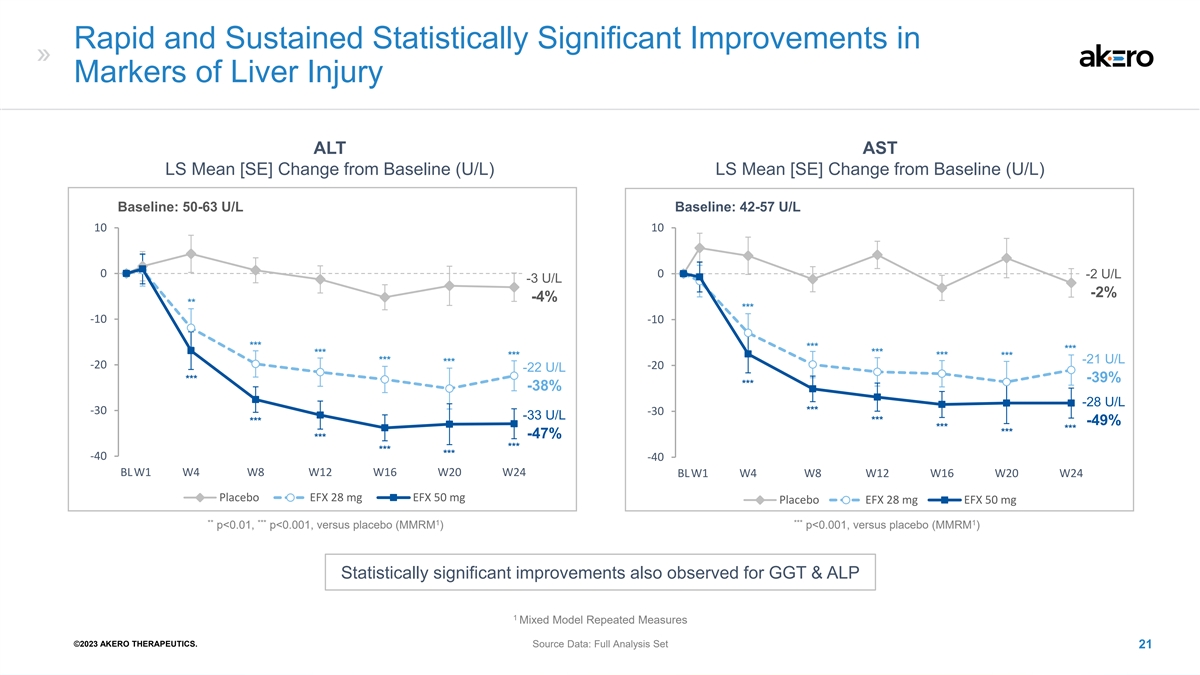
肝损伤标志物 的快速持续改善具有统计学意义 ALT AST LS 均值 [SE]与基线 (U/L) LS 均值相比的变化 [SE]与基线相比的变化 (U/L) 基线:50-63 U/L 基线:42-57 U/L 10 10 0 0 -2 U/L -3 U/L -2% *** -10 *** *** *** *** *** *** *** *** -21 U/L *** -20 -22 U/L *** -39% *** -38% -28 U/L -30 -30 -33 U/L *** 49% *** *** -47% *** *** -40 -40 BLW1 W8 W12 W20 BLW1 W20 BLW1 W8 W12 W16 W20 W24 安慰剂 EFX 28 mg EFX 28 mg EFX 28 mg EFX 28 mg EFX 50 mg *** 1 *** 1 p
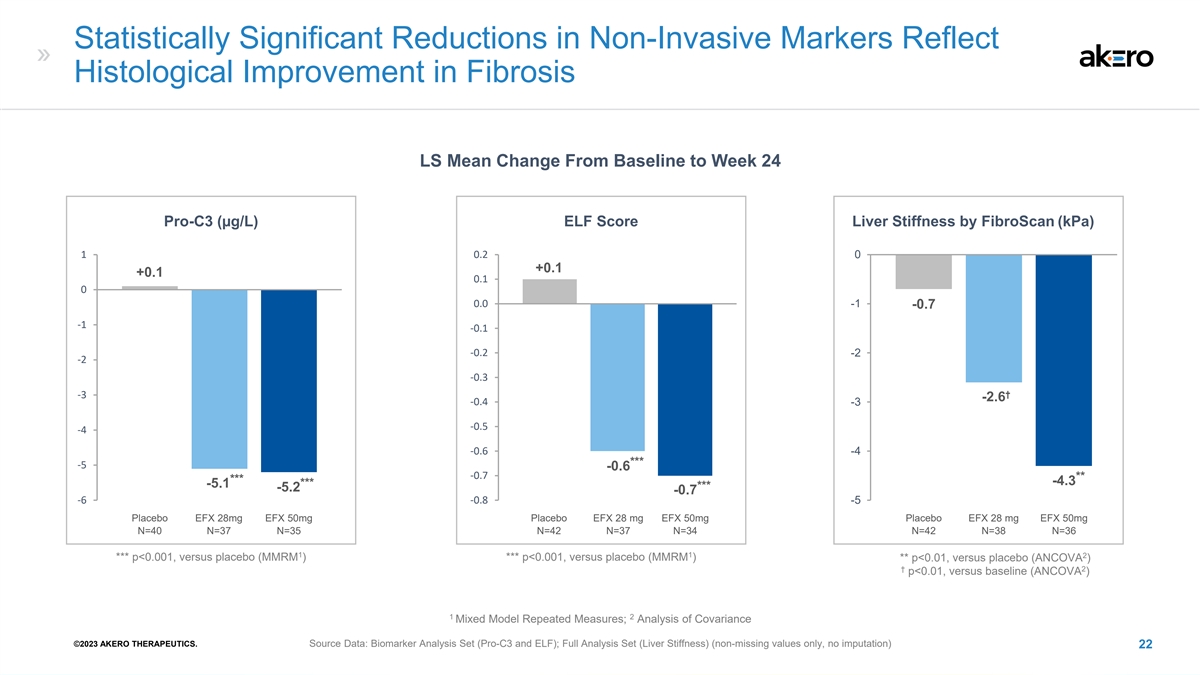
非侵入性标志物的统计学显著减少反映了 纤维化的组织学改善 LS 从基线到第 24 周 Pro-C3 (µg/L) ELF 评分肝硬度 fibroScan (kPa) 1 0.2 +0.1 -0.1 -0.1 -0.1 -0.2 -2 -3 † -3--2.6 -4 -0.6 -4 *** -5 -0.6 -7 ** *****--4.3 ***--4.3 ***--5.1 ***--5.2--0.7 -6 -0.7 -6 -8 -5 1 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28 mg EFX 50mg N=37 N=35 N=37 N=34 N=38 N=38 1 2 *** p
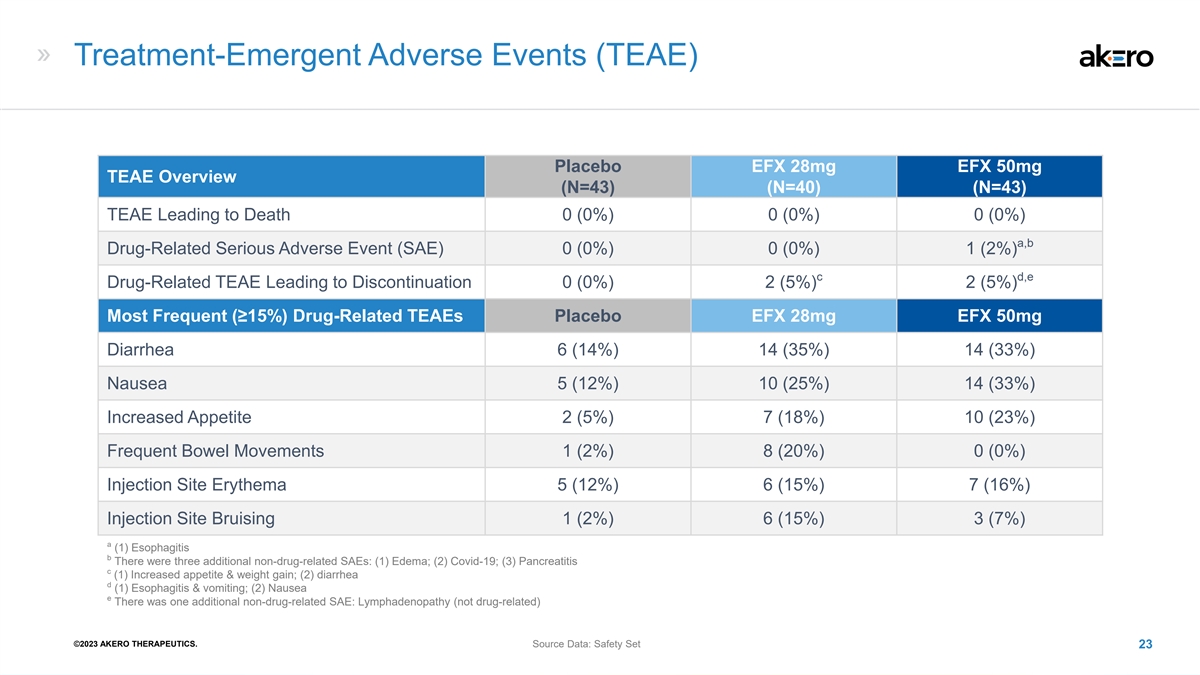
治疗-紧急不良事件 (TEAE) 安慰剂 EFX 28mg EFX 50mg TEAE 概述 (N=43) (N=40) (N=43) TEAE 导致死亡 0 (0%) 0 (0%) a, b 药物相关严重不良事件 (SAE) 0 (0%) 0 (0%) 1 (2%) c d,e 导致停药的药物相关 TEAE (0) 0%) 2 (5%) 2 (5%) 最常见 (≥ 15%) 药物相关 TeaES 安慰剂 EFX 28mg EFX 50mg 腹泻 6 (14%) 14 (35%) 14 (33%) 恶心 5 (12%) 10 (33%) 食欲增加 2 (5%) 7 (18%) 10 (23%) 经常排便 1 (2%) 8 (20%) 0 (0%) 注射部位红斑 5 (12%) 6 (15%) 7 (16%) 注射部位淤青 1 (2%) 6 (15%) 3 (7%) a (1) 食管炎 b 还有另外三种非药物相关的 SAE:(1) 水肿;(2) Covid-19;(3) 胰腺炎 c (1) 食欲增加和体重增加;(2) 腹泻 d (1) 食道炎和 呕吐;(2) 恶心 e 还有另外一种非药物相关的 SAE:淋巴结肿大(不是药物相关)©2023 AKERO THERAPEUTICS。来源数据:Safety Set 23
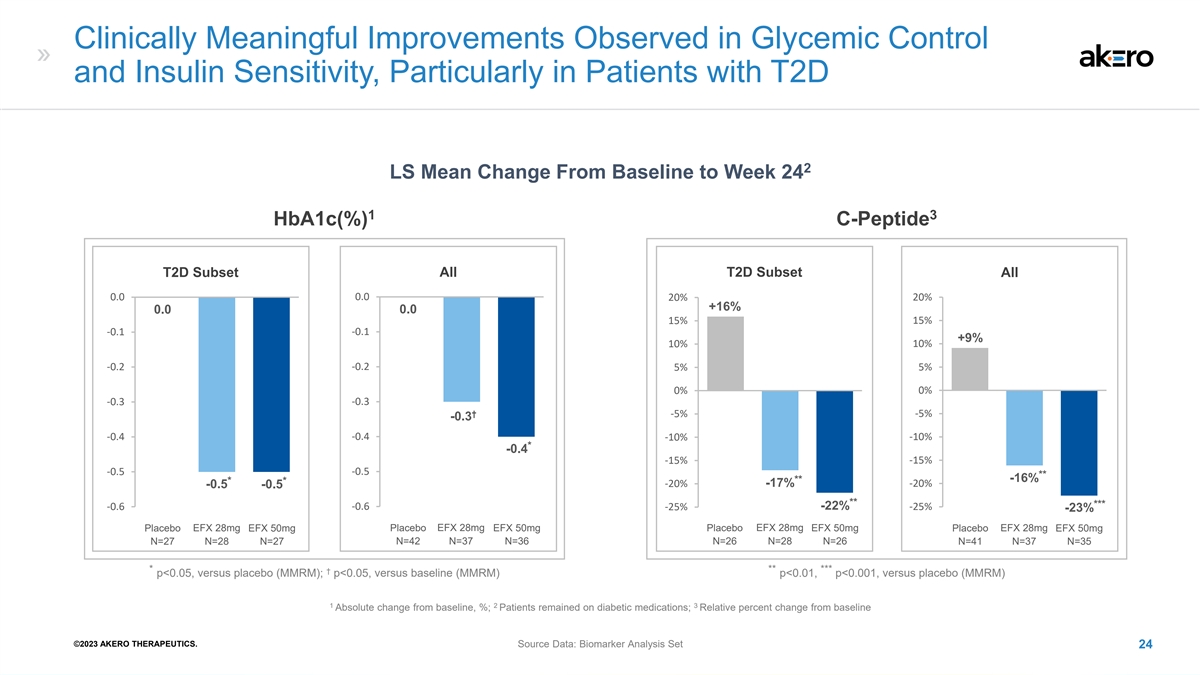
在血糖控制和 胰岛素敏感性方面观察到有临床意义的改善,尤其是在患有 T2D 2 LS 的患者中,从基线到第 24 周的平均值变化 1 3 Hba1c (%) C-Peptide T2D 子集所有 0.0 0.0 20% +16% 15% -0.2 -0.2 5% 0% -0.3 † -5% -0 0.. 3 3 -0.4 -0.4 -10% *-0.. 4 4 -15% -15% -0.5 -0.5 ** **--16% 16% ** * -20% -17% -20%--0.. 5 -0... 5 *** *** *** -0.6 -25%--22% -22% -23% 1 1 1 1 安慰剂 EFX 28mg 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg N=27 N=28 N=42 N=37 N=26 N=41 N=37 N=37 N=35 * **† p
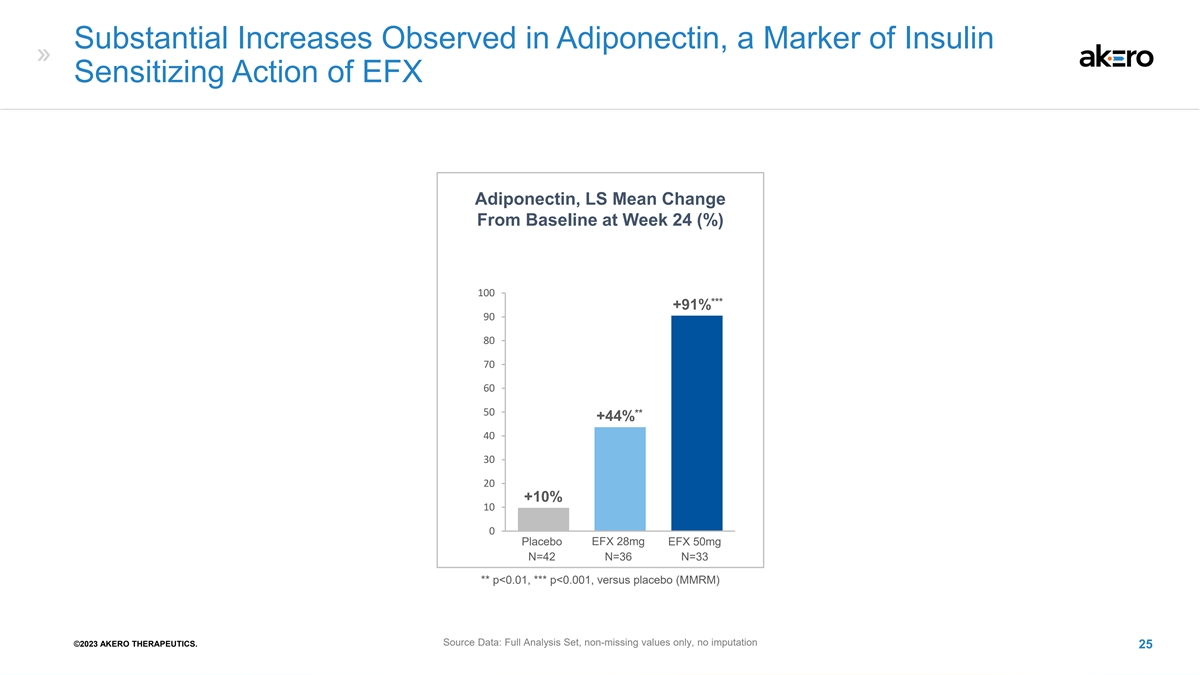
观察到脂联素(EFX 脂联素胰岛素 致敏作用的标志)显著增加,LS 第 24 周与基线相比的平均变化 100 *** +91% 90 80 70 50 ** +44% 40 30 20 +10% 10 0 安慰剂 EFX 28mg EFX 50mg N=42 N=36 N=33 ** p
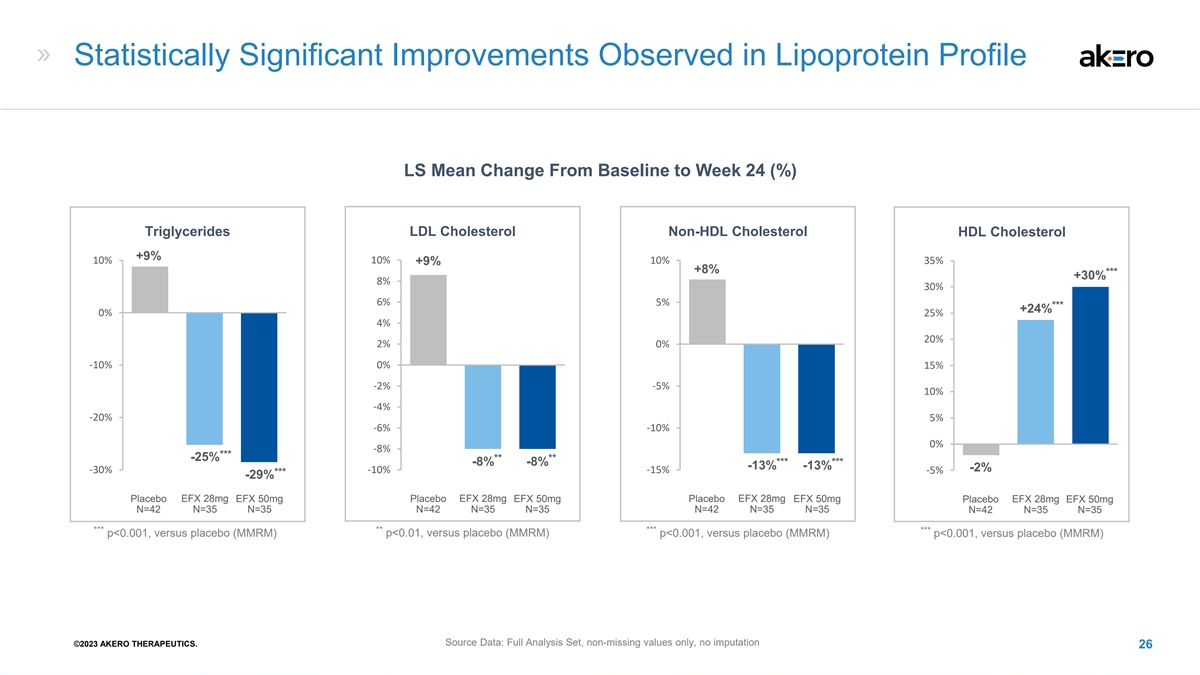
在脂蛋白谱中观察到统计学上的显著改善 LS 从基线到第 24 周的平均变化 (%) 甘油三酯低密度脂蛋白胆固醇非高密度脂蛋白胆固醇 +9% 10% 10% +9% +9% +8% *** +30 30% 8% 6% *** +24% 25% 2% 0% -10% -2% -20% 15% -2% -20% -6% -10% -10% -10% -6% -10% -10% -10% *** -25% **** -25% *** *** ***--8 8%--8 8%--13% -13% -13% -13% -13% -2% -10% -15% *** -29% 1 1 安慰剂 EFX 28mg 安慰剂 EFX 28mg 安慰剂 EFX 28mg 安慰剂 EFX 28mg 安慰剂 EFX 28mgEFX 50mg N=42 N=35 N=35 N=42 N=35 N=35 N=42 N=35 N=35 *** *** p
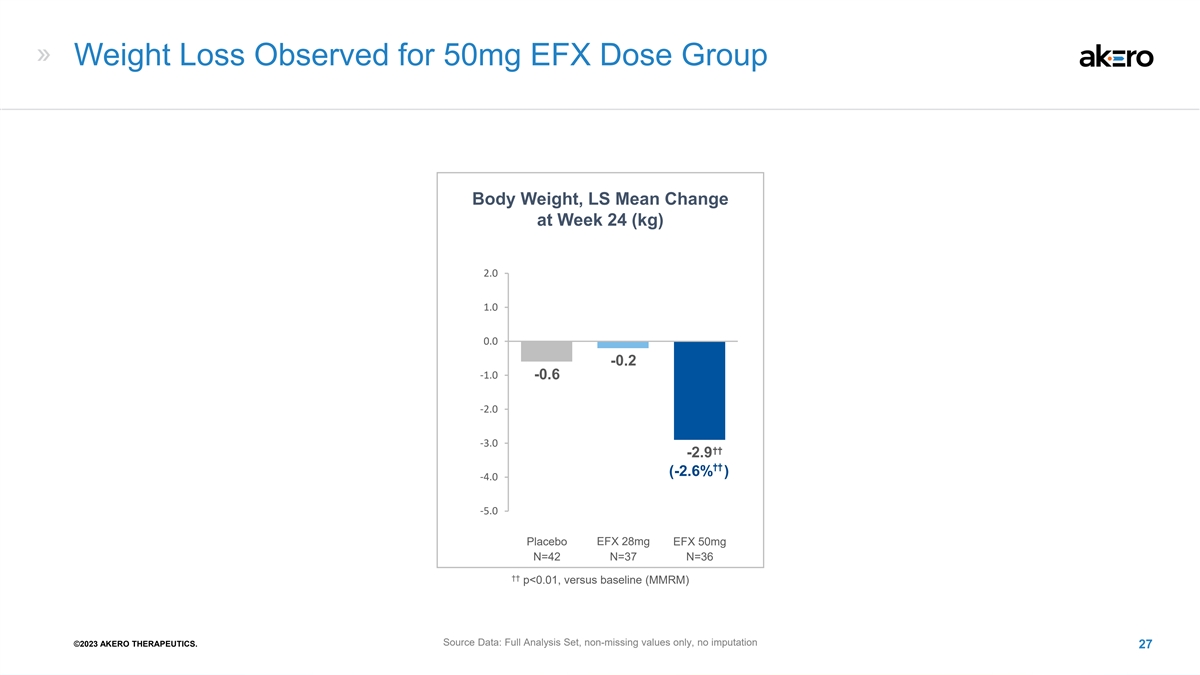
观察到 50mg EFX 剂量组体重减轻,LS 平均值 在第 24 周 (kg) 2.0 1.0 0.0 -0.2 -1.0 -0.6 -2.0 -3.0 ††--2. 2.9 9 †† (-2.6%) -4.0 -5.0 1 安慰剂 EFX 28mg EFX 50mg N=42 N=37 N=36 †† p
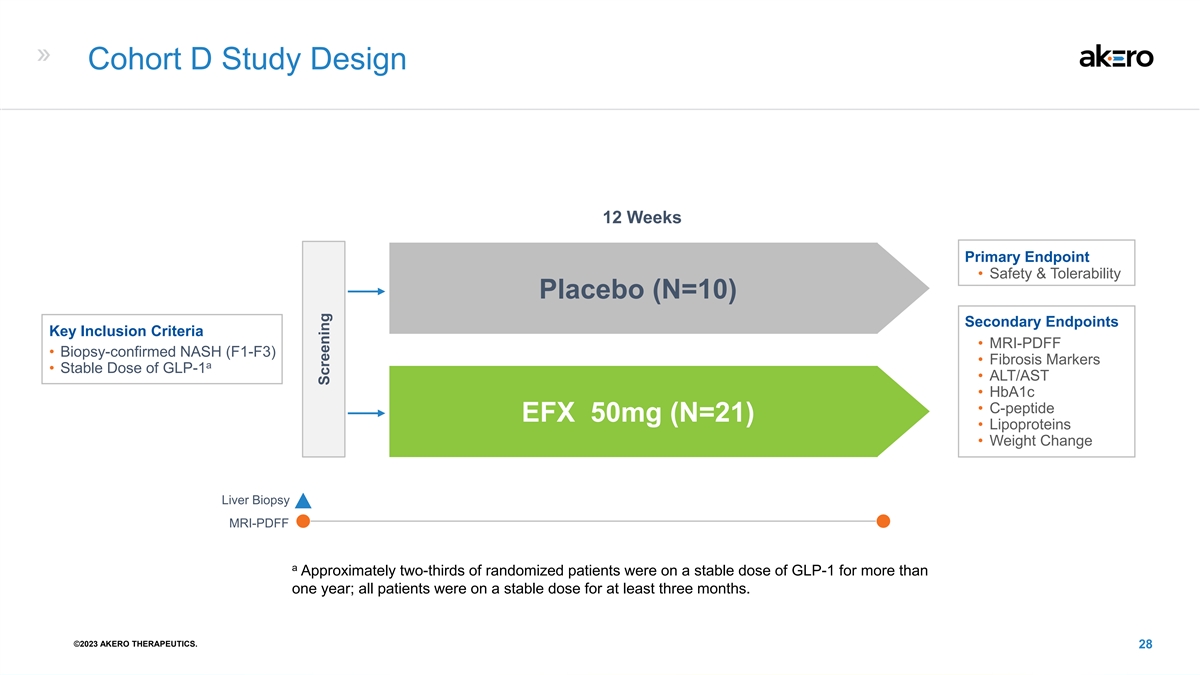
队列 D 研究设计 12 周主要终点 • 安全性和 耐受性安慰剂 (N=10) 次要终点关键纳入标准 • MRI-PDFF • 活检确认的 NASH (F1-F3) • 纤维化标志物 a • GLP-1 的稳定剂量 • ALT/AST • Hba1c • c-肽 EFX 50mg (N=21) • 脂蛋白 • 体重变化肝活检 mri-PDFF 约占三分之二随机组患者服用稳定剂量 GLP-1 的时间超过一年;所有患者服用稳定剂量至少三个月。©2023 AKERO THERAPEUTICS。28 筛查
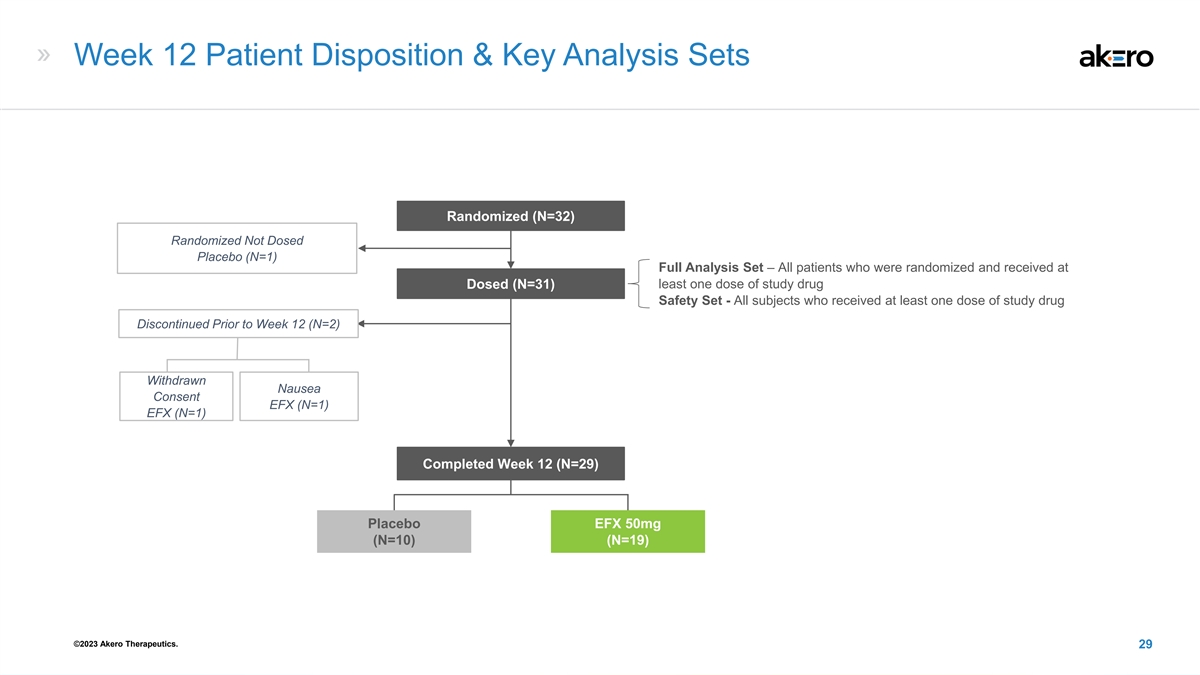
第 12 周患者处置和关键分析套装随机 (N=32) 随机未给药安慰剂 (N=1) 完整分析集 — 所有随机分组并在剂量 (N=31) 下接受至少一剂研究药物安全套装的患者-所有接受至少一剂研究药物的受试者 12 (N=2) 撤回恶心同意 EFX (N=1) EFX (N=1) 已完成第 12 周 (N=29) 安慰剂 EFX 50mg (N=10) (N=19) ©2023 Akero Therapeutics。29
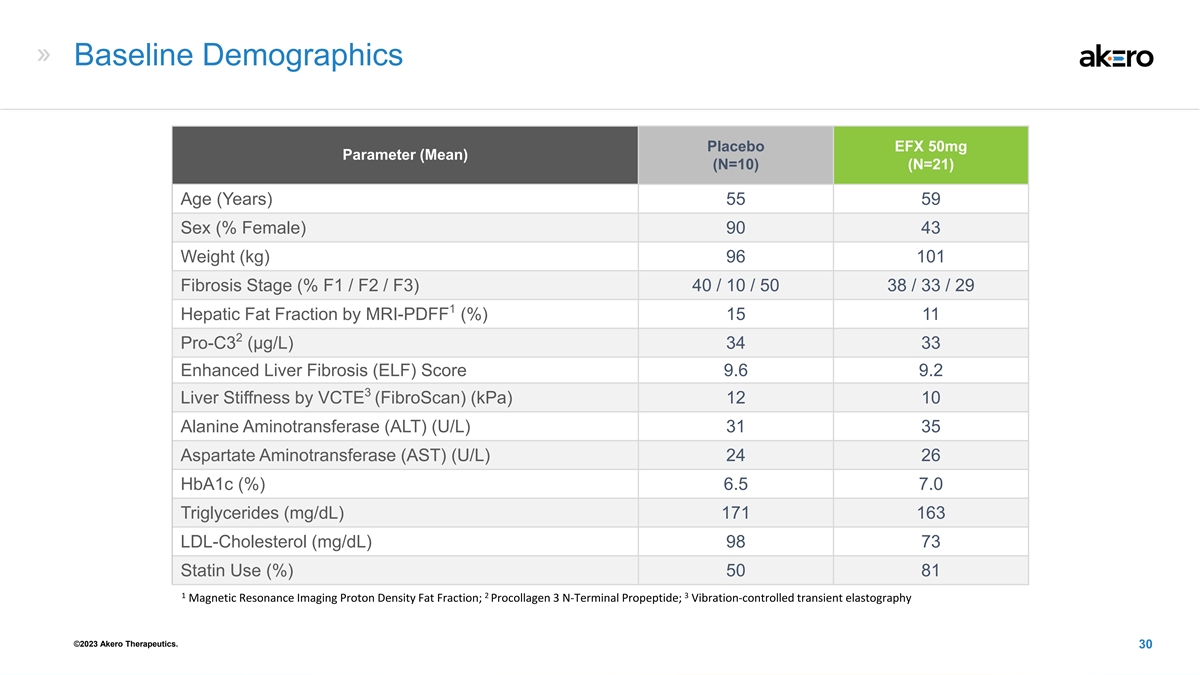
基线人口统计学安慰剂 EFX 50mg 参数(平均值)(N=10)(N=21) 年龄(岁)55 59 性别(% 女性)90 43 体重(kg)96 101 纤维化阶段(% F1 /F2/F3)40/10/50 38/33/29 1 肝脂肪分数(%)15 11 2 Pro-C3(μg/L)34 Liver 纤维化 (ELF) 得分 9.6 9.2 3 VCTE 的肝硬度 (FibroScan)(kPa) 12 10 丙氨酸氨基转移酶 (ALT) (U/L) 31 35 天冬氨酸氨基转移酶 (AST) (U/L) 24 26 Hba1c (%) 6.5 7.0 甘油三酯 (mg/dL) 171 163 低密度脂蛋白胆固醇 (mg/dL) 98 73 他汀类药物使用率 (%)) 50 81 1 2 3 磁共振 成像质子密度脂肪分数;前胶原蛋白 3 N 末端前肽;振动控制瞬态弹性成像 ©2023 Akero Therapeutics。30
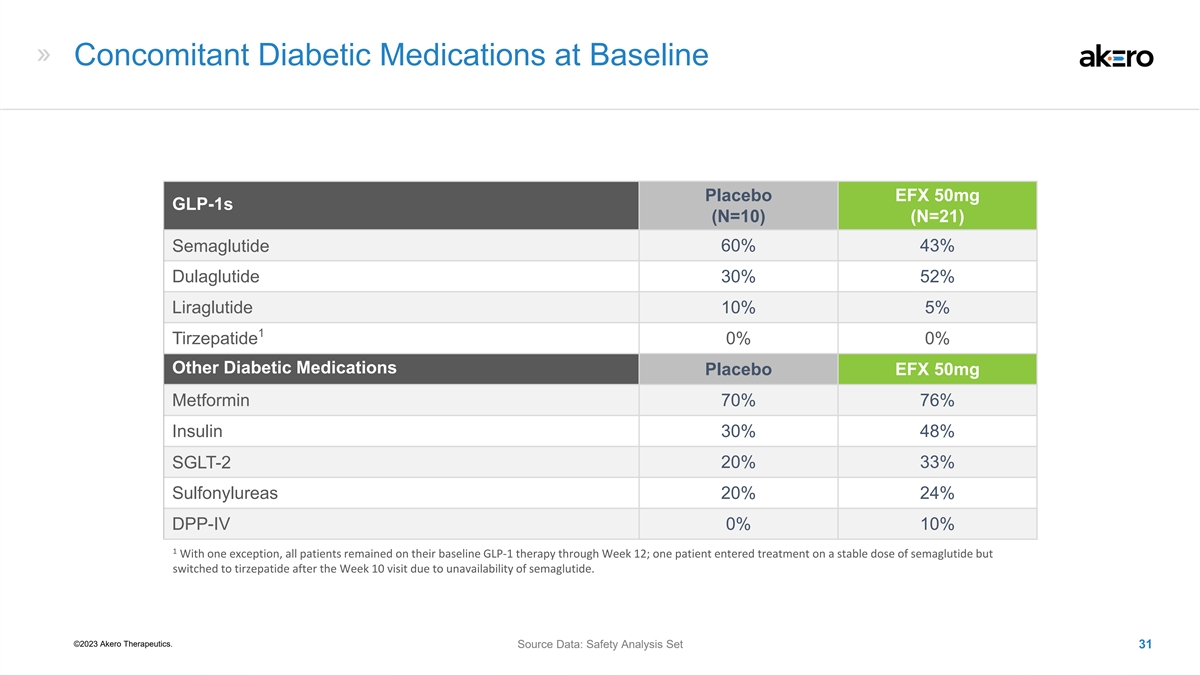
基线安慰剂同时服用糖尿病药物 EFX 50mg glp-1s (N=10) (N=21) 60% 43% Semaglutide dulaglutide 30% 52% 利拉鲁肽 10% 5% 1 替泽帕肽 0% 0% 0% 其他糖尿病药物安慰剂 EFX 50mg 76% 胰岛素 30% 48% SGLT-2 20% 33% 磺脲类 20% 24% DPP-IV 0% 1 一个例外,所有 患者在第 12 周之前都保持基线 GLP-1 疗法;一名患者接受了稳定剂量的西玛鲁肽治疗,但在第 10 周就诊后因西马鲁肽不可用而改用了替泽帕肽。©2023 Akero Therapeutics。 源数据:安全分析集 31
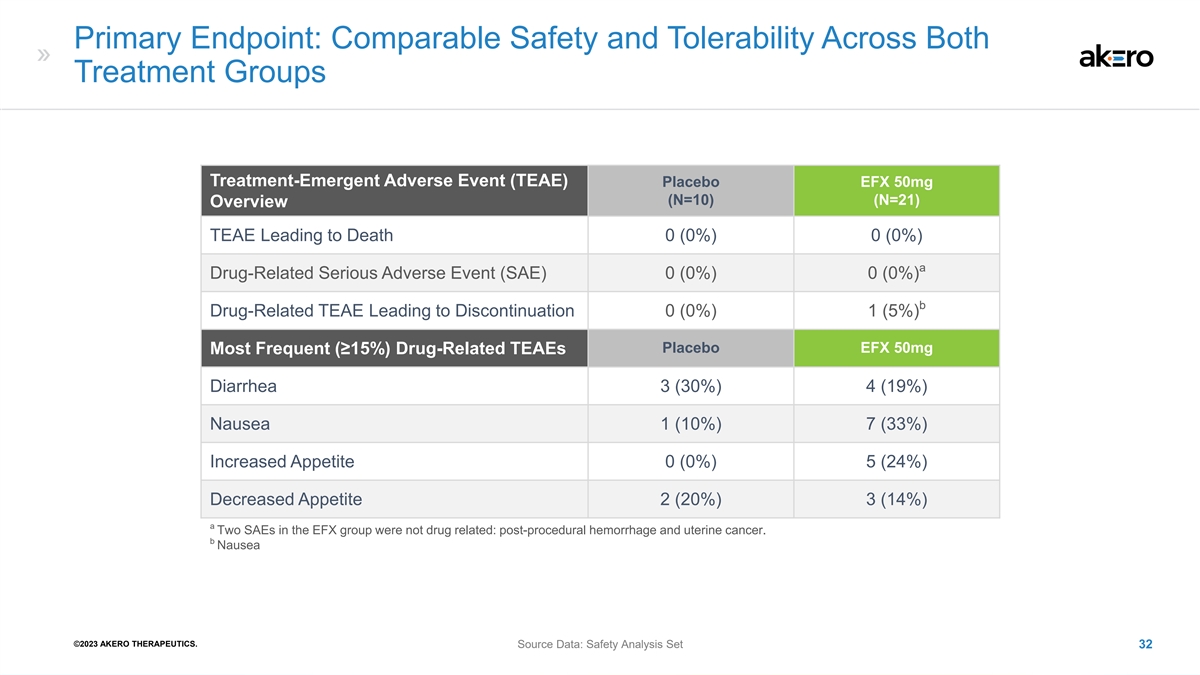
主要终点: 两个治疗组的安全性和耐受性相似治疗-紧急不良事件 (TEAE) 安慰剂 EFX 50mg (N=10) (N=21) 概述 TEAE 导致死亡 0 (0%) 0 (0%) a 药物相关严重不良事件 (SAE) 0 (0%) 0 (0%) b 药物相关 TEAE 导致停药 0 (0%) 1 (5%) 安慰剂 EFX 50mg 最常见 (≥ 15%) 药物相关的 TEAE 腹泻 3 (30%) 4 (19%) 恶心 1 (10%) 7 (33%) 食欲增加 0 (0%) 5 (24%) 食欲下降 2 (20%) 3 (14%) a EFX 组中的两个 SAE 与药物无关: 术后出血和子宫癌。b 恶心 ©2023 AKERO THERAPEUTICS。来源数据:安全分析集 32
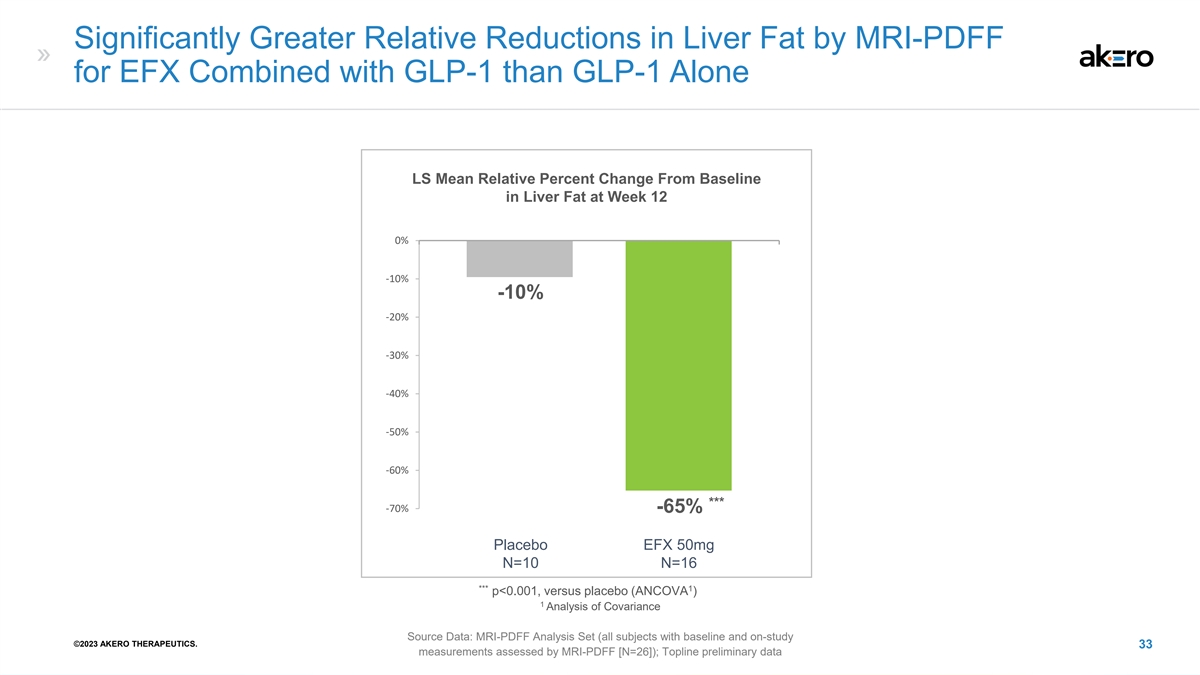
MRI-PDFF 对 EFX 结合 GLP-1 的肝脂相对减少幅度明显大于 GLP-1 LS 第 12 周肝脂肪与基线相比的平均相对变化百分比 0% -10% -10% -20% -30% -40% -60% *** -70% -65% 安慰剂 EFX 50mg N=10 N=16 *** 1 p
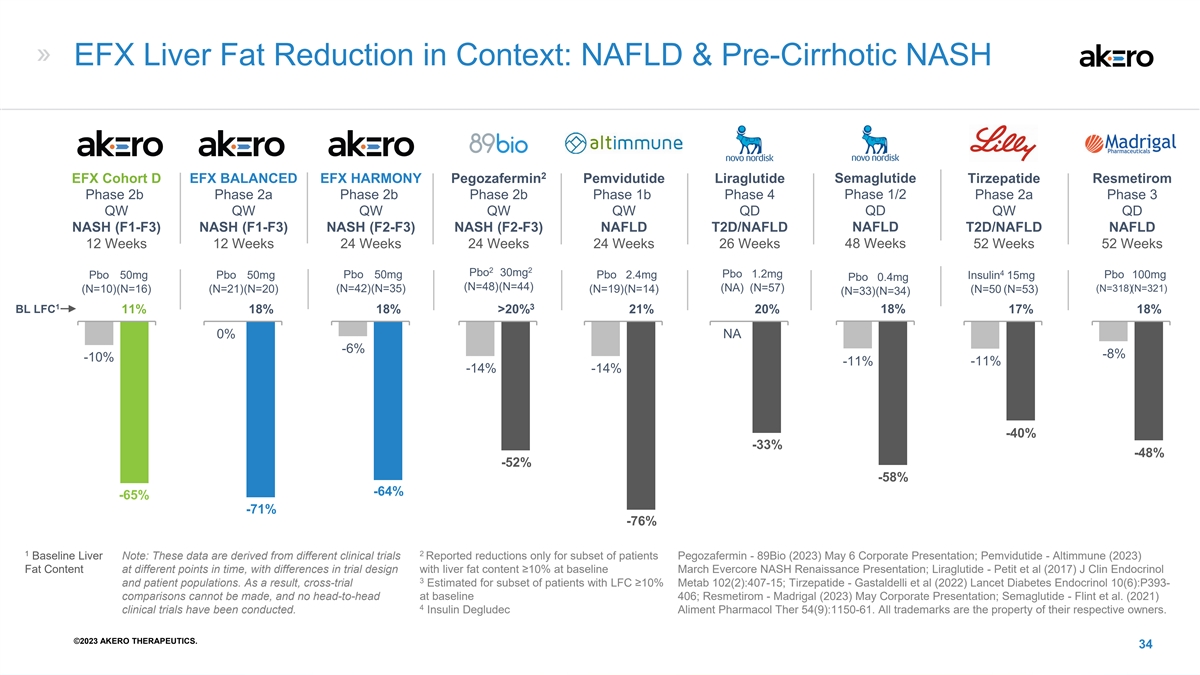
EFX 肝脏脂肪减少背景:NAFLD 和肝硬化前 NASH Akero Akero Akero Madrigal Inventiva Novo Nordisk Novo Nordisk Madrigal 2 Semaglutide EFX 群组 D EFX HARMONY pegozafermin pegozafermin pegozafermin pegozafermin pegozafermin phase 2b phase 2b phase 2b phase 2b phase 2b 第 4 阶段 2a 阶段 3 QD QW QW QW QW QW QD QD QD NAFLD NASH (F1-F3) NASH (F1-F3) NASH (F2-F3) NASH () NASH (F2-F3) NAFLD T2D/NAFLD 12 周 24 周 24 周 26 周 48 周 52 周 2 2 Pbo 30mg 1.2mg pbo 50mg Pbo50mg Pbo 50mg Pbo 2.4mg 胰岛素 15mg Pbo 100mg Pbo 0.4mg (N=48) (N=44) (N=44) (N=44) (N=57) (N=10) (N=16) (N=21) (N=42) (N=35) (N=19) (N=14) (N=38) (N=35) (N=35) (N=35) (N=48) (N=38) (N=35) (N=35) (N=48) (N=38) (N=35) (N=35) (N=48) (N=38) (N=35 =50 (N=53) (N=33) 1 3 BL LFC 11% 18% 18% > 20% 21% 18% 18% 0% NA -6% -10% -11% -14% -40% -33% -52% -58% -64% -65% -71% -76% 1 2 Baseline Liver 注意:这些数据来自不同的临床试验。报告的减少仅限于部分患者 Pegozafermin-89Bio (2023) 5 月 6 日企业演讲; Pemvidutide-Altimmune (2023) 不同时间点的脂肪含量,试验设计存在差异,肝脏脂肪含量在基线 3 月 Evercore NASH Renaissance 演示文稿;Liraglutide-Petit 等人(2017)J Clin Incentronol 3 和患者群体。因此,交叉试验估计 LFC ≥ 10% 的部分患者 Metab 102 (2): 407-15;Tirzepatide-Gastaldelli 等人 (2022) Lancet Diabeties Nectronol 10 (6): P393-无法进行比较,基线 406 时也无法进行正面交锋 ;Resmetirom-Madrigal (2023) 5 月企业演讲;Semaglutide-弗林特等人(2021)已经进行了4项临床试验。胰岛素 degludec Aliment Pharmacol Ther 54 (9): 1150-61。所有商标均为其 各自所有者的财产。©2023 AKERO THERAPEUTICS。34
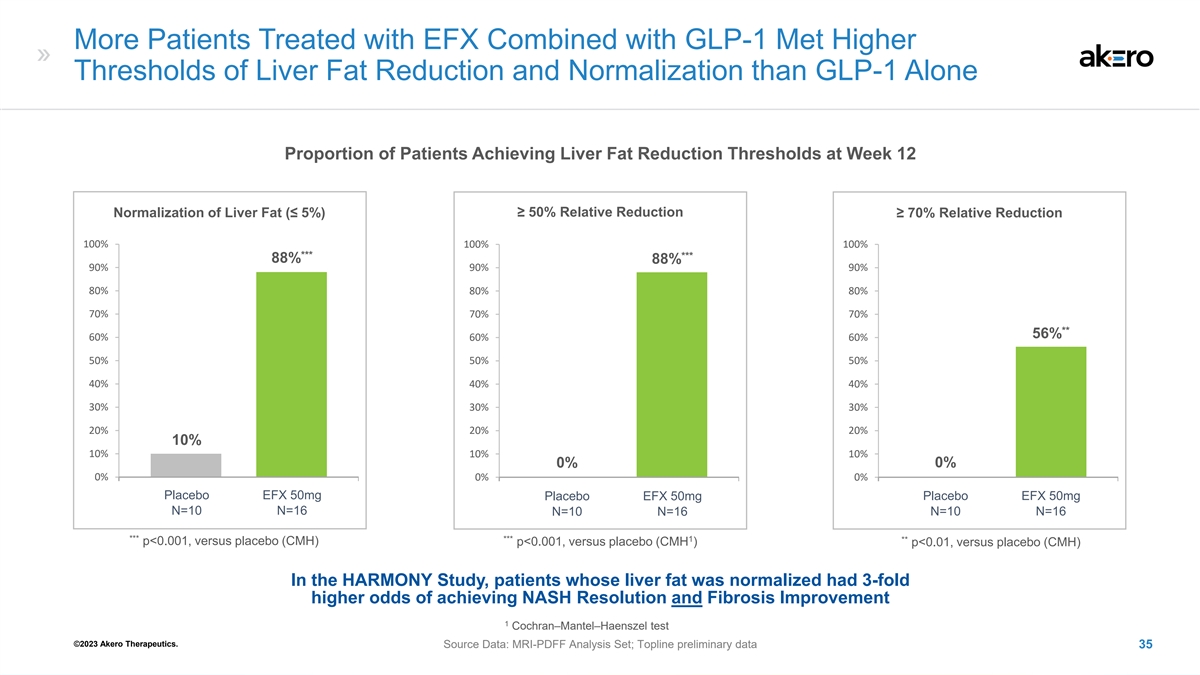
接受结合 GLP-1 的 EFX 治疗的患者达到更高 的肝脂减少和正常化阈值比单独使用 GLP-1 的患者在第 12 周达到肝脂减少阈值的患者比例 ≥ 50% 肝脂相对减少正常化 (≤ 5%) ≥ 70% 相对减少 100% *** 88% 90% 90% 8080% 70% ** 66% 60% 60% 50% 40% 40% 30% 20% 10% 10% 0% 0% 0% 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg N=10 N=10 N=10 N=10 N=10 N=10 N=16 *** *** 1 ** p
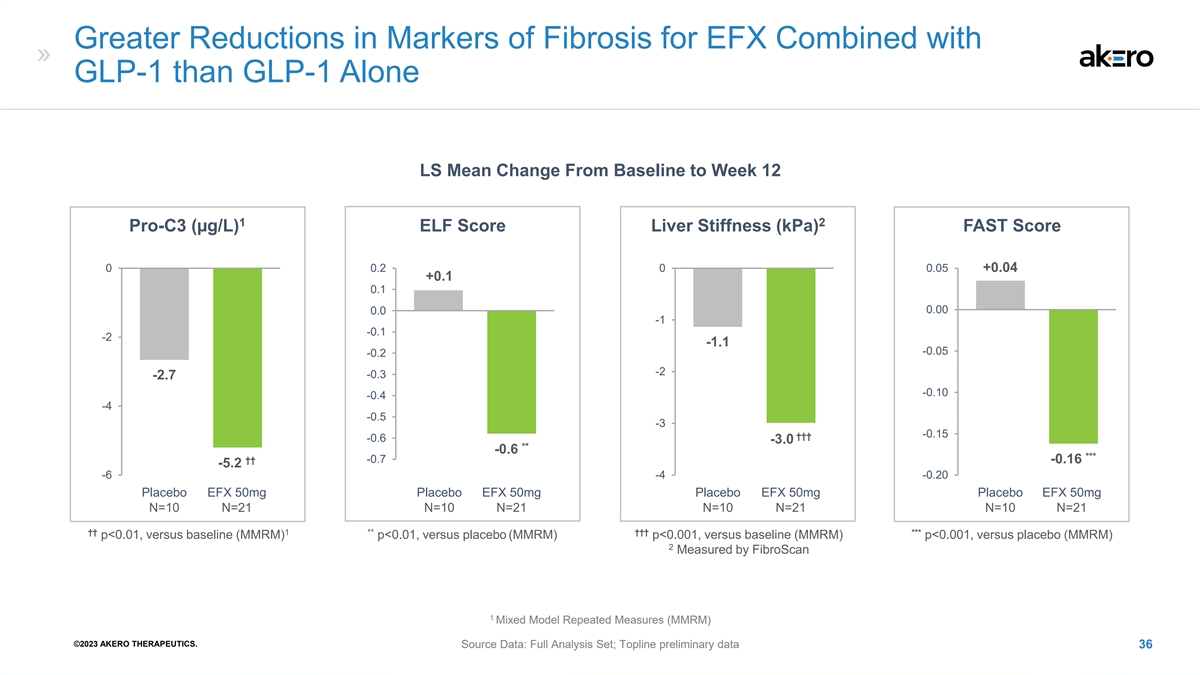
EFX 结合 GLP-1 的纤维化标志物的减少幅度大于单独使用 GLP-1 LS 从基线到第 12 周的平均变化 1 2 Pro-C3 (µg/L) ELF 评分肝硬度 (kPa) FAST 分数 0 0.0 0 0.05 +0.1 -0.1 -1.1 -1.1 -0.05 -0.2 -2.7 -0.10 -4 -0.5 -0.10 -4 -0.5 -0.5 -0.15 †† -0.6 -3.0 ** -0.6 *** †† -0.7 -0.16 -5.2 1 -6 -4 -0.20 1 1 1 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg N=10 N=21 N=10 N=21 N=10 N=21 †† 1**†† *** p
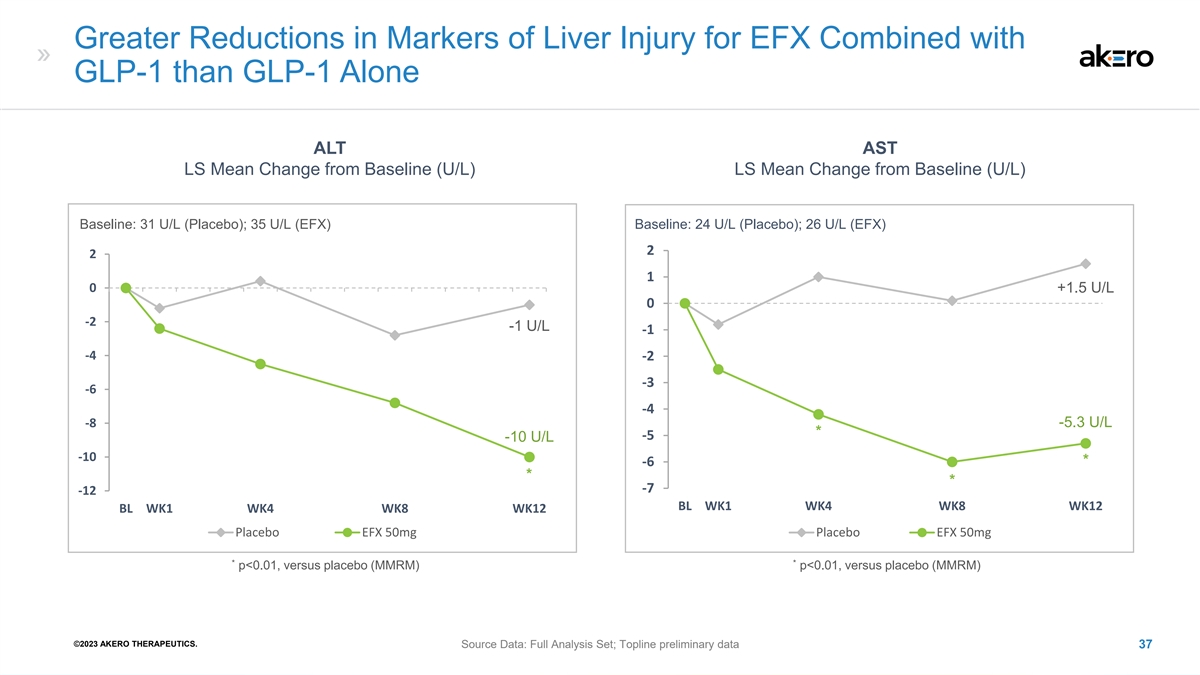
EFX 与 GLP-1 联合使用的肝损伤标志物的减少幅度大于 GLP-1 ALT AST LS 与基线的平均变化 (U/L) LS 与基线的平均变化 (U/L) 基线:31 U/L(安慰剂);35 U/L(EFX)基线:24 U/L(安慰剂);26 U/L(EFX)2 2 1 0 +1.5 U/L 0 -2 -1 U/L -4 -2 -3 -6 -4 -8 -5.3 U/L * -5 -10 U/L -10 * -6 * -7 -12 BL WK1 WK4 WK8 BL WK1 WK4 WK8 安慰剂 EFX 50mg 安慰剂 EFX 50mg * * p
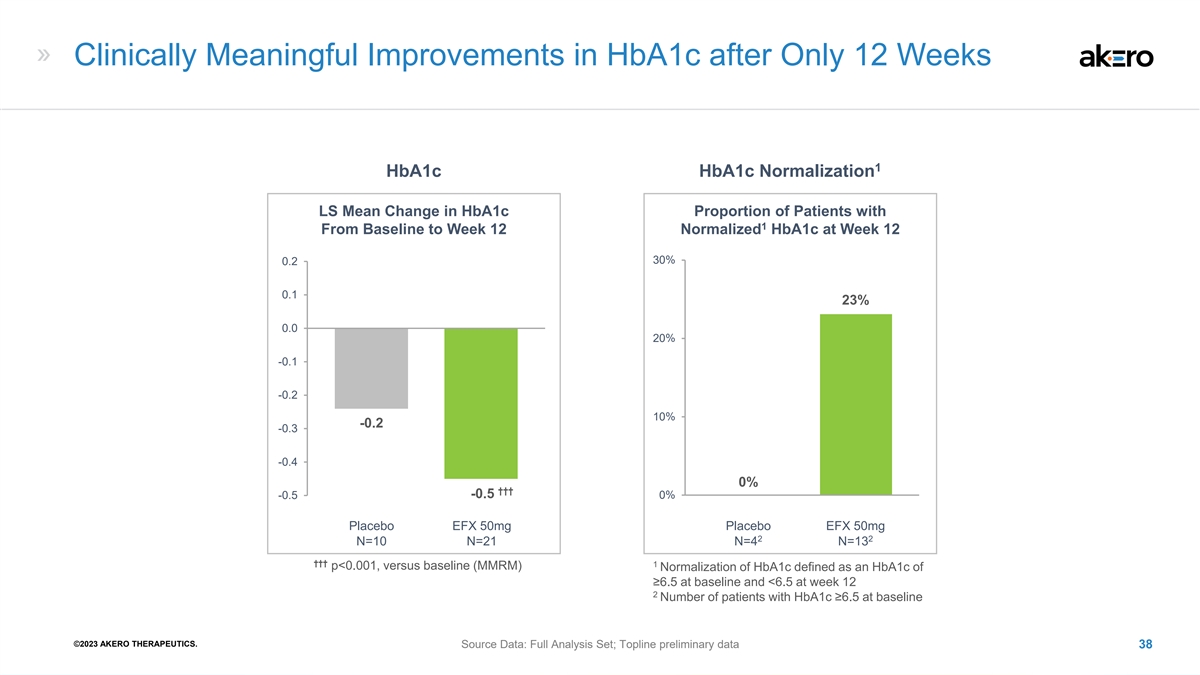
仅 12 周后 HbA1c 有临床意义的改善 1 Hba1c Hba1c 正常化 LS 从基线到第 12 周 Hba1c 的患者比例的平均变化 30% 0.2 23% 0.0 20% -0.1 -0.1 -0.2 10-0.3 -0.4 †† †† -0.5 -0.5 0% 1 安慰剂 EFX 50mg 2 2 N=10 N=21 N=4 N=13 ††† 1 p
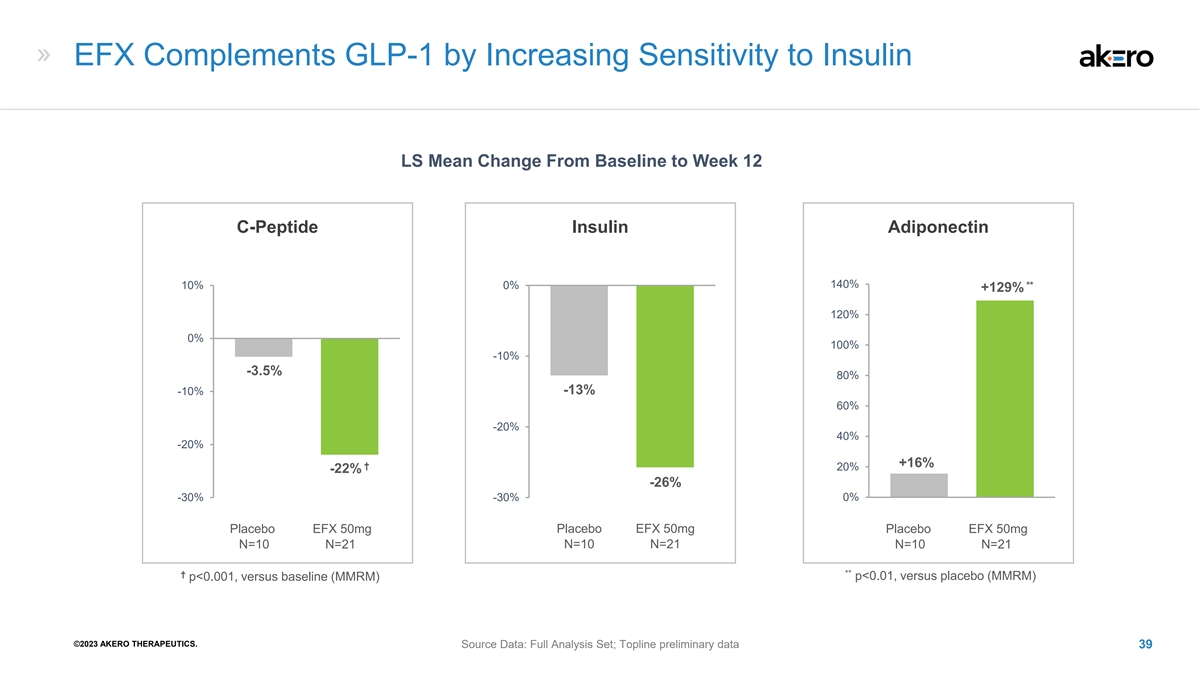
EFX 通过提高对胰岛素的敏感度来补充 GLP-1 LS Mean 从基线改为第 12 周 C 肽胰岛素脂联素 140% 10% 0% +129 29% 120% 100% -10% -10% -10% -13% -20% -20% +16% † 20% -26% -30% 1 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg N=10 =21 N=10 N=21 N=10 N=21 ** † p
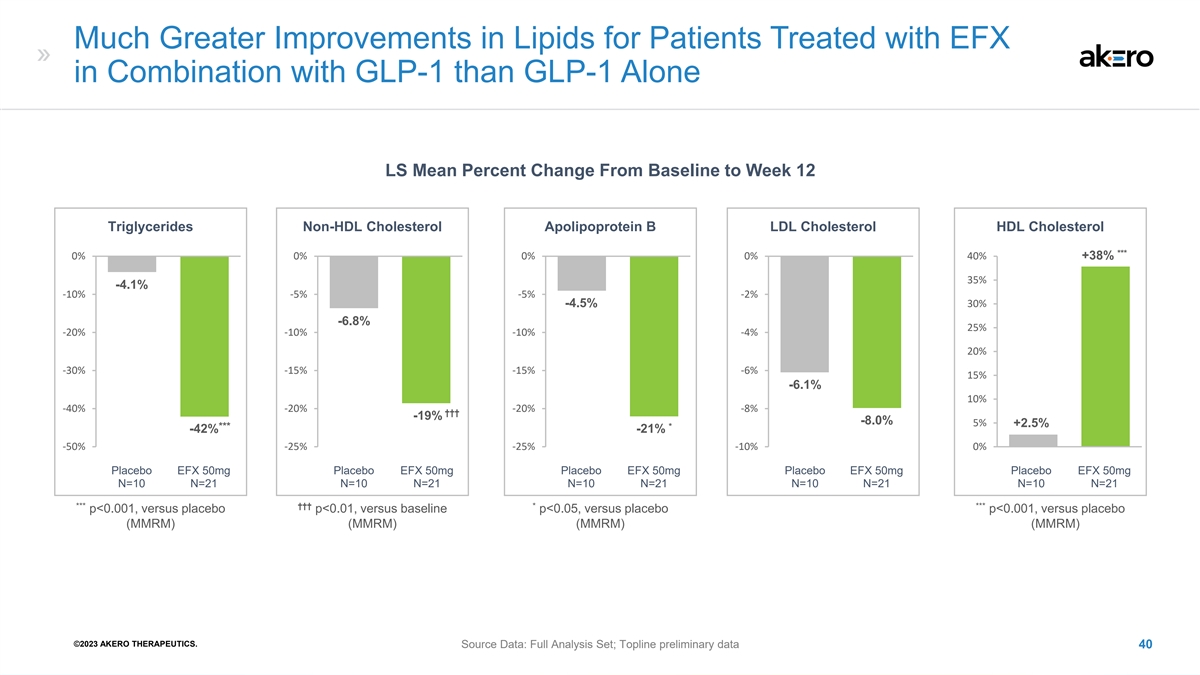
与 GLP-1 联合使用 EFX 治疗的患者的脂质改善远大于单独使用 GLP-1 LS 从基线到第 12 周甘油三酯的平均变化百分比非高密度脂蛋白胆固醇 B 低密度脂蛋白胆固醇 HDL 胆固醇 *** 0% 0% 0% 0% 40% +38% 35% -4.1% -10% -6.8% 25% -20% -10% -10% -10% 20% -30% -15% -6% 15% -6.1% 10% -40% -20% -8% †† †† -19% -8.0% 5% +2.5% * *** -42% -42% -50% -25% -10% 1 1 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mgN=21 N=10 N=21 N=10 N=21 N=10 N=21 N=10 N=10 N=10 N=21 *** ††† * *** p
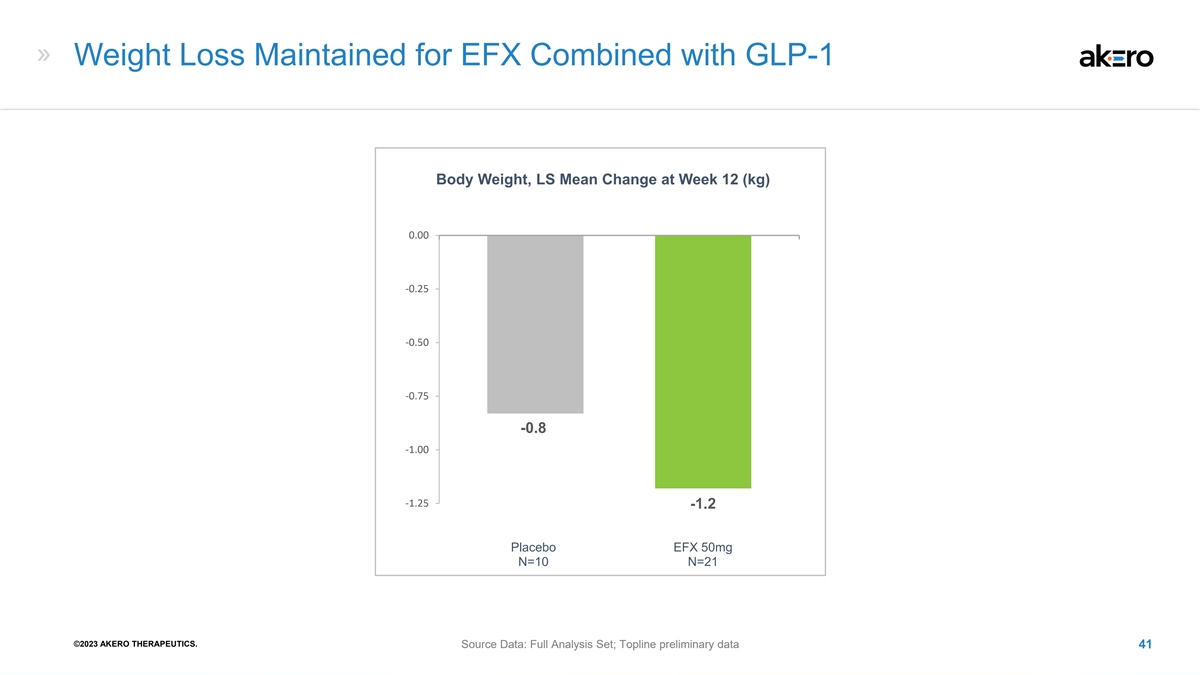
EFX 与 GLP-1 体重相结合,维持减肥效果,第 12 周 LS 平均值 变化 0.00 -0.25 -0.50 -0.75 -0.8 -1.00 -1.25 -1.2 安慰剂 EFX 50mg N=10 N=21 ©2023 AKERO THERAPEUTICS。来源数据:完整分析集;Topline 初步数据 41

队列 D 为越来越多的证据表明 EFX 作为基石 NASH 治疗的潜力 作为基石 NASH 治疗的关键要点补充 GLP-1 有可能使 EFX 比单独 GLP-1 更有效 v EFX 和 GLP-1 具有互补的作用机制。v 在 正常化 NASH 和 2 型糖尿病患者中,在 GLP-1 中添加 EFX 对肝脏脂肪的耐受性良好,没有增加性胃肠道副作用。GLP-1使用 GLP-1 改善的 V EFX 显示出多重益处 Fibrosis Liproteion Liprotein 在脂肪变性、损伤和纤维化中 12 周的肝标志物 Profile 在改善队列 D 血糖控制、血脂异常和减肥的情况下得以维持。GLP-1体重改善 v 群组 D EFX 概况与之前使用 EFX 进行的 BALANCED 和维持控制 HARMONY 研究中的血糖损失相当。©2022 AKERO THERAPEUTICS。42

在 基础上评估 NASH(F4)导致的肝硬化患者 EFX(F4)的令人鼓舞的 16 周数据显示 F4 纤维化、纤维化 NASH 58% 或 2a 期改善分辨率在 2a 期扩展队列(队列 C)中,有 12 名(58%)接受了 EFX 50mg 治疗的患者中有 7 名(58%)在纤维化方面取得了单阶段改善而没有恶化 NASH 或 NASH 的分辨率不会恶化纤维化,而安慰剂患者的这一比例为 0% ©2023 AKERO THERAPEUTICS。43
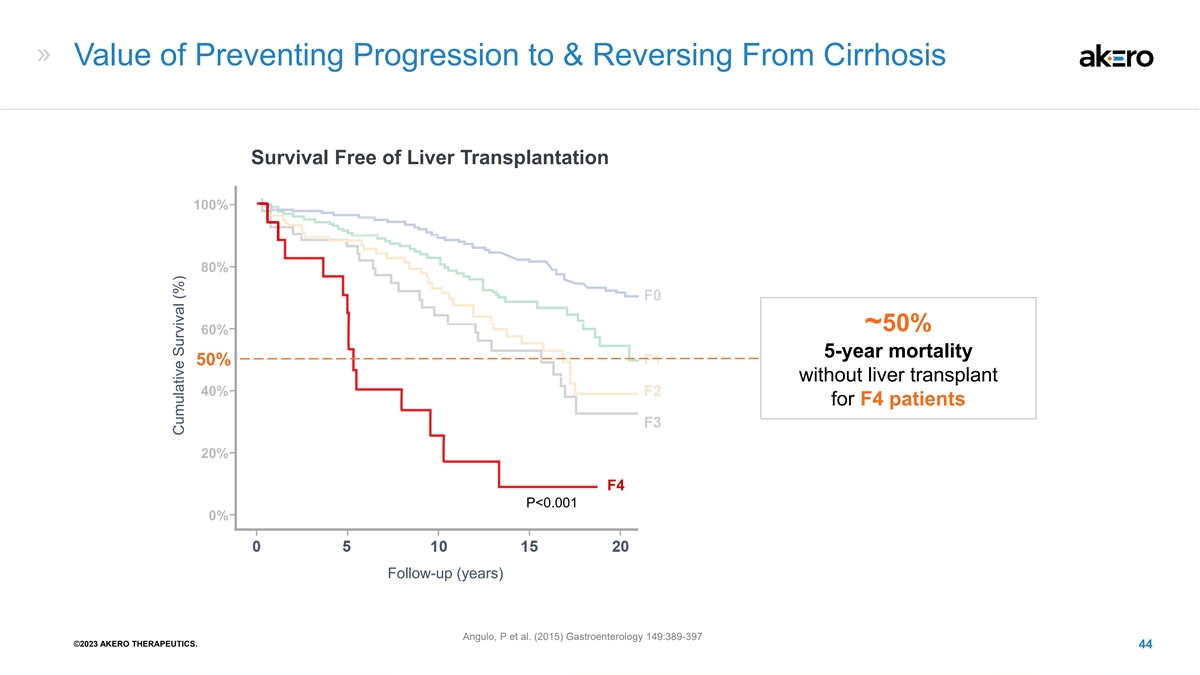
防止肝硬化进展和逆转肝硬化的价值 F4 患者无肝移植存活率 100% 80% F0 ~ 50% 60% 5 年死亡率 50% F1 不进行肝移植 40% F2 F3 20% F4 P
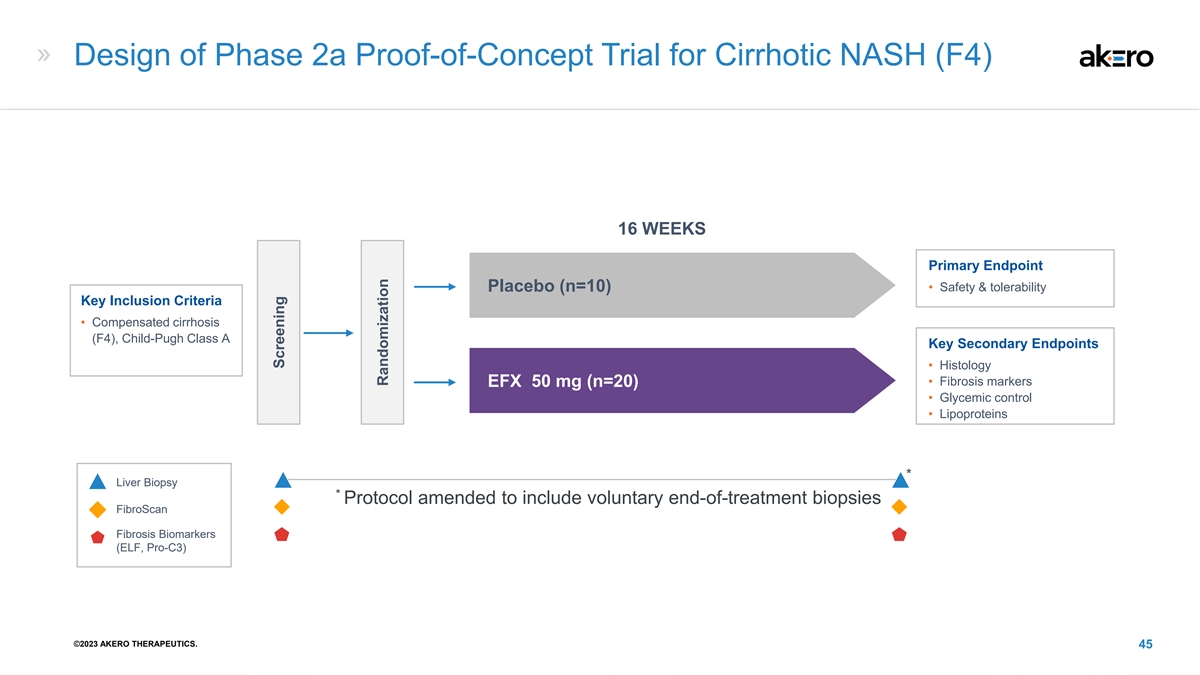
肝硬化 NASH (F4) 2a 期概念验证试验的设计 16 周主要终点 • 安全性和耐受性安慰剂 (n=10) 关键纳入标准 • 补偿性肝硬化 (F4),Child-Pugh A 类关键次要终点 • 组织学 • 纤维化标志物 EFX 50 mg (n=20) • 血糖控制 • 脂蛋白 * 肝活检 * 协议已修订,包括自愿结束治疗活检 FibroScan 纤维化生物标志物(ELF,Pro-C3)©2023 AKERO THERAPEUTICS。45 筛查随机化
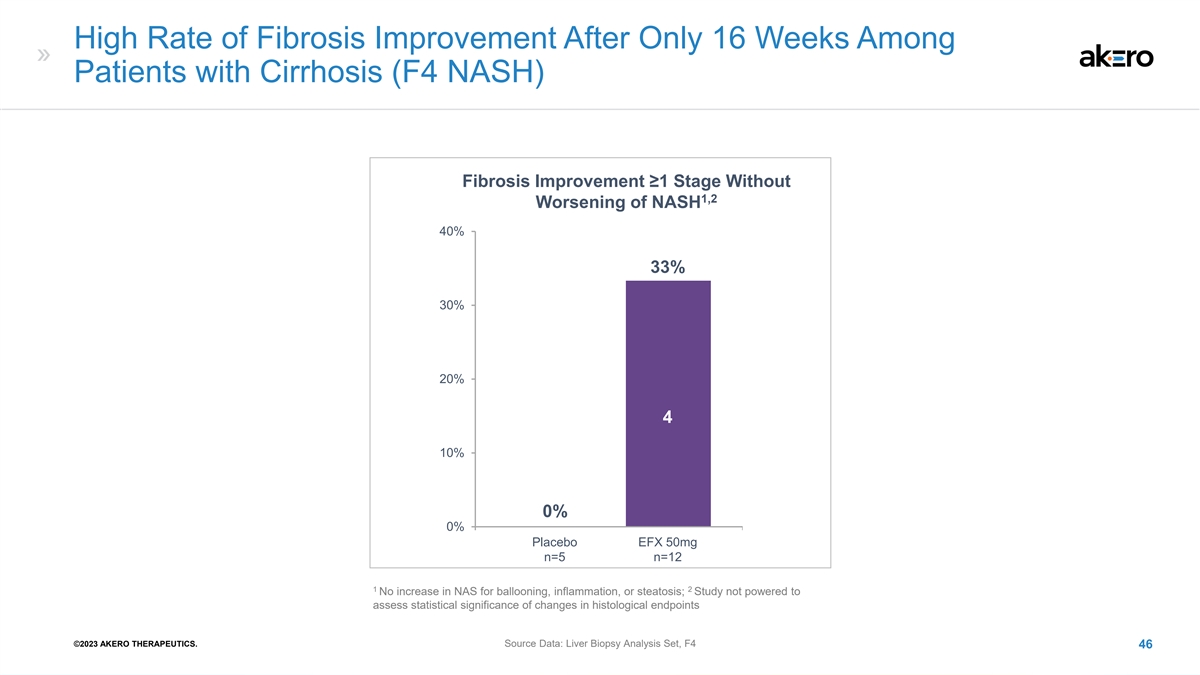
肝硬化 (F4 NASH) 患者 在仅 16 周后纤维化改善率很高(F4 NASH)纤维化改善 ≥1 阶段,无 1,2 NASH 恶化 40% 33% 30% 20% 4 10% 0% 总体安慰剂 EFX 50mg n=5 n=12 1 2 气球膨胀、炎症或脂肪变性的 NAS 没有增加;研究无法评估 组织学终点变化的统计学意义 ©AK2023 ERO THERAPEUT来源数据:肝活检分析集,F4 46
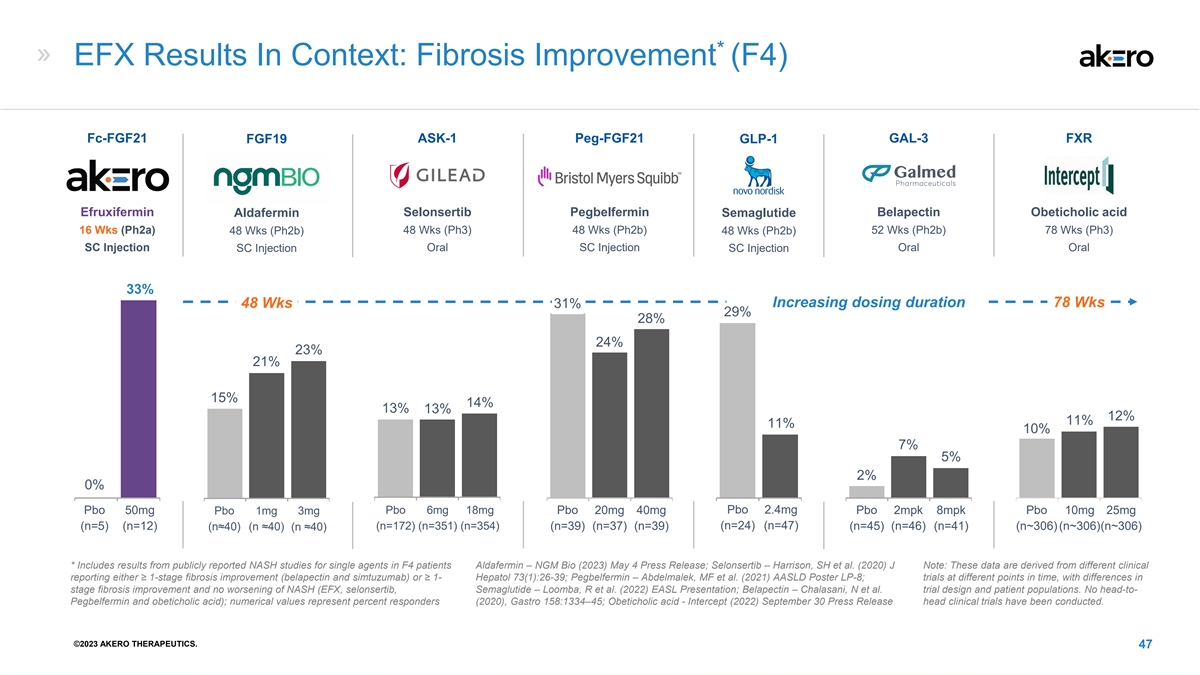
* EFX 在上下文中的结果:纤维化改善 (F4) fc-fgf21 ASK-1 peg-fgf21 GAL-3 FXR FGF19 GLP-1 efruxifermin selonsertib pegbelfermin Belapectin Obeticholic 酸 Aldafermin Semaglutide 16 Wks (ph2a) 48 Wks (ph3b) 48 Wks (ph2b) 52 Wks (ph2b) 78 Wks (ph3) 48 Wks (ph2b) 48 Wks (ph2b) SC 注射口服 SC 注射 口服 SC 注射 33% 增加给药时间 78 Wks 48 Wks 31% 28% 24% 21% 13% 11% 11% 107% 2pbo 50mg Pbo 6mg 18mg Pbo 2.4mg Pbo 2mpk 8mpk Pbo 10mg 25mg Pbo 1mg 3mg (n=5) (n=12) (n▲40) (n ▲40) (n=172) (n=351) (n=354) (n=39) (n=39) (n=24) (n=47) (n=45) (n=46) (n=46) (n~306) (n~306) (n~306) (n ▲40) * 包括公开报道的结果 NASH 对 F4 患者单药的研究 Aldafermin — NGM Bio(2023)5 月 4 日新闻稿;Selonsertib — Harrison,SH 等人(2020)J 注意:这些数据来自不同的临床报告,要么是 ≥ 1 阶段纤维化改善(belapectin 和 simtuzumab),要么≥ 1-Hepatol 73 (1): 26-39;Pegbelfermin — Abdelmalek、MF 等人(2021)AASLD Poster LP-8;不同时间点的试验,在分期纤维化改善方面存在差异,NASH 没有恶化(EFX、selonsertib、Semaglutide — Loomba、R 等 (2022) EASL 演讲;Belapectin — Chalasani,N 等人。试验设计和患者群体。不是 pegbelfermin 和 obeticholic acid);数值代表反应者百分比(2020),Gastro 158:1334 —45;Obeticholic acic- Intercept (2022) 9 月 30 日新闻稿负责人临床试验已经进行。©2023 AKERO THERAPEUTICS。47

在肝硬化患者 (F4 NASH) 中还观察到 NASH 分辨率 1,2 NASH 分辨率在达到 NASH 分辨率的受试者中有 30% 变化 25% EFX 受试者基线 NAS 第 16 周 20% A 7 1 B 3 1 C 6 1 3 10% NASH 降低率 50mg 0% 1 (20%) 7 (58%) 总体 安慰剂 EFX 50mg n=5 n=12 1 小叶炎症的 NAS 分数为 0 或 1,气球膨胀的 2 分为 0 研究无力评估组织学终点的统计学意义 ©2023 AKERO THERAPEUTICS。来源数据:肝活检 分析集,F4 48
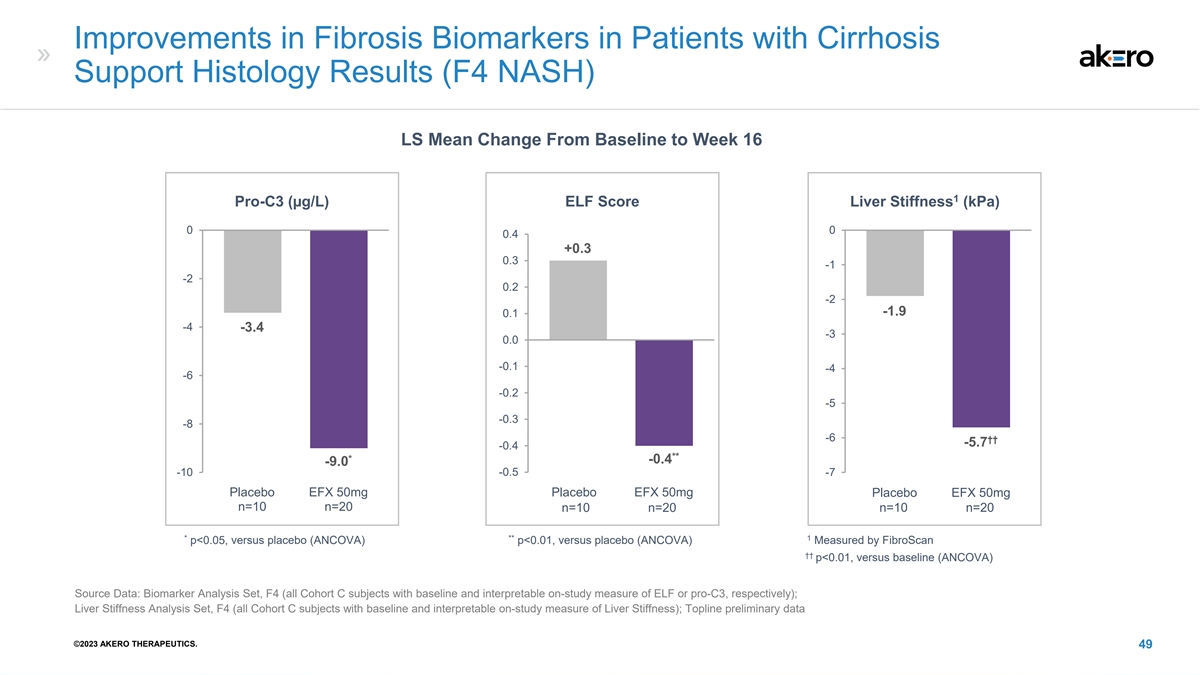
肝硬化患者纤维化生物标志物的改善支持 组织学结果 (F4 NASH) LS 从基线到第 16 周的平均变化 1 Pro-C3 (µg/L) ELF 评分肝硬度 (kPa) 0 0 0.4 +0.3 -2 -2 -2 -1 -4 -4 -4 -2 -4 -2 -4 -2 -6 -0.2 -3 -6 -5.7 -3 -7 -4 -0.3 -6 -5.7 -4 -0.3 -8 †† -5.7 -4 -9.0 -10 -0.5 -7 CFB CFB CFB 安慰剂 EFX 50mg 安慰剂 EFX 50mg 安慰剂 EFX 50mg n=10 n=10 n=20 n=10 n=10 n=20 n=20 * ** 1 p
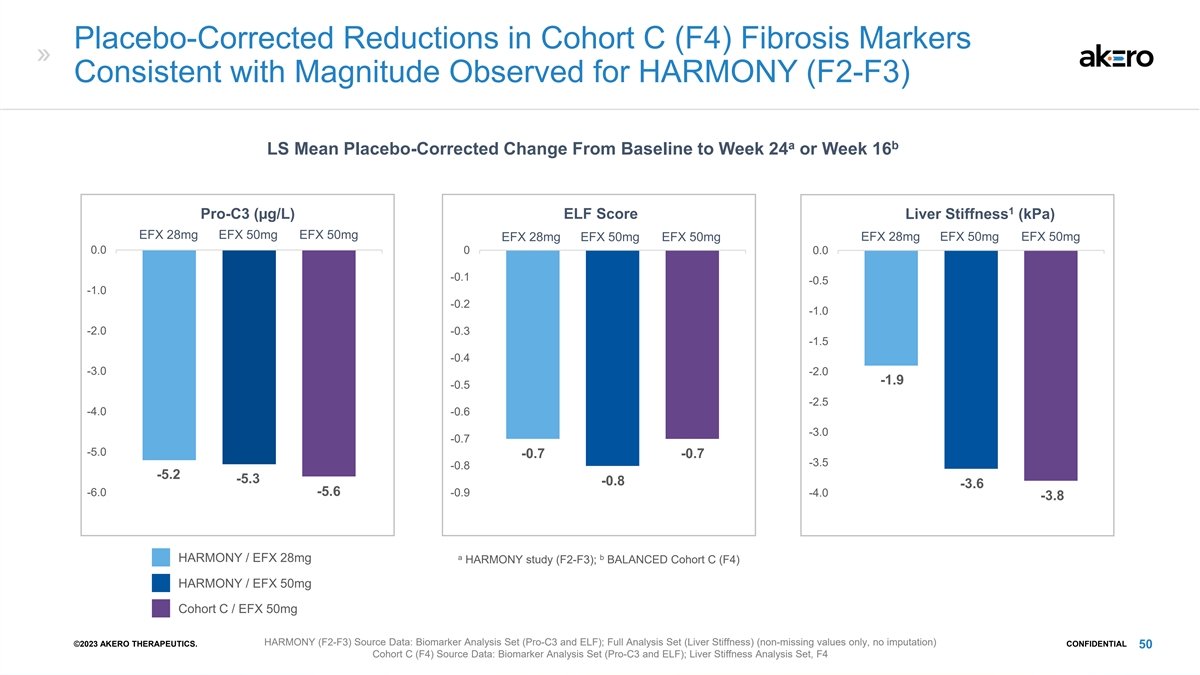
安慰剂校正后的队列 C (F4) 纤维化标志物降低 与 HARMONY (F2-F3) 观察到的幅度一致 a b LS 从基线到第 24 周或第 16 周的平均安慰剂校正后的变化 1 Pro-C3 (µg/L) EFX Score 肝硬度 (kPa) EFX 28mg EFX 50mg EFX 50mg EFX 50mg EFX 50mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 28mg EFX 50mg 0.0 0.0 -0.1 -0.5 -1.0 -0.2 -1.0 -2.0 -0.3 -1.5 -0.4 -2.0 -1.9 -0.5 -2.5 -4.0 -0.7 -5.0 -0.8 -3.6 -6.0 -0.9 -4.0 -3.8 a b HARMONY/EFX 28mg HARMONY 研究 (F2-F3);平衡队列 C (FB) 4)HARMONY /EFX 50mg Cohort C /EFX 50mg HARMONY (F2-F3) 来源数据:生物标志物分析套装(Pro-C3 和 ELF);完整分析套装(肝硬度)(仅限非缺失值,无归因)©2023 AKERO THERAPEUTICS。CONFIDENTIAL 50 Cohort C (F4) 来源数据:生物标志物分析套装(Pro-C3 和 ELF);肝硬度分析集,F4
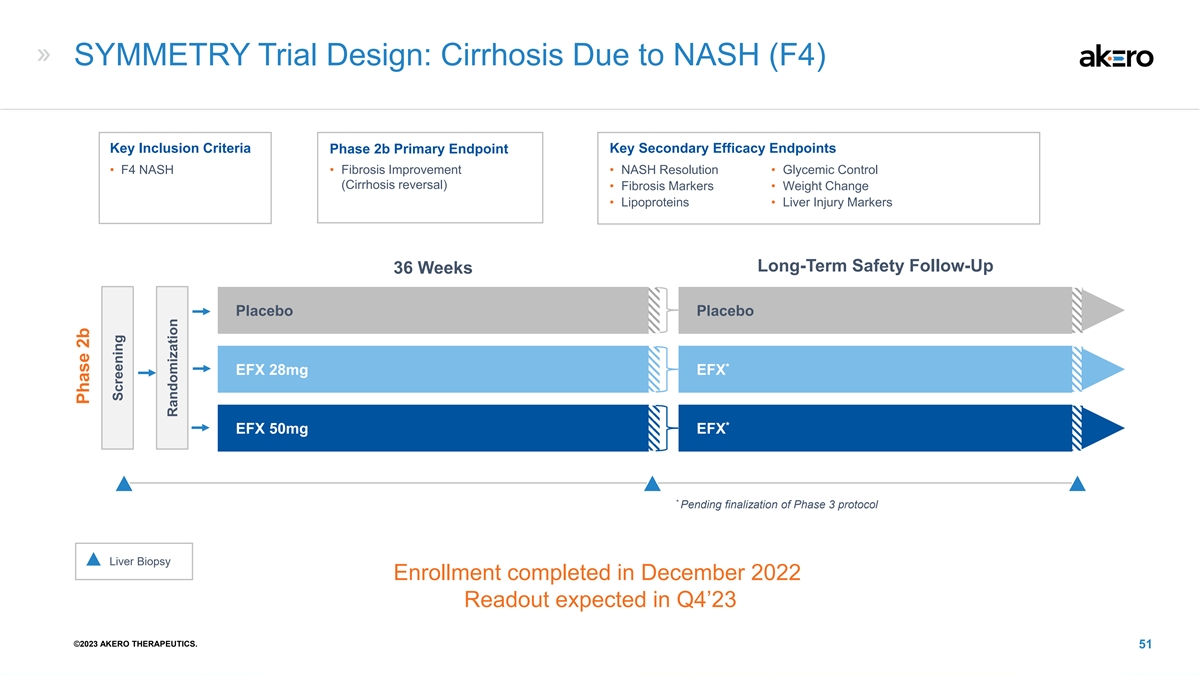
SYMETRY 试验设计:NASH(F4)导致的肝硬化关键包含 标准关键次要疗效终点 2b 期主要终点 • F4 NASH • 纤维化改善 • NASH 解决方案 • 血糖控制(肝硬化逆转)• 纤维化标志物 • 体重变化 • 脂蛋白 • 肝损伤标志物长期安全随访 36 周安慰剂安慰剂* EFX 28mg EFX * EFX 50mg EFX * 在第 3 阶段方案最终确定之前,肝活检注册将于 2022 年 12 月完成,预计在 23 年第 4 季度宣布 ©2023 年第四季度 AKERO THERAPEUTICS。51 2b 阶段筛查随机分组

展望未来
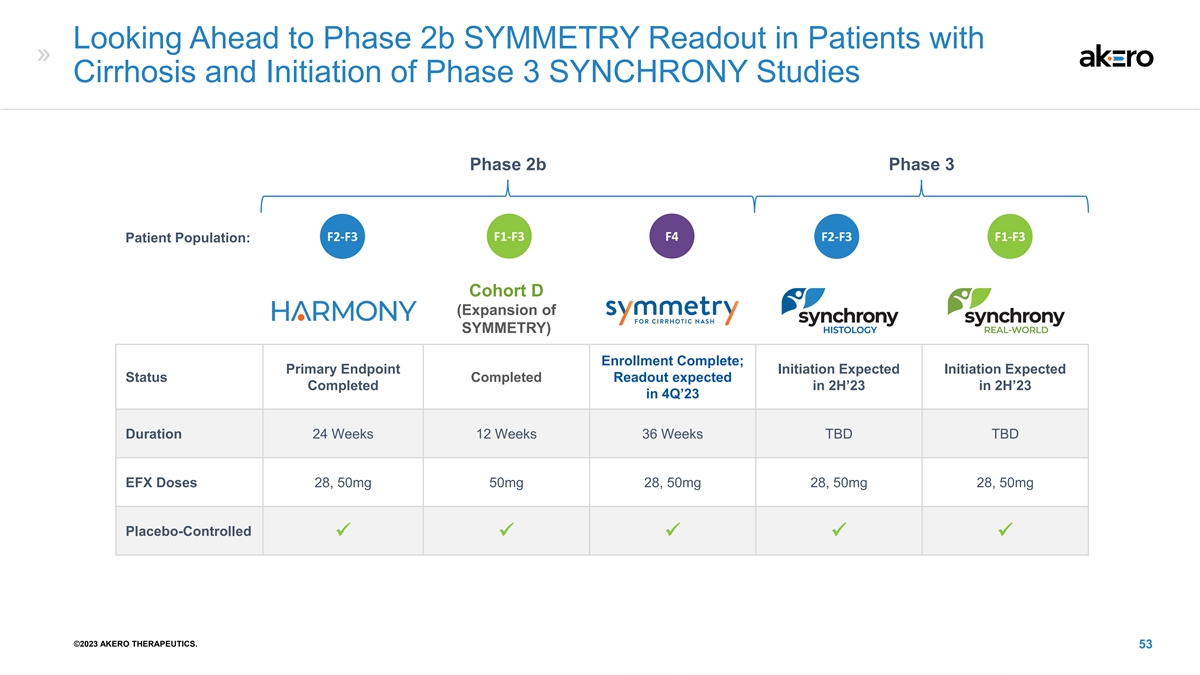
展望肝硬化患者的 2b 期对称读数 和启动 3 期 SYNCHRONY 研究 2b 阶段 3b 阶段 F2-F3 F1-F3 F4 F2-F3 F1-F3 患者群体:队列 D SYNCHRONY Real-HARMONY(扩大组织学世界对称性)注册完成;预计主要终点启动 启动预期状态读取预计于 23 年第 4 季度下半年完成持续时间 24 周第 36 周待定待定 EFX 剂量 28、50mg 50mg 28、50mg 28、50mg 28、50mg 28、50mg 安慰剂对照 üüüü ©2023 AKERO THERAPEUTICS。53

介绍 SYNCHRONY 第 3 阶段计划中的三期平行 随机、安慰剂对照临床试验 • 活检证实 F2-F3 NASH • 非侵入性诊断的 NASH/NAFLD 设计将最终确定如下 • 主要终点:≥ 1 期纤维化 • 主要终点:安全性和 耐受性 SYNCHRONY 2b 结果改善和解决 • 28 和 50mg EFX SYNCHRONY 入组受试者的持续时间和总数 Y 组织学和现实世界试验有待美国食品药品管理局的确认 ©2023 AKERO THERAPEUTICS。54

为第三阶段药物物质 (API) 供应 API 和药物产品/设备 药物产品/设备组合商业规模商业先例第 3 阶段发布可比性显示每周注射 1 mL SC 自行给药,稳定在 2-8°C ©2023 AKERO THERAPEUTICS。 55

备份幻灯片
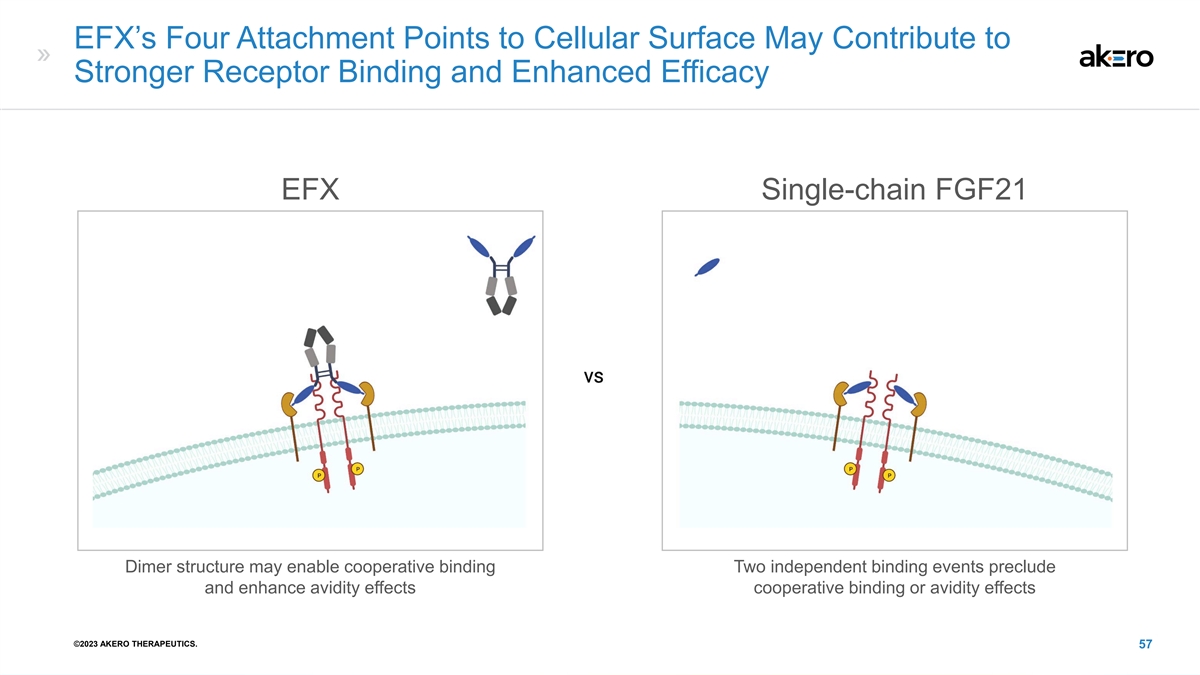
EFX 对细胞表面的四个附着点可能有助于 增强受体结合和提高功效 EFX 单链 FGF21 二聚体结构可能实现合作结合两个独立的结合事件可以排除和增强活性效应合作结合或亲和效应 ©2023 AKERO THERAPEUTICS。57
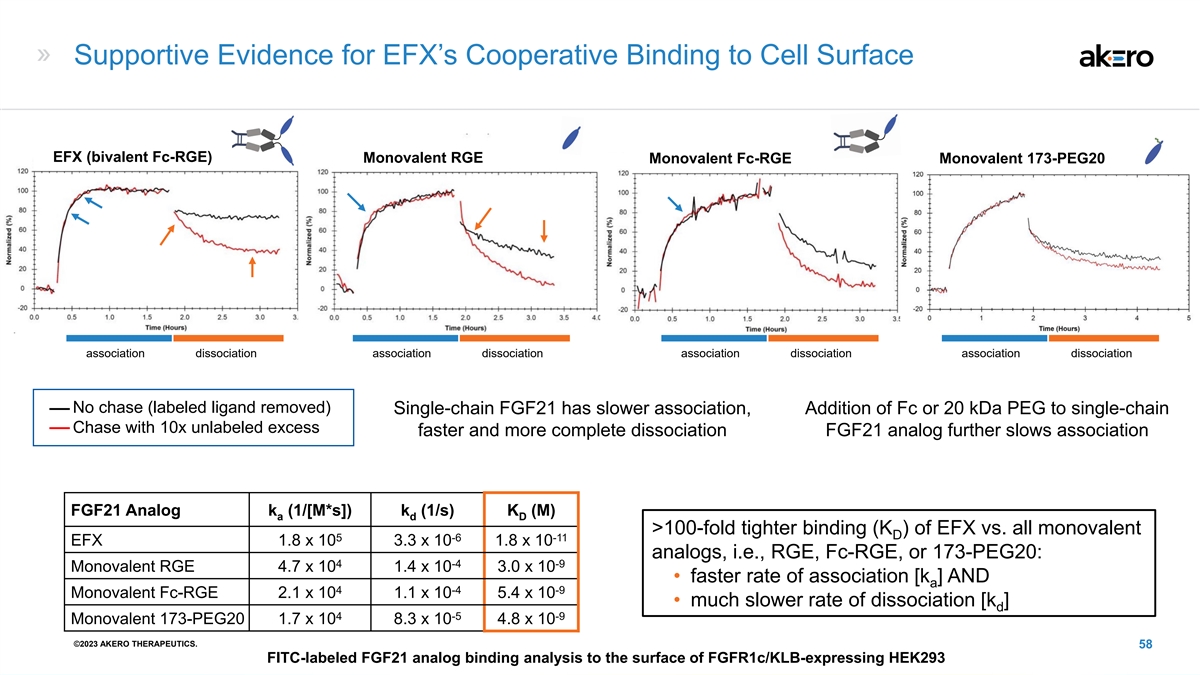
EFX 与细胞表面合作结合的支持证据 EFX(双价 fc-rgE)单价 RGE 单价 Fc-rGE 单价 173-PEG20 关联解离关联解离关联解离无追踪(已移除标记的配体)单链 FGF21 关联较慢 ,向单链 Chase 添加 Fc 或 20 kDa PEG,未标记的过量更快 10 倍,解离更彻底 ation FGF21 模拟进一步减慢了关联速度 FGF21 Analog k (1/[m*s]) k (1/s) K (M) a D >{ br} EFX 的绑定 (K) 与所有单价 D 5 -6 -11 EFX 1.8 x 10 3.3 x 10 1.8 x 10 类似物,即 RGE、fc-rgE 或 173-PEG20:4 -4 -9 单价 RGE 4.7 x 10 x 10 1.4 x 10 3.0 x 10 • 关联速度更快 [k ]还有 4 -4 -9 Monovalent fc-rge 2.1 x 10 1.1 x 10 5.4 x 10 • 解离速度要慢得多 [k ]d 4 -5 -9 Monovalent 173-PEG20 1.7 x 10 8.3 x 10 4.8 x 10 ©2023 AKERO THERAPEUTICS。58 带有 FITC 标签的 FGF21 对表达 fgfr1c/KLB 表面的模拟结合分析 HEK293

与 “半衰期延长剂” 融合的单个 FGF21 链类似物 的效力比带有两条 FGF21 链的 EFX 或 “未经修改的 FGF21” 双价单价单价 fc-rge RGE fc-rge 173-PEG20 (EFX) 20 kDa PEG 半衰期延长 FC-fusion minus n-terminus n-terminus fgf21-受体 20 kFc-rge (EFX) 20 kDa PEG 半衰期延长 fc-fusion minus n-terminus fgf21-受体 20 kFc-fusion DA PEG 没有将残留物 173 处的阻力与 Igg1 Fc 与 igg1 Fc mol 联系起来。FGF21/2 1 1 1 mol.模拟物 K(亲和力)D .018 nM 3 nM 5.4 nM 在活细胞上 EC(效力),50 细胞基 0.24 nM 0.52 nM 7.93 nM 16.2 nM 生物测定 • 单价 fc-rGE 的效力较低(更高 EC),是部分激动剂(折叠诱导较小)• 添加氟化物可能产生立体阻力效应 • 添加氟化物可能产生立体阻力效应 • 再将 FGF21 (RGE) 转换为单价 fc-rgE,形成二价 fc-rgE (EFX) 可恢复完全的激动作用并且更有效(更低 EC)50 • 足以克服 Fc 的立体阻力 • 在残留物 173 处添加 20 kDa PEG 似乎可以保持饱满激动作用但与 的效力较低(EC 较高)有关 50 ©2023 AKERO THERAPEUTICS。59
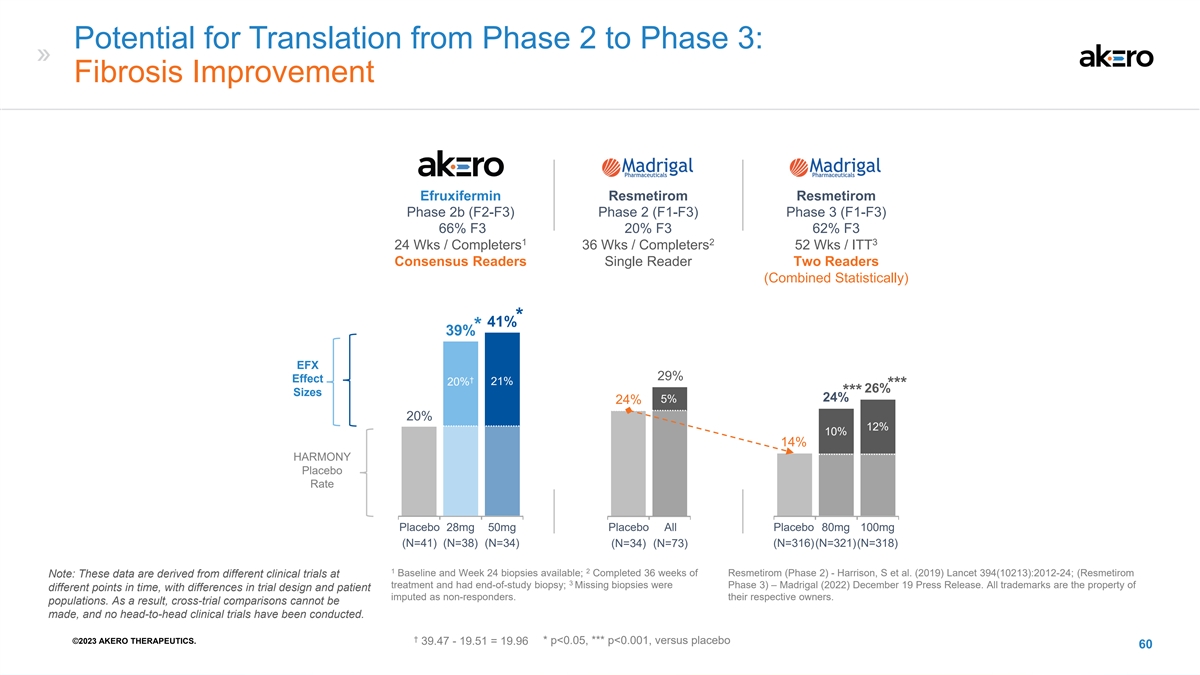
从第 2 阶段转化为第 3 阶段的可能性:纤维化改善 Akero Madrigal Madrigal efruxifermin resmetirom 2b 期 (F2-F3) 2 (F1-F3) 第 3 阶段 (F1-F3) 66% F3 20% F3 1 2 3 24 Wks /Completers 36 Wks /ITT Consensale Readers Single Readers 2b Statistiom(Combined 同样) * 41% * 39% EFX 29% 效果† 21% 20% *** 26% 尺寸*** 24% 24% 20% 12% 10% HARMONY 安慰剂 28mg 安慰剂 50mg 安慰剂 80mg 100mg (N=38) (N=34) (N=34) (N=36) (N=316) (N=316) (N=321) (N=318) 1 2 Baseline 和 Week有 24 次活检;已完成 36 周的 Resmetirom(第 2 阶段)——Harrison,S 等人(2019)Lancet 394 (10213): 2012-24;(Resmetirom 注意:这些数据来自于 3 次治疗的不同临床试验,已进行研究结束活检;缺失的 活检处于第 3 阶段)— Madrigal (2022) 12 月 19 日新闻稿。所有商标均为不同时间点的财产,试验设计不同,患者被视为无反应者。它们各自的所有者。人群。 的结果是,无法进行交叉试验比较,也没有进行过正面交叉临床试验。† ©2023 AKERO THERAPEUTICS。39.47-19.51 = 19.96 * p
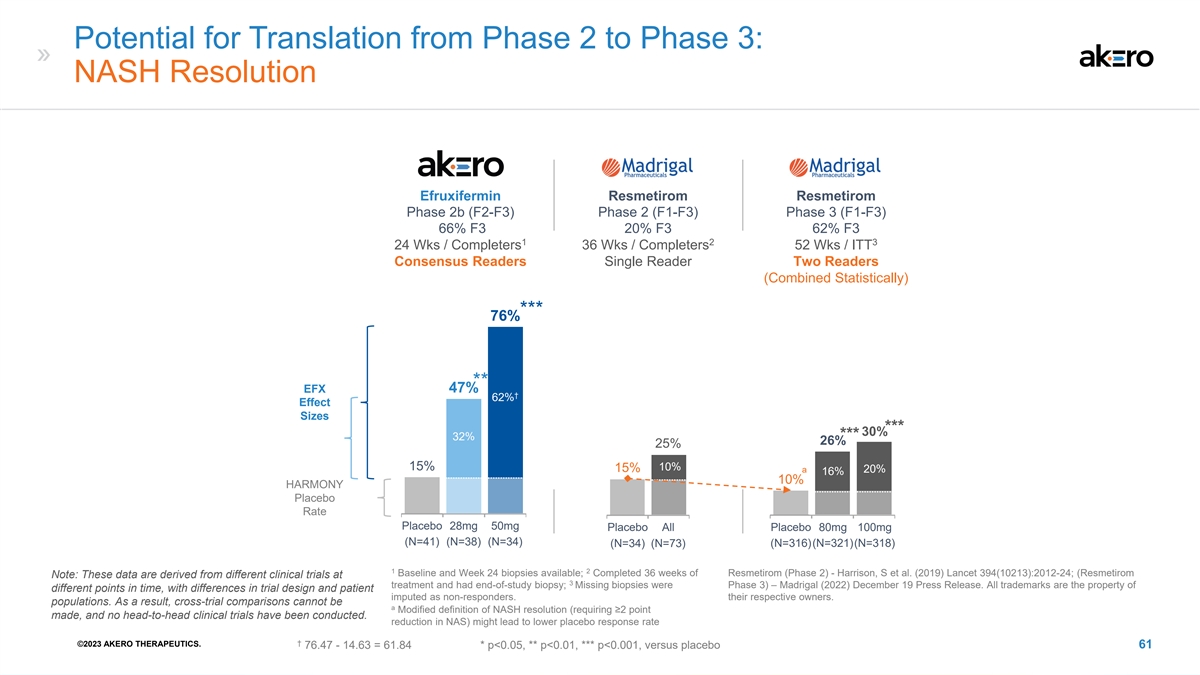
从第 2 阶段过渡到第 3 阶段的可能性:NASH Resolution Akero Madrigal Madrigal efruxifermin resmetirom 第 2b 阶段 (F2-F3) 第 2 阶段 (F1-F3) 第 3 阶段 (F1-F3) 66% F3 20% F3 1 2 3 24 Wks /Completers 36 Wks /ITT Consensaly Readers Single Readers 2b Statistiom(Combined 确实如此) *** 76% ** EFX 47% † 62% 效果大小 *** 32% 26% 25% 15% 15% a 20% HARMONY 安慰剂Rate 安慰剂 28mg 安慰剂 50mg 安慰剂 80mg (N=41) (N=34) (N=34) (N=36) (N=36) (N=316) (N=312) (N=318) 1 2 Baseline 和周有 24 次活检;已完成 36 周的 Resmetirom(第 2 阶段)——Harrison,S 等人(2019)Lancet 394 (10213): 2012-24;(Resmetirom 注意:这些数据来自于 3 次治疗的不同临床试验,已进行研究结束活检; 缺失的活检处于第 3 阶段)— Madrigal (2022) 12 月 19 日新闻稿。所有商标均为不同时间点的财产,试验设计不同,患者被视为无反应者。它们各自的所有者。 人口。因此,交叉试验比较不可能是 NASH 分辨率的修改定义(需要提出 ≥2 分,而且没有进行过正面交叉临床试验。NAS 降低)可能会导致安慰剂反应率降低 † ©2023 AKERO THERAPEUTICS。76.47-14.63 = 61.84 * p
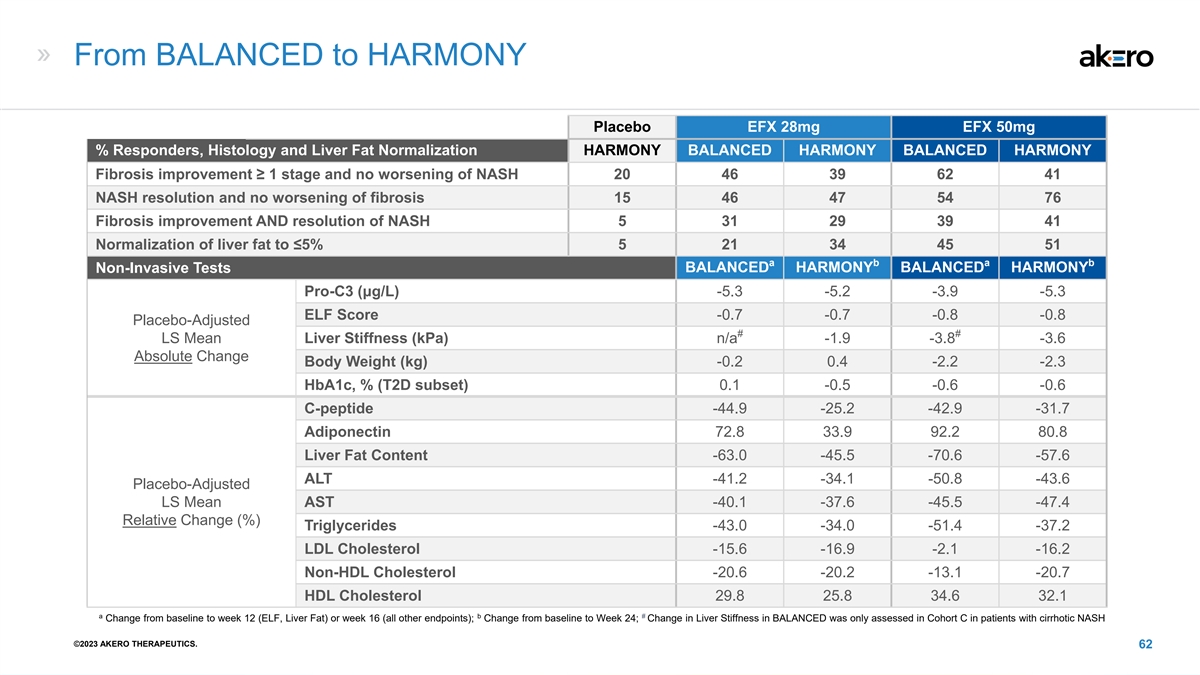
从 BALANCED 到 HARMONY EFX 28mg EFX 50mg% 应答者、组织学和肝脂正常化 HARMONY BALANCED HARMONY 纤维化改善 ≥ 1 阶段 NASH 没有恶化 20 46 39 62 41 NASH 分辨率且纤维化无恶化 15 46 47 54 76 纤维化改善 和 NASH 的分辨率 5 31 29 39 41 肝脂肪正常化至 ≤ 5% 5 21 45 45 51 a a a b BALANCED HARMONY BALANCE HARMONY 非侵入性测试 Pro-C3 (μg/L) -5.3 -5.2 -3.9 -5.3 ELF 分数 -0.7 -0.8 -0.8 安慰剂调整后 # LS 平均值 肝硬度(kPa) n/a -1.9 -3.8 -3.6 绝对变化体重 (kg) -0.2 0.4 -2.2 -2.3 Hba1c,%(T2D 子集)0.1 -0.5 -0.6 -0.6 c-peptidepe -44.9 -42.9 -31.7 adiponectin 72.8 33.9 92.2 80.8 肝脏脂肪含量 -63.0 -45.5 -70.6 -57.6 ALT -41.2 -34.1 -44.1 50.8 -43.6 安慰剂调整后的 LS 平均值 AST -40.1 -37.6 -45.5 -47.4 相对变化 (%) 甘油三酯 -43.0 -34.0 -51.4 -37.2 低密度脂蛋白胆固醇 -15.6 -16.9 -2.1 -20.7 HDL 胆固醇 29.8 25.8 34.6 32.1 a b # 从基线到第 12 周的变化 (ELF,肝脏脂肪)或第 16 周(所有其他)终点);从基线到第 24 周的变化;仅在队列 C 中评估了肝硬化 NASH 患者的平衡肝硬度变化 ©2023 AKERO THERAPEUTICS。62

EFX EFX 50mg EFX 50mg EFX 50mg EFX 50mg EFX 50mg 1 2 3 4 平衡队列 C HARMONY 队列 D 端点非侵入性测试 F1-F3 F4 F2-F3 F1-F3 16 周 24 周 Pro-C3 (μg/L) -4.7 -9.5 -5.2 ELF 分数 -0.7 -0.7 -0.7 -0.6 LS 平均肝硬度 (kPa)) NT -5.7 -4.3 -3.0 绝对变化体重 (kg) -1.7 -2.2 -2.9 -1.2 Hba1c,%(仅限 T2D 患者)-0.6 -0.5 -0.5 胰岛素 -16 -48 NT -26 -20 -23 -22 脂联素 +80 +95 +91 +129 肝脂含量 -71 NT -65 ALT -51 -22-47 -24 AST -44 -26 -49 -17 LS 平均相对变化 (%) 甘油三酯 -48 -40 -29 -42 非高密度脂蛋白胆固醇 -15 -14 -13 -19 载脂蛋白 B -12 -11 -3.9 -21 低密度脂蛋白胆固醇 -2.3 -8 -8 -8 HDL 胆固醇 +39 +33 +30 +38 1 2 3 4 从基线 (CFB) 到第 12 周的变化 (ELF、Liver Fat)或第 16 周(所有其他终点);CFB 到第 16 周;CFB 到第 24 周;CFB 到第 12 周 NT = 未测试注意:这些数据来自不同的临床试验,患者群体、研究持续时间、 试验设计、基线人口统计和安慰剂发病率存在差异。©2023 AKERO治疗方法。63

AKERO THERAPEUTICS 601 Gateway Boulevard NASDAQ:AKRO Suite 350 South