附录 99.1

UniQure公布2023年第一季度财务 业绩
并重点介绍公司最近的进展
~ 美国亨廷顿舞蹈病I/II期试验 的临床更新预计将于2023年第二季度公布 ~
~ 在启动两项针对难治性颞叶癫痫的 AMT-260 和 SOD1-ALS 中的 AMT-162 的 新的 I/II 期临床研究方面继续取得进展 ~
马萨诸塞州列克星敦和荷兰阿姆斯特丹, 2023 年 5 月 9 日 — 为有严重医疗需求的 患者推进变革性疗法的领先基因疗法公司 Uniqure N.V.(纳斯达克股票代码:QURE)今天公布了其 2023 年第一季度的财务业绩,并重点介绍了其业务的最新进展 。
uniQure首席执行官马特·卡普斯塔表示:“随着我们在所有企业目标方面取得进展,从历史性的 2022年到2023年第一季度,UniQure继续保持其势头。”“我们在2023年的优先事项包括供应CSL推出的HEMGENIX®, 推进 AMT-130 在亨廷顿舞蹈病中的发展,为启动两项关于 SOD1-ALS 和难治性颞叶癫痫的新临床研究做准备。我们期待在 2023 年第二季度晚些时候提供我们正在进行的 AMT-130 美国 I/II 期研究的临床最新情况,这是亨廷顿舞蹈病临床开发中的第一个 AAV 基因疗法。 本次更新将有助于进一步指导我们 AMT-130 的临床开发,因为我们正在努力为这种毁灭性神经退行性疾病的患者提供一种改善疾病的治疗方法 选项。”
最近更新
| ● | HEMGENIX 商业上线® (etranacogene dezaparvovec-drbl)用于治疗美国和欧盟的乙型血友病 |
| ● | 2023 年 2 月,欧盟委员会 批准了 HEMGENIX 的有条件上市许可®,这是第一种也是唯一一种用于治疗 18 岁及以上患有重度和中度重度血友病 B 的成人 的一次性基因疗法。这是在 HEMGENIX 于 2022 年 11 月获得美国上市批准 之后发布的®在患有B型血友病的成年人中 |
| ● | CSL Behring 向 HEMGENIX 授予了全球独家版权 ®2021 年 5 月来自 UniQure,并全权负责其商业化。继 HEMGENIX 首次商业销售 之后®在美国,UniQure有权从CSL Behring获得1亿美元的付款。 如果在2023年7月2日之前在五个主要的 欧洲国家之一首次销售产品,公司还有资格从CSL Behring获得7500万美元的付款。 |
| ● | 推进 AMT-130 用于治疗亨廷顿氏病 |
| ● | 该公司计划在2023年第二季度 公布来自其26名患者、随机、对照和双盲的美国I/II期临床研究的一到两年 的随访数据。 预计数据更新将包括高剂量和低剂量队列的安全性和耐受性、生物标志物、成像和功能 数据。 |
| ● | 高剂量队列 中的六名对照患者中有三名现已交叉接受治疗。这三名患者中有两人接受了更高剂量的 AMT-130。如果高剂量 队列中的对照患者在解盲后符合研究的资格标准,则可以选择交叉治疗。该公司预计 将在2023年第二季度末之前完成任何额外的交叉程序。 |
| ● | 所有六名患者均已加入低剂量 队列的 AMT-130 开放标签 I/II 期临床试验。该公司继续招收九名患者中的第二个高剂量队列 。高剂量队列的患者注册预计将于2023年中期完成,预计将在2023年下半年来自低剂量队列 的为期一年的临床数据。 |
| ● | 第三组患者 is 预计将于2023年下半年开始在美国注册,以探索旨在提高手术效率的某些手术适应措施的可行性。 |
| ● | 扩大 在研新药 (IND) 应用渠道并取得进展 |
| ● | 美国基因与细胞疗法学会 (ASGCT) 2023— 该公司将在2023年5月16日至20日在加利福尼亚州洛杉矶举行的ASGCT年度会议上大放异彩。 十二份摘要已获准发表,包括两份口头报告,这些摘要将重点介绍公司在扩大 研究渠道方面的创新以及在 AAV 基因疗法制造方面的进展。 |
| ● | AMT-162 用于治疗 SOD1 肌萎缩性 侧索硬化症 (ALS)-2023 年 1 月,公司与 Apic Bio 签订了 ABP-102(现为 AMT-162)的全球许可协议,用于治疗超氧化物歧化酶 1 (SOD1) 肌萎缩性侧索硬化症 (ALS),这是一种罕见的 ALS 遗传形式。该公司 预计将在2023年下半年启动 AMT-162 的 I/II 期临床研究。 |
| ● | AMT-260 用于治疗难治性颞叶 叶癫痫 (rtLE)— 在 2022 年第三季度,该公司启动了一项针对非人类灵长类动物体内的 AMT-260 的 GLP 毒理学研究。 该公司预计将于 2023 年下半年提交在研新药 (IND) 申请并启动 AMT-260 的 I/II 期临床研究。 |
| ● | AMT-191 用于治疗 Fabry 病 — 2022 年第三季度,该公司启动了一项针对非人类灵长类动物体内的 AMT-191 的 GLP 毒理学研究,预计 将支持 2023 年提交的临床试验报告。 |
| ● | 强劲的现金状况可推进公司的 计划 |
| ● | 截至2023年3月31日, 公司的现金和现金等价物以及投资证券为3.153亿美元。该公司预计,假设美国 美国实现了1亿美元的首次商业销售里程碑,则现金和现金等价物以及投资 证券将为运营提供资金;如果HEMGENIX实现7,500万美元的首次商业销售里程碑,则将进入2025年上半年® 五个合同规定的欧洲国家中的任何一个都是在2023年7月2日之前实现的。 |
财务要闻
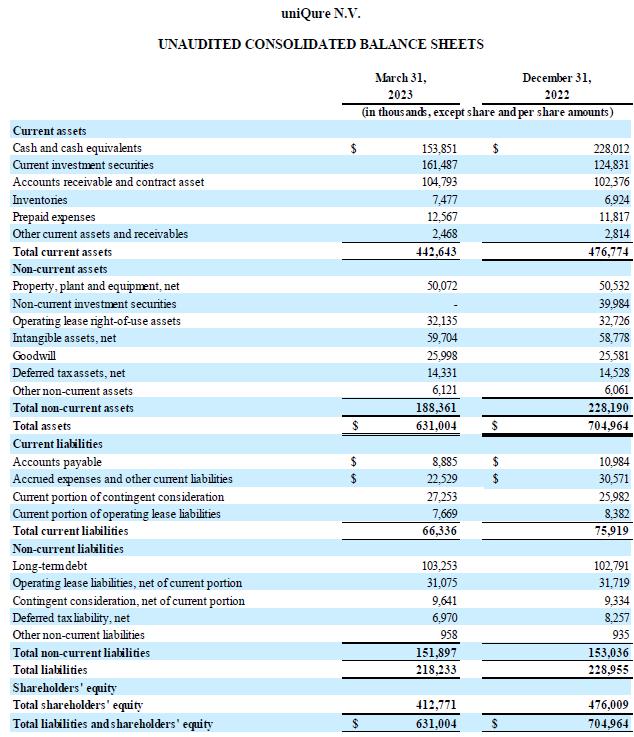
现金状况:截至2023年3月31日, 公司持有的现金及现金等价物和投资证券为3.153亿美元,而截至2022年12月31日为3.928亿美元。
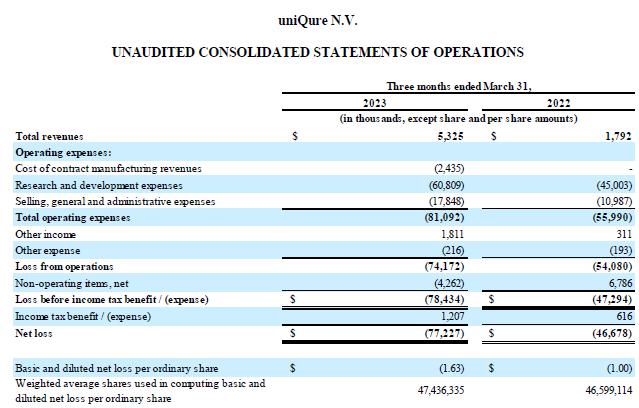
收入:截至2023年3月31日的三个月 的收入为530万美元,而2022年同期为180万美元。增长的主要原因是 本期确认的与合同制造相关的合同制造收入为490万美元 HEMGENIX® CSL Behring的合作收入减少了140万美元,部分抵消了这一点。
研发费用:截至2023年3月31日的三个月,研发费用 为6,080万美元,而2022年同期为4500万美元。 的增长主要与向Apic Bio支付的1,000万美元款项有关,用于收购 ABP-102(现为 AMT-162),颞叶癫痫计划(AMT-260)的临床前开发 ,支持 公司增长的人事和承包商相关开支的增加,以及EMA批准 HEMGENIX 后应向许可方支付的合同款项®.
销售和收购费用:截至2023年3月31日的三个月,销售、一般和 管理费用为1,780万美元,而2022年同期 为1,100万美元。增长主要与支持公司增长的人事和承包商相关费用增加有关 ,以及本期产生的专业费用的增加,这主要是由与 Apic Bio交易相关的专业费用增加所推动的。
其他非营业项目,净额:
截至2023年3月31日的三个月,其他非营业项目净支出为430万美元,而2022年同期的净收入为680万美元。其他非营业项目净额减少 主要与确认的外币亏损有关,本期净额为240万美元 ,而确认的外汇收益为前一时期净额860万美元。
净亏损:
截至2023年3月31日的三个月中, 的净亏损为7,720万美元,合每股普通股基本和摊薄亏损1.63美元,而 2022 年同期的净亏损为4,670万美元,相当于每股普通股基本和摊薄亏损1.00美元。
关于 HEMGENIX®
HEMGENIX® 是一种基因疗法, 使人体能够持续产生因子 IX,即 B 型血友病 缺陷蛋白,从而降低符合条件的 B 型血友病患者的异常出血率。它使用 AAV5,一种非传染性病毒载体,称为腺相关病毒 (AAV)。AAV5 载体 将因子 IX(fix-padua)的 Padua 基因变异携带到肝脏中的靶细胞,生成 IX 因子蛋白,其活性比正常细胞高 5x-8x 。这些遗传指令保留在靶细胞中,但通常不会成为一个人 自身DNA的一部分。一旦发出,新的遗传指令将允许细胞机制产生稳定水平的因子IX。
HEMGENIX® 是 CSL Behring 的注册商标 。
关于 Uniqure
UniQure正在兑现基因 疗法的承诺——具有潜在治愈效果的单一疗法。我们的乙型血友病基因疗法最近获得批准——这是一项基于十多年的研究和临床开发的历史性成就——代表着 基因组医学领域的一个重要里程碑,为血友病患者开辟了一种新的治疗方法。我们现在正在利用我们的模块化 和经过验证的技术平台来推进一系列专有基因疗法,用于治疗亨廷顿氏病 病、难治性颞叶癫痫、ALS、Fabry 病和其他严重疾病的患者。www.uniqure.com
UniQure 前瞻性陈述
本新闻稿包含前瞻性 声明。除历史事实陈述以外的所有陈述都是前瞻性陈述,通常由术语 表示,例如 “预期”、“相信”、“可以”、“建立”、“估计”、“期望”、“目标”、“打算”、“展望”、“可能”、“预测”、“项目”、“寻求”、“应该”,“将”、“将” 和类似的表达方式。前瞻性 陈述基于管理层的信念和假设,以及管理层仅在本新闻稿 发布之日可用的信息。这些前瞻性陈述包括但不限于 HEMGENIX 的商业化 是否会持续取得进展®,关于我们针对亨廷顿氏病 病的 AMT-130 临床试验中的第三组患者是否将于 2023 年下半年开始在美国入组、公司是否会在 2023 年第二季度公布美国 AMT-130 I/II 期临床研究的一到两年的随访 数据、这些数据是否有助于进一步指导我们 正在进行的 AMT-130 临床开发、临床数据是否来自低收入国家的声明 AMT-130 的剂量队列预计将于 2023 年下半年公布,该公司是否会在 2023 年提交法布里病的研究性新药申请,公司 是否会在 2023 年下半年启动用于治疗 ALS 的 AMT-162 的 I/II 期临床研究,以及公司是否会在 2023 年下半年 提交研究性新药申请或启动 rtLE 的 AMT-260 的 I/II 期临床研究。 公司的实际业绩可能与这些前瞻性陈述中的预期存在重大差异,原因有很多, 包括但不限于与监管部门批准和HEMGENIX商业启动相关的风险®,我们的亨廷顿舞蹈病临床 试验,金融和地缘政治事件对我们公司以及整个经济和健康 护理系统的影响,我们与CSL Behring的商业化和许可协议,我们的临床开发活动,临床结果,合作 安排,监管监督,产品商业化和知识产权索赔,以及公司 “风险因素” 标题下描述的风险、不确定性和 其他因素的定期证券申报,包括其年度 报告在2023年2月27日提交的10-K表格和2023年5月9日提交的10-Q表季度报告上。鉴于这些风险、 的不确定性和其他因素,您不应过分依赖这些前瞻性陈述,即使将来有新的信息,公司也没有义务 更新这些前瞻性陈述。
| Uniqure 联系人: | ||
| 对于投资者: | 对于媒体: | |
| 玛丽亚·E·坎托 | 基娅拉·鲁索 | 汤姆·马龙 |
| 直接:339-970-7536 | 直播:617-306-9137 | 直播:339-970-7558 |
| 手机:617-680-9452 | 手机:617-306-9137 | 手机:339-223-8541 |
| m.cantor@uniQure.com | c.russo@uniQure.com | t.malone@uniQure.com |