目录表
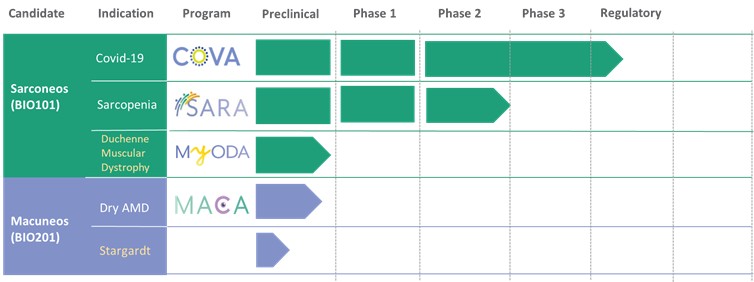
我们的临床渠道
我们正在开发一系列计划,目标是生物弹性途径,以减缓与衰老相关的退化过程,并改善与年龄相关疾病患者的功能结果。我们目前正在开发的候选药物如下所示。
我们的战略
我们专注于开发治疗方法,以改善患有年龄相关疾病的患者的功能结局,包括新冠肺炎患者的严重呼吸衰竭。我们的目标是将BiPhytis打造成一家领先的生物技术公司,专注于以生物弹性途径为目标,减缓与年龄相关的疾病进展相关的退化过程,以改善数百万治疗选择有限或没有治疗选择的患者的生活。我们目前计划开发我们的候选药物,然后通过监管批准和商业化为进一步的临床开发寻求许可和/或合作机会。为了实现我们的目标,我们正在实施以下战略:
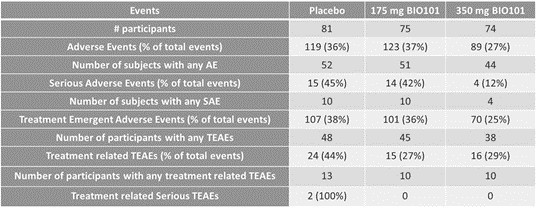
| ● | 在法国、巴西和其他选定国家获得EAP,以及针对有呼吸衰竭风险的新冠肺炎患者获得欧盟(US)和Sarconeos有条件批准(EU)(BIO101)。我们于2022年4月在住院的新冠肺炎严重呼吸道症状患者中完成了CoVA 2/3期研究的招募,并于2023年2月报告了最终分析。这项研究达到了其预先定义的主要终点,表明Sarconeos(BIO101)和安慰剂在第28天出现呼吸衰竭或过早死亡的患者比例在统计学上存在显著差异,代表着风险相对降低44%(p=0.043,Cochran-Mantel-Haenszel检验)。基于这些结果,我们于2023年3月在法国启动了EAP审查程序。我们还计划在巴西和其他选定的国家申请EAP,以及在美国申请EUA,并在欧盟有条件地批准。 |
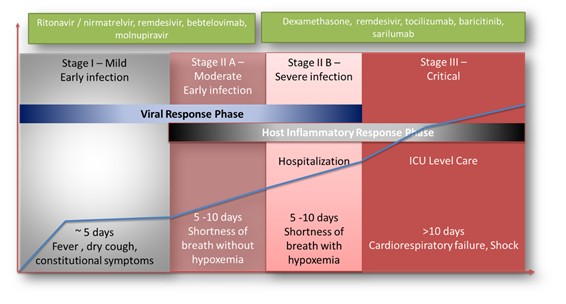
| ● | 展示Sarconeos(BIO101)对石棺减少症的疗效。我们的资源和业务努力主要集中在推动Sarconeos(BIO101)的临床开发,从治疗神经肌肉疾病入手,最初的重点是石棺减少症。我们的Sara-INT 2b期临床试验的背线数据于2021年10月公布。由于大流行对患者群体的影响,只有45%的研究对象能够完成具有治疗结束疗效评估的研究,研究没有足够的能力来观察假设的效果大小,并且没有满足主要和次要终点。在整个2022年,我们与欧洲(EMA)和美国(FDA)的监管机构进行了广泛的互动,以确定该适应症的3期临床试验的设计,同时与潜在的合作伙伴进行讨论,作为这一开发过程的一部分。 |
| ● | 启动DMD中Sarconeos(BIO101)的临床开发。我们的努力还集中在利用我们的知识和Sarconeos(BIO101)在石棺减少症和新冠肺炎中的开发,以开始和推进Sarconeos(BIO101)的临床开发,用于治疗具有呼吸恶化迹象的非动态DMD患者,独立于基因突变和跨病谱。我们已经收到了来自美国FDA的IND“可以继续”的信件和比利时FAMHP的CTA批准。在fda的“可能会继续”的信中,fda指出,它对这项研究的设计有很大的担忧,而且这项研究的结果,最初的设计是为了招募门诊和非门诊患者,并通过 |
56