附录 99.1
Adverum Biotechnologies公布2022年第四季度和全年财务业绩,并提供第二阶段LUNA试验最新情况
-预计将在2023年下半年全面招收LUNA试验-
-LUNA 14 周数据,包括 2023 年第三季度预计的初始 aflibercept 水平-
-LUNA的初步疗效和安全数据预计将在2023年第四季度公布-
-通往2025年的现金跑道-
加利福尼亚州雷德伍德城,2023年3月30日——Adverum Biotechnologies, Inc.(纳斯达克股票代码:ADVM)是一家临床阶段的公司,旨在将基因疗法确立为高度流行的眼部疾病的新护理标准,今天公布了截至2022年12月31日的第四季度和全年财务业绩,并提供了正在进行的评估ixoberogene soroparvovec(ixo-vevec)的2期LUNA试验的最新情况 c,以前称为 ADVM-022),用于治疗湿性年龄相关性黄斑变性(湿性 AMD)。
Adverum Biotechnologies总裁兼首席执行官洛朗·菲舍尔医学博士表示:“我们的2期LUNA试验仍在继续报名,我们对研究人员的热情以及迄今为止接受该试验筛查的参与者人数的进展感到满意。”“我们预计将在2023年下半年完成LUNA研究的注册,并正在与欧洲卫生当局接触,预计除美国临床试验场所外,还将在欧洲招收LUNA受试者。我们还计划在2023年第三季度为LUNA研究的一部分参与者提供为期14周的临时数据集,包括aflibercept蛋白水平,并在2023年第四季度提供初步的疗效和安全性数据。”
“光学延伸受试者单次玻璃体内(IVT)注射ixo-vec后,2x10^11 vg/eye剂量超过两年,其长期疗效和安全性非常显著。我很高兴能将我的第一个受试者报名参加第二阶段 LUNA 试验。Adverum科学顾问委员会成员Sierra Eye Associates管理合伙人兼临床研究主管Arshad M. Khanani医学博士说,正在评估2x10^11和6x10^10剂量的ixo-vec剂量,增强皮质类固醇的预防作用,因此受试者可以受益于单次IXO-VEC注射的功效,同时最大限度地降低炎症风险。也是第二期LUNA试验的首席研究员。
近期亮点
•评估湿性AMD受试者ixo-vec的2期LUNA试验仍在继续进行中。最多72名参与者将被平均随机分配两个剂量,即2x10^11 (2E11) vg/eye 剂量和一个新的、更低的 6x10^10 (6E10) vg/eye 剂量。将研究四种预防性皮质类固醇治疗方案,涵盖非临床研究和第一期OPTIC研究中观察到的免疫原性峰值时期。正在评估的具体方案包括22周的局部用二氟泼尼酯(Durezol®)的缩小疗法、单次IVT地塞米松(Ozurdex®)的给药以及两者组合
无论是局部使用Durezol® 还是IVT Ozurdex®,口服泼尼松的递减疗程长达 10 周,目的是建立一种预防方案,将预防后炎症管理的需求降至最低。
•2022年11月,Adverum在视网膜协会年会上公布了其针对湿性AMD的6x10^11(6E11)和2E11剂量的ixo-vec的1期OPTIC试验的研究结束结果。提供的新数据包括两年的最终疗效和安全性分析,包括减少年化抗血管内皮生长因子注射量、临床相关且稳定的aflibercept蛋白水平以及维持最佳校正平均视力(BCVA)和平均中心子场厚度(CST)的改善。
◦ixo-vec 对局部使用皮质类固醇有反应的剂量依赖性炎症的耐受性通常良好。
◦在研究结束时,所有在2E11给药的参与者均无炎症,并且不需要使用皮质类固醇来治疗炎症。
◦OPTIC试验参与者的年化抗血管内皮生长因子注射量降低了80%至98%,aflibercept蛋白的持续治疗水平降低了80%至98%,这在扩展研究参与者的三年中得到了证实。
◦ 在6E11和2E11剂量组中,分别有80%和53%的参与者在两年内免补充注射。
◦两种剂量的平均BVCA和平均CST在至少两年内均保持在改善状态。
2023 年 LUNA 第二阶段试验的预期里程碑
•2023 年下半年 — 预计第 2 阶段 LUNA 试验将全面入组
•2023 年第三季度——预测 LUNA 14 周数据,包括一定比例的队列的 aflibercept 水平
•2023 年第四季度——预测 LUNA 的初步功效和安全性数据
截至2022年12月31日的三个月的财务业绩
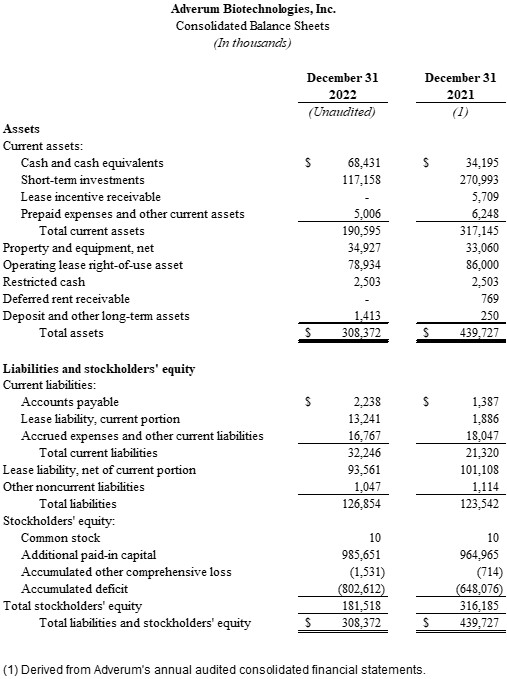
•截至2022年12月31日,现金、现金等价物和短期投资为1.856亿美元,而截至2022年9月30日为2.033亿美元,截至2021年12月31日为3.052亿美元。Adverum预计,现金、现金等价物和短期投资将为2025年的运营提供资金。
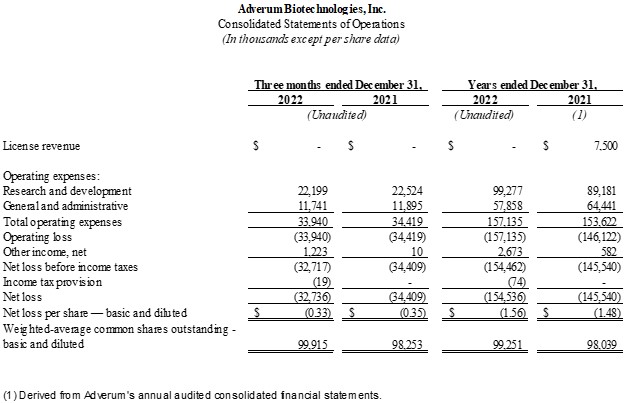
•截至2022年12月31日的三个月,研发费用为2,220万美元,而2021年同期为2,250万美元。由于顾问、外部研发服务、重组后的薪酬支出和设施相关费用减少,研发费用略有下降,但部分被LUNA推动的临床试验相关费用增加所抵消。2022 年第四季度,研发费用中包含的股票薪酬支出为 190 万美元。
•截至2022年12月31日的三个月,一般和管理费用为1170万美元,而2021年同期为1190万美元。一般和管理费用保持相对平稳。2022 年第四季度,一般和管理费用中包含的股票薪酬支出为 330 万美元。
•截至2022年12月31日的三个月,净亏损为3,270万美元,合每股基本亏损和摊薄后每股亏损0.33美元,而2021年同期为3,440万美元,或每股基本和摊薄后每股亏损0.35美元。
关于湿性年龄相关性黄斑变性
湿性 AMD,也称为新生血管 AMD 或 namD,是一种晚期 AMD,影响大约 10% 的 AMD 患者。湿性AMD是导致65岁以上人群失明的主要原因,全球约有2000万人患有这种疾病。随着人口老龄化,湿性AMD的新病例预计将在全球范围内显著增加。预计到2040年,AMD将影响全球2.88亿人,其中湿性AMD约占10%。
关于 Wet AMD 中的 Ixo-Vec
Adverum正在开发用于治疗湿性AMD的临床阶段基因疗法候选产品ixoberogene soroparvovec(ixo-vec)。ixo-vec 利用专有的矢量衣壳 Aav.7m8,在专有表达卡带的控制下承载 aflibercept 编码序列。与其他需要手术才能在视网膜下进行基因疗法(视网膜下方法)的眼科基因疗法不同,ixo-vec设计为在医生办公室一次性体外静脉注射,具有长期疗效,减轻频繁注射抗血管内皮生长因子(VEGF)的负担,优化患者依从性并改善湿性AMD患者的视力预后。美国食品药品监督管理局认识到湿性AMD需要新的治疗方案,因此批准了用于治疗湿性AMD的ixo-vec的快速通道资格。ixo-vec还获得了欧洲药品管理局的PRIME认证。
关于 LUNA 在 Wet AMD 更新中试用 ixo-vec
LUNA 试验是一项双掩码、随机的 2 期试验,在美国和欧洲的大约 40 个地点进行。LUNA将对50岁或以上且对抗血管内皮生长因子治疗有反应的湿性AMD受试者的ixo-vec进行评估。在先前评估的2E11 ixo-vec剂量和新的较低的6E10剂量之间,将平均随机分配多达72名受试者。将研究四种预防性类固醇治疗方案,目的是建立一种预防性皮质类固醇治疗方案,预防后对炎症管理的需求降至最低。正在评估的预防性方案包括22周局部使用二氟泼尼酯(Durezol®)的缩小疗法、单次给药 IVT 地塞米松(Ozurdex®),以及将外用 Durezol® 或 IVT Ozurdex® 与长达 10 周的口服泼尼松缩小疗法相结合,目的是在最少的需求下建立预防方案用于预防后的炎症管理。LUNA 中的所有四种预防性皮质类固醇治疗方案都涵盖了在非临床研究和第 1 期 OPTIC 研究中观察到的免疫原性峰值时期。
LUNA试验的主要终点是最佳矫正视力(BCVA)从基线到一年的平均变化以及不良事件的发生率和严重程度。LUNA 的关键次要终点包括从基线到一年的中心子场厚度 (CST) 的平均变化,以及评估预防性类固醇疗法在最大限度地减少炎症方面的有效性。此外,LUNA将从第14周开始评估aflibercept蛋白水平,并在第26周进行中期分析。研究参与者可以选择报名参加长期延期研究。
关于 Adverum 生物技术
Adverum Biotechnologies(纳斯达克股票代码:ADVM)是一家处于临床阶段的公司,旨在将基因疗法确立为高度流行的眼部疾病的新护理标准,希望开发出恢复视力和预防失明的功能性疗法。利用其专有的玻璃体内注射(IVT)平台的功能,Adverum正在开发耐用的单次给药疗法,该疗法旨在在医生办公室提供,以消除频繁眼部注射来治疗这些疾病的需要。Adverum正在评估其新的候选基因疗法ixoberogene soroparvovec(ixo-vec,前身为 ADVM-022),这是一种针对新生血管性或湿性年龄相关性黄斑变性患者的一次性体外受精注射。通过克服与当前使人衰弱的眼部疾病治疗模式相关的挑战,Adverum渴望改变护理标准,保护视力,并在全球范围内产生深远的社会影响。欲了解更多信息,请访问 www.adverum.com。
前瞻性陈述
本新闻稿中包含的关于未来可能发生的事件或结果的陈述是1995年《私人证券诉讼改革法》所指的 “前瞻性陈述”。此类声明包括但不限于有关ixo-vec的潜在益处、预防性皮质类固醇疗法的有效性、LUNA注册时间、在欧洲筛查患者、LUNA试验初步数据的时机以及为2025年之前运营提供资金的现金渠道的声明。实际结果可能与此类前瞻性陈述中的预期存在重大差异,这是由于各种风险和不确定性,包括但不限于以下固有的风险:Adverum的新技术使人们难以预测临床试验的开始和完成时间;监管不确定性;入组不确定性;早期临床试验的结果并不总是可以预测未来的临床试验和结果;以及未来与使用ixo-vec有关的并发症或副作用。Adverum面临的其他风险和不确定性在 “风险因素” 标题下以及Adverum的证券交易委员会(SEC)文件和报告的其他地方列出,包括Adverum截至2022年9月30日的季度10-Q表季度报告,以及Adverum未来的文件和报告,包括Adverum截至2022年12月31日止年度的10-K表年度报告。本新闻稿中包含的所有前瞻性陈述仅代表截至发表之日。Adverum没有义务更新此类陈述以反映在声明发表之日之后发生的事件或存在的情况。
企业、投资者和媒体查询
阿南德·雷迪
副总裁,企业战略、对外事务和参与负责人
Adverum 生物技术有限公司
T: 650-649-1358
E: areddi@adverum.com