目录表
| 与传统上专注于优势表位的“反复试验”抗体工程和筛选方法相比,治疗性抗体候选可以更好地选择性结合免疫和癌细胞。 |
| 2. | RubrYcHuTM库:一个AI生成的人类抗体库没有显著的序列缺陷,提供了一个独特的抗体库进行筛选。表位靶向引擎和筛选与RubrYcHu库已被证明可将发现时间从Ideation缩短到体内概念验证[PoC]最多4个月。这有可能使更多、更好的候选治疗药物更快地到达临床。 |
| 3. | 稳定的胡TM库:一个用于提高抗体性能的人工智能支持的序列优化库。一旦抗体被推进到先导优化阶段,稳定的胡允许精确和快速地优化抗体结合区,以快速将候选分子移动到IND使能阶段。 |
治疗学
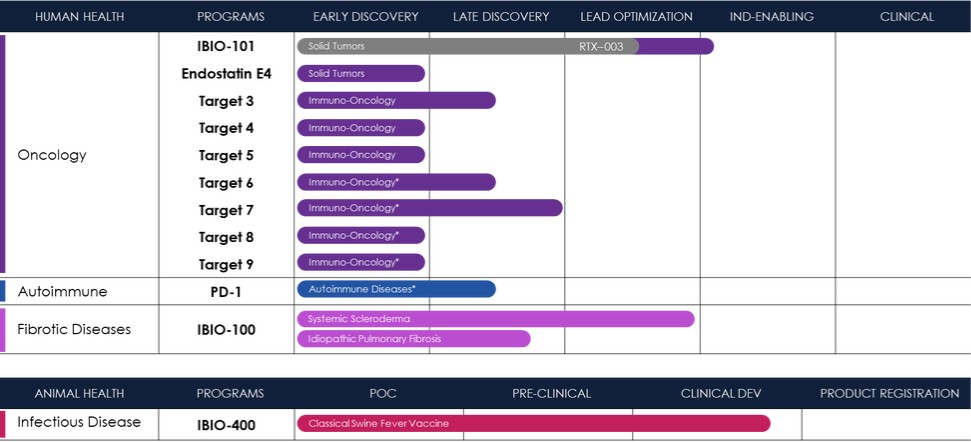
免疫肿瘤学
近年来,肿瘤学领域取得了显著的进展,可以说,没有比免疫疗法的出现更重要的了。该公司已经在加利福尼亚州圣地亚哥建立了自己的人工智能药物发现和药物开发能力,并建立了九个免疫肿瘤学项目的管道。
IBio-101
2021年8月,该公司与RubrYc签署了一项全球独家许可协议,开发和商业化抗CD25单抗RTX-003(现称为iBio-101[单抗]。截至2022年9月,该公司获得了iBio-101的独家所有权。在疾病的临床前模型中,iBio-101已经证明了结合和耗尽免疫抑制调节性T细胞的能力[特雷格]抑制实体瘤生长的细胞。
靶向消耗Treg细胞以控制肿瘤在过去几年中成为肿瘤学的一个感兴趣的领域。由于树突状细胞表达白细胞介素2受体α(IL-2Rα或CD25),因此可以开发出与CD25结合的单抗,从而触发自然杀伤细胞的耗竭,从而刺激抗肿瘤免疫。
2

