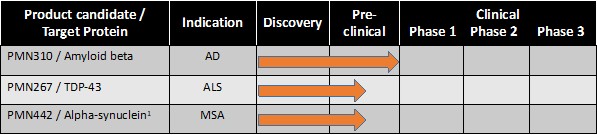
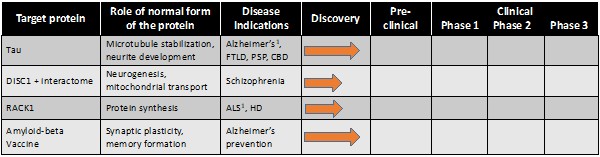
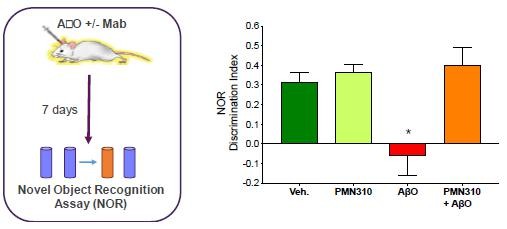
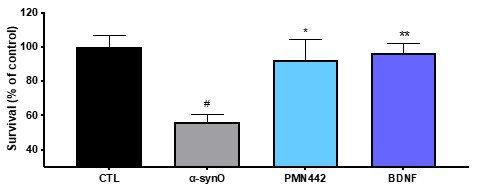
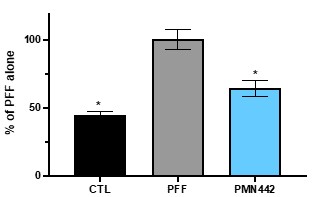
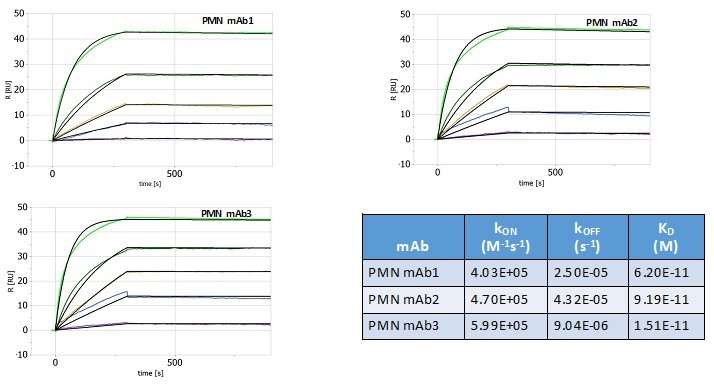
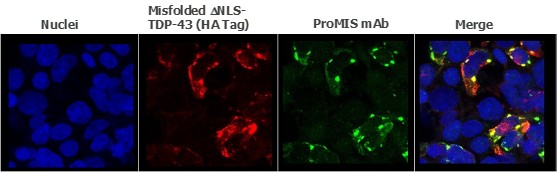
根据其章程,审计委员会负责监督本公司订立的关联方交易,并持续对所有关联方交易进行适当审查,以确定是否存在潜在的利益冲突情况。我们没有单独的关联人交易政策。
公司与关联方的交易
本公司已进行如下关联方交易:
尼尔·现金男。2016年4月,公司与UBC和温哥华海岸卫生局签订了一项为期三年的合作研究协议(CRA),金额为787,500加元,Cashman博士担任UBC的首席研究员。2018年3月,修订了CRA,并在三年内将资金增加到892,500加元。2018年7月,在协议期间,对UBC的总资金承诺增加到113万加元。2019年2月,修订了CRA,资金增加到2,130,000加元,再延长两年。2019年9月,修订了CRA,资金增加到2,630,000加元,再延长一年。2021年11月,对CRA进行了修订,从2022年1月1日起为2022年日历年额外拨款800,000加元,总资金为3,430,000加元。本公司于截至2022年及2021年12月31日止年度的成本分别为557,665美元及393,341美元,该等成本已计入随附的综合经营报表及综合亏损中的研发开支。卡什曼博士是不列颠哥伦比亚大学的荣誉退休教授。请参阅“业务了解更多有关该公司与UBC的关系的信息。关于本协议的更多信息以及为现金男先生提供服务所支付的款项,见第11项--“高管薪酬.”
尤金·威廉姆斯。威廉姆斯先生向公司提供的董事长和首席执行官服务历来是根据公司与Virtua,LLC于2015年6月29日签订的咨询协议提供的。关于此类咨询协议的更多信息,请参看项目11--“高管薪酬。”
Daniel·格夫肯。Geffken先生提供的CFO服务是根据本公司与丹佛斯顾问有限责任公司于2016年10月17日订立并经不时修订的咨询协议(“丹佛斯咨询协议”)提供的。根据丹福斯咨询协议,格夫肯先生同意以每小时325美元的时薪向公司提供CFO的常规服务,为期一年。2017年3月27日,对丹福斯咨询协议进行了修订,以每月5,000美元的预订费为基础提供服务,年增长率为4%,外加费用。丹福斯咨询协议随后于2017年12月12日修订,将期限延长一年,并于2018年8月31日修订,将期限延长一年。丹福斯咨询协议于2021年11月10日进一步修订,将咨询协议的期限延长至2024年10月29日,并将Geffken先生的固定月费定为15,000美元。在截至2022年和2021年12月31日的年度中,公司根据咨询协议分别向丹福斯顾问公司支付了365,247美元和322,639美元。丹佛斯咨询协议规定,经双方同意可延长协议期限,任何一方均可提前60天书面通知另一方终止协议,如果因任何原因终止协议,则可提前30天终止。此外,根据同一协议,本公司于2017年3月1日及2021年11月12日分别向Danforth Advisors,LLC授予8,333及8,333份购股权,其归属如下:于授出购股权后立即授予25%,其余部分将在36个月内等额分批授予。
拉里·阿尔斯蒂尔。2022年4月1日,关于被任命为本公司兼职首席营销官,本公司与Altstiel博士签订了一项咨询协议(“Altstiel咨询协议”)。根据Altstiel咨询协议,Altstiel博士担任公司首席营销官直至2023年4月1日(除非提前终止),作为交换,公司每月向Altstiel博士支付19,000美元的费用,外加偿还与他担任首席营销官相关的合理的自付费用或支出。2022年4月14日,本公司还根据股票期权计划的条款授予Altstiel博士30,833份股票期权(“Altstiel Consulting Options”)。Altstiel咨询期权将在48个月内按月等额分配。
请参阅“高管薪酬有关被任命的高管和董事薪酬的详细信息。