
美国
美国证券交易委员会
华盛顿特区,20549
表格8-K
当前 报告
依据第13或15(D)条
《1934年证券交易法》
报告日期(最早报告事件日期):2022年12月6日
YUMANITY治疗公司
(注册人的确切姓名载于其章程)
| 特拉华州 | 001-37695 | 20-8436652 | ||
| (国家或其他司法管辖区 成立为法团) |
(佣金) 文件编号) |
(税务局雇主 识别号码) |
| 客人街40号,4410号套房 马萨诸塞州波士顿 |
02135 | |||
| (主要执行办公室地址) | (邮政编码) | |||
注册人的电话号码,包括区号:617-409-5300
不适用
(前姓名或前地址,如自上次报告以来有所更改)
如果Form 8-K备案的目的是同时满足注册人根据下列任何规定(见一般说明A.2)的备案义务,请勾选下面相应的框。如下所示):
| 根据《证券法》第425条的书面通知(《联邦判例汇编》第17卷,230.425页) |
| ☐ | 根据《交易法》规则14a-12征集材料(17 CFR 240.14a-12) |
| ☐ | 根据《交易法》第14d-2(B)条(《联邦判例汇编》第17编240.14d-2(B)条)进行开市前通信 |
| ☐ | 根据《交易法》第13E-4(C)条(17 CFR 240.13E-4(C))进行开市前通信 |
根据该法第12(B)条登记的证券:
| 每个班级的标题 |
交易 符号 |
各交易所名称 在其上注册的 | ||
| 普通股,每股票面价值0.001美元 | YMTX | 纳斯达克资本市场 |
用勾号表示注册人是否为1933年《证券法》第405条(本章230.405节)或1934年《证券交易法》第12b-2条(本章第240.12b-2节)所界定的新兴成长型公司。
新兴成长型公司☐
如果是新兴的 成长型公司,请用复选标记表示注册人是否已选择不使用延长的过渡期来遵守根据交易所 法案第13(A)节提供的任何新的或修订的财务会计准则。☐
| 第7.01项。 | 《FD披露条例》。 |
如之前披露的,2022年6月5日,特拉华州的Yumanity治疗公司(Yumanity)与Janssen制药公司(Janssen PharmPharmtica NV)签订了资产购买协议(资产购买协议)。在签署资产购买协议的同时,2022年6月5日,Yumanity与华盛顿公司Kineta,Inc.和Yacht Merge Sub,Inc.签订了协议和合并计划 ,Kineta Inc.是Yumanity的全资子公司,位于华盛顿。
2022年11月29日,Kineta宣布,Kineta首席执行官Shawn Iadonato博士将出席JMP证券血液学和肿瘤学峰会(The Summit),这是一项虚拟投资者活动,将于2022年12月6日至7日举行。2022年12月6日,Iadonato博士介绍了KVA12123(以前称为KVA12.1)、Kineta的Vista阻断免疫疗法的企业更新和概述。现将在首脑会议上所作的幻灯片演示文稿作为附件99.1附上。
本项目7.01中的信息,包括本文所附的附件99.1,仅供提供,不应被视为已根据修订后的1934年《证券交易法》(《证券交易法》)第18节提交,也不应被视为以其他方式承担该部分的责任,也不应被视为已通过参考纳入根据修订后的《1933年证券法》(《证券法》)或《交易法》提交的任何文件,除非此类文件中明确规定了这一点。
重要信息以及在哪里可以找到
此 通信可被视为关于Yumanity与Kineta之间以及Yumanity与Janssen之间拟议交易的征集材料。关于拟议的交易,Yumanity于2022年8月29日向美国证券交易委员会(美国证券交易委员会)提交了S-4表格注册声明(初始注册声明),经2022年10月3日提交美国证券交易委员会的初始注册声明修正案1、2022年10月24日提交美国证券交易委员会的初始注册声明修正案2和2022年11月4日提交美国证券交易委员会的初始注册声明修正案3(连同初始注册声明、注册声明)修订后,其中包含一份初步的委托书和招股说明书。注册声明已于2022年11月10日被美国证券交易委员会 宣布生效。Yumanity随后于2022年11月10日提交了最终的委托书/招股说明书(委托书),该委托书已于2022年11月4日收盘时邮寄给登记在册的股东。2022年12月5日,Yumanity向美国证券交易委员会提交了申请,并于2022年11月4日收盘时邮寄给登记在册的股东,作为对注册 声明(招股说明书补编)中所载委托书和招股说明书的补充。建议Yumanity和Kineta的投资者和证券持有人在这些材料可用时阅读这些材料,因为它们包含有关Yumanity、Kineta和拟议的交易的重要信息。本通讯不能取代注册声明、委托书、招股说明书补编或任何其他文件
Yumanity可能会就拟议中的交易向美国证券交易委员会提交申请或发送给证券持有人。投资者和证券持有人一旦获得提交给美国证券交易委员会的文件,即可在尤曼尼的网站www.yumanity.com或美国证券交易委员会的网站www.sec.gov上获得免费副本,或致电(212)213-0006ext向尤曼尼的投资者关系部提出请求。331.
本通信不应构成出售要约或征求出售要约或征求购买任何证券的要约,也不应在任何司法管辖区的证券法律规定的登记或资格之前,在任何司法管辖区出售此类要约、招揽或出售是违法的证券。除非通过符合证券法第10节要求的招股说明书,否则不得发行证券。
征集活动的参与者
Yumanity、Kineta及其各自的董事和高管可被视为参与就建议交易向Yumanity股东征集委托书的活动。关于Yumanity高管和董事的信息载于Yumanity于2022年4月25日提交给美国证券交易委员会的关于2022年股东年会的附表14A的最终委托书 。有关这些个人利益的其他信息已在委托书中阐述,并将在提交给美国证券交易委员会的任何其他相关文件中阐明。这些个人可能被视为参与了为Yumanity股东征集委托书的活动。如上所述,您可以免费获得这些文档的副本。
关于前瞻性陈述的警告性声明
这份当前的8-K表格报告和随函提供的附件包含前瞻性陈述,包括根据1995年《私人证券诉讼改革法》的安全港条款所作的陈述。这些陈述可以通过以下词汇和短语来识别:目标、预计、相信、可能、旨在、估计、期望、预测、目标、意图、意图、可能、可能、潜在、寻求、意志、类似的词语和短语,这些词语和短语旨在识别前瞻性陈述。这些前瞻性陈述包括但不限于有关尤曼西和Kineta之间的拟议合并以及向扬森出售资产的提议,包括交易是否以及何时完成;有关拟议交易的结构、时间和完成的陈述;合并后的公司在拟议合并完成后在纳斯达克上市的预期;合并后公司的所有权结构预期;合并后公司的预期高管和董事;合并后的尤曼恩和Kineta以及合并后的公司各自在拟议合并结束时的预期现金状况;合并后公司的未来业务;合并后公司的性质、战略和重点;合并后公司的任何候选产品的开发和商业潜力及潜在利益;合并后公司的高管和董事会结构;合并后公司公司总部的所在地;预期的临床前和临床药物开发活动和相关时间表, 包括数据和其他临床和临床前结果的预期时间;Kineta有足够的资源推进其流水线;以及其他非历史事实的陈述。由于这些风险和不确定性,实际结果和事件的时间可能与此类前瞻性陈述中预期的大不相同,这些风险和不确定性包括但不限于:(1)拟议交易的完成条件未得到满足的风险,包括未能及时获得股东对交易的批准;(Ii)有关建议交易完成时间的不确定性,以及Yumanity、Kineta、Janssen和证券购买协议一方(日期为2022年6月5日并于2022年10月24日和2022年12月5日修订)的每一方完成建议合并、资产出售或证券购买协议预期的交易的能力(视适用情况而定);(Iii)与Yumanity管理其运营费用的能力有关的风险,以及与拟议待完成的交易相关的费用;(Iv)与未能或延迟获得完成拟议交易所需的任何政府或半政府实体的批准有关的风险;(V)由于交换比率的调整,Yumanity股东和Kineta股东可能拥有合并后公司更多或更少股份的风险;(Vi)与Yumanity普通股相对于交换比率的市场价格相关的风险;(Vii)意外成本, 任何一项或两项拟议交易所产生的费用或开支;(Viii)因宣布或完成拟议交易而对业务关系产生的潜在不良反应或变化;(Ix)在#年向Yumanity股东分配的股息金额
与资产出售的关联(如果有的话)可能低于目前的预期;(X)合并后的公司无法获得足够的额外资本以继续推进这些候选产品及其临床前计划的风险;(Xi)为候选产品获得成功的临床结果的不确定性以及由此可能导致的意外成本;(Xii)与 未能从候选产品和正在开发和预期开发的临床前计划中实现任何价值相关的风险,这些风险是根据成功将候选产品推向市场的内在风险和困难而开发的;和 (十三)与可能未能实现拟议交易的某些预期收益相关的风险,包括未来的财务和经营业绩。由于这些风险和不确定性,实际结果和事件的时间可能与这些前瞻性陈述中预期的大不相同。这些和其他风险和不确定性在提交给美国证券交易委员会的定期文件中有更全面的描述,包括在Yumanity提交给美国证券交易委员会的最新年度或季度报告中题为风险因素的章节,以及Yumanity已经和将向美国证券交易委员会提交的与拟议交易相关的其他文件中描述的因素,包括 委托书。您不应过分依赖这些前瞻性陈述,这些前瞻性陈述仅在本新闻稿发布之日或前瞻性陈述中指出的日期作出。除法律另有要求外,Yumanity明确表示不承担任何义务或承诺更新或修改本文中包含的任何前瞻性陈述,以反映其对此的预期的任何变化或事件的任何变化, 任何此类 声明所依据的条件或情况。
| 第9.01项。 | 财务报表和证物。 |
(D)展品
| 99.1 | 演示文稿幻灯片,日期为2022年12月6日。 | |
| 104 | 封面交互数据文件(嵌入在内联XBRL文档中)。 | |
签名
根据1934年《证券交易法》的要求,注册人已正式促使本报告由正式授权的签名人代表其签署。
| 尤曼尼治疗公司 | ||||||
| 日期:2022年12月6日 | 发信人: | /s/理查德·彼得斯 | ||||
| 理查德·彼得斯 | ||||||
| 总裁与首席执行官 | ||||||

展品99.1 2022年12月6日JMP证券血液学和肿瘤学峰会开发解决癌症免疫耐药性的下一代免疫疗法

免责声明和其他信息本演示文稿包含 前瞻性陈述,包括根据1995年《私人证券诉讼改革法》的安全港条款所作的陈述。这些表述可以通过诸如“目标”、“预期”、“相信”、“可能”、“旨在”、“估计”、“预期”、“预测”、“目标”、“打算”、“可能”、“ ”计划、“可能”、“潜在”、“寻求”、“意志”等词汇和短语以及这些词汇和短语的变体或类似的表述来识别前瞻性表述。这些 前瞻性陈述包括但不限于有关Yumanity治疗公司(“Yumanity”)和Kineta公司(“Kineta”)之间拟议的合并以及向扬森制药公司(“扬森”)出售资产的提议,包括交易是否以及何时完成;有关拟议交易的结构、时机和完成的陈述;合并后的公司在拟议合并结束后在纳斯达克上市的陈述;关于拟议合并结束后合并公司的所有权结构的预期;合并后公司的预期高管和董事;合并后公司和合并后公司各自的预期现金状况;合并后公司的未来业务;合并后公司的性质、战略和重点;合并后公司的任何候选产品的开发和商业潜力及潜在利益;合并后公司的高管和董事会结构;合并后公司的公司总部所在地;预期的临床前和临床药物开发活动和相关时间表, 包括数据和其他临床和临床前结果的预期时间;Kineta有足够的资源推进其流水线;以及其他非历史事实的陈述。实际结果和 由于这些风险和不确定性,事件的时间可能与此类前瞻性陈述中预期的大不相同,这些风险和不确定性包括但不限于:(I)拟议的交易未能满足条件的风险,包括未能及时获得股东对交易的批准;(Ii)有关建议交易的完成时间的不确定性,以及Yumanity、Kineta、Janssen和证券购买协议一方(日期为2022年6月5日,并于2022年10月24日和2022年12月5日修订)中的每一方完成建议的合并、资产出售或证券购买协议预期的交易的能力(视适用情况而定);(Iii)与Yumanity管理其运营开支的能力有关的风险,以及与拟议待完成的交易相关的开支;(Iv)与未能或延迟获得完成拟议交易所需的任何政府或半政府实体的批准有关的风险;(V)由于交换比率的调整,Yumanity股东和Kineta股东可能拥有或多于或少于目前预期的合并后公司股份的风险;(Vi)与Yumanity普通股的市场价格相对于 兑换比率有关的风险;(Vii)意外成本, 其中一项或两项拟议交易产生的费用或开支;(Viii)因宣布或完成拟议交易而导致的潜在不良反应或业务关系的变化;(Ix)与资产出售相关的分配给Yumanity股东的股息金额(如果有的话)可能低于目前预期的风险;(X)与合并后的公司 无法获得足够的额外资本以继续推进这些候选产品及其临床前计划相关的风险;(Xi)为候选产品获得成功的临床结果的不确定性以及由此可能导致的意外成本; (Xii)由于候选产品成功推向市场所涉及的固有风险和困难,与未能从候选产品和正在开发和预期开发的临床前计划中实现任何价值相关的风险;以及(Xiii)与可能无法实现拟议交易的某些预期收益相关的风险,包括未来的财务和运营结果。由于这些风险和不确定性,实际结果和事件的时间可能与这些前瞻性陈述中预期的大不相同。这些及其他风险和不确定性在提交给美国证券交易委员会(“美国证券交易委员会”)的定期文件中有更全面的描述,包括Yumanity提交给美国证券交易委员会的最新年度或季度报告中题为“风险因素”一节中描述的因素,以及Yumanity向美国证券交易委员会提交的与拟议交易相关的其他文件,包括委托书。您不应过分依赖这些前瞻性陈述。, 这些声明仅在本新闻稿发布之日或在前瞻性陈述中指出的日期作出。除非法律另有要求,否则Kineta明确不承担任何义务或承诺更新或修订本文中包含的任何前瞻性陈述,以反映其对此的预期的任何变化,或任何此类陈述所基于的事件、条件或情况的任何变化。2.

免责声明和其他信息其他信息以及在哪里查找该信息本演示文稿可能被视为有关Yumanity与Kineta以及Yumanity与Janssen之间拟议交易的征集材料。与建议的交易相关,于2022年8月29日,Yumanity 向美国证券交易委员会提交了S-4表格登记声明(“初始注册声明”),经2022年10月3日提交美国证券交易委员会的初始注册声明的第1号修正案、2022年10月24日提交美国证券交易委员会的初始注册声明的第2号修正案和2022年11月4日提交的美国证券交易委员会的初始注册声明的第3号修正案(连同初始注册声明,即“注册 声明”)修订后,其中包含一份初步的委托书和招股说明书。《注册声明》已于2022年11月10日被美国证券交易委员会宣布生效。Yumanity随后于2022年11月10日提交了最终的委托书/招股说明书( “委托书”),该委托书已于2022年11月4日收盘时邮寄给登记在册的股东。于2022年12月5日,Yumanity向美国证券交易委员会提交了申请,并于2022年11月4日收盘时邮寄给登记在册的股东,作为对注册说明书所载委托书和招股说明书(“招股说明书补编”)的补充。建议Yumanity和Kineta的投资者和证券持有人在这些材料可用时阅读这些材料,因为它们包含有关Yumanity、Kineta和拟议交易的重要信息。本演示文稿不能替代注册声明、委托书, 招股说明书 Yumanity可能向美国证券交易委员会提交的或与拟议交易相关的任何其他文件或发送给证券持有人的文件。投资者和证券持有人一旦获得提交给美国证券交易委员会的文件,即可在尤曼尼的网站www.yumanity.com或美国证券交易委员会的网站www.sec.gov上获得免费副本,或致电(212)213-0006ext向尤曼尼的投资者关系部提出请求。331.本陈述不应构成出售要约、要约出售或征求购买任何证券的要约,也不得在任何司法管辖区进行此类要约、招揽或出售在根据任何此类司法管辖区的证券法注册或取得资格之前被视为非法的任何证券出售。除非招股说明书符合修订后的《1933年证券法》第10节的要求,否则不得发行证券。招股书的参与者Yumanity、Kineta及其各自的董事和高管可被视为与建议交易相关的向Yumanity股东征求委托书的参与者。关于Yumanity高管和董事的信息载于Yumanity于2022年4月25日提交给美国证券交易委员会的与2022年股东年会相关的附表14A的最终委托书中。有关此类个人利益的其他信息将在委托书中阐述,并将在提交给美国证券交易委员会的任何其他相关文件中阐述。这些个人可能被视为参与了Yumanity股东的委托书征集。如上所述,您可以 获得这些文档的免费副本。3.

Kineta正在开发针对癌症免疫耐药的下一代免疫疗法 免疫耐药KVA12123:潜在分化的Vista阻断免疫疗法预计将于2022年第四季度进入临床针对CD27和CD24肿瘤的免疫单抗计划实体肿瘤领域巨大的市场机会 KA在纳斯达克上市预计将于2022年第四季度上市计划与Yumanity治疗公司计划的反向合并结束后,Yumanity治疗公司强烈预计从现有投资者承诺的Yumanity+PIPE融资中获得3750万美元财务状况现金跑道预计将在反向合并结束后18-24个月内为 运营提供资金*预计在未来18个月内显著的价值驱动催化剂4*Yumanity的ALS药物开发计划与默克公司合作在Kineta和Yumanity的反向合并完成后,授予Genentech的肿瘤学药物开发计划和授予Fair Treateutics的囊性纤维化药物开发计划4将保留在合并后的组织中。

免疫抵抗是当前癌症治疗的主要挑战 下一代癌症治疗需要:提高检查点阻断的存活率和下调免疫反应抑制物(CPI)无应答者的机制(70%-80%)*T细胞失去抗癌免疫功能抵抗 重新编程免疫系统以攻击癌症肿瘤细胞看不到免疫系统整合了天然和获得性免疫反应*基于公开信息5

Kineta流水线集成了天然免疫和获得性免疫,以解决癌症耐药性的机制 天然免疫参与癌症早期检测适当适应性免疫的必要驱动因素癌症耐药性的重要原因适应性免疫大多数竞争对手的药物开发仅专注于T细胞适应性免疫6

Kineta的免疫肿瘤学流水线旨在解决癌症免疫耐药的机制药物前计划发现临床第一阶段第二阶段第三阶段预期的里程碑免疫抑制:αVista mAb4Q2022:IND批准和启动第一阶段适应症:晚期实体肿瘤2023年第二季度:启动Pembrolizumab联合队列KVA12123非小细胞肺癌,结直肠癌,OC4Q2023:第一阶段数据读出耗尽的T细胞:αCD27mAb1H2024:IND申请适应症:晚期实体肿瘤1H2024年:开始第一阶段临床研究Kineta还启动了一项抗CD24拮抗剂单抗免疫治疗发现计划,以解决TME中肿瘤免疫原性差的问题,并正在努力确定领先的候选7

KVA12123潜在分化Vista阻断免疫疗法8 8
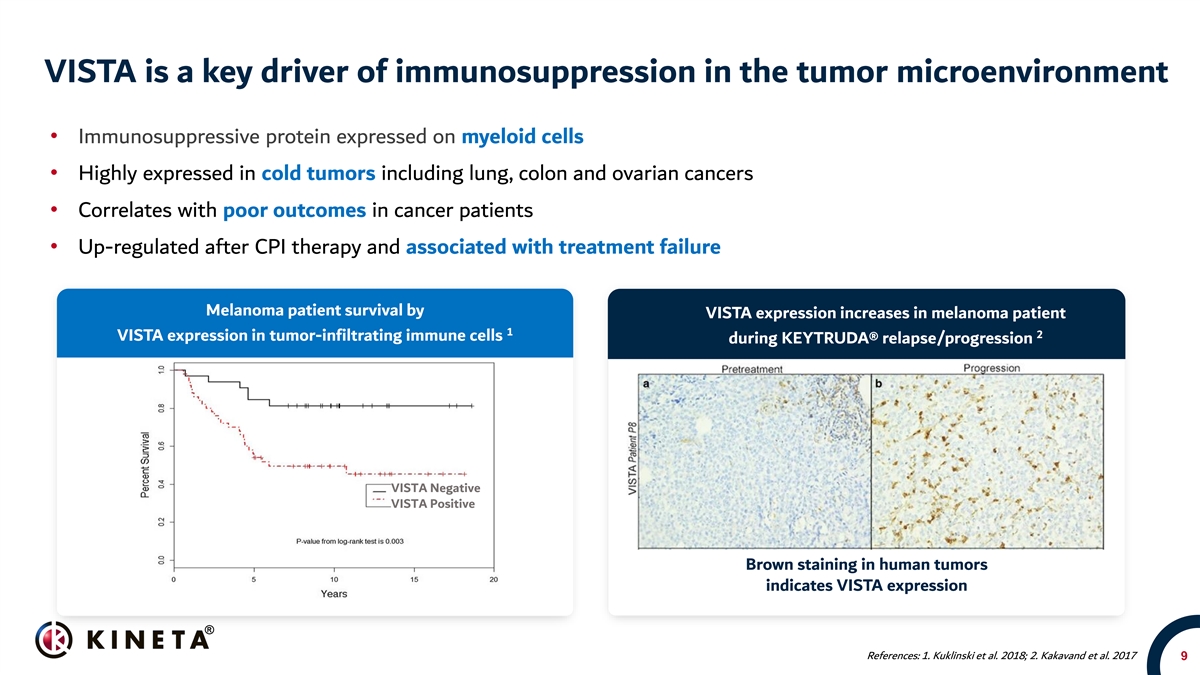
VISTA是肿瘤微环境中免疫抑制的关键驱动因素 ·免疫抑制蛋白在髓系细胞上表达·在包括肺癌、结肠癌和卵巢癌在内的冷肿瘤中高表达·与癌症患者的不良预后相关·CPI治疗后上调,并与治疗失败相关。VISTA表达在黑色素瘤患者中增加1 2在肿瘤浸润性免疫细胞中VISTA表达KEYTRUDA®复发/进展VISTA阴性VISTA阳性在人类肿瘤中的棕色表达表明VISTA表达:1.Kuklinski等人。2018年;2.卡卡万德等人。2017年9

KVA12123:潜在分化的VistA阻断免疫疗法pH 单剂肿瘤产品开发阶段同型结合模型效率CRS细胞因子释放强劲否工程IgG1Kineta Start阶段在生理pH单剂肿瘤生长CRS相关细胞因子单抗与2022年第四季度KVA12123结合和酸性pH中TME抑制结合,并结合临床前模型中临床前模型中看到的独特表位PD-1的释放或神经毒性Curis*肿瘤坏死因子α,干扰素γ,第一阶段IgG1生理性中等CI-8993IL2,IL-1βPierre Fabre阶段1 WO180蜂鸟阶段1 Ig G4生理中度IL-6 HMBD002 Pharmabine临床前IgG1酸性和生理中度干扰素γPMC309 Sensei临床前IgG1酸性弱肿瘤坏死因子αSNS-101其他发现阶段计划:Apexigen,Five Prime Treeutics/BMS,xCella Biosciences空细胞表示没有公开数据*Curt于2022年11月9日宣布:“集中资源专注于并加速emavusertib”, 公司的主要资产和“其他计划的剥夺”(CI-8993)Kineta数据和分析文件10

阻断Vista可逆转TME免疫抑制机制肿瘤免疫耐药抑制MDSC促进T细胞功能Eff增强NK细胞活化增强单核细胞活化11

用KVA12123阻断VISTA可同时激活先天免疫和获得性免疫细胞增加人类白细胞抗原依赖性减少MDSC介导增加单核细胞T细胞激活分化和激活T细胞抑制1000HLADR 3000 100000 2000 500 1000 50000 250 0 0 KVA12123 KVA12123 NK 依赖作用机制促进NK细胞活化(CD56+)+NK-NK门控NK细胞表达CD137,24小时3000 1000 2000 750 500 1000 250 0 0 KVA12123文件上的Kineta数据12 IgG1 3ug/ml KVA 12123 0.03ug/ml KVA12123 0.3ug/ml KVA12123 30ug/ml GG1 3ug/ml KVA12123 0.03ug/ml KVA12123 0.3ug/ml KVA12123 3ug/ml I PBMC单独IgG1 KVA12123 PBMC+Mono的IgG1 3ug/ml KVA12123 0.03ug/ml KVA12123 3ug/ml KVA120.03ug/ml KVA120.3ug/mlKVA12123 0.03ug/mlKVA12123 0.3ug/mlKVA12123 3ug/mlHLA-DR MFI增殖细胞绝对计数CD137 MFI干扰素(pg/mL)

KVA12123在临床前模型、联合治疗、联合治疗、单一治疗、结肠癌模型、膀胱癌模型MB49、膀胱癌模型MB49、T细胞淋巴瘤模型EG7、hVISTA Ki小鼠、平均肿瘤体积1500、平均肿瘤体积、人IgG1 3000、IgG对照、KVA12.1 2000、对照MS、IgG2a、KVA12.2a、抗MPD1、KVA-12.2a、12.2a KVA12.1/anti-mpd1组合KVA12.2a/anti-mpd-1 1000 1500 2000 1000 1000 500 500 0 0 0 5 10 15 20 25 0 2 4 6 8 10 12 14 16 18 20 22 24 26 0 2 4 6 8 10 12 14 16 18 20 22 24 26 0 10 20 20 30 40天植入后肿瘤生长抑制抗Vista:75%抗Vista:35-42%anti-Vista:{br40%抗Vista:66%抗PD1:42-60%抗PD1:67%Combo:68%Combo:85%*联合治疗研究使用次优剂量的每个制剂KVA12.2a:小鼠等同于KVA12123的Kineta数据文件13 3 Avg。肿瘤体积(Mm)3平均。肿瘤体积(Mm)3肿瘤体积(Mm)3平均。肿瘤体积(毫米)

在NHP毒理学研究中观察到KVA12123耐受性良好 CRS细胞因子没有改变与治疗相关的死亡率水平(IL6或肿瘤坏死因子α)结果良好没有明显的临床体征耐受或体重减轻Kineta在NHP完成了多次、单次和重复剂量的毒理学研究,KVA12123的剂量高达100 mg/kg Kineta数据在文件14
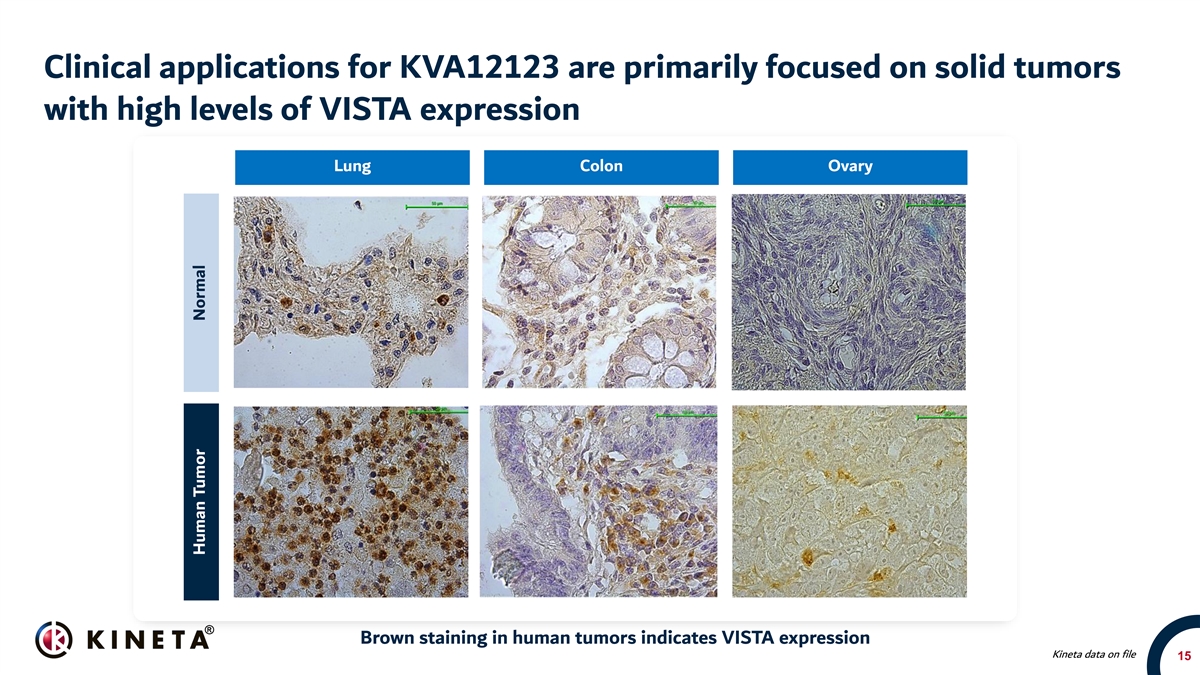
KVA12123的临床应用主要集中在Vista高水平表达的实体肿瘤 人类肿瘤中肺、结肠、卵巢20x 20x 20x棕色染色显示Vista表达Kineta数据文件15人类肿瘤正常

1期剂量递增研究单一疗法并联合培溴利珠单抗治疗晚期实体肿瘤患者人群:晚期实体肿瘤患者主要目标:KVA12123的安全性和耐受性、推荐的2期剂量(RP2D)或最大耐受剂量(MTD)次要目标:iRECIST(ORR)晚期实体肿瘤患者的药代动力学、免疫原性、肿瘤反应探索性目标:生物标志物和受体占有率B部分KVA12123单剂剂量递增计划剂量水平KVA12123剂量递增计划剂量水平联合静脉注射;Q2W=每2周(KVA12123)=IV;Q2W=每2周(KVA12123);Q6W=每6周(Pbro)3 10 30 100 300 1000 30 100 300 1000 mg mg 3-6受试者3-6受试者每队列1-6受试者KVA12123研究为1/2期临床试验。A部分和B部分如上所述。C部分和D部分是第二阶段扩展队列, 将招募A部分和B部分定义的肿瘤类型的患者16

1大型商业市场NSCLC 980K初期患者年度新机会$318亿KVA12123 2 270万结直肠癌年度新患者110万年度新患者$103亿市场机会3卵巢癌66万年度新患者$59亿市场来源:1.NSCLC GlobalData:2028年的全球药物预测和市场分析2.CRC GlobalData:2028年的全球药物预测和市场分析17.OC GlobalData:2028年的全球药物预测和市场分析

战略合作伙伴关系提供了巨大收入的潜力 持续合作KCP506用于慢性神经肌肉疾病神经病理性疼痛疾病-ALS(Kineta)(Yumanity)合作伙伴高达3.59亿美元的里程碑高达5.3亿美元的里程碑关键交易条款获得了2100万美元的开发资金版税净销售额 自成立以来研究合作高个位数和许可协议低青少年版税研究合作,选项和许可协议Yumanity的ALS药物开发计划与默克公司合作,在Kineta和Yumanity的反向合并完成后,授予Genentech的肿瘤学药物开发计划和授予Fair Treateutics的囊性纤维化药物开发计划将保留在合并后组织中。 18

未来18个月预期的重要催化剂2022 2023 1H 2024 4Q:KVA12123 1Q:KVA27mAb1H:KVA12123与默克公司的临床合作启动IND使能研究第一阶段合并的安全数据(KEYTRUDA®药品供应协议)读出2Q:KVA121231H:αCD27mAb4Q:KVA12123启动联合队列IND提交IND批准2Q:默克伙伴公司(ALS)1H:αCD27mAb4Q:KVA12123潜在的临床前研究启动阶段1晚期实体肿瘤临床研究4Q: KVA121H:αCD24mAb1阶段初步数据读出候选人4Q:基因泰克伙伴公司(α)1H:KVA12123潜在的临床前研究启动阶段1晚期实体肿瘤临床研究4Q: KVA121H:CD24mAb1阶段初步数据读出候选人4Q:基因泰克伙伴公司(α)1H:αCD27mAb4Q:KVA12123潜在的临床前研究启动阶段1临床研究启动晚期实体肿瘤的临床研究4Q: KVA121H:αCD24mAb1阶段初步数据读出候选人4Q:基因技术合作伙伴KCP506)启动IND支持研究潜在阶段1 SAD/MAD/Pilot 4Q:Genentech合作伙伴关系(KCP506)HEMP里程碑Genentech选项 19

经验丰富的领导团队Craig Philps Shawn Iadonato,博士总裁 首席执行官Keith Baker Thierry Guillaudeux,博士首席财务官首席科学官Jacques Bouchy Pauline Kenny,投资者关系总法律顾问兼业务发展20

Kineta正在开发下一代免疫疗法,以解决癌症免疫耐药KVA12123:潜在分化的Vista阻断免疫疗法预计将于2022年第4季度进入临床针对CD27和CD24肿瘤的免疫单抗(MAb)计划预计将于2022年第4季度在纳斯达克上市实体肿瘤KA预计将于2022年第4季度上市计划与Yumanity治疗公司计划的反向合并完成后,Yumanity+PIPE预计将提供3750万美元现有投资者承诺的3,750万美元财务状况Cash Runway预计 将从反向合并伙伴关系结束后18-24个月内为运营提供资金*预计未来18个月内Yumanity的ALS药物开发计划将带来显著的价值推动催化剂,授予Genentech的肿瘤学药物开发计划和授予Fair Treeutics的囊性纤维化药物开发计划21将在Kineta和Yumanity的反向合并完成后保留在合并后的组织中。

为癌症患者开发下一代免疫疗法 www.kinetabio.com i ir@kineta.us 22 22