目录表
非卧床的2型和3型SMA(据估计,这代表了美国和欧洲目前流行的SMA患者的大部分)。Apitegromab在我们的第二阶段黄玉概念验证临床试验中用于治疗2型和3型SMA患者。黄玉临床试验2期12个月的正面结果最初于2021年4月宣布,并于2021年6月在Cure SMA虚拟会议上公布。
2022年6月,在Cure SMA研究和临床护理会议上,我们公布了托帕兹公司的apitegromab的24个月疗效和安全性扩展数据。数据对于接受SMN治疗的2型和3型SMA的非门诊患者,支持使用apitegromab持续和持续的改善。
托帕兹评估了广泛年龄范围(2-21岁)的2型和3型SMA患者的apitegromab。所有35名非门诊患者(队列2和3)和23名门诊患者中的12名(队列1)正在接受努西那森维持治疗。非活动人群的主要疗效终点是扩展的Hammersmith功能运动量表(“HFMSE”)较基线的平均变化。其他终点包括修订的上肢模块(“RULM”)较基线的平均变化,这是一项专门为SMA患者的上肢功能设计的评估。HFMSE是评估SMA患者粗大运动功能的有效工具,而RULM是通过评估与用手和手臂执行各种日常活动的能力相对应的任务来评估上肢运动能力。
在这项为期24个月的评估中,进行了一项观察病例分析,它汇集了所有非门诊患者(队列2和3),并基于给定时间点的可用数据。该分析人群包括接受低剂量(2 mg/kg)或大剂量(20 mg/kg)apitegromab的患者(包括队列3中第二年从2 mg/kg改为20 mg/kg的患者),不排除任何因新冠肺炎研究网站准入限制而未能达到预期apitegromab剂量的患者。
接受有效HFMSE评估的非卧床患者(年龄范围为2至21岁)在24个月后HFMSE评分有显著、持续的增加,而RULM评分在24个月时继续增加。非门诊患者与基线结果的平均变化显示:
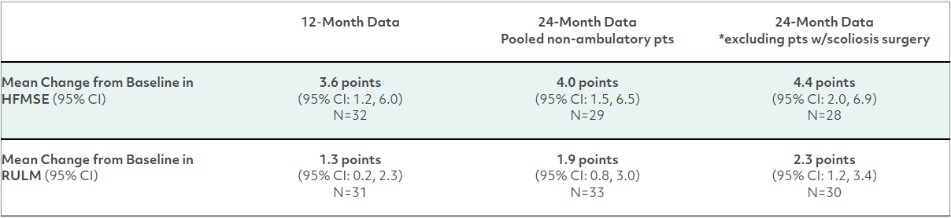
*非活动组中的三名患者在第二年接受了脊柱侧弯手术,据报道,这在此后相当长的一段时间内对HFMSE评分产生了负面影响。这项分析排除了这些患者的术后数据。
根据HFMSE评分和药效学数据(通过血清潜在的肌肉生长抑素浓度来衡量靶点参与),在服用apitegromab的24个月中继续观察到剂量反应,有迹象表明,随着最初接受低剂量治疗的非门诊患者转向高剂量治疗,HFMSE可能会进一步增加。
3型SMA的24个月非卧床患者(队列1)的数据表明,接受20 mg/kg的apitegromab和Nusinesen的患者的修订Hammersmith Scale(“RHS”)评分是稳定的。24个月时,平均RHS较基线的变化,阿替格罗布和努辛那森组(n=10)为-0.7分(95%CI:-3.1,1.7),单用组(n=11)为-2.8分(95%CI:-8.4,2.8)。队列1中的一组个体(n=21)RHS有所改善,42.9%(9/21)和23.8%(5/21)的患者≥1点和≥3点RHS在24个月时较基线分别增加。
20