| ©版权所有2022 Aclaris Treateutics,Inc.保留所有权利 ©版权所有2022 Aclaris Treateutics,Inc.保留所有权利 2022年11月8日 通过 Kinome Innovation 第一阶段单一 递增剂量(SAD)试验 - 2138, 和 口服 同价ITK/TXK/JAK3(ITJ) 抑制剂 初步数据 |
| ©版权所有2022 Aclaris Treateutics,Inc.保留所有权利 本演示文稿中包含的任何未描述历史事实的陈述可能构成前瞻性陈述 - 该术语在1995年《私人证券诉讼改革法案》中定义。这些陈述可以通过诸如“Believe ”、“ ”“Expect”、“ ”“May”、“”plan“”、“Potential”、“Will”和类似的表达方式来识别,并且基于Aclaris当前的信念和期望。这些 e f 前瞻性 陈述包括对ATI - 2138作为T细胞介导的自身免疫性疾病的潜在治疗方法的预期,以及ATI - 2138的临床 发展。这些陈述涉及风险和不确定性,可能导致实际结果与此类陈述中反映的结果大不相同。可能导致实际结果大相径庭的风险和不确定性包括:临床试验进行过程中固有的不确定性,Aclaris对第三方的依赖,而它可能并不总是完全控制第三方,关于COVID - 19大流行的不确定性,包括它对Aclaris监管和 研究和开发活动时间的影响,以及在截至12月31日的年度Aclaris年度报告表格10 - K的风险因素部分描述的其他风险和不确定性 , 2021年 和Aclaris不时向美国证券交易委员会提交的其他文件。这些文件可从Aclaris网站http://www.aclaristx.com.投资者栏目的“美国证券交易委员会备案”页面获得。任何前瞻性陈述 - 截至本演示文稿发布之日仅供参考 ,并基于截至本演示文稿发布之日Aclaris可获得的信息,因此Claris承担 没有义务也不打算更新任何前瞻性陈述,无论是由于新信息、未来的 事件还是 其他原因 有关前瞻性陈述的警示说明 - 前瞻性陈述 2 |
| ©版权所有2022年Aclaris Treateutics,保留所有权利 · ATI - 2138共价阻止Itk/Txk/JAK3 1 ➢ T细胞受体(Tcr)信号所需的潜在协同效应 · Tcr}· 血浆清除后cytokines (IL - 2/4/7/9/15/21) ➢ PD效应所需的JAK3持续存在 g c· ATI - 2138对T细胞信号转导具有选择性 2,3 ➢ 环孢素A等药物抑制广泛表达的钙调神经磷酸酶 ➢ ATI - 2138针对仅在免疫细胞中表达的独特激酶 - ATI - 2138有可能治疗T细胞 - 介导的 自身免疫性疾病 4,5 ATI - 2138:可能导致溃疡性结肠炎和其他T细胞介导的疾病的共价ITK/TXK/JAK3(ITJ)抑制剂 - 1.存档数据。 2.Graham RM. Cleve Clin J Med. 1994;61(4):308 - 313. 3. Siliciano JD,等人 美国国家科学研究院 。1992年;89(23):11194 - 11198. 4.Robinson MF等人。[在印刷前在线发布,2020年5月18日]. 关节炎 大黄醇 。2020年。 5.Russell SM等人。 科学 。1995年;270(5237):797 - 800。 · 第一阶段单次递增剂量研究成功 于2022年10月向消化内科提交了新的IND · 正在等待FDA的反馈,有望在2022年底启动第一阶段 多个递增剂量研究 · 第二阶段溃疡性结肠炎概念验证研究正在开发中 背景 状态 |
| ©版权所有2022 Aclaris Treateutics,Inc.保留所有权利 研究设计 资格 · 年龄从18岁到55岁的健康受试者 ,包括筛查 最低体重50公斤 · 体重指数18到 32 kg/m 2 ,包括 N=64 8个队列 6个手臂主动/2控制 目标 主要 · 评估安全性和安全性健康受试者单剂量口服ATI - 2138的耐受性和药代动力学(PK)图 次级 · 评估食物对单次口服ATI - 2138的耐受性和药代动力学(PK)的影响以评估制剂 (片剂与胶囊)对ATI的pK的影响 单剂量口服ATI - 2138 4 Cohort No. Subjects Planned Dose 1 8 1后 -2138 · 探讨单剂量口服ATI -2138后的药效学反应 3 8 5 mg 4 8 15 mg 1 5 8 25 mg 2 6 8 50 mg 7 8 50 mg 3 8 8 80 mg 1. 队列4(食物效应;禁食与喂食) 2. 队列5(制剂搭桥;片剂与胶囊) 3. 队列7(由于队列6的预期变异性高于预期,重复了50 mg队列) |
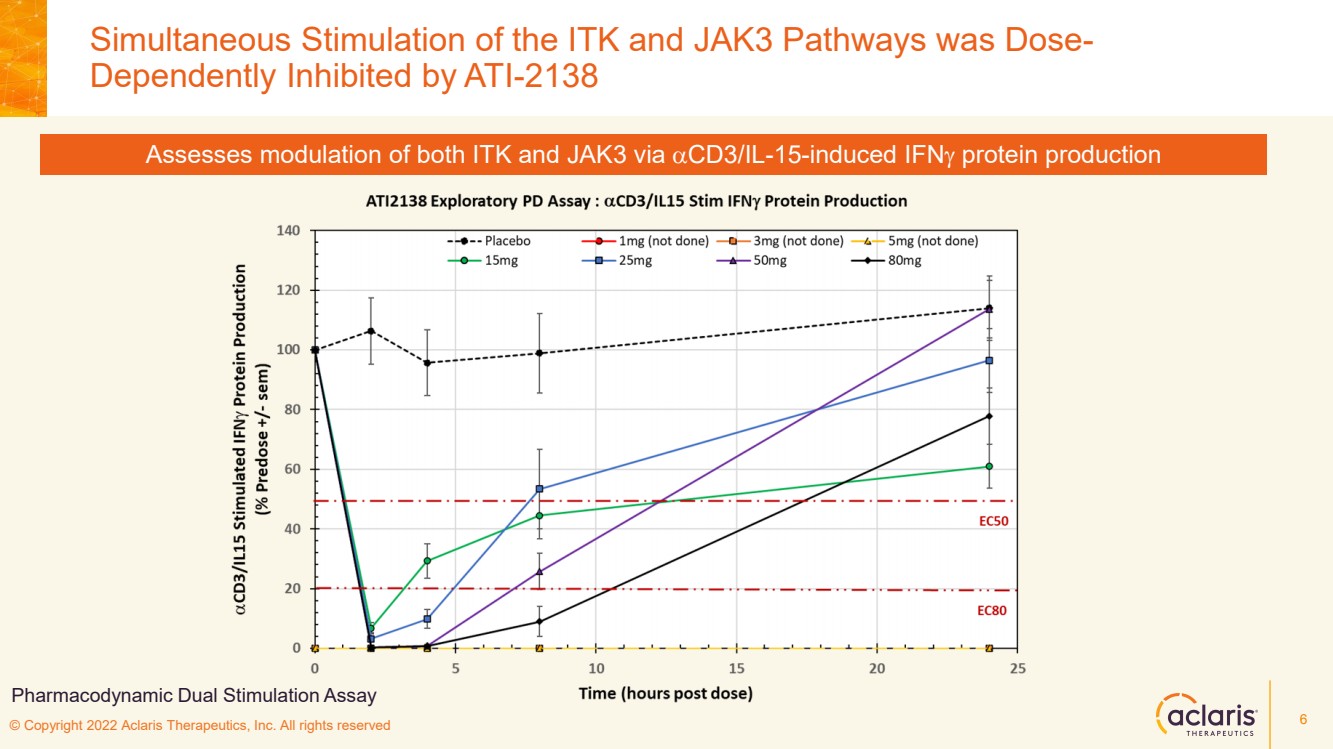
| © Copyright 2022 Aclaris Therapeutics, Inc. All rights reserved • Safety ‒ ATI - 2138 was generally well tolerated at all doses tested in the trial. No serious adverse events or severe adverse events were reported. The most common adverse events in subjects treated with ATI - 2138, headache (four subjects) and lightheadedness (two subjects), were mild and transient. • PK ‒ The PK data were linear, and absorption was linear. This shows that ATI - 2138 has a favorable PK profile up to 80 mg single dose. ‒ Terminal half - life ranged from 1.5 – 2.5 hours. ‒ No significant food effect at 15 mg (fasted versus fed) was observed. ‒ Similar PK was observed with the capsule versus tablet formulations at 25 mg. • PD ‒ Dose - dependent inhibition of both ITK and JAK3 exploratory PD biomarkers was observed. • Near complete inhibition of the dual ITK and JAK3 - stimulated IFN g protein production was observed at the 15 mg through 80 mg doses. Preliminary Data 5 |
| © Copyright 2022 Aclaris Therapeutics, Inc. All rights reserved Simultaneous Stimulation of the ITK and JAK3 Pathways was Dose - Dependently Inhibited by ATI - 2138 6 Assesses modulation of both ITK and JAK3 via a CD3/IL - 15 - induced IFN g protein production Pharmacodynamic Dual Stimulation Assay |