目录表
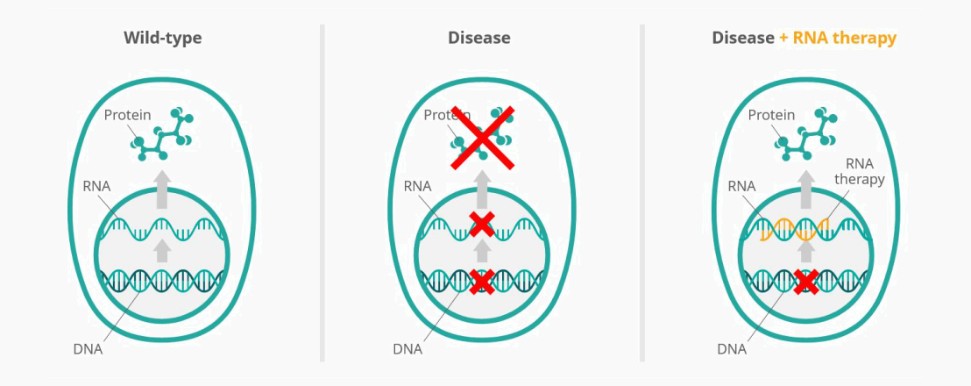
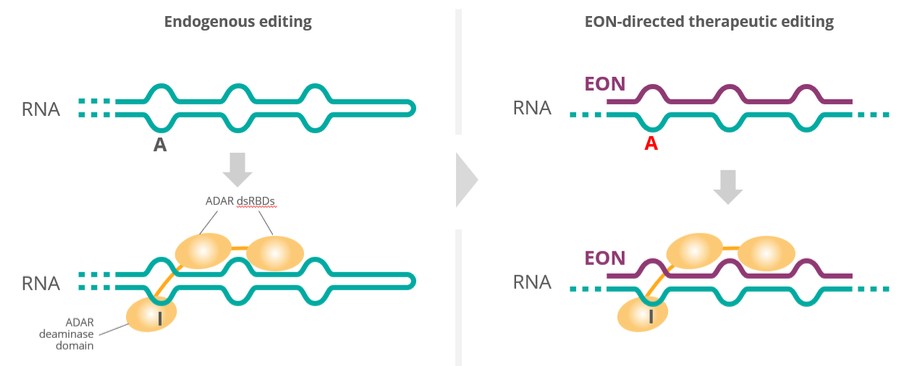
我们正在研究的RNA疗法是经过化学修饰的单链RNA寡核苷酸,以增强稳定性和细胞摄取。我们的每一种研究RNA疗法都旨在修复特定的RNA突变,我们相信,与其他治疗方法相比,这种有针对性的方法在治疗我们瞄准的罕见遗传病方面可能提供几个优势。
Sepofarsen治疗Leber先天性巨结肠10例
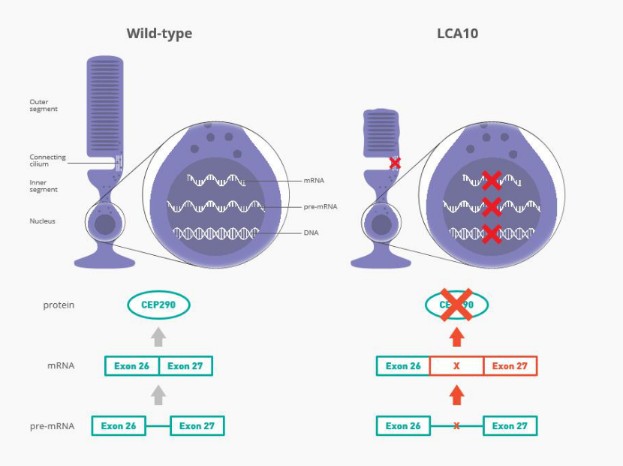
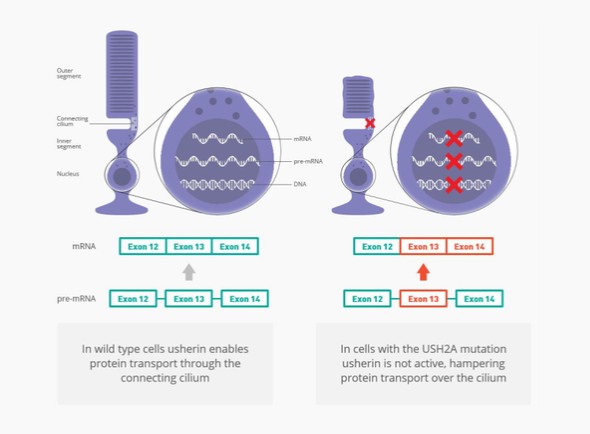
Leber先天性黑发(LCA)是导致儿童失明的最常见遗传原因,其中LCA10型(LCA10)是最严重的形式之一。患有LCA10的人通常在生命的头几年就会失明,目前还没有批准的治疗方法。最常见的突变是C.2991+1655A>G(也称为p.Cys998X)CEP290吉恩。我们估计这种突变发生在西方世界大约2000名患者中。
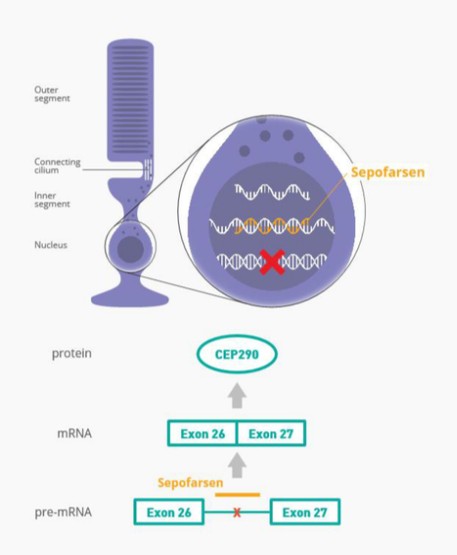
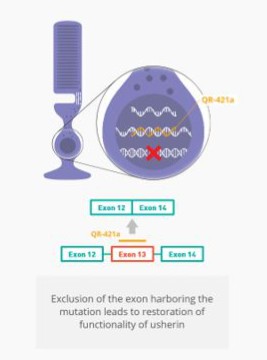
Sepofarsen正在开发中,作为一种潜在的治疗方法,用于治疗因p.Cys998X突变而患有LCA10的患者。Sepofarsen的目标是通过剪接纠正修复RNA中的潜在原因。这种RNA剪接校正允许生产正常的(野生型)CEP290可以恢复LCA10患者视力的蛋白质。Sepofarsen是通过玻璃体内注射在眼睛内给药的。
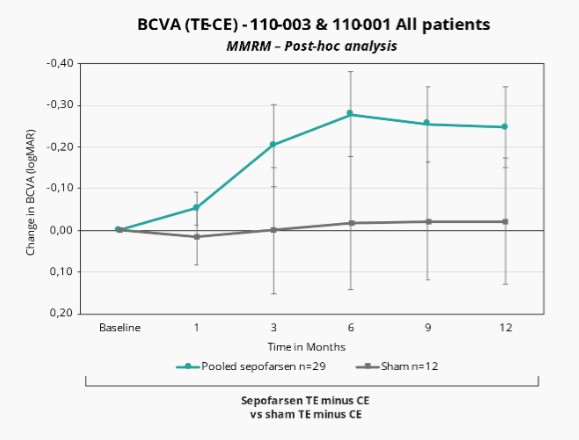
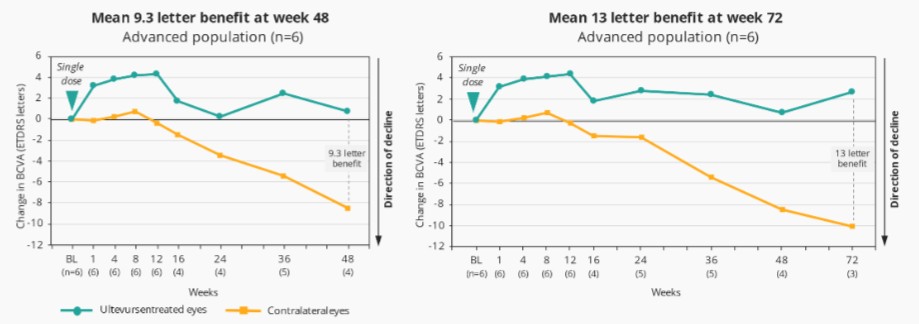
Sepofarsen对因p.Cys998X突变导致的成人和儿童LCA10的1/2期临床试验已经完成。我们在2020年视觉和眼科研究协会(ARVO)年会上公布了这项试验的最终数据,在会上,Sepofarsen在LCA10患者中展示了临床概念验证,大多数患者的视力都有了显著、快速和持续的改善。
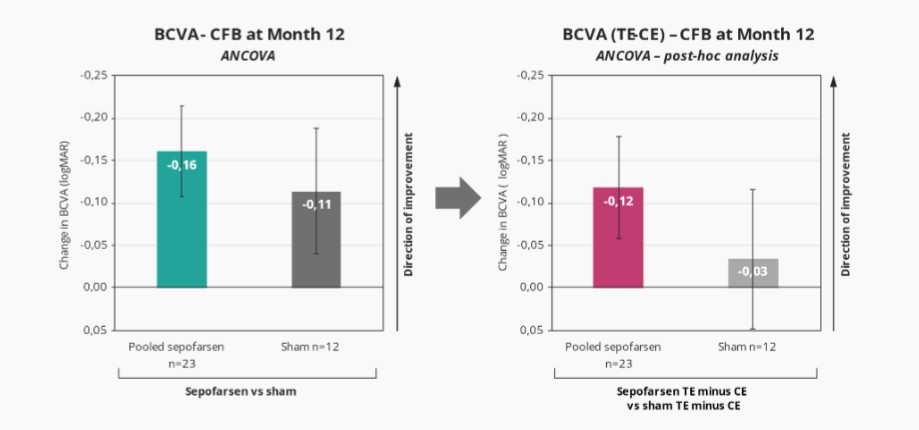
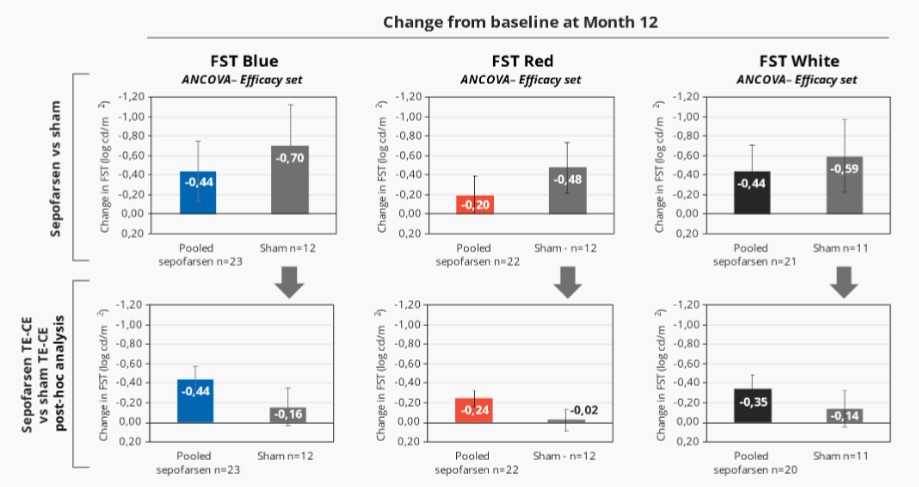
2022年2月,我们宣布照亮,我们关键的Sepofarsen 2/3期试验CEP290-LCA10,与假手术对照组相比,在12个月时没有达到最佳矫正视力(BCVA)的主要终点。事后分析显示,在BCVA、全场刺激测试(FST)和其他终点(包括患者报告的结果(PRO))中,将积极治疗和假眼与相应的对侧眼睛进行比较时,sepofarsen的疗效信号与早期研究结果(以对侧眼作为对照)中看到的结果更一致。我们计划在2022年第三季度与EMA和FDA会面,讨论这些数据。
数据来自照亮试验将在2022年4月29日举行的第七届年度视网膜细胞和基因治疗创新峰会和2022年5月1日至4日举行的视觉和眼科研究协会(ARVO)年会上公布。
56