
7897269 Orchard Treeutics(Europe)Limited和Pharing Technologies B.V.之间的V13执行版研究合作和许可协议,日期为2021年7月1日

7897269 V13 1本研究合作和许可协议由以下公司签订并于2021年7月1日(“生效日期”)生效:(1)Orchard Treeutics(Europe)Limited,一家根据英格兰和威尔士法律成立的公司,其办事处位于伦敦Cannon Street 108号EC4A 6EU(“Orchard”);(2)Pharing Technologies B.V.,一家根据荷兰法律成立,办事处位于荷兰达尔文韦格24,2333 CR Leiden,荷兰(“Pharming”)的公司。Orchard和Pharming有时在本文中单独称为“当事人”,并统称为“当事人”。背景(A)Orchard是一家全球性的商业阶段的生物制药公司,开发创新的基因疗法,并拥有或控制着某些关于造血干细胞慢病毒介导的基因疗法的研究和开发的知识产权。(B)Pharming是一家全球性的商业阶段生物制药公司,开发创新的蛋白质替代疗法和精准药物,用于治疗罕见疾病和未得到满足的医疗需求。(C)双方同意合作研究、开发和制造一种体外自体造血干细胞慢病毒介导的基因疗法,Pharming将对其进行商业化,所有这些都将在本协议中进一步阐述。因此,考虑到下文所述的相互承诺和条件,以及其他良好和有价值的对价,现确认这些对价的收据和充分性,双方拟受法律约束,特此协议如下:

7897269 V13 2第1条定义本协议中使用的下列大写术语,无论是单数还是复数,应具有下列含义:1.1第9.3.1节(开发里程碑付款)中使用的“FDA对药品批准申请的接受”是指FDA对药品批准申请足够完整以允许进行实质性审查的确定(与21 C.F.R.§314.101(A)中“提交”NDA的定义一致)。1.2“会计准则”对每一缔约方而言是指国际财务报告准则(IFRS)。1.3“额外竞争计划”是指(I)任何竞争计划,和/或(Ii)任何造血干细胞基因治疗产品的研究、开发、推广、监管批准或商业化。1.4“从属关系”就一方或其他人而言,是指通过一(1)个或多个中间人直接或间接控制、被该方或其他人控制或与该方或其他人共同控制的任何人。就本定义而言,“控制”以及具有相关含义的术语“控制”、“受控制”和“受共同控制”是指(A)直接或间接拥有指导某人的管理或政策的权力,无论是通过有表决权证券的所有权、通过与投票权或公司治理有关的合同,还是通过其他方式;或(B)个人(或就有限合伙或其他类似实体而言,指其普通合伙人或控股实体)直接或间接拥有超过50%(50%)的有投票权证券或其他所有权权益。1.5“协议”是指本协议和所有附表, 本协议附件及其他附件中的任何一项均可根据本协议的规定进行修改。1.6“联盟经理”的含义见第2.10节。

7897269 V13 31.7“年度净销售额”是指许可产品在特定年度的总净销售额,或就包括首次商业销售的年度而言,指自首次商业销售之日起至发生首次商业销售的年度结束为止的期间。1.8“反腐败法”具有第13.3.4节规定的含义。1.9“适用法律”是指联邦、州、地方、国家和超国家的法律、法规、规则和条例,包括政府当局、主要国家证券交易所或主要证券上市组织可能在任期内不时生效并适用于本协议所述特定活动或国家或其他司法管辖区的任何规则、法规、指导方针或其他要求。1.10“营业日”指荷兰阿姆斯特丹、纽约、美利坚合众国和英国伦敦的银行机构在星期六或星期日以外的日子营业。1.11“集中审批程序”是指向欧洲市场管理局提交的MAA获得在整个欧盟范围内有效的单一营销授权的程序。1.12“控制权变更”就一方而言是指:(A)一方(或一方的控股公司)出售、转让或以其他方式处置其全部或基本上所有财产或业务的交易;或(B)一方(或一方的控股公司)与任何其他人(该方的全资子公司或控股公司除外)合并或合并的交易,或(Ii)任何其他交易或一系列交易;在第(I)或(Ii)款的每一种情况下, 因此,任何人和/或任何一致行动的人(如守则中定义的那样)获得了该缔约方(或该缔约方的控股公司)的控股权。就第1.12或1.107节而言,下列大写术语应具有下列含义:

7897269 V13 4“法规”系指英国关于收购和合并的城市法规;“控股权益”是指赋予一名或多名持有人以下权力的股份权益:(A)透过持有股份或拥有与该法人团体或任何其他法人团体有关的投票权,及/或(B)由于规管该法人团体或任何其他法人团体的组织章程细则或其他文件所赋予的任何权力;(I)选举公司董事会或类似管治机构的过半数成员及/或(Ii)该公司的事务是按照该持有人或该等持有人的意愿处理;“控股公司”的含义与2006年“公司法”第1159条赋予“控股公司”的含义相同。1.13“索赔”具有第14.1节规定的含义。1.14“临床开发计划”是指列出以下内容的计划:(I)将由Pharming或代表Pharming进行的临床开发活动,(Ii)将由Orchard执行的制造活动以及技术和知识转让义务,以及(Iii)由任何一方或双方执行的与NTCR相关的开发活动,因为该计划已由JSC根据第2.2.5节批准,并经JSC根据第2.2.5节不时修订。1.15“临床研究”是指任何和所有第1阶段试验、第2阶段试验、第3阶段试验、第4阶段试验和Pivotal研究,以及适用法律要求或任何适用监管机构以其他方式建议的人体受试者的其他测试和研究,以获得或维持许可产品的监管批准, 包括旨在扩大许可产品的批准适应症的此类测试或研究。1.16“合作”是指双方就本协议的主题--许可产品--进行的合作。1.17“商业化”是指任何与准备销售、要约销售或销售任何许可产品有关的活动,包括与以下有关的活动

7897269 V13 5销售、推广、分销、进口和出口此类产品,就本协议项下各方的权利和义务而言,应被视为包括开展医疗事务活动和进行第四阶段试验,并就上述任何一项与监管当局进行互动。当用作动词时,“商业化”和“商业化”的意思是从事商业化,而“商业化”也有相应的意思。1.18“商业上合理的努力”是指:1.18.1就一缔约方的活动而言,是指利用该缔约方及其关联公司通常为开展此类活动而投入的努力和资源,在开发或产品生命周期的类似阶段,对具有类似市场潜力的产品进行此类活动,同时考虑到该缔约方及其关联公司通常会考虑的所有科学、商业和其他因素,包括:(1)[预期和实际成本以及开发时间的问题]、(Ii)[发展阶段], (iii) [有效性和安全性](四)实际的或预期的[监管部门批准](五)预期和实际情况[贴标]、(Vi)预期和实际[盈利能力(包括特许权使用费和本协议规定的其他付款)]、(Vii)预期和实际情况[替代第三方产品(包括仿制药)在市场上的竞争力]、(Viii)以及预期和实际情况的性质和程度[市场排他性(包括专利覆盖率、专有地位和监管排他性)]、(Ix)预期和实际情况[可报销和定价]以及(X)预计和实际的[所需的营销和促销费用];但在任何情况下,此类努力和资源应不少于双方各自行业中处境相似且声誉良好的公司所做的努力(考虑到上述科学、商业和其他因素);以及1.18.2对于由该缔约方或其任何附属公司在本协议允许的情况下分包给第三方的活动,应谨慎行事

7897269 V13 6以及该缔约方或其关联方在(A)选择该第三方、(B)与该第三方订立分包合同(包括就其条款而言)以及(C)该分包合同的管理(在每种情况下均为(A)、(B)和(C))方面所作出的努力,符合相关分包方通常采用的标准,并且在任何情况下,该第三方应促使该第三方至少按照第1.18.1节中所述的努力和资源水平进行该分包活动,就好像该分包商就是该分包方一样。1.19“竞争性侵权”具有第11.3.1节规定的含义。1.20“竞争性计划”的含义如第4.1节所述。1.21“调理方案”是指任何用于[耗尽残存的造血干细胞]在服用许可产品之前的患者中。1.22“保密信息”是指一方(或其关联方或代表)或其代表就本协议向另一方(或该方的关联方或代表)提供的任何口头、视觉、书面或其他形式的信息或数据,包括与本协议的条款、任何许可产品、对任何许可产品的任何开发、由披露方或其关联方开发的任何专有技术(包括制药合作专有技术和果园合作专有技术)有关的任何信息或数据。或任何一方的科学、法规、商业事务或其他活动。尽管如此,(A)果园背景IP、果园协作IP、果园调理IP和平台IP将被视为果园的保密信息,(B)制毒背景IP、制毒协作IP和制毒调理IP将被视为制药业的保密信息,以及(C)联合协作IP和联合调理IP将被视为双方的保密信息,双方均应被视为接收方和披露方。

7897269 V13 71.23“控制”是指,对于任何信息、专有技术、材料、专利或其他财产权以及一方或其关联方,该方或其关联方直接或间接地,无论是通过所有权、许可证、不起诉的契约或其他方式(通过本协议中许可的操作和其他授予除外),授予对该等信息、专有技术、材料、专利或其项下的许可、再许可或其他权利,或本协议规定的其他财产权,但不违反与任何第三方的任何协议或其他安排的条款;但是,对于由该缔约方或其附属公司从第三方获得许可的上述任何内容,如果(A)向另一方授予对该项目或权利的访问或许可,和/或(B)在(A)或(B)两种情况下,另一方行使该许可项下的权利,将触发一方对第三方的付款义务,该项目或权利(视情况而定)应:(A)如果该方是果园,只有在以下情况下,Pharming才被视为由Orchard控制:(I)Pharming书面同意并签署双方均可接受的协议,确认Pharming应负责因授予Pharming访问或许可和/或Pharming在该许可下行使该等权利而产生的付款义务,以及相应第三方根据Orchard与该第三方之间的适用许可协议所要求的任何其他义务,作为该再许可的条件;以及(Ii)仅在构成制造工艺改进的任何专有技术或专利的情况下, 在Orchard根据第2.2.7节披露的范围内,或Orchard或其关联公司以其他方式提供或提供用于合作;或(B)如果该方是Pharming,则不应被视为受Pharming方或其关联公司控制。尽管有上述规定,任何一方或其关联公司都不会被视为“控制”任何信息、专有技术、材料、专利或其他财产权,该信息、专有技术、材料、专利或其他财产权是由该一方的关联公司拥有或控制的,而该关联公司在紧接该缔约方的控制权变更之前不是该缔约方的关联公司:(1)在该控制权变更之前,该信息、技术诀窍、材料、专利或其他财产权不是通过使用或合并该缔约方或其任何关联公司(在该控制权变更之前是该缔约方的关联公司)材料而产生的,专有技术或专利权,或通过对许可产品的利用,或(2)在该当事一方的控制权发生变更后,

7897269 V13 8使用或合并任何果园背景IP、药剂背景IP、果园协作IP、联合协作IP、药剂协作IP、果园调理IP、联合调理IP和药剂调理IP,并在不涉及许可产品开发的范围内通过活动产生。1.24“成本”是指所有:(A)自付成本和费用以及(B)全时工作成本。1.25“涵盖”指,就有关的特定标的物及相关专利而言,在该专利没有拥有权或特许的情况下,该标的物的制造、使用、销售、要约出售或进口会侵犯该专利的一项或多项已发出的有效权利要求,或就该专利所包括的待决权利要求而言,该标的物的制造、使用、销售、要约出售或进口会侵犯该专利,而该等待决权利要求是在已发出的专利中发出的。1.26“开发”是指在首次提交IND时或之后进行的与许可产品的临床开发有关的所有活动,包括但不限于测试、测试方法开发和稳定性测试、毒理学、配方、工艺开发、生产规模扩大、资格和验证、质量保证/质量控制、临床研究(包括为其提供支持的制造)、统计分析和报告撰写、药品审批申请的准备和提交、与上述有关的监管事务。以及监管当局作为条件或支持获得或维持监管批准而要求或要求的所有其他必要或合理有用的活动。当用作动词时,“发展”的意思是从事发展。为清楚起见, 开发应包括适用法律或监管机构要求的作为获得批准的许可产品的定价或补偿批准的条件或支持的任何提交(和支持提交的活动)。1.27“发展里程碑付款”的含义见第9.3.1节。1.28“发展里程碑”具有第9.3.1节规定的含义。1.29“争议”具有第16.8(A)节规定的含义。

7897269 V13 9 1.30“分销商”的含义如第3.4节所述。1.31“美元”或“$”指美元。1.32“药品批准申请”是指(A)根据《联邦食品、药品和化妆品法》第505条和《联邦法规》第21章314.50节(“新药品法”)向食品和药物管理局提交的新药申请;(B)根据《公共卫生服务法》第351(A)条和根据其颁布的法规向食品和药物管理局提交的生物制品许可证申请;(C)向美国以外任何国家或司法管辖区的监管当局提交的销售及/或销售生物制品或药剂制品的授权申请,就欧盟而言,包括根据中央审批程序向欧洲专利局提交的销售授权申请;或。(D)就已获适用的监管当局批准的任何生物制品或药剂制品而言,补充、修订或更改该等专利品、BLA或MAA的申请。1.33“生效日期”系指本协议序言中规定的本协议的生效日期。1.34“选举公告”具有第15.6.2节所载的涵义。1.35“欧洲药品管理局”是指欧洲药品管理局和任何具有实质上相同职能的后续机构或机构。1.36“欧洲联盟”系指成员国的经济、科学和政治组织,称为欧洲联盟,其成员可随时变更,其任何继承者。1.37“开发”或“开发”是指制造、制造、进口、进口、出口、出口、使用、使用、销售、出售、要约出售或要约出售,包括研究、开发、商业化、登记、制造、制造、持有, 或保存(无论是否为了处置),或以其他方式处置。

7897269 V13 101.38“食品和药物管理局”是指美国食品和药物管理局和任何具有实质上相同职能的后续机构或机构。1.39“领域”是指对人类的任何和所有用途,包括诊断、预防、治疗、缓解或治愈任何人类适应症。1.40“首次商业销售”,就许可产品和国家而言,是指在该国监管部门批准该许可产品后,供该许可产品的最终用户在该国家使用或消费的第一次货币值销售。为免生疑问,在该国监管部门批准许可产品后,该许可产品在该国的任何所谓的“治疗销售”、“指定患者销售”和/或“同情使用销售”应构成该许可产品在该国的首次商业销售。1.41“FTE”指相当于一(1)名具有适当资质的个人在十二(12)个月内全职从事与本协议有关的工作的工作量,至少包括[1,680(1,680)]每年的工作时数。1.42“FTE成本”是指一方在履行与本协议有关的工作时发生的内部成本,即该方在履行工作中产生的FTE乘以FTE费率。1.43“全时税率”是指自生效之日起至2021年12月31日止的期间,[30万美元(30万美元,约合人民币186万元)]每个FTE。此后,全时当量税率应为[在1月1日增加或减少]每一年的[英国国家统计局公布的英国消费者价格通胀年度涨幅或降幅]。1.44“通用竞争”具有第9.5.3(C)节规定的含义。1.45“通用产品”是指,就特定的许可产品(“参考产品”)和监管管辖权而言,任何由非Pharming关联公司或从属受让人的第三方销售的产品

7897269 V13 11监管机构在该监管管辖区向该第三方授予,并且(A)含有许可产品的相同活性成分(或任何同等衍生品),(B)其监管批准是通过参考对参考产品的监管批准而给予的,和/或(C)被批准为(I)参考产品的生物相似物(根据美国《美国法典》第42篇第262(I)(2)节的定义),(Ii)“类似生物药用产品”(根据欧盟指令2001/83/EC),就其而言,参考产品是“参考药用产品”,或(Iii)如果不在美国或欧盟,则为该参考产品的“生物相似”或“类似生物药用产品”的外国等价物。1.46“政府官员”是指(A)代表政府、政府控制的机构或实体或公共国际组织行事的任何人,(B)任何政党、政党官员或候选人,(C)担任或履行根据习俗或惯例设立的任命、职位或职位的任何人,或(D)任何自称是上述任何人的授权中间人的人。1.47“政府当局”系指具有管辖权的任何法院、行政机关、地方当局或其他政府或准政府实体、任何超国家、国家、联邦、州、市、省或地方政府、监管或行政当局、机关、委员会、法院法庭、仲裁机构、自律实体、行使任何监管、征税、进口或其他政府或准政府权力机构或其他政府实体, 包括任何相关的监管机构。1.48“高发二次适应症”是指许可产品未在美国获得孤儿药物称号的二次适应症。1.49“IND”是指向监管当局提交的授权开始临床研究的申请,包括(A)经修订的美国联邦食品、药物和化妆品法案中定义的调查性新药申请,或向FDA提交的任何后续申请或程序,(B)其他国家或监管司法管辖区的任何等同于美国IND的申请,(例如,临床试验

7897269 V13 12申请),以及(C)可能就上述内容提交的所有补充、修订、变更、延期和续订。1.50“IND许可”就IND而言,是指:(A)Pharming、其任何关联公司或任何次级受让人收到监管当局的书面确认,确认可根据该IND开始或进行临床研究;或(B)在适用的等待期过后,可根据该IND开始或进行临床研究。1.51“受偿人”具有第14.3节规定的含义。1.52“赔偿人”具有第14.3节规定的含义。1.53“适应症”是指一种疾病、紊乱、疾病或健康状况及其所有相关迹象、症状、阶段或前述的任何进展(包括先兆疾病),在每种情况下,都需要进行单独的关键研究。1.54“间接税”具有第10.4.2节规定的含义。1.55“信息”系指技术、科学、商业或其他性质的所有知识,包括技术诀窍、技术、手段、方法、过程、实践、配方、说明、技能、技术、程序、经验、想法、技术援助、设计、图纸、组装程序、计算机程序、仪器、规格、数据、结果和其他材料、法规数据以及其他生物、化学、药理、药物、物理和分析、临床前、临床、安全、制造和质量控制数据和信息,包括研究设计和方案、试剂(例如,质粒、蛋白质、细胞系、分析和化合物)和生物方法;在每一种情况下(无论是否保密、专有、专利或可专利,或具有商业优势)以书面、电子, 或现在已知或以后开发的任何其他形式。1.56“侵权”的含义如第11.3.1节所述。

7897269 V13 131.57“启动”是指,就临床研究而言,在该临床研究的第一个(第一个)人类受试者中首次使用许可产品。“启动”有一个相关的意思。1.58“联合协作知识产权”是指联合协作专利和联合协作专有技术。1.59“联合协作专有技术”是指在生效日期后,一方面由Pharming或其关联方或其代表以及Orchard或其关联方或其代表在执行本协议项下的活动时联合、构思或开发的任何及所有专有技术,但不包括所有平台专有技术、Orchard协作专有技术、Pharming Collaboration专有技术和联合调节专有技术。1.60“联合协作专利”是指涵盖任何联合协作专有技术的任何和所有专利。1.61“联合调节知识产权”是指联合调节专有技术和联合调节专利。1.62“联合调理专有技术”指在生效日期后,一方面由Pharming或其联营公司或其代表,以及由Orchard或其联属公司或代表Orchard或其联属公司在执行本协议项下与调理方案有关的活动时联合、构思或开发的任何及所有专有技术,但不包括所有平台专有技术、Orchard协作专有技术和Pharming协作专有技术。1.63“联合调节专利”是指涵盖任何联合调节专有技术的任何和所有专利。1.64“联合指导委员会”或“联合指导委员会”的含义如第2.1节所述。1.65“专有技术”是指任何和所有数据、结果、发明、方法、过程、实践、商业秘密、技术、技术和其他专有信息,无论是否可申请专利,但一般不为人所知, 包括发现,公式,

7897269 V13 14材料(包括化学品)、生物材料(包括表达结构、核酸序列、氨基酸序列和细胞系)、临床试验和患者选择设计和方法、测试数据(包括药理、毒理、临床前和临床前信息和测试数据)、分析和质量控制数据(包括药物稳定性数据)、制造技术和数据(包括配方数据)、销售预测、数据和描述。1.66“知识”是指Orchard的首席业务官和总法律顾问的实际知识,不需要进行任何具体的查询或尽职调查。1.67“[LCIA]规则“具有第16.8(B)节规定的含义。1.68“许可产品”是指根据本协议开发的任何体外自体造血干细胞慢病毒介导的基因疗法,无论是全部还是部分。1.69“损失”具有第14.1节规定的含义。1.70“低发病率二次适应症”是指许可产品在美国获得孤儿药物称号的二次适应症。1.71“制造”和“制造”是指与任何分子、产品或其任何中间体的合成、制造、生产、加工、提纯、配制、填充、整理、包装、标签、运输和持有有关的所有活动,包括工艺开发、工艺鉴定和验证、放大、临床前、临床和商业生产和分析开发、产品表征、供应链、稳定性测试、质量保证测试和放行以及质量控制,“制造”和“制造商”具有相关含义。1.72“制造过程”是指与许可产品的制造有关的所有信息,包括慢病毒载体、制造方法、测试方法、规格、材料以及与许可产品的制造相关的其他程序、指导和控制。

7897269 V13 151.73“制造过程改进”是指由Orchard或其关联公司控制的任何专利或专有技术,(A)构成对制造过程的修改、增强、开发或改进,(B)在从生效日期至许可产品的第一个药品批准申请在区域内任何地方提交的期间内的任何时间,独立于协议的履行而创建、构思或开发,以及(C)Orchard根据第2.2.7节向Pharming披露或有义务披露的任何专利或技术。1.74“[MolMed]“意思是[AGC Biologics Spa]及其附属公司。1.75“[MolMed]协议“是指Orchard与[MolMed]根据该条款,果园将安排授权产品的制造和供应[MolMed]自生效日期起至果园。1.76“净销售额”是指,就任何时期的许可产品而言,[已开票或开票的总金额]在此期间,Pharming、其关联公司或再被许可人在区域内以真诚的公平交易将许可产品销售给第三方(包括分销商),减去以下实际发生的扣减,在每一种情况下,都与许可产品有关,且未由Pharming、其关联公司或再被许可人以其他方式收回或补偿:(A)[贸易、现金和数量折扣]; (b) [销售税(如销售税、增值税或使用税),增加到销售价格上,并在发票总额中单独列出]; (c) [因退货、缺陷、退货津贴、召回或退货,或因追溯降价而退还或记入贷方的金额]; (d) [给予第三方(包括政府当局、采购商、报销人、客户、分销商、批发商和管理人员)的回扣(或其等价物,包括绩效回扣)、行政费用、退款和追溯价格调整以及任何其他类似津贴

7897269 V13 16护理组织(及其他类似实体和机构)有效降低许可产品的销售价格或销售总额];及(E)[运费、保险费、进出口费和其他运输费加在销售价格上,并在发票总额中单独列明。]。净销售额不应包括[出于慈善、促销、临床前、临床、监管或政府目的的转让或处置,只要此类转让或处置是免费进行的]。净销售额应包括以下金额或公平市场价值[Pharming、其关联公司或分被许可人就许可产品收到的所有其他对价,无论此类对价是现金、实物支付、交换或其他形式]。净销售额不应包括[Pharming、其附属公司或分被许可人之间的销售]。除上述规定外,净销售额应根据Pharming、其关联公司或分被许可人的标准内部政策和程序计算,这些政策和程序必须符合会计准则,并与Pharming对外报告的经审计的净销售额一致。为了计算净销售额,所有净销售额应按照第10.3节的规定换算成美元。1.77“NTCR”指[减毒调理方案](A)不涉及使用[白花丹和/或特雷奥丹];及。(B)所需费用不超过[出院前在医院过夜两(2)次,没有已知的影响接受者生育能力的副作用]。1.78“NTCR活动”是指在临床前计划和/或临床发展计划中指定为NTCR活动的活动。为免生疑问,NTCR活动不应包括(I)特定于许可产品的任何活动,或(Ii)与NTCR或任何调节方案的实施有关的任何活动,而不是与其发展、改进或增强相反的任何活动。

7897269 V13 17 1.79“NTCR活动费用”具有第9.2.1(B)节规定的含义。1.80“NTCR预算”是指临床前计划和临床发展计划中所列的NTCR活动预算。1.81“正在进行的临床研究”具有15.6.3节规定的含义。1.82“果园背景知识产权”是指果园背景专利和果园背景技术。1.83“果园背景专有技术”指果园或其任何附属公司控制的任何和所有专有技术:1.83.1在生效日期,或在自生效日期起至就许可产品提交第一份药品审批申请期间的任何时间,该专有技术并非在履行本协议时产生的,在每种情况下,仅限于以下情况:(A)果园、其附属公司或分包商在履行本协议项下的活动时实际使用该专有技术;或提供给Pharming或其关联公司用于执行其在本协议项下的活动,如果是与许可产品的制造有关的任何专有技术,则该专有技术包括在实际用于生产许可产品的制造过程中,或(B)在不限制前述的情况下,为履行Pharming在本协议项下的义务或开发任何许可产品所必需的,或1.83.2构成根据第3.7节许可给Pharming的任何制造过程改进中所包括的专有技术。1.84“果园背景专利”是指果园或其任何附属公司控制的任何和所有专利:1.84.1在生效日期或从生效日期到许可产品的第一次药品批准申请期间的任何时间

7897269 V13 18是在领土的任何地方提交的,在履行本协议以外的情况下,这些专利由Orchard或其关联公司控制,但仅限于以下情况:(A)Orchard、其关联公司或分包商在执行本协议项下的活动时实际使用此类专利,或授权给Pharming或其关联公司用于执行其本协议项下的活动,如果是与许可产品的制造有关的任何专利,则此类专利涵盖实际用于制造许可产品的制造过程;或(B)在不限制前述规定的情况下,为履行Pharming在本协议项下的义务或开发任何许可产品所必需的;或1.84.2,构成根据3.7节授权给Pharming的任何制造工艺改进中包含的专利;或1.84.3,涵盖任何果园背景技术。为免生疑问,果园背景专利包括可不时以书面修订的附表1.84所载的专利。1.85“果园CMC成本”的含义见第8.1.3节。1.86“果园CMO”是指果园为制造和供应许可产品而雇用的任何第三方合同制造组织,包括第三方制造商。自生效日期起,在不限制上述规定的情况下,Orchard CMO预计包括[MolMed]。1.87“果园协作知识产权”是指果园协作专利和果园协作专有技术。1.88“果园协作专有技术”指在生效日期后完全由果园或其关联公司或其代表在执行本协议项下的活动时创造、构思或开发的任何和所有专有技术,但不包括所有平台专有技术和果园调节专有技术。

7897269 V13 191.89“果园协作专利”是指在生效日期后由果园或其关联公司控制的涵盖任何果园协作专有技术的任何和所有专利。1.90“果园调理知识产权”是指果园调理专利和果园调理专有技术。1.91“果园调理专有技术”是指在生效日期后完全由果园或其关联公司或其代表在执行本协议项下与调理方案有关的活动时创造、构思或开发的任何及所有专有技术,但不包括所有平台专有技术。1.92“果园调理专利”指涵盖任何果园调理专有技术的任何专利。1.93“果园决策事项”具有第2.8.2(A)节规定的含义。1.94“果园受偿人”具有第14.1节规定的含义。1.95“Orchard Platform Patents”指任何及所有涵盖Orchard或其联属公司或其代表单独创造、构思或开发的Orchard协作专有技术的平台专利。1.96“果园临床前研究费用”具有第9.2.1(A)节规定的含义。1.97“专利挑战”具有15.4节中规定的含义。1.98“专利”是指(A)所有国家、区域和国际专利和专利申请,包括临时专利申请和要求其优先权的任何和所有权利;(B)从这些专利、专利申请或临时申请提交的所有专利申请,或从要求其中任何一项优先权的申请提交的所有专利申请,包括分立、延续、部分延续、条款、转换条款和继续起诉申请;(C)已经颁发或将来从上述专利申请((A)和(B))发出或将来发出的任何和所有专利,包括实用新型, 小额专利、外观设计专利和发明证书;(D)现有或未来扩展或恢复机制的任何和所有扩展或恢复;

7897269 V13 20包括前述专利或专利申请或授予后程序((A)、(B)和(C))所产生的前述专利或专利申请或其他专利的重新生效、重新发布、重新审查和延期(包括任何补充保护证书等),以及(E)任何类似的专利权,包括所谓的流水线保护或任何前述专利申请和专利的任何引进、重新生效、确认或引进、注册专利或专利的补充。1.99“个人”是指个人、独资、合伙、有限合伙、有限责任合伙、公司、有限责任公司、商业信托、股份公司、信托、非法人团体、合资企业或其他类似的实体或组织,包括政府或政府的政治部门、部门或机构。1.100“制药背景知识产权”是指制药背景专利和制药背景技术。1.101“制药背景专有技术”是指自生效之日起,或在药明或其任何关联公司从事本协议项下活动以外的活动期间,由其或其代表开发或发明的任何和所有专有技术。1.102“普明背景专利”是指在生效日期或有效期内由普明或其任何关联公司控制的涵盖任何普明背景技术的任何和所有专利。1.103“Pharming COC Notify Date”具有第16.4节规定的含义。1.104“药品协作知识产权”是指药品协作专利和药品协作专有技术。为免生疑问,Pharming Collaboration IP不包括平台IP。1.105“医药协作专有技术”是指创建的任何和所有专有技术, 仅由Pharming或其代表在生效日期后构思或开发

7897269 V13 21关联公司执行本协议项下的活动,但不包括所有平台专有技术。1.106“Pharming Collaboration专利”是指在生效日期之后由Pharming控制的涵盖任何Pharming协作专有技术的任何和所有专利。1.107“Pharming竞争性收购”是指根据Pharming控制权变更而获得Pharming(或Pharming控股公司)或其财产或业务的控股权的任何人,其中,截至控制权变更之日,该收购人或其任何关联公司:1.107.1获得超过[25%(25%)]来自体外基因治疗产品的总收入的1.107.2[50%(50%)]该人或其任何附属公司正在开发的公开披露的产品中,有更多是体外造血干细胞基因治疗产品。1.108“调理专利”是指调理专利和调理专有技术。1.109“药剂调理专有技术”是指在生效日期后,仅由药明或其关联公司或其代表在执行本协议项下与调理疗法有关的活动时创建、构思或开发的任何和所有专有技术,但不包括所有平台专有技术。1.110“医药调理专利”是指涵盖任何医药调理专有技术的任何专利。1.111“损害被赔付人”具有第14.2节中规定的含义。1.112“1期试验”是指对许可产品进行的符合21 CFR§312.21(A)(或任何修订或后续法规)中定义的1期研究要求的人类临床试验,无论在何处进行此类临床试验。

7897269 V13 22 312.21(B)(或任何修订或后续法规)中定义的满足21 CFR§22(B)(或任何修订或后续法规)所定义的第二阶段研究要求的许可产品的人类临床试验,无论在何处进行,均指2期临床试验。1.114“第三阶段试验”是指符合21 CFR§312.21(C)(或任何修订或后续法规)中定义的第三阶段研究要求的许可产品的人体临床试验,无论在哪里进行此类临床试验。1.115“第4阶段试验”是指在从适当的监管机构获得许可产品的监管批准后对该许可产品进行的人体临床研究,包括(A)为加强对批准的适应症的营销或科学知识而自愿进行的试验,以及(B)因监管当局的请求或要求或作为先前批准的监管批准的条件而在监管批准之后进行的试验,包括应儿科书面请求或批准研究的条件而进行的研究。1.116就许可产品而言,“关键研究”是指:(A)满足第三阶段试验要求的临床研究;(B)Pharming指定为关键临床研究或注册临床研究;或(C)以其他方式设计产生的疗效数据,其性质和质量足以支持许可产品的药品批准申请。为清楚起见,第(C)款中描述的关键研究可以是任何形式的临床研究;然而,对于第(A)款中描述的临床研究以外的任何临床研究,, 只有在以下情况下,该临床研究才应被视为关键研究:(I)如果适用的监管机构书面同意,该临床研究将被视为足以获得许可产品监管批准的关键试验,且在授予监管批准之前不再进行进一步的临床研究;或(Ii)Pharming、其任何附属公司或许可产品的任何次级受让人根据该临床研究的结果向FDA、EMA或欧盟任何监管机构提交药品批准申请,作为关键研究,在这种情况下,为避免怀疑,该关键研究也应被视为已启动。

7897269 V13 23 1.117“平台”是指果园在生效日期存在的、在本协议之外开发的专有基因治疗平台,包括果园背景IP中描述的平台。1.118“平台知识产权”是指平台专利和平台专有技术。1.119“平台专有技术”是指在生效日期后创建、构思或开发的任何和所有专有技术:(A)由任何一方或其代表创建、构思或开发,或(B)由Pharming或代表Pharming共同创建、构思或开发,另一方面由Orchard或其代表(A)和(B)在执行本协议项下的活动时创建、构思或开发,只要该等专有技术仅与平台有关。1.120“平台专利”是指涵盖任何平台专有技术的任何专利。1.121“药品和医疗器械管理局”是指日本的药品和医疗器械机构以及任何具有实质上相同职能的后续机构或机构。1.122“临床前预算”是指临床前计划中列出的临床前计划的预算(不包括任何NTCR活动)。1.123“临床前计划”是指附表1.123所附的临床前研究计划。1.124“临床前研究”是指本协议项下一方或其代表根据临床前计划开展的活动(无论是单独进行还是与另一方共同进行)。1.125“定价批准”是指,对于政府当局授权药品或生物制品的报销或获取,或批准或确定定价的任何国家,收到(或,如果需要,则批准确定有效公布)此类报销或获取授权,或定价批准或确定(视情况而定)。1.126“主要适应症”是指诊断、预防、治疗, 人类遗传性血管性水肿的缓解或治愈。

7897269 V13 24 1.127“产品特定专利”是指明确且唯一要求许可产品的物质组成、制造和/或使用方法的任何果园背景专利、果园协作专利、果园调理专利或平台专利。在不限制前述规定的情况下:(A)由果园识别并于生效日期存在的特定产品专利载于附表1.127;(B)特定产品专利包括附表1.127所载的专利,以及声称因该等专利而享有优先权或因该等专利而产生的所有专利;及(C)双方可选择指定任何其他果园背景专利、果园协作专利、果园调节专利或平台专利为特定产品专利,但须受事先书面协议的规限。1.128“概念验证NTCR终点”是指临床前计划中列出的临床前活体概念验证NTCR研究的终点,范围为JSC根据第2.2.4节批准将其包括在临床前计划中,之后由JSC根据第2.2.4节进行修订。1.129“出版方”的含义见第12.5.3节。1.130“季度”是指每一连续三个历月的期间,从1月1日、4月1日、7月1日和10月1日开始,但第一个季度应从生效日期开始,并在生效日期后第一个日历月的前一天结束,最后一个季度应从上述日期中最后一个出现的日期开始,并在期限的最后一天结束。1.131“合理努力”是指,就一缔约方在本协定项下就许可产品进行的任何活动而言,至少使用相同程度的技能进行此类活动, 质量和维护,并至少使用相同水平的努力和资源,由该缔约方及其附属公司为自己在与许可产品类似的开发阶段或产品生命周期的其全资拥有的产品上使用。1.132“监管批准”是指,就领土内的一个国家或其他司法管辖区而言,任何和所有批准(包括药品批准申请)、许可证、

7897269 V13 25在该国家/地区或其他司法管辖区将许可产品商业化所需的任何监管机构的注册或授权,不包括在该国家或其他司法管辖区的定价批准。1.133“监管机构”是指任何适用的超国家、联邦、国家、地区、州、省级或地方政府或监管机构、机构、部门、局、委员会、理事会或其他实体,管理或以其他方式行使与本协议所述活动有关的权力,包括在领土内开发许可产品,包括食品和药物管理局、环境和药物管理局。1.134“监管独占性”是指,对于领土内的任何国家或其他司法管辖区,由该国家或其他司法管辖区的监管当局授予的除专利保护以外的额外市场保护,该保护授予独家商业化期间,在此期间,Pharming或其关联公司或再被许可人有权通过监管排他性权利(例如,新的化学实体独占性、新的用途或适应症独占性、新配方的独占性、孤儿药品独占性、儿科独占性或任何适用的数据独占性)在该国家或其他司法管辖区营销和销售许可产品。1.135“使用费专利”具有1.137节中规定的含义。1.136“特许权使用费支付”的含义见第9.5.1节。1.137“特许权使用费期限”是指,就领土内的每个国家而言,自许可产品在该国家首次商业销售之日起至(A)任何果园背景专利、果园合作专利、平台专利或联合合作专利的最后到期有效权利要求到期之日止的期间(前提是, 关于联合合作专利,其最早的优先日期是:(A)在该国,(B)被许可人的法规排他性到期;(B)被许可产品的第一个IND申请之前,该专利涵盖该国的被许可产品(这种专利包含这种有效权利要求,即“专利权使用费专利”);

7897269 V13 26产品在该国家/地区销售,以及(C)许可产品在该国家/地区首次商业销售十二(12)周年。1.138“销售里程碑付款”的含义见第9.4.1节。1.139“销售里程碑”的含义见第9.4.1节。1.140“二次适应症”是指除一次适应症外的任何适应症。1.141“高级管理人员”,对果园而言,是指其首席执行官或其指定人员;就法明而言,是指其首席执行官或其指定人员。1.142“分包商”是指缔约方根据临床前计划或临床开发计划向其分包其任何义务的任何承包商、分包商或其他供应商。1.143“从属被许可人”是指分销商或第三方以外的第三方,Pharming、其关联公司或从属被许可人将与开发或制造许可产品有关的任何活动分包给第三方,Pharming(或Pharming的从属被许可人)向其授予从属许可,以便在区域内开发、使用、进口、推广、要约销售、销售、已销售或以其他方式商业化任何许可产品。1.144“术语”具有第15.1节规定的含义。1.145“领土”是指世界各地。1.146“第三方”指果园、药明或果园或药明的关联公司以外的任何人。1.147“第三方制造商”是指JSC根据第2.2.10节批准的第三方制造商。1.148“有效权利要求”是指:(A)未决专利申请的权利要求,该权利要求是真诚地提出并正在起诉的,并且在没有上诉或重新提交申请的可能性的情况下没有被放弃或最终被驳回,前提是

7897269 V13 27此类起诉没有持续超过[八(8)]并进一步规定,如果此后发布了包含此类权利要求的专利,则该权利要求此后应根据下述(B)款被视为有效权利要求;或(B)任何已发布且未到期的专利的权利要求,其有效性、可执行性或专利性不受下列任何一项的影响:(X)不可挽回的失效、放弃、撤销、对公众的奉献或免责声明;或(Y)法院、政府机构、国家或地区专利局或具有管辖权的其他适当机构作出的无效、不可强制执行或不可申请专利的扣押、裁定或决定,这些扣押、裁定或决定是最终的,在允许上诉的时间内不可上诉或未上诉。1.149第9.3.1节(开发里程碑付款)中使用的“药品批准申请由环境管理机构进行验证”是指环境管理协会确定科学评估所需的所有必要的监管要素都已包含在药物管理评估中,从而启动了对药物管理评估的评估。1.150“年”是指从1月1日起至12月31日止的每十二(12)个日历月的连续期间, 但任期的第一年应自生效之日起至生效之年的12月31日止,任期的最后一年自任期结束之年的1月1日起至任期的最后一天止。1.151在本协议中:1.151.1凡提及某一特定条款或附表,均应指本协议中或根据本协议可不时修改的该条款或附表;1.151.2插入标题仅为方便起见,在解释本协议时应忽略;1.151.3表示男性的词语应包括女性,反之亦然,单数中的词语应包括复数,反之亦然;

7897269 V13 28 1.151.4“包括”、“包括”和“包括”一词的解释不应对上述词语的一般性作出任何限制;1.151.5对任何法规或条例的提及包括对该法规或条例的任何修改或重新颁布;1.151.6任何对寻求或以书面形式寻求或给予的通知或同意的提及应要求由适当授权的人签署同意或通知,但不包括通过电子邮件传达的同意或通知;1.151.7如果本协议与本协议所附任何附表之间存在任何不一致或冲突,则在该冲突的范围内,本协议正文中所述的规定应优先于所附附表中相冲突的规定,除非所附附表中明确规定本协议正文中的该规定优先于本协议正文中的该规定。第2条协作管理2.1联合指导委员会。在[十五(15)]在生效之日起数日内,或经缔约方共同商定,缔约方应成立一个联合指导委员会(“联合指导委员会”或“联合指导委员会”)。联委会应由每一缔约方的两(2)名代表组成,每一名代表都具有必要的经验和资历,使其能够代表各方就属于联委会职责范围内的问题作出决定。尽管各方不时做出诚意努力,以确保在联委会中代表各方的关键人员的连续性,但每一缔约方均可通过事先向另一方提供书面确认(可以通过电子邮件)来替代一名或多名其在联委会的代表,只要被替代的联委会成员具备必要的经验和资历,使其能够按照本协议的规定代表各方作出决定。JSC主席应由Orchard在特许产品IND许可前选出的代表之一和由以下机构选出的代表之一担任

7897269 V13 29之后。指定方可在书面通知另一方后,不时更换担任主席的代表。2.2司法人员叙用委员会的具体职责。联委会应对合作进行战略监督。特别是,JSC应:2.2.1审查和讨论根据临床前计划和/或临床发展计划开展的所有实质性活动的结果,以及与此相关的战略;2.2.2作为缔约方之间交流信息的论坛。在不限制前述规定的情况下,Orchard应通过JSC定期通知Pharming任何Orchard的背景IP、Orchard协作IP、Orchard调理IP、联合协作IP、联合调理IP和平台IP,其中Orchard合理预期合作下的任何果园背景IP、Orchard协作IP、Orchard调理IP和平台IP对Pharming有利,且在每种情况下,均不得向Pharming报告;2.2.3协助Pharming准备和提交有关许可产品的提交给监管机构的文件;2.2.4审查并同意对临床前计划的任何重大修订。在不限制前述规定的情况下,JSC应审查并同意对临床前计划的任何修订,以包括或修改[临床前的活体概念验证NTCR研究]确定是否达到第9.3.1节表格第1行所列的开发里程碑;2.2.5评审并同意临床开发计划及其任何实质性修订;2.2.6评审并讨论任何联合合作专利的起诉策略;

7897269 V13 30 2.2.7审查和讨论许可产品的任何制造要求,包括仅在就地区内任何地方的许可产品提交第一次药品批准申请之前,(A)任何制造工艺改进:(I)果园或其任何附属公司已在其参与的任何其他开发计划中使用,以及(Ii)果园合理地预期在合作下和(B)仅在就地区任何地方的许可产品提交第一次药品批准申请之前,第(A)款中未包括的任何第三方知识产权,且Orchard确定并合理地相信该知识产权将对合作项下的Pharming有利。Orchard应根据第2.2.7节的规定,通过其JSC代表定期向Pharming披露上述信息。如果果园根据第2.2.7(B)节确定了任何第三方知识产权,双方应讨论一方是否应获得该第三方知识产权的许可,以及果园因获得该许可而产生的所有费用(如果同意果园将获得该许可),或根据本协议为合并或以其他方式使用该第三方知识产权而进行的任何活动所产生的所有费用,除非双方另有书面约定,否则在每种情况下,均应由Pharming承担;2.2.8符合第9.2.2条的规定, 审查并同意对临床前预算或NTCR预算的任何修订;2.2.9讨论并同意一项沟通计划,该计划规定了双方在首次提交许可产品的IND之前与监管机构沟通的义务;2.2.10确定并同意一家总部位于美国的药品第三方制造商;

7897269 V13 31 2.2.11根据需要设立小组委员会,以履行联委会的具体职责,指导每个小组委员会履行其设立的职能,并监督每个小组委员会,包括任何小组委员会向联委会提出的争议的解决;以及2.2.12履行本协议规定的或各方可能以书面商定的其他职能,并指示每个小组委员会履行本协议任何规定相抵触的其他职能。2.3解散。JSC应继续存在,直到出现以下情况时为止:(A)双方共同同意解散JSC;(B)许可产品的首次商业销售(除非双方另有书面协议)。尽管本协议有任何相反规定,但一旦出现上述(A)或(B)项中的第一项,JSC将自动解散,并且不再具有本协议项下的进一步权利或义务,此后(I)各方应在必要的范围内指定一名联络人负责本协议项下的信息交换或此类信息交换应通过联盟管理人员进行,以及(Ii)JSC的决定(如果有)应为双方之间的决定,受本协议其他条款和条件的约束。2.4会议地点。司法人员推荐委员会应至少满足[每季度一次]或者当事人另有约定的。联委会会议可以亲自举行,也可以通过音频或视频电话会议举行;但除非另有约定,至少[一(1)次会议]每年应亲自举行,只要这种面对面的会议是合理可行的。面对面会议应在联合王国或荷兰的地点或缔约方选定的其他地点举行。2.5举行会议。联委会主席负责召集不少于以下时间的会议[十五(15)]除非有紧急问题需要提前开会日期,在这种情况下,主席应在双方共同商定的第一个可利用的日期召开会议。每一缔约方应就议程项目提出所有建议,并至少提供有关这些建议项目的所有适当信息[ten (10)]提前几个工作日

7897269 V13 32适用会议;但如果迫切需要联委会提供投入,一缔约方可在会议前较短时间内向另一方提供其议程项目,或可提议某一次会议不设具体议程,只要另一缔约方同意以后为该会议增加此类议程项目或不设具体议程,则不应无理地拒绝、附加条件或推迟这种同意。尽管有上述规定,任何一方均可指示主席在以下时间内召开联委会会议[十五(15)]如果该缔约方合理地认为某一重大事项必须在该较早的时限内由司法人员叙用委员会处理,该缔约方应提供任何合理足够的材料,使司法人员叙用委员会能够在该会议上作出知情决定。联委会主席指定的一名个人应编写并分发每次会议记录,供缔约方在以下时间审查和批准[三十(30)]会议结束后的几天。双方应迅速商定每次会议的记录,但无论如何不得迟于联委会的下一次会议。2.6程序规则。在不与本协定相抵触的范围内,联委会有权通过其工作所需的常设规则。只要每一缔约方指定的至少一(1)名代表出席会议,联委会的法定人数即应存在。应允许委托代理人代理。联委会应以出席会议法定人数的代表协商一致的方式采取行动,无论出席会议的代表人数多少,每一缔约方均有一票表决权,或以电子邮件确认的方式提交书面决议。非联委会缔约方代表的任何一方的雇员或顾问均可出席联委会的会议;但(A)除非另一方同意,否则不得超过两(2)名此类人员(不包括该缔约方的联盟经理)出席任何特定会议,(B)任何非雇员的出席必须事先得到另一方的批准,此类批准不得被无理拒绝、附加条件或拖延,(C)此类与会者不得投票或以其他方式参与联委会的决策过程,以及(D)此类与会者受与第12条规定的基本相似的保密和保密义务的约束。

7897269 V13 33 2.7临床发展计划。JSC应根据第2.2.11节设立一个小组委员会,其任务是协助拟定一份临床开发计划草案,该草案列出了Pharming在本协议项下要开展的开发活动,使Pharming能够根据下一句话提交临床开发计划的初始版本。PURING应真诚地考虑小组委员会的任何意见,但应自行决定将临床开发计划的初始版本提交给JSC进行审查和批准,提交日期不得晚于生效日期的一周年。2.8决策。2.8.1联委会的决定。联委会的所有决定应以全票方式作出,每一缔约方的代表共有一(1)票。如果在合理讨论和真诚考虑每一缔约方对某一特定事项的意见后,联委会不能或不能就联委会管辖范围内的问题在[五(5)]在司法人员叙用委员会首先讨论该事项的工作日后,争端应首先提交当事各方的高级官员,他们应真诚地协商问题的解决。高级官员共同商定的任何最后决定均为终局决定,对双方均有约束力。2.8.2最终决策权。如果高级官员不能根据第2.8.1节就任何此类问题的解决达成一致[三十(30)]在该问题首次提交给他们之后的几天内,则:(A)对于与(I)临床前研究、(Ii)制造过程(包括纳入任何制造过程改进)或许可产品的制造有关的任何问题,果园应拥有最终决定权,该许可产品在领土内任何地方提交第一次药品批准申请之前,以及(Iii)第三方药品的身份

7897269 V13 34第2.2.10节中引用的制造商,为清楚起见,在每个情况下(I)至(Iii),不涉及临床开发计划或与监管当局就许可产品提交的任何文件或与其进行的其他沟通(每一项均为“果园决定事项”),但果园不得使用其最终决策权:(A)要求Pharming违反任何适用法律或其在做出相关决定时与第三方达成的任何协议;(B)将临床前计划下的药物治疗所产生的FTE工作或费用的总水平增加超过[10%(10%)]从Pharming批准的上一版临床前预算或NTCR预算(如适用)中列出的,包括其中所包括的NTCR活动,或如果没有任何版本,则为附表1.123中所列的临床前计划版本;(C)大幅增加或减少Pharming根据本协议应履行的义务;(D)根据临床前计划将一方的义务重新分配给另一方;(E)大幅减少Orchard为协作提供的资源水平;(F)关于Pharming合理确定为对许可产品的安全性有重大不利影响的任何事项;或(G)关于对临床前计划的任何修订,以包括或修订临床前体内概念验证NTCR研究的任何终点;此外,Orchard不得并应促使其JSC代表:(1)不得无理地拒绝、限制或延迟批准Pharming提出的任何第三方药品制造商,以及(2)不得拒绝、限制或延迟批准纳入根据2.2.7节披露并由Pharming根据3.7节许可的任何制造工艺改进;以及

7897269 V13 35(B)Pharming对以下事项拥有最终决定权:(I)自首次提交IND之日起以及在剩余期限内,与临床开发计划有关的任何问题;(Ii)在任期内的任何时间,就许可产品向监管当局提交的任何文件或与其进行的其他沟通;以及(Iii)在Pharming就许可产品提交第一份药品批准申请之时或之后的制造过程(包括任何制造过程改进)或许可产品的制造,其关联公司或再被许可人不得向领土内任何地方的适用监管机构转让,但制药公司不得使用其最终决策权:(A)要求果园违反任何适用法律或其在作出相关决定时与第三方达成的任何协议;(B)将果园在临床发展计划下招致的费用增加超过[10%(10%)]在上一版临床开发计划或NTCR预算(视情况适用)的基础上,(C)实质性修改临床开发计划中包括的NTCR活动,(D)将Orchard、其附属公司或分包商执行任何活动所需的时间增加超过[10%(10%)](E)将临床发展计划下的义务从一方重新分配给另一方。为清楚起见,在第一次IND提交之日之前,Pharming无权对与临床开发计划有关的任何问题(包括关于第2.7节中规定的初始临床开发计划的问题)拥有最终决定权,该问题必须得到JSC的一致同意,但Orchard不得(并应促使其JSC代表不得)无理地扣留、条件或推迟批准任何此类问题(包括关于JSC的初始

7897269 V13 36由Orchard根据第2.7节提交的临床开发计划)。2.8.3其他纠纷。为清楚起见,双方之间因本协议或本协议交付的任何文件或文书而产生的、不属于JSC管辖范围的争议应根据第16.8条予以解决。2.9对监督的限制。每一方应保留本协议赋予它的权利、权力和酌处权,除非本协议明确规定或双方书面明确同意,否则不得将该等权利、权力或酌处权授予或授予JSC。根据第2.2.4、2.2.5和2.2.8节的规定,JSC无权修改、修改或放弃遵守本协议;只能按照第16.11节的规定修改或修改本协议,并且只能按照第16.13节的规定放弃遵守本协议。2.10联盟经理。生效日期后,每一缔约方应立即任命一名人员,负责监督双方在联委会会议之间就所有事项的联系,并应承担双方在生效日期后以书面商定的其他职责(每一人均为“联盟经理”)。联盟管理人员应共同努力管理和促进双方在本协议项下的沟通,包括促进(根据本协议的条款)解决双方之间出现的与本协议有关的问题。联盟管理人员对本协议项下的任何事项没有最终决策权。如果不是司法人员叙用委员会的成员, 每名联盟经理应支持联委会的努力,并应被允许酌情以列席会议的身份参加联委会会议。每一方均可随时更换其联盟经理[三十(30)]提前几天以书面形式通知另一方。每一方应承担其联盟经理的费用。2.11成本。每一缔约方应负责其成员和其他代表出席联委会会议或以其他方式参加联委会的所有旅费和相关费用。

7897269 V13 37第3条许可证向Pharming发放3.1.许可证。Orchard特此授予Pharming独家许可(即使对Orchard及其关联公司),并有权按照第3.3节的规定,在Orchard背景IP、Orchard协作IP、平台IP、Orchard调节IP以及Orchard在联合协作IP和联合调节IP中的权益下授予再许可,以在区域内的田野中使用许可产品。3.2向果园批出牌照。Pharing特此授予Orchard:3.2.1非独家许可,有权在Pharming背景IP、Pharming协作IP、Pharming调节IP以及Pharming在联合协作IP和联合调节IP中的权益下,向附属公司和分包商授予再许可,仅用于进行临床前研究;和3.2.2非排他性的全额支付许可,有权在(A)与平台有关的Pharming协作IP和(B)Pharming条件IP下授予再许可,在每种情况下(A)和(B)用于领土内的所有用途和目的,但在现场开发许可产品除外。3.3子许可证。根据第3.1节向其关联方和第三方授予的许可,PURING应有权通过多级再许可授予从属许可;但就授予次级被许可人的任何次级许可而言:(A)通知果园将在以下范围内订立此类次级许可和该次级被许可人的身份[ten (10)](B)任何此类再许可应(I)以书面形式进行,并且(Ii)与本协议的条款和条件一致。Pharing应对任何次要许可方构成违反本协议的任何行为或不作为负责,就像该次要许可方是本协议项下的“药方”一样。

7897269 V13 38 3.4经销商和促销。在不限制第3.3条的情况下,Pharming及其关联公司将有权自行决定向任何第三方授予在该领域进口、营销、分销、促销和销售任何许可产品的权利,其中许可产品的所有权转让给该第三方,并且所授予的权利与根据本协议授予Pharming的许可的范围一致(包括或不包括包装和/或标签权利);但就本协议而言,该第三方仅在以下情况下才构成“分销商”:(A)此类授予不包括授予任何果园背景专利、果园协作专利、平台专利、果园调理专利、联合协作专利或联合调理专利下的再许可,以开发或制造许可产品,(B)指定分销商从Pharming或其附属公司购买其要求的许可产品,但不会就许可产品向Pharming支付使用费、预付款、里程碑付款或其他付款,以及(C)Pharming或其关联公司与该分销商之间的任何此类安排与Pharming为其类似产品达成的分销安排一致。3.5保留权利。尽管Pharming根据第3.1条获得独家许可,Orchard在此明确保留权利(A)在Orchard Background IP、Orchard Collaboration IP、Orchard Condition IP以及Orchard在联合协作IP和联合调节IP中的权益:(I)用于其内部临床前研究目的;(Ii)直接或通过一个或多个附属公司或分包商行使其在本协议项下的权利和履行其义务, 包括执行根据临床前计划分配给它的活动的权利;以及(Iii)在3.1节授予Pharming的许可范围和4.1节下其契诺的范围之外,从事Orchard背景IP、Orchard Conditions IP、Orchard Collaboration IP以及Orchard在联合协作IP和联合Condiation IP中的权益,并根据Orchard进行实践和授予许可。3.6无默示许可。除本协议明确规定外,任何一方均不得根据本协议或与本协议相关的任何专利,以默示、禁止反言或其他方式获得任何许可或其他知识产权权益,

7897269 V13 39由另一方拥有或控制的专有技术、信息或其他知识产权。3.7制造工艺改进。在JSC同意的情况下,Pharming有权将Orchard根据第2.2.7(A)节披露的所有制造工艺改进包括在第3.1条下的许可证范围内。该权利可通过在以下日期或之前向Orchard发出书面通知来行使[90(90)]在JSC会议之后的几天内,向Pharming通报了这种制造工艺改进。当Pharming就任何制造工艺改进行使该权利时:(I)Orchard应尽合理努力转让给Pharming,并执行使Pharming能够利用该制造工艺改进的合理必要或有用的活动,前提是Pharming向Orchard偿还在执行该等活动中合理且实际发生的费用;以及(Ii)此类制造工艺改进应构成Orchard后台知识产权的一部分,并应根据第3.1节授权给Pharming。3.8不得修改。尽管本协议有任何相反规定,Pharming不得直接或间接:(A)除非果园另有同意,否则不得基于授权产品中使用的逆转录病毒载体生成类似物或衍生产品、修改其结构或对其进行反向工程;或(B)除非果园或JSC另有同意,否则在就授权产品提交第一份药品批准申请之前,不得直接或间接修改与授权产品相关的药品制造流程。3.9确认性专利许可证。如缔约另一方提出要求,缔约双方应立即以请求方合理要求的形式或实质上订立确认性许可协议,以便向请求方认为适当的专利局记录根据本协定授予的许可。

7897269 V13 40第4条排他性4.1相互排他性。在合约期内,在第16.3条(控制变更)的规限下,每一方不得,也应确保其各自的关联方不得或通过第三方研究、开发、制造或商业化:(A)任何主要适应症中的体外自体造血干细胞慢病毒介导的基因治疗产品;及(B)现场使用的任何体外自体造血干细胞基因治疗产品(主要适应症除外)。[编码自然产生的人血浆蛋白水解酶C1抑制物的慢病毒载体]或其变体,在每种情况下(A)和(B),除非在履行其在本协议下的各自义务或行使其各自的权利(该等研究、开发、制造和商业化活动,“竞争计划”)。第5条临床前研究5.1概述。根据本协议的条款和条件,双方将在临床前研究的执行方面进行合作,并应随时向JSC通报此类活动。5.2临床前计划的实施。5.2.1勤奋工作。(A)双方应使用各自在商业上合理的努力,执行临床前计划中分配给他们的任务。每一缔约方应尽其商业上合理的努力,遵守临床前计划中规定的任何时间框架。(B)除临床前计划中分配给每一缔约方的活动外,每一缔约方不得被要求开展与许可产品的非临床研究有关的任何活动。

7897269 V13 41(C)双方承认并同意,尽管根据第5.2.1(A)条采取了各自的商业合理努力,但不能或不能保证取得任何结果或成功,未能实现预期结果本身并不构成对本协议中任何义务的违反或违约。5.2.2监管支持。Orchard应仅按照临床前计划中的规定或各方书面同意的其他方式,支持Pharming为许可产品提交IND,并在支持该IND的活动中提供Orchard或其任何附属公司控制的所有文件或其他材料,这是Pharming为许可产品提交IND所必需的。5.2.3更新。时不时地,但不少于[季刊](在临床前计划下的所有活动完成之前),缔约方将酌情编制临床前计划的更新和修正(包括临床前预算的任何相应变化),供JSC审查和批准,但须遵守并符合第2条的适用规定,包括第2.8条。5.2.4优先顺序。如果临床前计划的条款与本协议的条款相抵触或产生不一致或不明确之处,则应以本协议的条款为准。5.2.5分包。每一缔约方应有权将其在本协议项下关于临床前计划的义务分包给分包商及其附属公司,但须遵守临床前计划中规定的任何限制、约束或其他资格;前提是:(I)任何分包商以书面形式同意遵守本协议的适用条款和条件,包括第12条的保密规定;(Ii)已制定适当的协议或其他措施,确保在与根据本协议创建的许可产品有关的范围内,构思、发现、开发或开发任何知识产权

7897269 V13 42此类分包商或关联公司以其他方式订立的合同将根据第11条归属、分配给或许可给一方当事人,(3)分包方应对其所有分包商的管理负责,并应继续对另一方的行为和不作为承担全部责任。5.2.6研究记录。(一)创造。每一缔约方应根据专利和监管目的,按照适用法律和监管指导原则,以足够详细和良好的科学方式保存完整、准确的记录(包括纸质和电子记录),记录在实施临床前计划下的任何活动中所做的所有工作和取得的成果。此类记录应由适用一方保存至少一段时间[三(3)]在本协议终止或期满后数年,或适用法律可能要求的较长期限内。(B)检查。每一方均有权合理地检查另一方的记录,并应在要求方行使或履行本协定项下的权利所合理需要的范围内提供所要求的所有记录的副本;但要求方应根据本协定第12条将该等记录和另一方的信息作为另一方的机密信息保存,除非本协定另有允许,否则不得使用该等记录或信息。5.2.7临床前计划;更新;信息共享。(一)《临床前计划》的初版载於附表1.123。任何一方均可随时对临床前计划进行适当的更新和修订,以供审查

7897269 V13 43并经JSC根据第2.8条批准,但任何此类更新或修改应在JSC批准该更新或修改之前生效。(B)最少每[六(6)]每一缔约方应通过JSC会议,向JSC通报其根据临床前计划负责的任何当时正在进行的临床前研究活动的最新情况。缔约方应在此类联委会会议上讨论所有此类活动的现状、进展和结果。第6条开发6.1概述。根据本协议的条款和条件,在双方就许可产品进行第一次IND审批后,Pharming将独自负责进行所有开发活动,并应向JSC通报此类活动。6.2临床发展计划的实施。6.2.1临床发展计划的最后定稿。临床开发计划的初始版本应由Pharming编制,并由JSC根据第2.2.5节进行批准。6.2.2勤奋工作。(A)Pharming应使用其商业上合理的努力来开展分配给它的活动以及临床开发计划中规定的活动,包括使用其商业上合理的努力来遵守临床发展计划中规定的与该等活动有关的任何时间框架。Orchard应使用其商业上合理的努力来实施临床开发计划中指定给Orchard的任何制造、供应和NTCR活动,包括使用其

7897269 V13 44在商业上合理的努力,以遵守与此类活动有关的临床开发计划中规定的任何时间框架。上述义务不再适用于在领土内任何地方就许可产品提交第一次药品批准申请之日。(B)双方承认并同意,尽管各方根据第6.2.2(A)条采取了各自在商业上合理的努力,但不能或不能保证取得任何结果或成功,未能实现预期结果本身并不构成对本协议中任何义务的违反或违约。6.2.3更新。根据第2条的适用规定(包括第2.8条),缔约方可不时地对临床开发计划进行适当的更新和修正,以供JSC审查和批准。6.2.4优先顺序。如果临床开发计划的条款与本协议的条款相抵触或产生不一致或不明确之处,则应以本协议的条款为准。6.2.5分包。每一缔约方应有权将其在本协议项下关于临床开发计划的义务分包给分包商和附属公司,但须遵守临床开发计划中规定的任何限制、约束或其他资格;前提是:(I)任何分包商书面同意遵守本协议的适用条款和条件,包括第12条的保密规定;(Ii)已制定适当的协议或其他措施,确保在与本协议项下创建的许可产品相关的范围内,构思、发现、开发任何知识产权, 或由该等分包商或关联公司以其他方式作出的,将根据第11条归属、转让给或许可给其中一方当事人,以及(3)分包方应

7897269 V13 45对其所有分包商的管理负责,并对该等分包商的作为和不作为继续对另一方承担全部责任。6.2.6研究记录。(一)创造。Pharing应根据专利和监管目的,按照适用法律和监管指导,保持完整、准确的记录(包括纸质和电子记录),充分详细并以良好的科学方式,记录在执行临床开发计划下的任何活动中所做的所有工作和取得的结果。此类记录应由Pharming保留至少一段时间[三(3)]在本协议终止或期满后数年,或适用法律可能要求的较长期限内。(B)检查。果园有权合理检查药厂的记录,并在行使或履行本协议项下权利的合理需要范围内提供所有要求的记录的副本;但是,果园应根据本协议第12条将该等记录和药剂信息作为药剂的保密信息保存,除非在本协议允许的范围内,否则不得使用该记录或信息。6.2.7更新;信息共享。在每次定期安排的JSC会议上,每一缔约方应向JSC通报其根据临床发展计划负责的任何当时正在进行的活动的最新情况。缔约方应在此类联委会会议上讨论所有此类活动的现状、进展和结果。此外,Pharming应每季度向Orchard提供其在临床开发计划下的活动以及此类活动的结果的书面报告。

7897269 V13 46第7条商业化7.1概述。自许可产品在该领域获得第一次监管批准之日起,Pharming应独自负责该领域领域许可产品的商业化和制造。7.2勤奋工作。[加密化]将利用其在商业上合理的努力,寻求监管部门对许可产品的批准,并将其在[美国、欧盟、英国和日本的主要适应症]。7.3报告。应向果园内的果园提供[六十(60)]每一年期限结束后(自第一次商业销售开始)的书面报告副本,其中包含足够的详细信息,使Orchard能够评估Pharming对第7.2节的遵守情况。所有此类报告和其中包含的信息应构成Pharming的保密信息。第八条制造和供应;技术转让和其他援助8.1果园制造。8.1.1果园应尽其合理努力:(A)根据临床前计划开发生产工艺;(B)根据临床开发计划,为实施临床开发计划下的临床研究生产和供应足够数量的许可产品的药品;(C)按照临床开发计划的进一步规定,将与药品相关的生产工艺转移到第三方制造商在美国的工厂;以及(D)将与制造过程有关的必要信息和知识转让给Pharming,如临床开发计划中进一步规定的那样。为免生疑问,Orchard不应要求或促使任何Orchard CMO或任何第三方:(I)

7897269 V13 47创造任何新的专有技术,(Ii)从事临床前计划或临床开发计划中未明确规定的任何制造活动,或(Iii)将任何制造过程转让给上文第8.1.1(C)节所述的第三方制造商以外的任何第三方,或转让给第8.1.1(D)节所述的Pharming,在每种情况下,(I)至(Iii)除非事先与Orchard达成书面协议。8.1.2在收到Pharming的书面要求后,Orchard应协助Pharming与Orchard CMO达成直接制造和供应安排,将Orchard CMO介绍给Pharming,并提供Orchard的同意,允许Orchard CMO为Pharming的利益使用Orchard CMO开发的与制造特许产品有关的任何技术。8.1.3 CMC成本。药剂应补偿Orchard根据本协议履行其在本条款8.1项下的义务所发生的所有费用,但不得构成Orchard临床前研究成本或NTCR活动成本(“Orchard CMC成本”)。在与第三方达成任何协议或安排或进行任何可能导致Orchard产生任何CMC成本的活动之前,Orchard应确保Pharming已首先批准该协议或安排以及该Orchard CMC成本(该批准不得被无理扣留、附加条件或拖延)。如果Orchard在未根据第8.1.3节规定事先获得Pharming批准的情况下产生任何Orchard CMC费用,则Pharming没有义务根据第9.2.1(C)节支付此类费用。如果Pharming根据本第8.1.3条延迟、附加条件或拒绝其同意, 则Orchard将不对因该延迟或拒绝给予同意而导致的任何延迟或未能履行其义务承担责任。

7897269 V13 48 8.1.4 Orchard应与Pharming合理合作,以确保商业基础设施稳健高效,包括许可产品的制造、供应链和管理,但前提是,如果Pharming希望利用Orchard已在使用的任何第三方资源,且不限制其在本协议项下的其他义务,Orchard应促成向该第三方的介绍,但Pharming应被要求与选定的第三方直接签订合同。8.1.5 Pharming将独自负责用于商业化的许可产品的制造,费用自理。8.1.6监管支持。(A)在双方之间,根据第5.2.2节和第8.1.6(B)节的规定,Pharming应全权负责准备、获得和维护IND和其他监管批准和提交,并在每种情况下与监管当局就许可产品进行沟通。每一方应在JSC根据第2.2.8节批准的范围内,履行其在任何监管沟通计划下的各自义务。(B)Orchard应支持Pharming按照临床前计划或各方书面同意的其他方式提交许可产品的IND,并支持其开展活动,包括提供必要的由Orchard或其任何附属公司控制的所有文件或其他材料,以便Pharming提交许可产品的IND。(C)如果园、其附属公司或其分包商(包括[MolMed])收到监管当局关于许可产品的任何通知或通信时,果园应迅速(无论如何,在[三(3)]营业天数为

7897269 V13 49 Orchard收到该通知)向Pharming提供其副本,尽管上述规定,Pharming同意在向Pharming提供该会议记录和摘要之前,可以对该通知或通信中与许可产品无关的任何内容进行编辑。(D)如果果园、其附属公司或其分包商(包括果园CMO)被要求出席与监管当局就许可产品举行的会议,果园应尽合理努力促使制药公司的代表出席该会议,并应向制药公司提供所有会议记录和会议摘要的副本[ten (10)]在Orchard收到或制作此类会议纪要或摘要的工作日后,Pharming同意在向Pharming提供此类会议纪要和摘要之前,对与许可产品无关的此类会议纪要和摘要的任何内容进行编辑。第九条付款并记录9.1预付款。9.1.1内[三十(30)]自生效之日起,Pharming应向Orchard支付1000万美元(1000万美元)的不可退还、不可贷记的金额。9.1.2 Pharming将按双方于生效日期订立的股份购买协议所载的价格及条款,购入750万港元(7,500,000美元)的Orchard普通股。9.2临床前研究成本;NTCR活动成本和CMC成本

7897269 V13 50 9.2.1费用分配。(A)Pharming应100%(100%)承担非NTCR活动的所有成本:(A)Pharming或其关联公司在履行临床前计划或临床开发计划下的义务时发生的费用;以及(B)Orchard或其关联公司在履行临床前计划下的义务时发生的费用(“Orchard临床前研究费用”),符合第9.2.2(A)节的规定。(B)根据第9.2.2(B)节的规定,缔约方或其关联方在开展NTCR活动时发生的所有费用(“NTCR活动费用”)应由双方平分。(C)根据第8.1.3节的规定,药明应承担果园CMC费用的100%(100%)。9.2.2预算上限。(A)Pharming没有义务向Orchard支付与临床前计划下的任何活动相关的任何Orchard临床前研究费用[110%(110%)]在临床前预算下分配给此类活动的费用,这些额外费用应被视为排除在果园临床前研究费用之外,除非这些额外费用此后被JSC修订的任何临床前预算所涵盖。(B)任何一方均无义务分担另一方或其关联方因任何非关税性关连活动而发生的费用,其数额超过[110%(110%)]该缔约方在NTCR预算项下为此类NTCR活动分配的费用,这些超出的费用应被视为排除在NTCR活动之外

7897269 V13 51费用,除非这些额外费用此后由司法人员叙用委员会修订的任何NTCR预算支付。(C)如果任何一方合理地预计,对于Orchard、Orchard临床前研究费用,或对于任何一方,NTCR活动成本将超过临床前预算或NTCR预算(视情况而定)中相应的预算成本,则在第9.2.1(A)和9.2.1(B)节的限制下,该缔约方应立即通知JSC,JSC应在此基础上讨论并在适当情况下批准对该临床前预算或NTCR预算(视情况适用)的任何修订,以弥补第2.2.8节下的此类额外费用。如果JSC根据第2.2.8条延迟、附加条件或拒绝同意批准任何此类修订以支付超额费用(见上文[110%(110%)]如果实际或潜在的超额费用是由于该缔约方未能以其商业上合理的努力履行临床前计划或其NTCR活动(视情况而定)下的义务或未能切实遵守适用法律而造成的,则该缔约方对因这种拖延或拒绝给予同意而造成的任何延误或未能履行其义务不负责任,但如果实际或潜在的超额费用是由于该缔约方未能利用其商业上合理的努力履行其在临床前计划或其NTCR活动下的义务或未能切实遵守适用法律造成的,则该缔约方不应对这种拖延或未能履行其义务承担责任。9.2.3报告。每一方应在以下时间内向另一方报告[三十(30)]在每个季度结束后的几天,Orchard临床前研究成本、NTCR活动成本和Orchard CMC成本在该季度内由该缔约方或其附属公司或其代表发生的程度。该报告应以双方不时商定的形式,合理详细地说明该季度此类费用中包含的所有金额。在
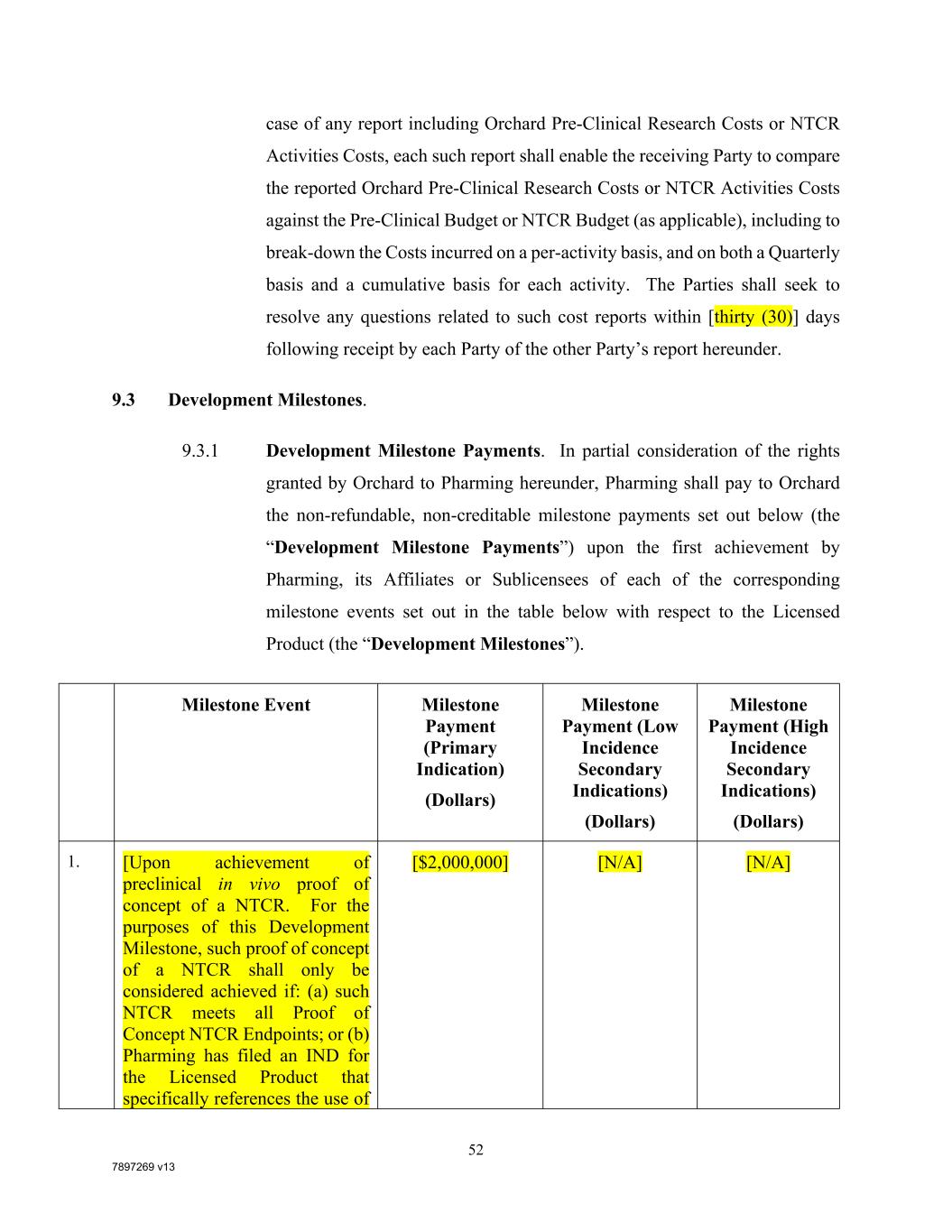
7897269 V13 52任何报告,包括Orchard临床前研究成本或NTCR活动成本,每份此类报告应使接受方能够将报告的Orchard临床前研究成本或NTCR活动成本与临床前预算或NTCR预算(视情况而定)进行比较,包括按活动、按季度和按累计对每项活动产生的成本进行细分。双方应寻求在以下时间内解决与此类费用报告有关的任何问题[三十(30)]每一方收到另一方的报告后数日。9.3发展里程碑。9.3.1发展里程碑付款。考虑到Orchard授予Pharming的部分权利,Pharming应在Pharming、其关联公司或分被许可人就许可产品(下表)中列出的每个相应里程碑事件(“开发里程碑”)首次取得成果时,向Orchard支付下列不可退还、不可计入的里程碑付款(“开发里程碑付款”)。里程碑事件里程碑付款(主要症状)(美元)里程碑付款(低发病率次要症状)(美元)里程碑付款(高发病率次要症状)(美元)1.[在临床前活体验证NTCR概念的基础上。就本开发里程碑而言,只有在以下情况下,才应认为NTCR的概念证明已经完成:(A)此类NTCR满足所有概念证明NTCR Endpoint;或(B)Pharming已为许可产品提交IND,明确提到使用[$2,000,000][不适用][不适用]
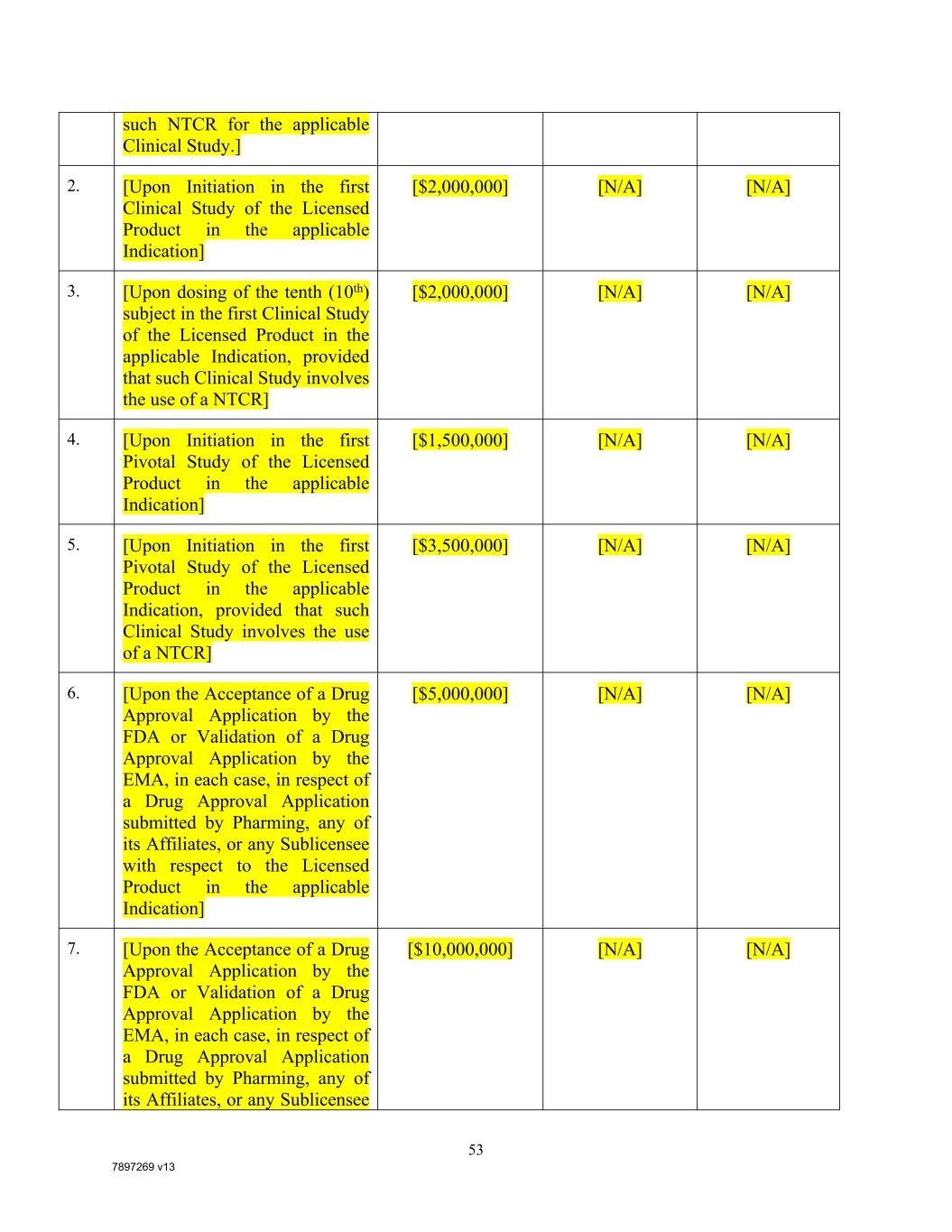
7897269 V13 53适用的临床研究的NTCR。] 2. [在适用的适应症中启动许可产品的第一次临床研究][$2,000,000][不适用][不适用] 3. [在许可产品的第一次临床研究中以适用的适应症给第十(10)名受试者剂量时,只要该临床研究涉及使用NTCR][$2,000,000][不适用][不适用] 4. [在开始对适用适应症中的许可产品进行第一次关键研究时][$1,500,000][不适用][不适用] 5. [在适用适应症的许可产品的第一次关键研究中启动时,如果该临床研究涉及使用NTCR][$3,500,000][不适用][不适用] 6. [在FDA接受药品批准申请或EMA批准药品批准申请后,在每种情况下,针对Pharming、其任何关联公司或任何次级受让人就适用适应症中的许可产品提交的药品批准申请][$5,000,000][不适用][不适用] 7. [在FDA接受药物批准申请或EMA批准药物批准申请后,在这两种情况下,都是针对Pharming、其任何附属公司或任何次级受让人提交的药物批准申请[$10,000,000][不适用][不适用]
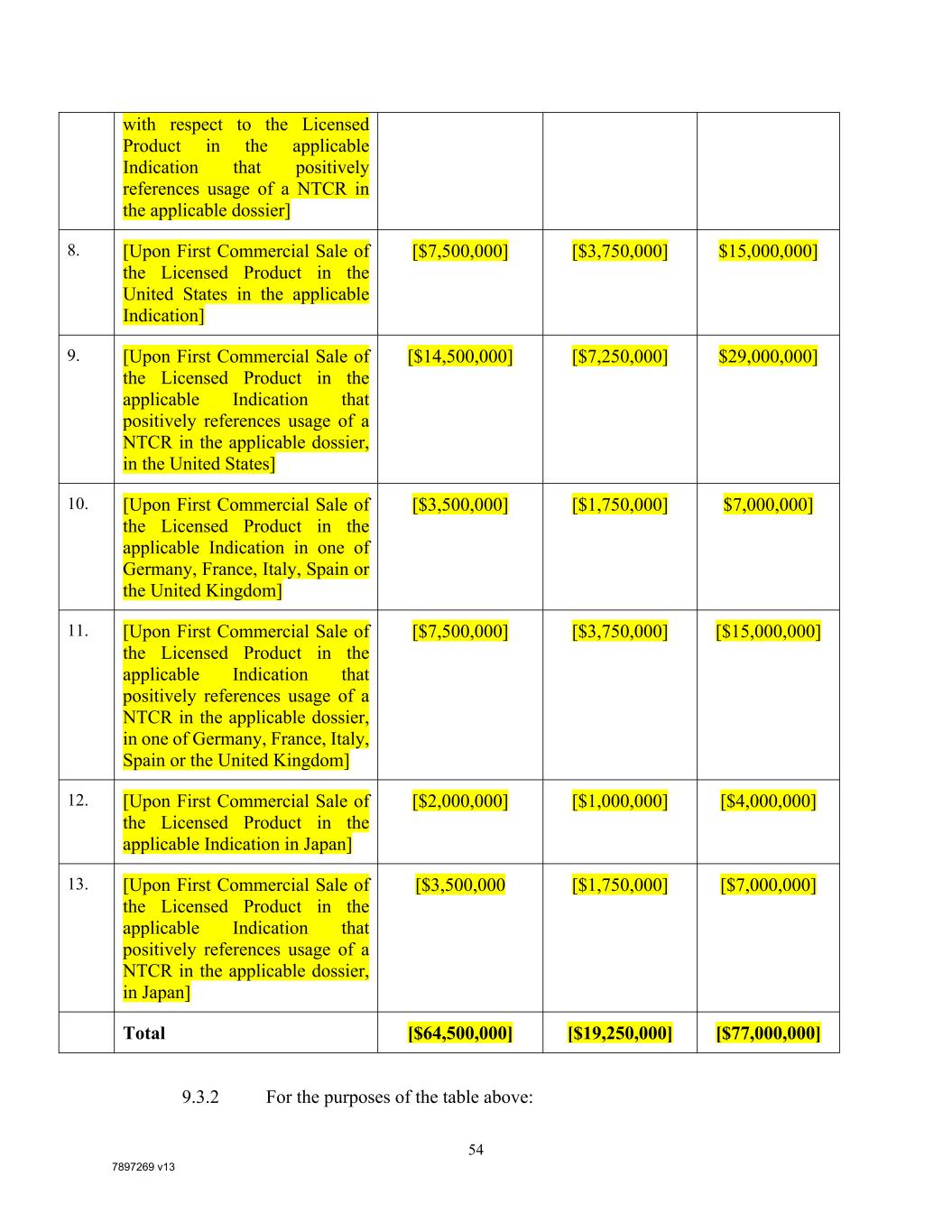
7897269 V13 54与适用指示中的许可产品有关,该指示在适用的档案中肯定地引用了NTCR的使用] 8. [在适用的指示中首次在美国商业销售许可产品][$7,500,000][$3,750,000] $15,000,000] 9. [在许可产品的首次商业销售中,在适用的指示中,在适用的档案中肯定地提到了NTCR的使用,在美国][$14,500,000][$7,250,000] $29,000,000] 10. [在德国、法国、意大利、西班牙或英国之一的适用指示中首次商业销售许可产品][$3,500,000][$1,750,000] $7,000,000] 11. [在德国、法国、意大利、西班牙或英国之一的适用指示中明确提到适用档案中的NTCR使用的许可产品首次商业销售时][$7,500,000][$3,750,000][$15,000,000] 12. [许可产品在日本首次商业销售时的适用指示][$2,000,000][$1,000,000][$4,000,000] 13. [首次商业销售许可产品时,在适用的说明中,在适用的档案中肯定地提到了NTCR的使用,在日本][$3,500,000 [$1,750,000][$7,000,000]总计[$64,500,000][$19,250,000][$77,000,000]9.3.2就上表而言:

7897269 v13 55 (a) [“在适用的档案中肯定提及NTCR的使用”,是指:(A)对于在德国、法国、意大利、西班牙或英国向EMA提交的药品批准申请或许可产品在适用适应症中的首次商业销售,在管理该许可产品之前,将该NTCR的管理作为要求或建议包括在该许可产品的适用监管批准的产品特性概要(SmPC)中;或(B)对于向FDA提交的药品批准申请或许可产品在美国或日本的适用适应症的首次商业销售,在每种情况下,该NTCR的管理都作为管理该许可产品的要求或建议包括在该药品批准申请中的拟议产品标签中,或FDA或PMDA(视情况适用)为该许可产品批准的产品标签中];(B)如果作为首次商业销售标的的许可产品已获得该国家/地区监管机构的监管批准,可以在该国家/地区使用该特定指示中的许可产品,则在该国家/地区首次商业销售将被视为已经发生;(C)如果任何开发里程碑同时在多个指示中触发,则根据第9.3.5节的规定,应同时支付所有适用的开发里程碑付款(如果之前未支付)。举例来说,如果许可产品在日本的首次商业销售是已经获得日本监管当局对主要适应症和低发生率次级适应症的监管批准的许可产品,但适用的档案没有肯定地提到NTCR的使用,并且如果相应的

7897269 V13 56发展里程碑付款之前未支付,此类事件将触发发展里程碑付款[300万美元(300万美元),包括200万美元(200万美元)的主要适应症和100万美元(100万美元)的低发病率次级适应症];以及(D)如果在特定国家/地区的适用指示中存在许可产品的首次商业销售,并且该许可产品的档案(即,SmPC或产品标签,视情况适用)没有积极地提到适用档案中NTCR的使用,则如果该许可产品的档案随后被修改、更新或变更以包括该正面引用,则在许可产品第一次商业销售时应支付的任何开发里程碑在该指示中肯定地提到适用档案中NTCR的使用,但受第9.3.5节的限制,在档案被如此修改、更新或更改后,应被视为已实现并在相关国家/地区首次商业销售许可产品时支付(如果以前未支付),但此类档案的修改、更新或更改发生在[五周年纪念]该许可产品的第一次商业销售。9.3.3通知和付款。在取得任何发展里程碑的第一个成就后,药剂应立即书面通知果园,果园将在此基础上向药剂开具发票。Pharing应确保在第(A)项中的较晚者之前向果园支付每笔开发里程碑付款[六十(60)]第一次达到相应发展里程碑的天数和(B)[五(5)]从果园收到此类开发里程碑付款发票起的工作日。9.3.4跳过里程碑。如果第9.3.1节表中第4行所列的开发里程碑首次在没有

7897269 V13 57表中第2行所列发展里程碑达到后,应视为同时实现该表中第2行所列发展里程碑,并应同时支付相应的发展里程碑付款。如果第6行所列发展里程碑在未达到该表第2行或第4行所列发展里程碑的情况下首次实现,则该表第2行或第4行所列发展里程碑(以前未达到的范围)应被视为同时实现,并应同时支付相应的发展里程碑付款。9.3.5一次性付款。第9.3.1节所列表格中第1行至第7行的每个开发里程碑只能实现一次,该表中第8行至第13行的开发里程碑对于每个不同的指示只能实现一次。举例而言:(A)[如果许可产品在美国的主要适应症的首次商业销售是由Pharming实现的,但适用的档案没有明确提到NTCR的使用,则将根据第9.3.3节支付750万美元(7,500,000美元)的主要适应症开发里程碑]; (b) [如果在美国首次低发二次适应症许可产品的首次商业销售是由Pharming公司随后实现的,但适用的档案并没有积极地提到NTCR的使用,那么根据9.3.3节的规定,将支付375万美元(3,750,000美元)的低发二次指征开发里程碑]及
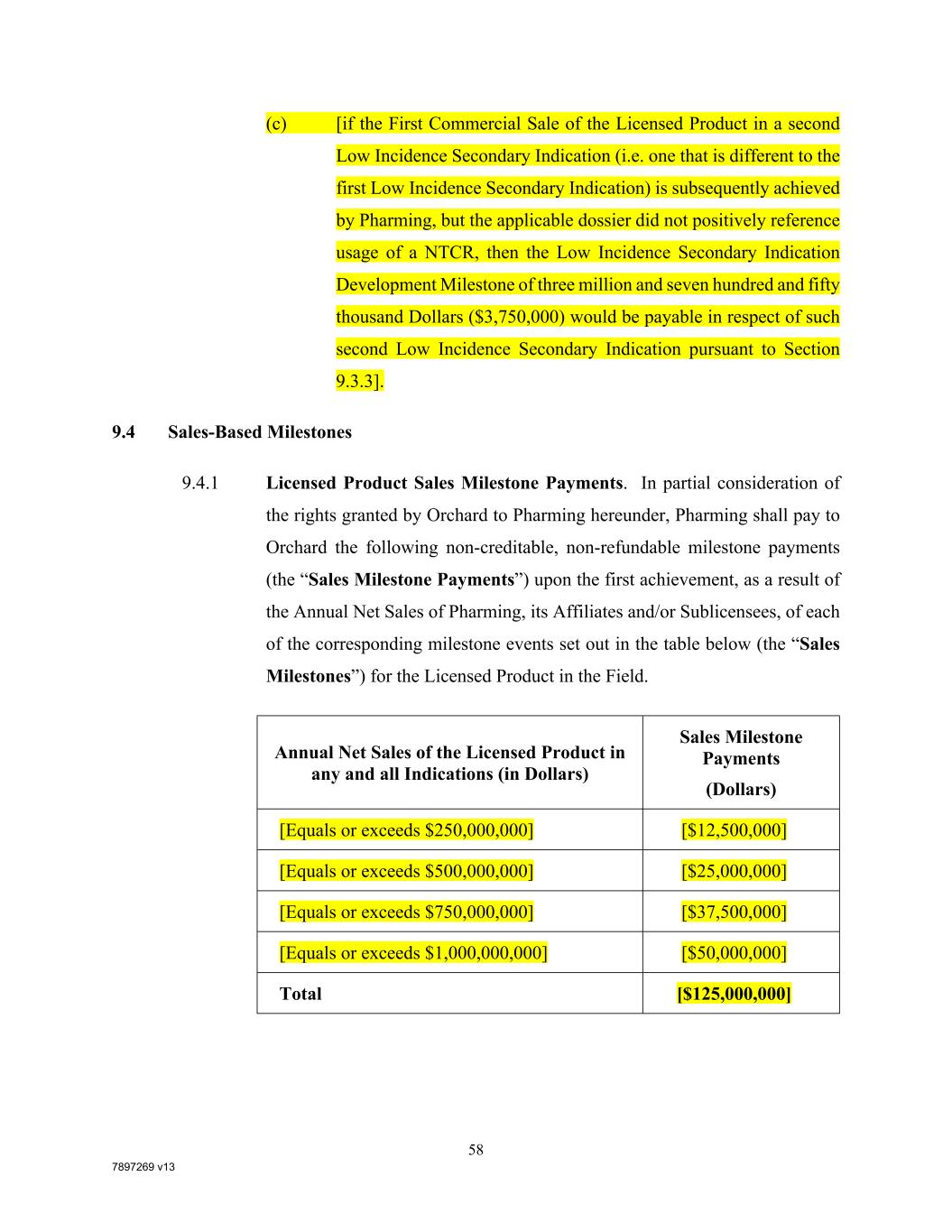
7897269 v13 58 (c) [如果第二个低发二次指征(即不同于第一个低发二次指征)的许可产品的第一次商业销售随后通过Pharming实现,但适用的档案没有积极地引用NTCR的使用,则根据第9.3.3节,将就该第二个低发二次指征支付375万美元(3,750,000美元)的低发二次指征开发里程碑]。9.4基于销售的里程碑9.4.1许可产品销售里程碑付款。考虑到Orchard在本协议项下授予Pharming的权利,Pharming应向Orchard支付以下不可计入、不可退还的里程碑付款(“销售里程碑付款”),这是由于Pharming、其关联公司和/或分被许可人在该领域中的每个相应里程碑事件(“销售里程碑”)的年度净销售额首次实现的结果。授权产品的年净销售额(以美元为单位)销售里程碑付款(美元)[等于或超过250,000,000美元][$12,500,000][等于或超过500,000,000美元][$25,000,000][等于或超过750,000,000美元][$37,500,000][等于或超过10亿美元][$50,000,000]总计[$125,000,000]
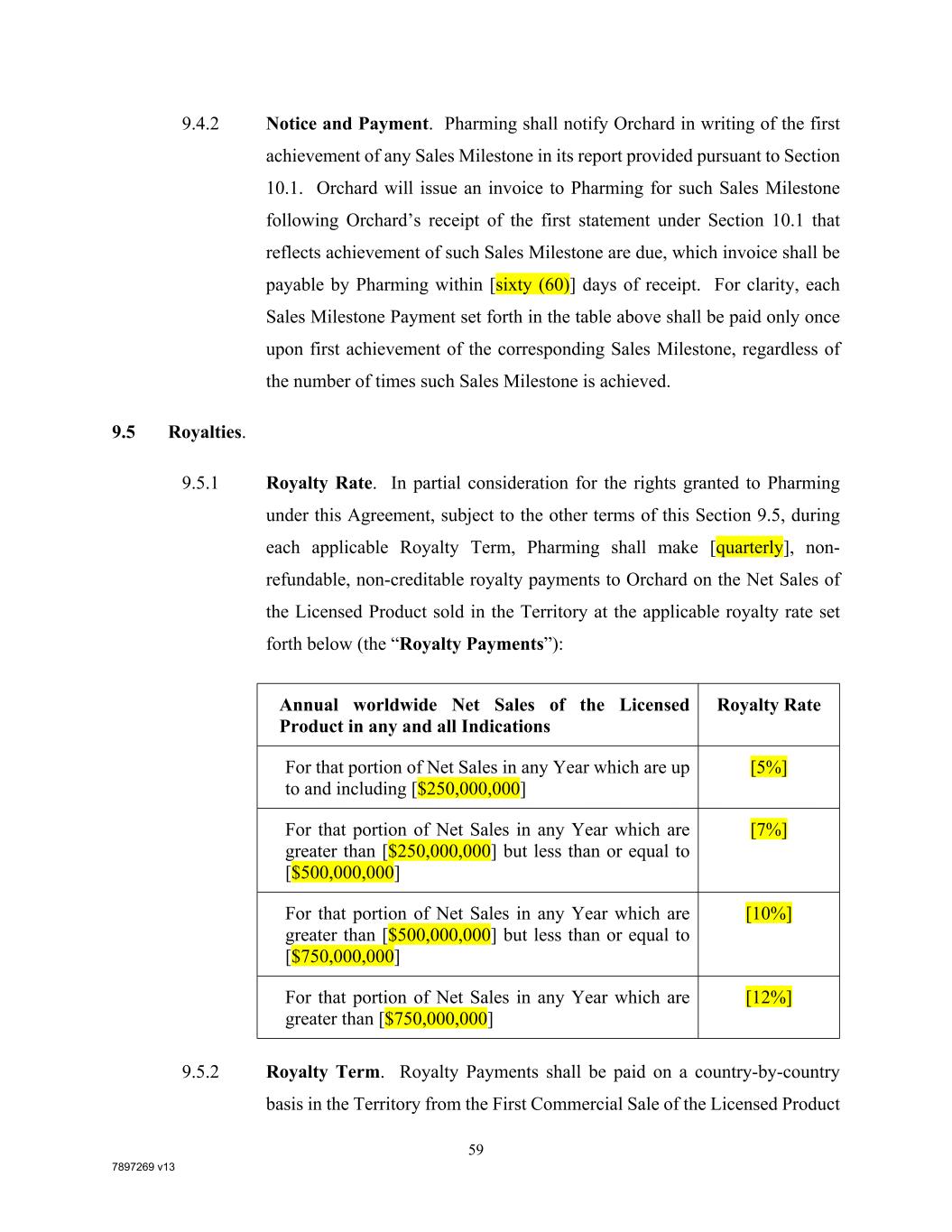
7897269 V13 59 9.4.2通知和付款。Pharing应在其根据第10.1节提供的报告中以书面形式通知Orchard任何销售里程碑的首次实现。Orchard将在Orchard收到第10.1节规定的反映该销售里程碑的完成情况的第一份声明后,向Pharming开具发票,该发票应由Pharming在[六十(60)]收据的天数。为清楚起见,上表中列出的每笔销售里程碑付款应仅在第一次达到相应的销售里程碑时支付一次,无论该销售里程碑实现了多少次。9.5特许权使用费。9.5.1版税税率。作为对根据本协议授予Pharming的权利的部分对价,在符合本第9.5节的其他条款的情况下,在每个适用的版税期限内,Pharming应作出[每季度一次],不可退还、不可入账的特许权使用费支付给Orchard,按以下规定的适用特许权使用费税率在领土内销售的特许产品的净销售额(“特许权使用费支付”):特许产品在任何和所有指示中的年度全球净销售额,以及任何年度达到并包括的该部分净销售额的特许权使用费税率[$250,000,000][5%]在任何一年的净销售额中大于[$250,000,000]但小于或等于[$500,000,000][7%]在任何一年的净销售额中大于[$500,000,000]但小于或等于[$750,000,000][10%]在任何一年的净销售额中大于[$750,000,000][12%]9.5.2版税条款。特许权使用费的支付应从许可产品的首次商业销售开始,在领土内按国家/地区支付

7897269 V13 60由制药公司、其关联公司或分被许可人或其代表在一个国家/地区,直至该国家/地区许可产品的版税期限届满为止。为清楚起见,在许可产品在该国家/地区的任何许可使用费期限期满后,在根据第9.5.1节中的表格确定版税费率时,不应考虑该许可产品在该国家/地区的净销售额。9.5.3削减。(A)如果(I)Pharming与第三方达成协议,就主要适应症中任何许可产品的物质组成或使用方法与第三方拥有的任何专利项下的许可或其他权利达成协议,并为免生疑问,排除了与调理方案或制造过程有关的任何许可或第三方权利,以及(Ii)在没有该许可或其他第三方权利的情况下,许可产品不能在主要适应症中开发或商业化,则Pharming有权扣除[50%(50%)]根据该协议支付给该第三方的所有特许权使用费中,根据第9.5.1节应支付给果园的特许权使用费。(B)如果在逐个许可产品的基础上,根据第9.5.1节应支付的可归因于在美国的净销售额的任何特许权使用费付款,而在果园背景专利、果园协作专利或果园平台专利中没有关于该许可产品在现场的物质或使用方法的组成的有效主张,则根据第9.5.1节适用于该许可产品在美国的净销售额的特许权使用费费率将减少[30%(30%)].

7897269 V13 61(C)如果与许可产品有关的一(1)种或多种仿制药在特定地区的特定国家/地区(“仿制药竞争”)在特定季度内可在市场上购买,则制药公司有权就除美国以外的所有国家扣除(I)(X)[35%(35%)]和(Y)就美国而言[7.5%(7.5%)]在每一种情况下,(X)和(Y)从根据第9.5.1节应支付给Orchard的关于该国家/地区的许可产品的特许权使用费中扣除,前提是该许可产品在该季度在该国家/地区的净销售额等于[75%(75%)][和50%(50%)]在紧接一个或多个仿制药首次在该国上市的季度之前的连续四(4)个季度内,许可产品的平均净销售额;或(Ii)[50%(50%)]根据第9.5.1节应支付给Orchard的特许权使用费,如果该特许产品在该国家/地区的净销售额在该季度少于[50%(50%)]在紧接一个或多个仿制药首次在该国上市的季度之前的连续四(4)个季度内,在(I)和(Ii)项中的每一种情况下,在特许权使用费期限内与该国家的许可产品存在任何一种程度的仿制药竞争的每一个季度中,许可产品的平均净销售额。(D)在任何情况下,在领土内某个国家/地区的特许产品的特许权使用费期限内,在该国家/地区的果园应支付的特许权使用费总额不得减少超过[50%(50%)]如果不是第9.5.3(A)、(B)和(C)节规定的减免额,根据第9.5.1节的规定,在该国的特许产品本应在本季度到期并应支付给果园的金额

7897269 V13 62以上。Pharming有权将Pharming没有使用的任何超额扣减部分结转到下几个季度,以抵销因9.5.3(D)节的规定而在该季度到期的版税付款,直到抵扣全部使用为止。第十条支付;记录;审计10.1特许权使用费的支付和报告。Pharing应在每个季度末根据第9.5节计算应支付给Orchard的所有金额,并根据第10.3节将这些金额转换为美元。在[六十(60)]在本季度结束之日,Pharming应向Orchard提供以下内容的报表:(A)适用季度内许可产品在领土内每个国家的总销售额和净销售额(包括以当地货币和美元表示的金额);(B)从总销售额中扣除的金额;(C)第9.5.1节下适用的特许权使用费税率(包括根据第9.5.3节对特许权使用费税率的任何减少);以及(D)就该季度的此类净销售额应支付的特许权使用费数额的计算。收到该季度的该报表后,果园应向Pharming开具该季度的特许权使用费支付发票,该发票应由Pharming在[三十(30)]收据的天数。10.2临床前研究、NTCR和制造业付款。在[三十(30)]在(A)收到第9.2.3节规定的每一份报告和(B)接收方就该报告提出的任何问题得到解决后的几天内,适用方应向付款方开具发票,以实现第9.2.1条规定的费用分摊,付款方应在[三十(30)]收据的天数。10.3付款方式。在本协定项下向任何一方支付的所有款项,应在不抵销的情况下,通过将美国、英国或荷兰境内的实体按所需金额存入收款方不时通知付款方指定的银行账户的方式支付。对于

7897269 V13 63为了计算本协议项下到期的任何款项或根据本协议应以其他方式报销的任何款项(包括计算以美元以外的货币表示的净销售额),一方应使用该方在发生此类净销售额时在其符合会计准则的标准转换方法中使用的汇率,将以外币表示的任何金额折算为美元等值。10.4个税。10.4.1预提税金。如果根据本协议应向任何一方支付的任何款项根据适用法律须缴纳任何预扣税,双方应尽其合理努力采取一切行动,包括但不限于签署和交付相关文件,以使他们能够利用任何适用的双重征税协议或条约,或以其他方式减少或取消此类预扣税。如果适用预缴税金,付款人应将预扣税金汇给有关政府机关,从应付给收款人的金额中扣除已支付的金额,并确保并向收款人发送支付该预扣税金的令人信服的证据。如果任何预扣税款可退还、可抵免或以其他方式退还,每一缔约方应向另一方提供合理需要的协助,以获得预扣税款的退还、就已支付的该等税款获得抵免或以其他方式收回该等税款。10.4.2间接税。所有付款不包括增值税、销售税、消费税和其他类似税种(“间接税”)。如果对任何付款征收任何间接税,付款方应在收到付款后按适用的税率就该等付款缴纳该等间接税, 收款方就这些付款开具的适当形式的间接税发票。双方应为本协议项下的所有应付金额开具发票

7897269 V13 64符合间接税要求的协议,无论是否可以将款项净额用于结算目的。10.4.3一方的行动所产生的税收。尽管在第10.4节中有前述规定,但如果一方自行采取任何行动(适用法律、本协议或监管机构的条款或双方之间的任何其他书面或其他协议没有要求),包括未经另一方事先书面同意的任何转让,或公司成立地点的变更,或未能遵守适用法律或备案或记录保留要求,与没有采取此类行动时相比,直接导致根据本协议支付的预扣税额增加或增加(“预扣税行动”),则该缔约方应承担因该预扣税行动而产生的预扣税额。为清楚起见,如果Pharming采取了预扣税行动,则Pharming应支付的金额(需要对其进行预扣)应在必要的程度上增加,以确保Orchard在考虑到受款人可就此类预扣税额获得的任何税收抵免后,收到的金额等于没有发生此类预扣税行动时的金额,且Pharming在任何情况下都不对任何如果收款人是联合王国居民并有资格享受适用的联合王国双重税收条约下的所有福利而产生的任何预扣税负责。10.5财务记录。每一方应并应促使其关联方和再被许可方, 保持与临床前计划、临床开发计划或许可产品开发活动(包括许可产品的净销售额)有关的完整、准确的财务账簿和记录,以足够详细地计算本协议项下应支付的所有金额,并核实其对本协议义务的遵守情况。该等簿册及纪录须

7897269 V13 65由各方及其关联方保留,直至[三(3)]在该等簿册及纪录所属的年度终结后数年。10.6审计。应任何一方的要求,另一方应并应促使其关联公司和分许可人允许由审计方指定的、被审计方合理接受的具有国际公认地位的独立公共会计师事务所在正常营业时间内的合理时间和在合理通知下审计根据第10.5条保存的账簿和记录,以确保本协议项下所有报告和付款的准确性。此类检查不得在一年内进行一次以上[十二(12)]月期(除非在此期间进行过前一次审计[十二(12)]-一个月的期间显示与该期间有关的少付或多付款项)。会计师事务所应当向当事人报告其报告是否正确的原因,并说明不一致的具体情况。除下列规定外,本次审计的费用应由审计方承担,除非审计发现被审计方少付了超过[7.5%(7.5%)]在这种情况下,被审计方应承担审计费用。除非被审计方对第16.8条所规定的审计结论提出异议,否则如果审计得出的结论是(X)被审计方欠下了额外的款项,则被审计方应在[三十(30)]天,或(Y)被审计方多付了款项,审计方应在(X)或(Y)的情况下,在[三十(30)]在审计方完成该审计之日起数日后。10.7保密性。接受方应按照第12条的保密规定对待根据本条第10条审查的所有信息,双方应促使按照第10.6节指定的任何独立会计师事务所与被审计方签订合理可接受的保密协议,根据该保密协议,该事务所有义务保密所有此类财务信息。

7897269 V13 66第11条知识产权11.1知识产权的所有权。11.1.1美国法律。为了确定双方对根据本协议构思、发现、开发或以其他方式作出的知识产权的各自所有权,根据本协议构思、发现、开发或以其他方式作出的信息和发明的发明权应根据美国的适用法律确定,无论该等构思、发现、开发或作出在何处发生。11.1.2果园所有权。在双方之间,Orchard或Orchard指定的关联公司应拥有和保留对任何和所有Orchard后台IP、Orchard Condition IP、Orchard Collaboration IP和Platform IP的所有权利、所有权和权益,并在Pharming的任何Orchard Condition IP、Orchard Collaboration IP或Platform IP归属范围内的任何权利、所有权或权益的范围内,Pharming特此将其对Orchard的所有权利、所有权和权益转让给Orchard。11.1.3医药所有权。在双方之间,Pharming或由Pharming指定的关联公司应拥有并保留对任何和所有Pharming背景IP、Pharming调节IP和Pharming协作IP的所有权利、所有权和权益。在Orchard的任何Pharming Collaboration IP或Pharming Heating IP归属范围内的任何权利、所有权或权益范围内,Orchard特此将其对任何Pharming Collaboration IP或Pharming Heating IP的所有权利、所有权和权益转让给Pharming。11.1.4共同拥有联合协作知识产权。在双方当事人之间, 双方在任何和所有联合合作知识产权和联合调节知识产权中拥有平等和不可分割的权益,并在此转让

7897269 V13 67加入双方的联名,在所有联合协作知识产权和联合调节知识产权中享有平等和不可分割的权益。至少[每季度一次]每一方应以书面形式向另一方披露任何联合协作知识产权和联合调节知识产权的开发、制作、构思或缩减为实践。根据第3.1节授予联合协作IP和联合调节IP的独家许可,每一方均有权研究和利用(包括通过授予许可、转让、抵押或其他方式,在每一种情况下,仅就其在联合协作IP或联合调节IP中的份额)联合协作IP和联合调节IP,而无需寻求同意或对另一方进行核算。11.1.5转让义务。每一缔约方均应促使根据本协议为该缔约方执行临床前研究或开发活动的所有人员有义务将其在由此产生的任何信息、专有技术和发明中的权利转让(或,如果该缔约方无法使该人同意该转让义务,尽管该缔约方已尽合理努力就该转让义务进行谈判,则提供许可)给该缔约方,前提是上述内容仅与许可产品有关。11.2专利的维护和起诉。11.2.1果园专利。根据第11.2.1节的规定,Orchard有权在全球范围内准备、提交、起诉和维护Orchard背景专利、Orchard协作专利、Orchard调理专利和平台专利,但没有义务。此类活动的成本和费用应按以下方式承担:(I)与任何和所有产品特定专利有关的部分,由Pharming公司承担;(Ii)与任何和所有果园背景专利、果园协作专利、果园调理专利和平台专利相关的非产品特定专利的部分, 果园公司。果园要保持药效

7897269 V13 68合理地告知有关果园背景专利、果园协作专利、果园调理专利和平台专利(包括任何产品专用专利)的准备、备案、起诉和维护的所有步骤。如果果园在任期内自行决定放弃或不保留区域内的果园背景专利、果园协作专利、果园调节专利或平台专利中的任何专利,并且该果园背景专利、果园协作专利、果园调节专利或平台专利涵盖任何许可产品,则果园应在任何放弃之前充分提前向Pharming发出书面通知,使Pharming能够根据情况保留该等果园背景专利、果园协作专利、果园调节专利或平台专利,并承担诉讼责任,果园在收到该通知后,应自行承担费用,并将起诉移交给Pharming。11.2.2制药专利。对于Pharming背景专利,Pharming拥有关于Pharming背景专利和Pharming协作专利的唯一权利,并且根据本第11.2.2节关于Pharming调理专利和Pharming协作专利的唯一权利,但没有义务在全球范围内准备、提交、起诉和维护Pharming背景专利、Pharming调理专利和Pharming协作专利,费用和费用由Pharming自己承担。Pharming应合理地向Orchard通报有关Pharming调理专利和Pharming协作专利的准备、备案、起诉和维护的所有步骤。如果法明,在任期内, 决定在区域内放弃或不保留任何制药协作专利或制药调节专利,则制药公司应在放弃任何专利之前充分提前书面通知果园,使果园能够自行决定保留该等制药协作专利或制药调节专利(视情况而定)并承担

7897269 V13 69起诉费用自负,收到通知后,药明应将起诉移交果园。11.2.3联合合作专利。Pharing拥有准备、提交、起诉和维护全球范围内的联合协作专利和联合调节专利的第一权利,但没有义务,此类活动的成本和开支应由Pharming按以下方式承担:(I)由Pharming在首次IND许可时或之前就许可产品提交的任何和所有联合协作专利和联合调节专利,以及(Ii)对于首次IND许可后就许可产品提交的任何和所有联合协作专利和联合调节专利,双方平等承担。Pharing应合理地向Orchard通报有关此类联合协作专利和联合调节专利的准备、备案、起诉和维护的所有步骤,并应向Orchard提供与专利当局之间关于此类联合协作专利和联合调节专利的所有通信的副本,包括在提交此类申请或答复之前向该专利当局提交的任何备案或答复的草稿,以便Orchard有合理的机会对其进行审查和评论。Pharing应合理考虑并纳入Orchard关于此类草案以及关于提交和起诉此类联合协作专利和联合调节专利的策略的请求和建议。如果Pharming在任期内自行决定放弃或不在领土内保留任何此类联合协作专利和联合调节专利,则Orchard有权, 但不是维护和承担起诉该专利的义务。Pharing应在任何放弃之前充分提前向Orchard提供书面通知,使Orchard能够自行决定保留该联合协作专利或联合调节专利并承担诉讼费用。在收到Orchard希望维护的任何通知后立即

7897269 V13 70并根据前述规定承担对该专利的起诉,Pharming应将起诉移交给Orchard。11.2.4专利期延长和补充保护证书。双方应就专利期限延长的决定进行合作,包括补充保护证书,以及适用于任何国家或其他司法管辖区的产品特定专利和联合协作专利以及联合条件专利的现在或将来可用的任何其他延长。Pharing有权但无义务申请产品特定专利和联合协作专利、联合条件专利的任何延期或补充保护证书,如果Pharming选择不申请任何延期或补充保护证书,则应通知Orchard提出申请,并提供Orchard提出申请可能需要的所有文件和其他信息的副本。每一缔约国应随时向另一方通报其为获得此种延期或补充保护证书所作的努力。每一方应应另一方的请求提供迅速和合理的协助,包括作为专利权人采取任何适用法律所要求的行动,以获得这种专利延期或补充保护证书。11.3专利的强制执行。11.3.1通知。任何指控或威胁侵犯果园背景专利、果园调理专利、果园协作专利、Pharming调理专利、Pharming协作专利、联合调理专利、平台专利或联合协作专利的行为,每一方应立即书面通知另一方, 包括产品特定专利,在该缔约方知道的领土内的任何司法管辖区内,涉及任何许可产品或与许可产品竞争的任何产品的开发(和

7897269 V13 71“侵权”),在每一种情况下,此类侵权涉及领域内与之竞争的产品(“竞争性侵权”)。11.3.2果园专利。在第11.3.5节的约束下,Orchard有权在其控制下的全球范围内自费强制执行和保护Orchard背景专利、Orchard协作专利、Orchard调理专利和平台专利,但没有义务。11.3.3制药专利。Pharing有权但没有义务在其控制下的全球范围内自费强制执行和保护Pharming背景专利、Pharming调节专利和Pharming协作专利。11.3.4联合协作专利和联合调节专利。除非和直到[果园]根据第11.2.3节承担该联合协作专利或联合调节专利的维护和起诉,[加密化]应享有在其控制下并自费在全球范围内强制执行和保护联合协作专利和联合调节专利的权利,但不是义务。如果[加密化]没有采取合理的努力来强制或抗辩关于该等联合协作专利或联合条件专利的任何此类侵权行为(A)[一百二十(120)]根据第11.3.4节向其提供第一次通知的日期,或(B)如果在此之前,[四十(40)]在适当的法律法规规定的提起此类诉讼的期限(如有)之前的几个工作日,则[果园]可自费执行该等联合协作专利或联合调节专利。11.3.5产品特定专利。[加密化]应享有在其控制下并自费在全球范围内强制执行和保护产品特定专利的第一权利,但不是义务。如果[加密化]未尽合理努力就该等特定于产品的专利(A)在[六十(60)]第一天之后的几天

7897269 V13 72根据本第11.3.5节向其提供的通知,或(B)如果较早,[三十(30)]在适当的法律法规规定的提起此类诉讼的期限(如有)之前的几个工作日,则[果园]可自费实施此类产品的特定专利。11.3.6合作。双方同意根据第11.3.6条在任何侵权诉讼中充分合作。如一方提起此类诉讼,另一方在必要时应仅为此目的提供授权书,或应加入或被指定为此类诉讼的必要一方。除非本条款另有规定,否则有权根据第11.3.6条提起任何侵权诉讼的一方有权解决该索赔;但任何一方都无权以下列方式解决根据本第11.3.6条提起的任何侵权诉讼:[将限制另一方拥有或控制(除根据本协议)的专利的范围或承认其无效或不可强制执行], (b) [削弱或对另一方的权利或利益产生实质性的不利影响], or (c) [对另一方施加任何费用或责任,或涉及另一方的任何承认]在每一种情况下,(A)-(C)在没有该另一方明确书面同意的情况下,不得无理地拒绝、附加条件或拖延这种同意。提起诉讼的一方应向另一方提供向法院提交的所有诉状和其他文件的副本,并应考虑另一方在诉讼过程中提供的合理意见。11.3.7恢复。除当事各方另有关于费用分担安排的约定外,因本节第11.3.7节所述诉讼(无论是否以和解方式)而实现的任何追回应首先用于补偿当事各方在追回时的费用和开支(如果不足以支付全部费用和开支,应按比例分配)。在作出这种补偿之后的任何剩余部分,应由已行使提起强制执行诉讼的权利的缔约方保留;但在

7897269 V13 73就任何特许权使用费专利向Pharming支付的任何裁决或和解(无论是通过判决或其他方式),该等金额应被视为相关许可产品在收到该裁决或和解的当季的净销售额,仅用于计算特许权使用费付款,但为清楚起见,该等金额不应计入任何销售里程碑的实现。11.4第三方的侵权索赔。如果根据本协议在领土内对许可产品的开发导致或可能导致第三方提出任何索赔、诉讼或诉讼,指控专利受到[加密化](或其关联方或再许可方),[加密化]有权(但无义务)使用自己选择的律师,自费为任何此类索赔、诉讼或诉讼程序辩护和控制辩护;但第11.3.2节和第11.3.5节的规定应管辖下列权利[加密化]对任何果园背景专利、果园协作专利、果园调理专利或平台专利的侵权行为提出反诉。11.5无效或不可执行的抗辩或行动。11.5.1通知。每一方应立即以书面形式将第三方在领土内知悉的任何果园背景专利、果园协作专利、果园调节专利、平台专利、联合调节专利或联合协作专利的任何声称或威胁无效或不可强制执行的主张通知另一方。11.5.2果园专利。除第11.5.5节所述外,Orchard有权(但无义务)捍卫和控制Orchard背景专利、Orchard协作专利、Orchard条件专利和平台专利的有效性和可执行性的辩护。11.5.3制药专利。除第11.5.5节所述外,Pharming拥有唯一的权利,但无义务来捍卫和控制

7897269 V13 74药物背景专利、药物调节专利和药物协作专利的有效性和可执行性。11.5.4联合协作专利和联合调节专利。除非和直到[果园]根据第11.2.3节承担该联合协作专利或联合调节专利的维护和起诉,[加密化]对联合协作专利和联合调节专利的有效性和可执行性进行辩护和控制的第一权利,但不是义务。[果园]可在区域内参与与此类联合协作专利或联合调节专利有关的任何此类权利要求、诉讼或诉讼,并自费聘请律师;[加密化]应保留对该索赔、诉讼或法律程序中的抗辩的控制权。如果[加密化]在领土提起的诉讼中,选择不对任何此类联合协作专利或联合调节专利的抗辩进行辩护或控制,或以其他方式未能发起和维持对任何此类权利要求、诉讼或诉讼程序的抗辩,则[果园]可自费进行和控制任何该等索赔、诉讼或法律程序的抗辩;[果园]须取得下列人士的书面同意[加密化]在解决或妥协此类抗辩之前,不得无理地拒绝、附加条件或拖延此类同意。如果领土内的任何联合协作专利或联合调节专利存在上述程序未涵盖的任何索赔、诉讼或诉讼,则各方均有权根据适用法律对联合协作专利或联合调节专利的有效性和可执行性进行抗辩和控制。11.5.5产品特定专利。[加密化]享有捍卫和控制产品特定专利的有效性和可执行性的第一权利,但不是义务。[果园]可在区域内参与与此类产品特定专利有关的任何此类权利要求、诉讼或诉讼,并自费聘请律师;[加密化]应

7897269 V13 75在此类索赔、诉讼或诉讼中保留对答辩的控制权。如果[加密化]选择不捍卫或控制对任何此类产品特定专利的辩护,或以其他方式未能发起并维持对任何此类权利要求、诉讼或诉讼程序的辩护,则[果园]可自费进行和控制任何此类索赔、诉讼或法律程序的抗辩;但[果园]须取得下列人士的书面同意[加密化]在解决或妥协此类抗辩之前,不得无理地拒绝、附加条件或拖延此类同意。11.5.6合作。每一方均应根据另一方可能不时提出的合理要求,就其在第11.5款中规定的活动向另一方提供协助和合作,包括作为诉讼或诉讼中的原告加入,提供查阅相关文件和其他证据的机会,以及让其员工在合理的办公时间内待命。对于与第11.5.4节有关的任何此类抗辩或索赔或反索赔,控制方应将所采取的任何步骤合理地告知另一方,并应提供与此类抗辩、索赔或反索赔相关的所有存档文件的副本。关于第11.5节规定的活动,每一方应就联合协作专利和联合调节专利的保护战略与对方进行协商。11.6UPC。11.6.1在Pharming或其指定人根据第11.2条维护和起诉此类专利的范围内,Pharming将有权决定是否选择加入或选择退出(以及再次选择加入)关于Pharming背景专利、Pharming协作专利、Pharming调理专利、联合调节专利、产品特定专利和联合协作专利的统一专利法院系统,如果Pharming提出要求,Orchard将立即采取一切合理必要的措施并执行实施此类决定所需的所有文件

7897269 V13 76药明将偿还果园因实施此类行为而产生的合理自付费用。11.6.2在Orchard或其指定人根据第11.2条维护和起诉此类专利的范围内,在双方之间,Orchard将有权决定是否加入或退出(并再次选择加入)统一专利法院系统中关于Orchard背景专利、Orchard调理专利、Orchard协作专利和平台专利的所有专利,在每种情况下,不包括任何产品特定专利,如果Orchard提出要求,Orchard将迅速采取所有合理必要的措施并执行实施此类决定所需的所有文件。前提是Orchard将补偿Pharging因实施此类行为而产生的合理自付费用。第十二条保密和不披露12.1保密义务。在任期内和一段时间内的任何时间[ten (10)]在本协议终止或全部终止后数年内,每一方应、以及上述每一方应促使其关联方及其各自的高级管理人员、董事、员工、顾问、承包商和代理人保密,不得向第三方发布或以其他方式披露,也不得出于任何目的直接或间接使用另一方直接或间接向其提供或以其他方式获知的任何保密信息,除非该披露或使用是本协议条款明确允许的。尽管如上所述,在接收方可以通过文件或其他合格证据证明的范围内,本条款12.1项下关于任何机密信息的保密和不使用义务不应包括以下任何信息:12.1.1已经由第三方发布,或者在接收方没有过错的情况下成为或此后成为公共领域的一部分;

7897269 V13 77 12.1.2在披露方披露之前由接收方掌握,对此类信息没有任何保密义务;12.1.3接收方随后从第三方无限制且未违反该第三方与披露方之间的任何协议;12.1.4披露方通常不受披露限制地向第三方提供的信息;或12.1.5由接收方独立开发或为接收方开发的信息,而不参考或使用披露方的保密信息。机密信息的特定方面或细节不应仅仅因为机密信息包含在公共领域中或由接收方拥有的更一般信息而被视为在公共领域内或由接收方拥有。此外,任何机密信息的组合不得仅仅因为此类机密信息的个别元素处于公共领域或由接收方拥有而被视为在公共领域或由接收方拥有,除非该组合及其原则属于公共领域或由接收方拥有。12.2允许的披露。在下列情况下,每一方均可在合理必要的范围内披露另一方的保密信息:12.2.1(A)本协议预期的专利申请或起诉,(B)本协议预期的诉讼或辩护,或(C)获得或维持对许可产品的监管批准;12.2.2遵守适用的法院命令或政府法规, 包括披露方证券在其上市(或已向其提交上市申请)的证券交易所颁布的规定;

7897269 V13 78 12.2.3根据本协议的条款,根据书面保密义务和不使用义务,向ITS及其附属公司各自的高级管理人员、董事、员工、审计师、顾问、承包商和代理人披露与根据本协议的条款开发任何许可产品有关的信息,每种情况下的保密和不使用义务至少与本协议中的规定一样严格;和12.2.4向实际和真诚的潜在投资者、收购人、被许可人、再被许可人和其他金融或商业合作伙伴披露信息,以评估或实施实际或潜在的投资、收购或合作,在每种情况下,根据至少与本文同样严格的保密和不使用书面义务(但如果此类保密义务和不使用义务的期限至少与本文中的义务一样严格,则视为已履行上述义务[ten (10)]在其他方面,此类保密和不使用义务至少与本协议中的条款一样严格);但披露方应修订本协议中与此类潜在投资、收购或合作相关的不合理要求披露的财务条款和其他条款,这些条款的修订应与另一方协商。尽管如上所述,如果根据第12.2.1或12.2.2节的规定,一方被要求披露另一方的保密信息,则除不允许的情况外,它应就此类披露向另一方发出合理的提前通知,并遵守披露方关于对此类保密信息保持保密的所有合理要求,在任何情况下,应采取与该方保护自身保密信息相同的勤奋努力,确保此类保密信息的保密处理,但在任何情况下,不得低于合理的努力。在任何情况下,双方同意采取一切合理行动,避免泄露保密信息。根据本第12条第2款披露的任何信息均应保密,并受本协议规定的限制,包括第12条的前述规定的约束。

7897269 V13 79 12.3名称的使用。除本协议明确规定外,除第12.4款另有规定外,未经另一方事先书面批准,任何一方不得在任何出版物、新闻稿、营销和促销材料或其他形式的宣传中使用该另一方或其任何附属公司的名称、徽标或商标(或其任何缩写或改编),且批准不得被无理扣留、附加条件或拖延。第12.3节规定的限制不应禁止任何一方披露披露方律师认为适用法律所要求的、确定另一方身份的任何披露;前提是,该一方应在合理可行的范围内尽可能提前将确定另一方身份的书面披露提交给该另一方(在任何情况下不得低于[三(3)]预期披露日期之前的工作日),以便提供一个合理的机会对这种披露发表意见。12.4公告。双方同意将附表12.4中的新闻稿作为宣布本协议所设想的交易的新闻稿。除本新闻稿外,未经另一方事先书面同意,任何一方不得发布关于本协议或其标的的任何公告、新闻稿或其他公开披露,但披露方律师认为适用法律或披露方证券所在证券交易所的上市规则(或已向其提交上市申请)要求的任何此类披露除外。如果一方的律师认为,根据适用法律或其证券上市所在的证券交易所的规则(或已向其提交上市申请的证券交易所的规则),一方当事人应在合理可行的范围内尽可能提前以书面形式向另一方提交建议的披露(在任何情况下不得低于[五(5)]预计披露日期之前的工作日),以便提供一个合理的机会就此发表意见,但前提是[五(5)]工作日审查期已满的,该方应可自由公开披露。尽管本协议有任何相反的规定,但在宣布本协议的最初新闻稿发布后,每一方均有权在未经另一方事先书面同意的情况下披露本协议的存在,

7897269 V13 80其他缔约方,以及已根据本协议公开披露的协议条款。12.5出版物。缔约方承认,必须严格监测科学出版物,以防止过早公布本协议项下的临床前研究和开发活动的结果所产生的任何不利影响。12.5.1由Orchard提供。在第12.4节的约束下,Orchard有权发布、演示或公开披露与许可产品或其临床前研究或开发相关的任何出版物、演示文稿或公开披露,但须经Pharming根据第12.5.3节事先审查和批准,此类批准不得无理扣留、附加条件或拖延。尽管有上述规定,Orchard不应要求Pharming审查或批准任何此类发布、演示或公开披露:(I)先前已获得Pharming批准,或(Ii)仅包含已在公有领域的信息。12.5.2作者:Pharming。根据第12.4节的规定,Pharming有权发布、演示或公开披露与授权产品有关的任何内容,但须经Orchard事先审查,如第12.5.3节所述。尽管有上述规定,如果任何此类出版物、演示文稿或公开披露已(I)已获Orchard先前批准,或(Ii)仅包含已在公共领域中的信息,则Pharming不应要求Orchard事先审查。12.5.3评审过程。在根据第12.5.1节或第12.5.2节提交任何论文、海报或摘要以供发表或进行口头陈述之前,出版或陈述方(“出版方”)应至少向非出版方交付论文或材料的当时的副本以供口头陈述[四十五(45)]在将论文提交给出版商或进行演示的前几天。非出版方应在以下时间内审查任何此类论文并向该出版方提出意见[三十(30)]在将该纸张交付给该另一方后的几天内,

7897269 V13 81如果果园是出版方,则制药公司应确认是否批准该出版、演示或披露(不得无理扣留、附加条件或推迟批准)。出版方应遵从另一方的要求,在提交前删除任何此类论文中提及另一方机密信息的内容,并将停止发表任何此类论文或对其进行任何演示[90(90)]允许各方在对方认为必要时获得专利保护的天数(如果Orchard作为出版方,并且如果Pharming批准适用的出版物提交或披露,则Pharming可能要求将上述内容作为批准的条件)。12.6机密信息的返还。在本协议全部终止后,每一方应立即将该方拥有或控制的包含另一方机密信息的所有记录和材料归还或删除或销毁;但应允许另一方保留此类机密信息的一(1)份副本,仅用于履行适用法律要求的本协议下的任何持续义务,或用于法律存档目的。尽管有上述规定,该另一方也应被允许保留仅由该方的自动存档和备份程序创建的此类机密信息的其他副本或包含此类机密信息的任何计算机记录或文件,但以符合该另一方的标准存档和备份程序的方式创建和保留,但不得用于任何其他用途或目的。第十三条陈述和保证13.1相互保证。自生效之日起,各方特此声明并保证如下:13.1.1组织。它是一家根据其组织管辖的法律正式成立、有效存在和信誉良好的公司,并具有所有

7897269 V13 82签署、交付和履行本协议所需的权力和授权,无论是公司还是其他机构。13.1.2授权。本协议的签署和交付以及本协议所设想的交易的履行均已得到所有必要的公司行动的正式授权,且不违反(A)该方的章程文件、章程或其他组织文件,(B)该方受约束的任何协议、文书或合同义务,(C)任何适用法律的任何要求,或(D)任何法院或政府机构目前适用于该方的任何命令、令状、判决、禁令、法令、裁决或裁决。13.1.3具有约束力的协议。本协议是一项合法、有效和具有约束力的义务,该缔约方可根据其条款对其强制执行,但须受影响债权人权利强制执行的破产法、资不抵债或其他一般适用法律、影响具体履约的司法原则以及衡平法的一般原则(无论可执行性被视为法律程序还是衡平法程序)的影响。13.1.4没有不一致的义务。它对任何人不承担任何与本协议条款相冲突或不一致的义务,或不会妨碍其勤奋和全面履行本协议项下的义务。13.1.5不得提起诉讼。没有任何针对该公司或其任何附属公司的索赔、要求、诉讼、诉讼、仲裁、调查、调查或其他任何性质的民事、刑事、监管或其他法律行动悬而未决,或据其实际所知受到威胁。13.2 Orchard提供额外保证。Orchard特此向Pharming保证,截至生效日期:13.2.1 Orchard或其关联公司是Orchard背景IP的唯一所有者, 所有这些都是免费的,没有任何留置权、费用和产权负担,但

7897269 V13 83留置权、押记和产权负担不会对果园履行其在本协议下的义务或授予任何许可证的能力造成不利影响或削弱;13.2.2果园没有收到任何书面通知,也没有任何持续的索赔或据果园所知,任何第三方威胁要提出以下索赔:(I)质疑任何已颁发的果园背景专利的范围、有效性或可执行性;(Ii)主张滥用或未侵犯任何果园背景知识产权;(Iii)挑战果园对任何果园背景知识产权的所有权或控制权;或(Iv)以其他方式提起任何专利挑战;13.2.3附表1.84列出了所有果园背景专利的完整和准确的清单,这些专利在生效日期存在;13.2.4果园不拥有、控制或以其他方式拥有与许可产品的开发有关的任何必要的专有技术或专利,因为许可产品在生效日期存在,这不是或不打算根据本协议获得许可;13.2.5 Orchard及其联营公司已在所有重大方面遵守所有适用法律,包括与Orchard背景专利在领土内的提交、起诉和维护相关的任何披露要求。此外,Orchard已就Orchard背景专利支付所有必要的申请、注册、维护和续展费用,并已向有关机构提交所有必要的文件和证书,以维护Orchard背景专利;13.2.6据Orchard所知,没有第三方侵犯、正在侵权或威胁侵犯任何Orchard背景专利或

7897269 V13 84挪用、挪用或威胁要挪用任何果园背景技术;13.2.7据Orchard所知,特许产品的开发、制造或商业化不侵犯任何第三方专利或挪用任何第三方技术。据Orchard所知,Orchard没有(A)侵犯任何第三方的任何专利,或(B)挪用任何第三方的任何专有技术,在每个情况下(A)和(B),与其开发或制造任何许可产品有关;13.2.8与任何许可产品相关的所有材料和非公共Orchard背景技术一直保密或仅在保密条款下披露给第三方。据Orchard所知,没有任何第三方重大违反此类保密规定;13.2.9 Orchard和[MolMed]已经签订了[MolMed]协议是完全有效的,Orchard有权根据[MolMed]订货协议[MolMed]并向Pharming交付用于进行临床研究的许可产品,以及[MolMed]协议不与Orchard条款8.1项下的义务相冲突;13.2.10 Orchard、其关联公司及其各自的承包商和顾问已在所有实质性方面根据适用法律进行所有许可产品的开发和制造(包括相关文件的生成、准备、维护和保留);13.2.11 Orchard及其任何关联公司,据Orchard所知,未收到与任何许可产品相关的任何程序的书面通知,也未收到任何监管机构的任何待决程序或任何许可产品的威胁。

7897269 V13 85仅就本第13.2节的目的而言,在解释第13.2节所使用的“果园背景知识产权”的定义时,果园背景技术和果园背景专利应被解释为果园、其关联公司或分包商在执行本协议项下的活动时预期自生效日期起使用的专有技术或专利(如适用),或预期在生效日期提供给制药公司或其关联公司用于其执行本协议项下活动的那些专有技术或专利。包括根据临床前计划预期使用或提供的技术诀窍或专利(如适用)。13.3共同契诺。各缔约方特此约定并同意:13.3.1缔约方不得直接或间接雇用、合同或聘用任何人从事本协议项下的任何活动,如果此人正在接受FDA的调查,以禁止其从事本协议项下的任何活动,或目前正被FDA根据修订后的《仿制药执法法》禁止(《美国法典》第21篇第301节,及以后);13.3.2本协定项下由其或代表其开展的所有活动应依照适用的法律和适用的既定内部政策和程序(如有)进行,包括与涉及实验动物或危险试剂和材料的研究有关的政策和程序(如适用)。每一缔约方同意,在根据临床前计划进行研究时所使用的任何动物,将按照关于照顾和使用实验动物的既定指南进行处理;13.3.3履行临床前计划或临床发展计划下的义务, 确保其符合下列良好的数据管理做法:(A)使用健全的科学技术和程序生成数据;(B)开展这类活动的人员按照良好的科学做法准确地记录数据;(C)根据良好的科学做法对数据进行适当的分析,没有偏见

7897269 V13 86实践;和(D)存在数据追踪以显示或再现在开展此类活动期间作出的关键决定;13.3.4在行使本协定规定的权利和履行本协定规定的义务时,缔约方应遵守并应促使其及其附属公司的雇员和承包商遵守所有适用的法律,并且在不限制前述规定的一般性的情况下,不得采取当地或其他反腐败法(统称为“反腐败法”)可能适用于该缔约方的任何行动。在不限制上述一般性的情况下,任何一方不得以违反反腐败法的方式向任何政府官员或政府雇员、任何政党官员或政治职位候选人或任何其他第三方支付与交易有关的任何款项、提供或转移任何有价值的东西;13.3.5若该方为Orchard,Orchard不得且不得促使其关联方在生效日期后不得向Orchard的任何关联方或任何第三方授予任何许可或其他权利,以大幅减少或限制根据本协议授予Pharming的权利,限制或导致限制Pharming根据本协议开发任何许可产品的能力,或限制或消除在没有该等协议或安排的情况下须根据第3.1节授予许可的任何专有技术或专利的所有权或控制权。13.4免责声明。除本文所述的明示保证外,Orchard和Pharming及其各自的任何附属公司都不会做出任何明示或默示的保证,无论是事实还是法律实施、法规或其他方式, 每一方明确拒绝任何其他担保,无论是书面的还是口头的,明示的还是默示的,包括对质量、适销性或特定用途或目的的适用性的任何保证,或对任何专利的有效性或不侵犯第三方任何知识产权的任何保证。

7897269 V13 87第14条赔偿14.1果园的赔偿Pharing应赔偿Orchard、其附属公司及其各自的董事、高级管理人员、员工、顾问、承包商和代理人(统称为“Orchard Indemnitee”)与任何和所有第三方(统称为“Orchard Indemnitee”)有关的任何和所有损失、损害赔偿、责任、罚款和费用(包括合理的律师费和费用)(统称为“损失”)。“索赔”)果园受赔人因以下原因而招致或向其提出的索赔:14.1.1任何药用受赔人或次要受偿人或其代表对任何许可产品的剥削;或14.1.2 Pharming违反Pharming在本协议中作出的任何保证、陈述、契约或协议;或14.1.3任何Pharming受偿人或次要受偿人的疏忽、鲁莽或故意不当行为;在第14.1.1至14.1.3款中的每一种情况下,不包括此类损失:(A)根据第14.2条,果园对此类损失负有赔偿义务,双方应就此类损失各自承担责任,或(B)果园任何受赔方违反本协议、疏忽或故意不当行为造成的损失。14.2对药剂的赔偿。Orchard应赔偿Pharming、其关联公司及其各自的董事、高级管理人员、员工、顾问、承包商和代理人(统称为“Pharming受赔方”)因以下原因引起或发生的任何和所有损失:14.2.1 Orchard违反Orchard在本协议中作出的任何保证、陈述、契诺或协议;或

7897269 V13 88 14.2.2任何果园受赔人的疏忽、鲁莽或故意不当行为;不包括第14.2.1和14.2.2节中的每一种情况下的此类损失:(A)根据第14.1条,Pharming有赔偿义务的损失,各方应以其各自对此类损失承担的责任的范围内对另一方进行赔偿,或(B)任何受保人违反本协议、疏忽或故意不当行为造成的损失。14.3赔偿程序。打算根据第14条要求赔偿的一方(“被赔偿方”)应将被赔偿方打算要求赔偿的任何索赔以书面形式迅速通知给赔偿方(“赔偿方”),而赔偿方应独家控制此类索赔的抗辩或和解。被赔偿人可自费参与赔偿人对任何索赔的辩护和和解谈判,并由被赔偿人自己选择律师。本条第14条中的赔偿安排不适用于为解决与索赔有关的任何诉讼而支付的金额,如果和解是在未经赔偿人同意的情况下进行的,而同意不得被无理地拒绝、附加条件。, 或者被推迟了。在就索赔提起任何诉讼后的合理时间内未向赔偿人送达书面通知,只有在赔偿人因此而受到实际损害的范围内,才能解除赔偿人根据本条第14条承担的赔偿义务。在调查与本赔偿范围内的索赔有关的任何诉讼时,被赔偿人应与赔偿人及其法定代表人充分合作。14.4间接和相应损失。除非作为一方根据第14条规定提供赔偿的索赔的一部分需要向第三方支付任何此类损害赔偿,否则任何一方及其任何关联公司均不对以下任何情况承担责任:(I)间接或相应损失,或(Ii)利润损失、收入损失、商誉损失或业务中断,不论其是否直接或间接造成,以及(I)和(Ii)在每种情况下(I)和(Ii)无论是合同、侵权行为、疏忽、违反法定义务,或以其他方式与任何

7897269 V13 89不符合本协议的条款或本协议拟进行的交易或许可产品的使用,即使已被告知可能发生此类损害。上述责任限制不得限制或排除任何一方对(A)死亡或人身伤害、(B)故意不当行为(包括欺诈和欺诈性失实陈述)或(C)根据适用法律不能限制或排除的任何其他责任的责任。14.5保险。每一方应拥有并自费提供足够的责任保险或自我保险计划(包括产品责任保险),以防范因根据本协议和与本协议相关的任何协议而进行的活动以及按照制药业通常为该缔约方根据本协议开展的活动而产生的潜在责任和风险(包括承保范围、可扣除限额和自我保险保留)。该责任保险或自我保险计划应为该当事人在本合同项下的活动所引起的所有责任投保,包括人身伤害、人身伤害或财产损失的责任。第14.5节不应对双方在本协议项下的责任构成任何限制。此类保险信息的保密方式应与双方在本合同项下披露的任何其他保密信息相同。第十五条期限和终止期限。本协议自生效之日起生效,除非按本协议的规定提前终止,否则在各国的基础上继续有效,直至该国家许可产品的版税期限届满(下称“期限”)。在特定国家/地区许可产品的版税期限到期时, 根据第3.1节授予Pharming在该国的特许产品的许可应为全额支付、免版税、永久和保持独家,并且应仅在此类许可授予以下权利的有限范围内继续存在:(I)当时的专有技术,且这些专有技术仍然是保密的和/或(Ii)根据第3.1节许可给Pharming的任何专利的有效主张。为清楚起见,请遵守

7897269 V13 90第4条,本协议的任何内容不得限制或限制任何一方(或其各自的关联公司或分被许可人)使用或实践果园或其关联公司随后属于公共领域的任何专有技术的能力。15.2为方便起见,由Pharming终止。PURING有权以任何或无任何理由终止本协议:(I)如果终止通知是在收到关于许可产品的第一次IND许可之前提交的,则在[90(90)]提前几天向果园发出书面通知,以及(Ii)如果终止通知是在收到许可产品的第一次IND许可之时或之后提交的,则在[180(180)]提前几天向果园发出书面通知,但在第(I)或(Ii)种情况下,该通知不是由Pharming在[18个月]在生效日期之后。15.3因重大违约终止合同。如果另一方严重违反本协议,则另一方有权终止本协议,并且这种违反行为将持续[90(90)]天数(或[ten (10)]在收到来自非违约方的书面通知并要求对其进行补救之后),但如果另一方对另一方是否严重违反了本协议发生善意争议,则与此相关的补救期限应从非违约方收到该书面通知之日起收取费用,并根据第16.8条对该争议进行解决,双方理解并同意,在该争议悬而未决期间,本协议的所有条款和条件应继续有效,双方应继续履行其在本协议项下的所有义务。并且,如果所涉实质性违约在收费治疗期结束时(即在根据该适用条款解决该争议之前)得到纠正,则非违约方不再有权根据本15.3节对该实质性违约进行终止。15.4果园因专利挑战而终止。果园有权在下列时间终止本协议[六十(60)]提前一天书面通知Pharming,在此期间[六十(60)]日期限内,双方应真诚协商解决任何

7897269 V13 91如果制药公司或其任何关联公司或再被许可人直接以自己的名义主张或指示第三方主张专利挑战,则在下列情况下,果园根据本条款第15.4条终止的权利不适用:(A)制药公司或其任何关联公司或再被许可人在[六十(60)]-日通知期,或(B)该专利挑战是针对Orchard(或其任何关联公司)或其代表针对Pharming或其任何关联公司或再被许可人提出的索赔、诉讼或程序提出的抗辩,或与交叉索赔或反索赔的主张有关的抗辩。就本15.4节而言,“专利挑战”是指在法律或行政诉讼中对果园背景专利、果园调理专利、果园协作专利或果园平台专利(或其任何主张)的可专利性、有效性、所有权或可执行性提出的任何挑战,包括:(X)提起或提起宣告性判决诉讼,其中果园背景专利、果园调理专利、果园协作专利或果园平台专利中的任何一项被指控无效或不可强制执行;(Y)申请或寻求重审任何果园背景专利、果园调理专利、果园协作专利、果园平台专利(Orchard的书面协议除外),或成为干扰的一方或寻求干预;或(Z)针对任何果园背景专利、果园调理专利、果园协作专利或果园平台专利提起或进行任何反对、撤销、无效或其他类似法律程序。15.5因破产而终止合同。如果一方当事人(A)根据(一)破产、(二)资不抵债、(三)重组(有偿付能力的重组除外)、(四)重组(有偿付能力的重组除外)或(五)适用于任何管辖区的企业救助法申请保护;(B)为债权人的利益进行转让;(C)指定或接受指定接管人、管理接管人。, 执达主任或受托人或对其实质上所有财产的类似委任;。(D)提出或实施一项安排计划、公司自愿安排或其他债务重整、妥协或延期协议(该计划、安排或协议不会对本协议任何其他当事方的权利造成不利影响的情况除外);。

7897269 V13 92任何解散或清算的一方或停止其实质上所有业务的一方;(F)根据任何(I)破产、(Ii)无力偿债、(Iii)重组(有偿付能力的重组除外)、(Iv)重组(有偿付能力的重组除外)或(V)商业救助法或任何此类申请或请愿书提出的任何申请或请愿书的任何提交,而在任何该等情况下,该等申请或请愿书不会在[六十(60)]如果缔约另一方在提交本协定之日起三天内不履行其在一般程序中到期的义务,或(G)书面承认其一般无力履行在一般过程中到期的义务(但推迟一段时间履行特定义务的请求始终不等于承认缔约方一般无法履行到期的义务),则缔约另一方可在书面通知缔约另一方后立即全部终止本协定。15.6终止的效果。15.6.1许可证终止。本协议终止后,根据第3.1条授予的所有权利和许可均应终止,并且不再具有任何效力或效果。为免生疑问,根据第3.2.2节授予的许可在本协议终止后继续有效。15.6.2因果园违约而由Pharming终止协议的其他补偿措施。如果根据第16.8节最终确定Pharming有权根据第15.3节终止本协议(为清楚起见,应遵守第15.3节关于固化和收费的规定),并且如果该确定发生在以下较后一项之前:(I)第8.1.1(C)和(D)节项下的技术转让活动成功完成;和(Ii)Pharming、其联属公司或再被许可人向领土上任何地方的适用监管机构提交关于许可产品的第一份药品批准申请的日期,如果仲裁员已根据第16.8条以书面形式确定本条款15.6.2中规定的补救措施将是合理和相称的补救措施,则Pharming有权通过向Orchard提供书面通知来选择

7897269 V13 93不迟于15.6.2引用本节[三十(30)]根据第16.8条(“选举通知”)作出上述决定的天数,作为Pharming对Orchard此类重大违约行为的唯一和唯一补救措施,使本协议继续充分有效,并适用以下规定:(A)Pharming支付开发里程碑付款、销售里程碑付款和版税付款的义务应减少为[75%(75%)](B)果园应根据适用法律的要求,包括任何法规或道德要求,以及所有正在进行的工作的有序完成和逐步结束,立即停止执行临床前计划或临床发展计划下的任何进一步活动,并应解散联合临床委员会;以及(C)在制造过程尚未成功转移到Pharming的情况下,Orchard应自费尽合理努力将该制造过程转移给Pharming,并在根据下一句达成一致的技术转移计划的范围内,按照双方商定的任何技术转移计划。双方将立即真诚地商定一项技术转让计划,其中将包括转让所有必要的信息和文件,以使Pharming能够承担和执行之前被归因于Orchard根据临床前计划和临床开发计划进行的终止活动。尽管有上述规定,在第15.6.2(C)节规定的服务期满后,果园不应被要求提供支持或协助或执行任何活动[六(6)]自收到之日起的几个月

7897269 V13 94 Pharming根据本条款15.6.2发出的通知,并为清楚起见:(1)Pharming根据本条款15.6.2规定的权利仅在Orchard根据第15.3条规定的适用治愈期限内未得到补救的情况下适用;以及(2)如果Pharming未在第15.3条规定的适用补救期限内提供任何选举通知[三十(30)]在作出最终决定后的几天内,Pharming将继续有权根据第15.3款终止本协议或使本协议继续完全有效,此外,还有权寻求Pharming可用的任何其他权利或补救措施。15.6.3发展减速或过渡。(A)临床研究。在向Orchard发出书面通知后,Pharing应酌情决定(I)结束在本协议终止前由其或其代表发起的所有临床研究(“正在进行的临床研究”),或(Ii)负责完成(根据既定协议)所有正在进行的临床研究;但如果Orchard以书面形式提出要求,则Pharming应将该等正在进行的临床研究过渡到Orchard。在根据第15条发出或收到终止通知后的任何时间,PURING不得就任何许可产品开始任何临床研究。(B)合作。(I)如果Orchard要求承担任何正在进行的临床研究的责任,Pharming应向Orchard及其指定人员提供合理合作,以促进正在进行的临床研究和其他开发的合理、有序和迅速的过渡,双方应尽合理努力

7897269 V13 95在终止通知交付后,向果园和/或其指定人提供与许可产品有关的活动,以便果园能够在终止生效之日对此承担责任(除非任何一方对终止有争议)。如果在终止生效日期之前不能完全实现这一点,Pharming应继续向Orchard及其指定人提供此类合理合作,直至此类过渡完成。在不限制前述一般性的情况下,如果本协议终止,Pharming应在终止后提供合理的咨询和协助,以便在每种情况下向Orchard转让或过渡到Orchard、Pharming背景技术和Pharming协作技术,使Orchard在合理必要或有用的范围内继续进行许可产品的持续临床研究。(Ii)如果为了方便起见,Pharming根据第15.2节终止了本协议,Orchard for Pharming违反了15.3节,Orchard根据15.4节终止了专利挑战,或者Orchard根据15.5条终止了Pharming的破产,则Pharming应承担任何一方在处理15.6.3节规定的正在进行的临床研究时产生的所有合理费用。(Iii)如果本协议因Orchard违反第15.3条而被Pharming终止,或因Orchard根据第15.5条破产而被Pharming终止,则Orchard应承担任何一方根据第15.6条进行的活动的所有合理费用。

7897269 V13 96(Iv)如果Orchard要求承担进行中的临床研究的责任,则在Orchard的要求下,双方应在合理可行的情况下,在其后尽快真诚地谈判一项过渡援助协议,进一步详细列出Orchard应承担该责任的条款,包括15.6.3(B)(I)节所述将提供的援助的细节(如果适用)。该协议的目的是确保Orchard能够尽可能迅速和高效地承担与许可产品相关的任何正在进行的临床研究和任何其他开发活动的责任,确保及时维护和提交所有必要的法规备案或提交,并确保Orchard能够访问与此相关的所有合理需要的文件、记录、信息和通信。15.6.4采购存货。如果Pharming为了方便而根据第15.2条终止本协议,或Orchard因Pharming违反15.3款而终止本协议,则Orchard有权酌情从Pharming购买终止日期由Pharming或代表Pharming持有的与许可产品制造相关的任何或全部库存,以及与许可产品制造相关的所有质粒和载体,价格与Pharming的制造成本相同,没有加价;前提是Pharming应能够保留足够数量的库存,以完成其开发或商业化活动的终止。Orchard应通知Pharming in[六十(60)]无论果园是否选择行使这种权利,终止生效之日起数日内。15.6.5合同转让。如果Pharming为了方便而根据第15.2条终止本协议,则Orchard会因Pharming的违约而终止本协议

7897269 V13 97如果果园根据15.4条款提出专利挑战,或果园根据15.5条款破产,应果园的要求,果园应采取商业上合理的努力,向果园或其指定人转让与特许产品有关的所有当时存在的商业协议(或者,如果是与由或代表药明开发或商业化的许可产品和其他产品有关的商业协议,此类商业协议项下的权利和义务仅与许可产品有关),在果园继续许可产品的开发和/或商业化的合理必要范围内。15.6.6排他性。为清楚起见,在本协定终止时,各缔约方在第4条项下的义务即告终止。15.6.7许可证和专利起诉。本协议终止后,Orchard特此授予Pharming在Orchard背景IP、Orchard协作IP、Orchard调理IP、Platform IP和Orchard在联合协作IP和联合调理IP中的权益下的非独家、可再许可的权利,仅用于履行Pharming在本协议项下的剩余义务和完成任何正在进行的临床研究。为清楚起见,在本协议终止时,Pharming在起诉和执行任何果园背景专利、果园调理专利、果园协作专利、平台专利和产品特定专利方面的权利将终止。15.6.8机密信息。在本协议终止时, 每一方应将第12.6节规定的另一方的所有保密信息归还或促使归还给另一方。15.6.9补救措施。除非本协议另有明文规定,否则根据本协议的规定终止本协议不应限制法律或衡平法上的补救措施。

7897269 V13 98 15.6.10知识产权许可证谈判。在Orchard根据第15.3、15.4或15.5节终止本协议时,或在Orchard的请求下由Pharming根据第15.2条终止本协议时,Pharming特此向Orchard授予自终止之日起由Pharming控制的任何专利和专有技术下的田间许可,除勤勉义务外,基本上符合本协议的条款,范围为开发许可产品所需的范围,并应包括高达[5%(5%)]根据许可产品的适用净销售额(在该定义中,每个提及的“Pharming、其附属公司或再被许可人”应被解释为“果园、其附属公司或其再被许可人”,就本章节15.6.10节中的净销售额而言,应被解释为“果园、其附属公司或其再被许可人”),但在其他情况下应全部付清。如果双方不能就适当的特许权使用费费率或该许可的任何其他条款达成一致,则特许权使用费费率和/或其他条款应由第16.8节中规定的争议解决程序确定。15.6.11应计权利;存续义务。本协议因任何原因终止或期满,不影响在终止或期满之前为一方所产生的任何权利。此类终止或期满不应解除一方在本协议终止或期满后仍需履行的义务。在不限制前述规定的情况下,下列条款和章节在任何此类终止或期满后继续有效:[第1条、第12条、第14条和第16条;以及第3.6款第10.1至10.4款(在本协定项下任何未偿付款义务期间)、第10.5款(在本协定所列任何剩余债务期间)以及第11.1款和15.6款]。第十六条其他16.1不可抗力。任何一方都不对另一方承担责任或责任,也不被视为在本协议项下违约或违反本协议

7897269 V13 99履行或履行本协议的任何条款,如果此类不履行或延迟是由非履约方合理控制的事件引起或导致的,这些事件包括火灾、洪水、地震、飓风、禁运、短缺、流行病、大流行病、检疫、战争、战争行为(无论是否宣战)、恐怖主义行为、叛乱、骚乱、内乱、罢工、停工或其他劳工骚乱(不论涉及不履约方的工作人员或任何其他人)、天灾或其他行为,任何政府当局在采取行动方面的疏忽或拖延(除非这种拖延是由于不履约方或其任何关联方违反本协定的任何条款或条件造成的)。不良方应在下列时间内将不可抗力通知另一方[三十(30)]在此类事件发生数日后,向另一方发出书面通知,说明事件的性质、预计的持续时间以及为避免或尽量减少其影响而采取的任何行动。暂停履行的范围和持续时间不得超过必要的范围,不履行方应尽合理努力纠正其不能履行的行为。16.2出口管制。任何一方未根据适用法律事先获得有关机构或其他政府实体的书面同意,不得直接或间接将根据本协定从缔约另一方获得的任何技术信息或使用此类技术信息的任何产品出口到出口时需要出口许可证或其他政府批准的地点或方式。16.3控制权的变更。16.3.1如果任何一方与第三方发生控制权变更,且紧接在控制权变更之前,该方或其附属公司正在执行任何竞争计划:(A)该一方(或其继承方)应在以下时间内向另一方发出关于控制权变更的书面通知[ten (10)]在首次公开宣布签署与该交易有关的任何协议和该交易的结束日期之前的一个工作日内;和(B)该缔约方将

7897269 V13100不会因与该第三方的控制权变更而违反第4.1节中规定的限制,且该第三方(或该关联方)可以继续执行或开始执行适用的竞争计划,只要该第三方(或其继承方)执行以下操作之一:(A)在该第三方的控制权变更或发起该竞争计划后,尽快建立和实施适当的防火墙程序,将该竞争计划(以及进行该等活动的人员)与根据本协议由该方或代表该方进行的活动隔离,包括确保直接参与此类竞争计划的人员不得访问任何一方关于本协议项下活动的任何保密信息,前提是此类防火墙程序和隔离义务不得延伸至任何帐户、财务或行政人员,并且适用第三方的董事可以获得关于竞争计划和根据本协议执行的活动的进展和所有财务信息的一般更新;或(B)通过出售、转让、独家许可或其他方式,剥离或促使其相关关联公司剥离其在此类竞争计划中的权益[十二(12)]在这样的控制权变更之后的几个月里。如果一方根据第16.3.1(A)条实施防火墙,则该方(或其继承方)应在该方完成控制变更后,在合理可行的情况下尽快向另一方提供合理详细的适用防火墙程序的书面描述,另一方应有机会对该防火墙发表意见

7897269 V13101程序,该缔约方应真诚地考虑将其纳入此类程序的意见。为清楚起见,如果发生此类控制权变更的一方是Pharming,且此类Pharming控制权变更是由任何Pharming竞争性收购方进行的,并且此类Pharming竞争性收购方有任何额外的竞争计划,则第16.4节的规定也应适用于此类额外的竞争计划。16.4 Pharming(或其继任者)应向Orchard提供书面通知,说明任何Pharming竞争性收购方在紧接该控制权变更之前有任何其他竞争计划对Pharming的控制权变更[ten (10)]在首次公开宣布签署与该交易有关的任何协议和该交易的结束日期(“Pharming COC通知日期”)之前的一个工作日内。在Pharming控制权变更的情况下,如果Pharming竞争收购方已经或启动了任何其他竞争计划:(A)Pharming(或其继任者)将针对每个此类其他竞争计划至少执行以下一项操作:(I)在Pharming控制权更改或启动其他竞争计划后,尽快建立和实施适当的防火墙程序,将此类额外竞争计划中的所有活动(以及进行此类活动的人员)与Pharming根据本协议进行的或代表Pharming执行的活动分开,包括确保参与此类竞争计划的人员不得访问任何一方关于本协议项下活动的任何机密信息;或

7897269 V13102(Ii)通过出售、转让、独家许可或其他方式,剥离或促使其相关关联公司剥离其在该附加竞争计划中的权益[十二(12)]在Pharming的控制权发生变化后的几个月里。(B)如果Pharming根据第16.4(A)(I)条实施防火墙,则Pharming(或其继任者)应在Pharming的控制变更完成后,在合理可行的情况下尽快向Orchard提供合理详细的适用防火墙程序的书面说明,Orchard应有机会对该等防火墙程序发表意见,而Pharming应真诚地考虑这些意见,以便纳入该等程序。(C)在Pharming变更控制权后,Orchard有权将根据本协议规定必须提供给Pharming或JSC的信息或报告限制在确保Pharming履行其义务所必需的范围内,并且Orchard有权避免在该等信息或报告中包含Orchard的商业敏感信息(由Orchard自行决定)。为清楚起见,在任何一方发生控制权变更(包括所有权变更)后,该缔约方应继续按照本协议的条款履行其在本协议项下的义务。16.5作业。除本协议项下明确规定外,任何一方未经另一方事先书面同意,不得转让或以其他方式转让本协议或本协议项下的任何权利或义务(同意不得被无理拒绝、附加条件或延迟);但是,任何一方均可在未经另一方同意的情况下将本协议及其在本协议项下的权利和义务转让或以其他方式转让给关联公司,但如果接受本协议的人

7897269 V13103如果转让的协议不再是转让方的附属公司,则该协议应自动转让回转让方或其继承方。此外,任何一方均有权转让其在本协议项下的权利和义务,以取得其与本协议有关的全部或几乎所有资产。双方在本协议项下的权利和义务应对双方的继承人和允许的受让人具有约束力,并符合他们的利益,本协议中出现的一方的名称将被视为包括该方的继承人和允许的受让人的名称,在必要的范围内,以实现本第16.5节的意图。任何不符合第16.5条规定的转让均为无效。16.6可分割性。如果本协议的任何部分因任何原因被有管辖权的法院裁定为无效、不可执行或非法,则在可行的范围内,此类裁决不得全部或部分影响或损害本协议任何其余部分的有效性、可执行性或合法性。所有剩余部分应保持完全效力和效力,就像原始协议在没有无效、不可执行或非法部分的情况下签署一样。在这种情况下,双方应迅速进行谈判,以最接近双方原意的有效、可执行和法律规定取代无效、不可执行或非法的部分。16.7适用法律。本协议或本协议的履行、违约或终止应按照下列法律解释、管辖和解释[英格兰和威尔士]排除任何冲突或法律选择规则或原则,否则可能会将本协议的解释或解释提交给另一个司法管辖区的实体法;但前提是,有关(A)本协议项下的专利的发明权应根据第11.1.1节确定,以及(B)专利的解释或效力应根据特定专利已提交或授予的国家或其他司法管辖区(视情况而定)的法律确定。双方同意排除《联合国国际货物销售合同公约》对本协定的适用。16.8争议解决。

7897269 V13104(A)除通过第2.8.2节规定的程序解决的争议外,如果双方之间因本协议或与本协议相关交付的任何文件或文书而产生争议(“争议”),则应根据第16.8条解决。任何争端应首先提交当事各方的高级官员,他们应真诚地协商问题的解决。高级官员共同商定的任何最后决定均为终局决定,对双方均有约束力。如果高级官员不能在以下时间就解决任何此类问题达成一致[三十(30)](B)除第16.8(A)款另有规定外,任何争议均应提交并最终由高级官员仲裁解决。[伦敦国际仲裁法院]在[自2021年1月1日起施行的《仲裁规则》] (the “[LCIA]规则“)由一名独任仲裁员担任,该仲裁员应按照[LCIA]规矩。仲裁的法定地点为[英国伦敦]。仲裁应以英语进行。仲裁员作出的裁决是终局的,对争议各方具有约束力,不得上诉。本协议各方同意,承认和执行裁决的判决可以在任何有管辖权的法院进行,并不可撤销地服从任何此类法院对双方或其资产的管辖权,以承认和执行裁决。双方特此同意,本条款第16.8(B)款规定的仲裁协议应受下列法律管辖[英格兰和威尔士].

7897269 V13 105 16.9临时救济尽管本协议有任何相反规定,但第16.8节的任何规定均不妨碍任何一方在必要时寻求临时或临时救济,包括临时限制令、初步禁令或其他临时衡平法救济,以保护该方的利益。本节应具体可执行。16.10通知。本协议项下要求的任何通知或其他通信均应以书面形式进行,应特别提及本协议,并且只有在下列情况下才应被视为已发出:(A)专人递送或(B)通过国际公认的隔夜快递服务寄给当事各方,地址在下文中规定的当事各方的地址或当事各方根据本条款第16.10节规定的其他地址。该通知应被视为自专人交付之日起或在寄存于国际公认的隔夜递送服务后的第二个(2)营业日(在交付地点)发出。本第16.10节的目的不是为了管理双方在履行本协议条款下的义务时所需的日常业务通信。

7897269 V13106IF to Pharming,To:Pharing Technologies B.V.Darwinweg 24,Leiden 2333 CR,荷兰收信人:Leging Department,Inc.10独立大道,Warren,New Jersey 07059收信人:Legal Department IF to Orchard,TO:Orchard Treateutics(Europe)Limited 108 Cannon Street London EC4N 6EU[邮箱:LegalNotitions@orchard-tx.com](I)Orchard Treeutics(Europe)Limited伦敦坎农街108号EC4N 6EU[邮箱:Business.Development@orchard-tx.com]16.11整个协议;修正案。本协议连同本协议所附的附表,阐明并构成双方之间关于本协议标的的完整协议和谅解,以及与此有关的所有先前的协议、谅解、承诺和陈述,无论是书面的还是口头的,均为

7897269 V13107被取代(包括双方于2021年1月21日签署的某些保密披露协议;但根据该保密披露协议披露或收到的所有“保密信息”应被视为本协议项下的“保密信息”,并受本协议的条款和条件的约束)。每一方确认,除本协议明确规定外,不依赖另一方的任何陈述或保证。除非以书面形式并由双方授权代表正式签署,否则任何修改、修改、解除或解除对双方均无约束力。16.12英语。本协议应以英语编写和签署,而根据本协议或与本协议相关的所有其他通信应使用英语。任何其他语言的翻译不应是其正式版本,如果英语版本与该翻译之间在解释上有任何冲突,则以英语版本为准。16.13豁免和不排除补救措施。享有本协议任何条款或条件的一方可随时放弃本协议的任何条款或条件, 但除非由放弃该条款或条件的当事一方正式签署的书面文书中列明,否则该豁免无效。任何一方放弃任何权利,或放弃另一方未能履行或违反的任何权利,不得被视为放弃任何其他权利,或放弃该另一方的任何其他违反或不履行的行为,无论是否具有类似的性质。本协议规定的权利和补救措施是累积的,不排除适用法律规定或以其他方式获得的任何其他权利或补救措施,除非本协议明确规定。16.14对第三方没有任何好处。除第14条另有规定外,本协定中规定的契诺和协定仅为本协定双方及其继承人和允许受让人的利益,不得解释为赋予任何其他人任何权利。16.15进一步保证。每一方应正式签立和交付,或促使正式签立和交付此类进一步的文书,并作出和促使作出此类进一步的行为和事情,包括提交此类转让、协议、文件和

7897269 V13108根据与本协议有关的必要或合理要求,或为了更有效地执行本协议的规定和目的,或为了更好地向该另一方保证和确认其在本协议项下的权利和补救措施,签署本协议。16.16当事人之间的关系。Orchard和Pharming是独立的承包商,双方之间的关系不应构成合伙企业、合资企业或代理机构,包括出于税收目的。未经另一方事先书面同意,任何一方均无权发表任何声明、陈述或作出任何形式的承诺,或采取对另一方具有约束力的任何行动。一方雇用的所有人员应为该方的雇员,而不是另一方的雇员,因雇用任何此类雇员而产生的一切费用和义务均应由该方承担。16.17副本;传真执行。本协议可签署两(2)份或更多份,每份应被视为正本,但所有副本应共同构成一(1)份相同的文书。本协议可通过传真或电子传输的签名方式签署,此类签名应被视为对本协议各方具有约束力,如同它们是原始签名一样。{签名页如下所示}

7897269 V13自生效之日起,本研究合作和许可协议由双方授权代表签署。Orchard Treeutics(欧洲)有限公司:名称:标题:Pharing Technologies B.V.由:名称:标题:
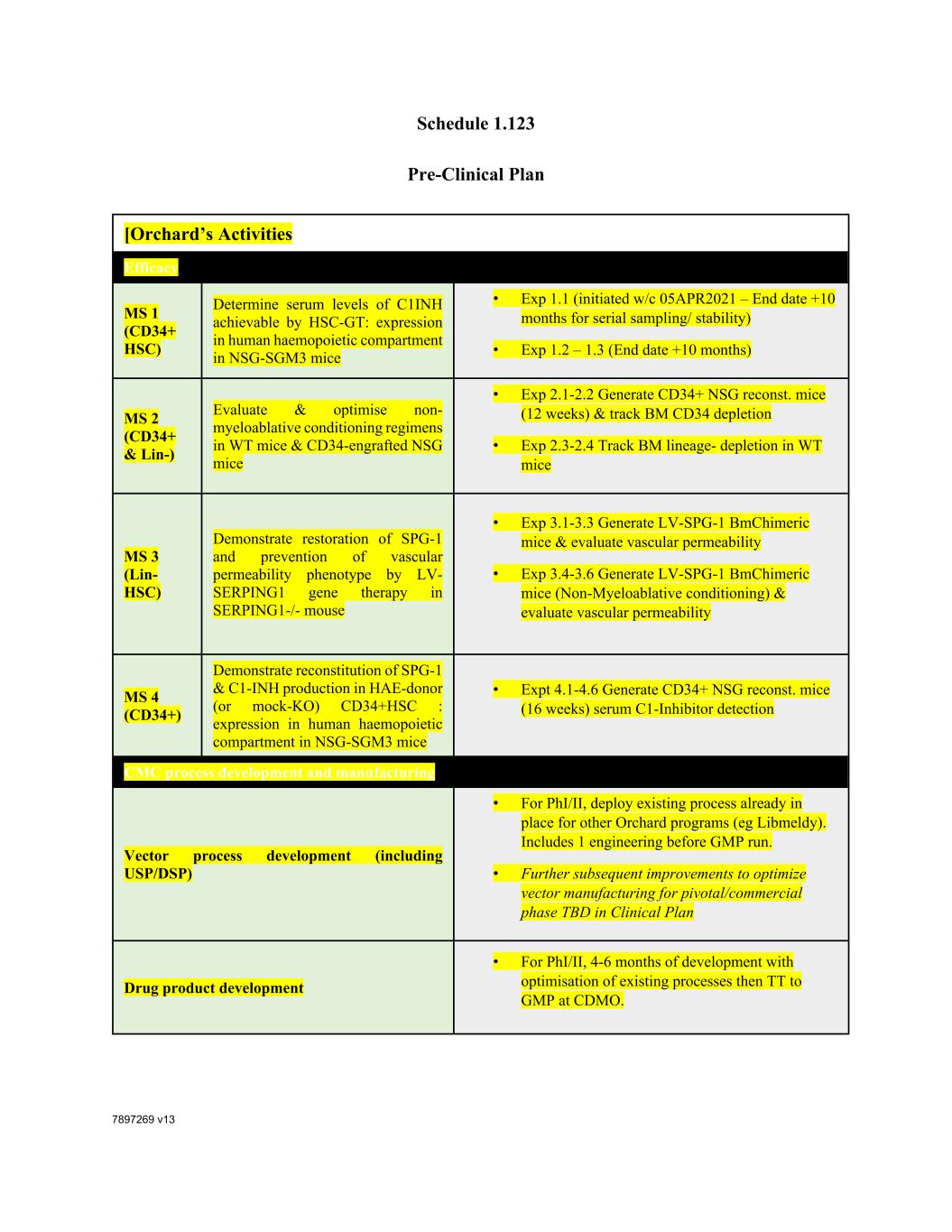
7897269 V13时间表1.123临床前计划[Orchard的活动功效MS 1(CD34+HSC)确定HSC-GT可实现的C1INH血清水平:在NSG-SGM3小鼠的人类造血室中表达·实验1.1(开始w/c 05APR2021-结束日期+10个月的连续采样/稳定性)·实验1.2-1.3(结束日期+10个月)MS 2(CD34+和LIN-)评估和优化WT小鼠和CD34移植的NSG小鼠的非骨髓调节方案·实验2.1-2.2生成CD34+NSG重建。小鼠(12周)和跟踪BM CD34耗竭·实验2.3-2.4跟踪WT小鼠的BM谱系耗竭MS 3(LIN-HSC)展示通过LV-SERPING1基因治疗在SERPING1-/-小鼠中恢复SPG-1和防止血管通透性表型·实验3.1-3.3产生LV-SPG-1 Bm嵌合小鼠并评估血管通透性·Exp 3.4-3.6产生LV-SPG-1 Bm嵌合小鼠(非清髓条件)并评估血管通透性MS 4(CD34+)展示重建SPGHAE供体(或模拟KO)CD34+HSC产生-1和c1-INH:在NSG-SGM3小鼠的人造血室中表达·实验4.1-4.6产生CD34+NSG。小鼠(16周)血清C1抑制物检测CMC流程开发和制造载体流程开发(包括USP/DSP)·对于Phi/II,部署其他果园项目(如Libmeldy)已经到位的现有流程。包括1个GMP运行前的工程部。·进一步改进,以优化临床计划药物产品开发中关键/商业阶段待定的载体制造·对于Phi/II,通过优化现有流程进行4-6个月的开发,然后在CDMO从TT到GMP。
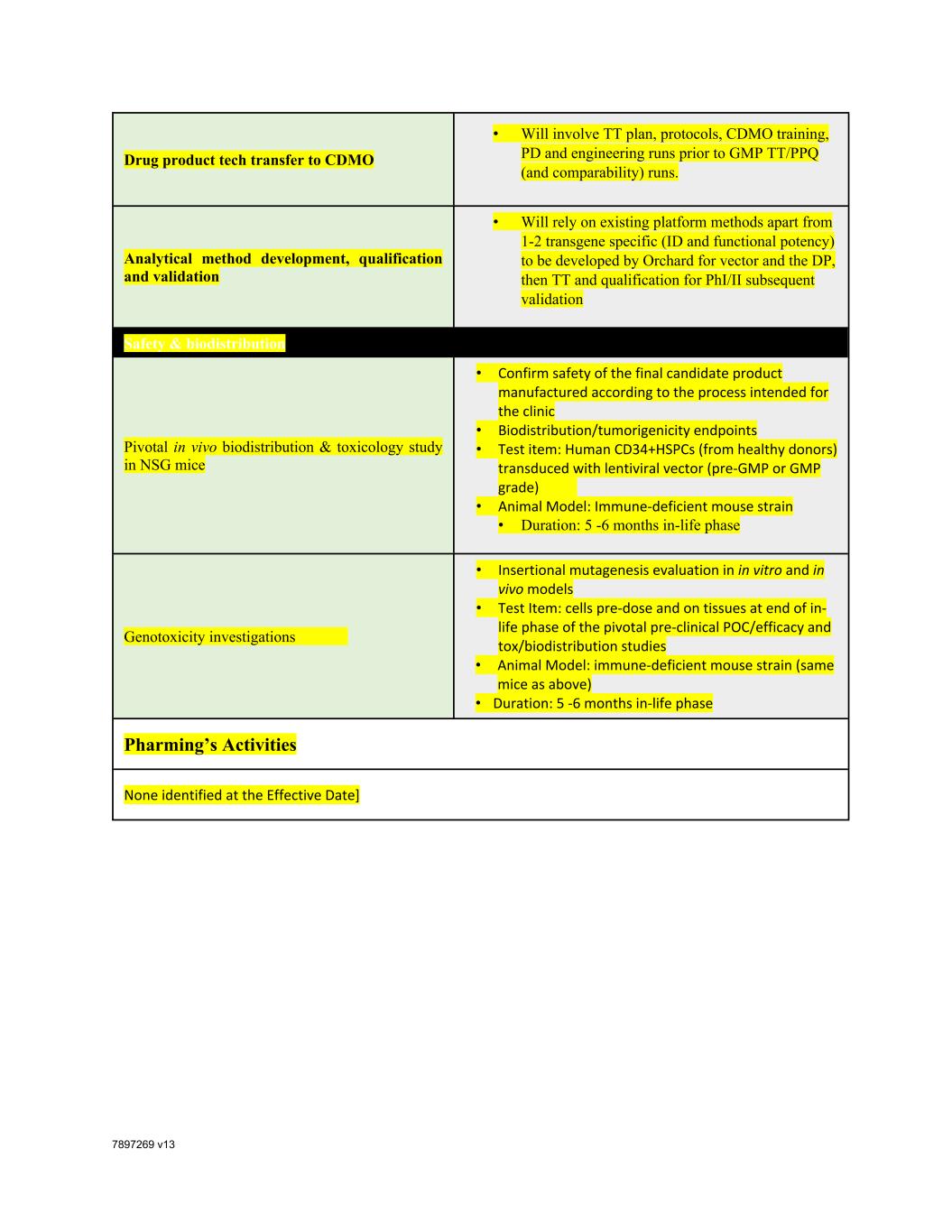
7897269 V13药品技术转让至CDMO·将涉及在GMP TT/PPQ(和可比性)运行之前的TT计划、方案、CDMO培训、PD和工程运行。分析方法的开发、鉴定和验证·将依赖于现有的平台方法,而不是由Orchard为载体和DP开发的1-2个转基因特异性(ID和功能效力),然后TT和Phi/II后续验证安全性和生物分布关键在NSG小鼠体内的生物分布和毒理学研究·确认按照临床流程生产的最终候选产品的安全性·生物分布/致瘤性终点·测试项目:转导慢病毒载体(GMP前或GMP级)的人CD34+HSPC·动物模型:免疫缺陷小鼠品系·持续时间:5-6个月的生命阶段遗传毒性研究·体外和体内模型的插入突变评估·测试项目:细胞剂量前和结束时对组织的影响关键的临床前POC/有效性和毒性/生物分布研究的生命阶段·动物模型:免疫缺陷小鼠品系(同上)·持续时间:5-6个月生命阶段Pharming的活动在生效日期未确定]
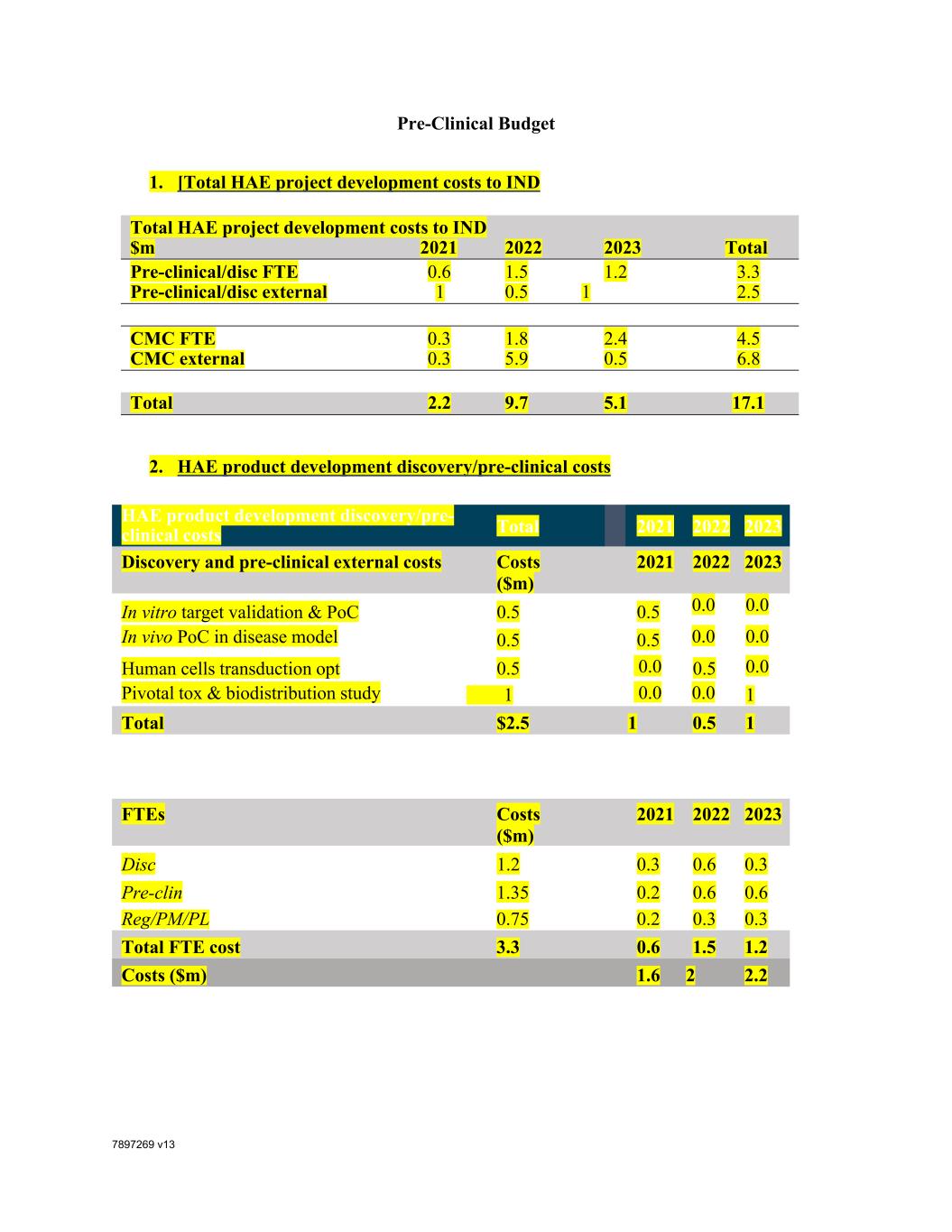
7897269 V13临床前预算1.[HAE项目开发总成本占IND的比例2021 2022 2023 HAE项目开发成本总计百万印尼盾2021 2022 2023临床前/盘前FTE 0.6 1.5 1.2 3.3临床前/盘前1 0.5 1 2.5 CMC FTE 0.3 1.8 2.4 4.5 CMC外部0.3 5.9 0.5 6.8总计2.2 9.7 5.1 17.1 2.HAE产品开发发现/临床前成本HAE产品开发发现/临床前成本总计2021 2022 2023-临床外部成本成本(百万美元)2021 2022 2023体外目标验证和PoC 0.5 0.5 0.0 0.0疾病模型中的体内PoC 0.5 0.5 0.0 0.0人类细胞转导OPT 0.5 0.0 0.5 0.0关键毒性和生物分布研究1 0.0 1总计2.5 1 0.5 1 FTE成本(百万美元)2021 2022 2023 Disc 1.2 0.3 0.6 0.3 preclin 1.35 0。2 0.6 0.6 REG/PM/PL 0.75 0.2 0.3 0.3 FTE总成本3.3 0.6 1.5 1.2成本(百万美元)1.6 2 2.2
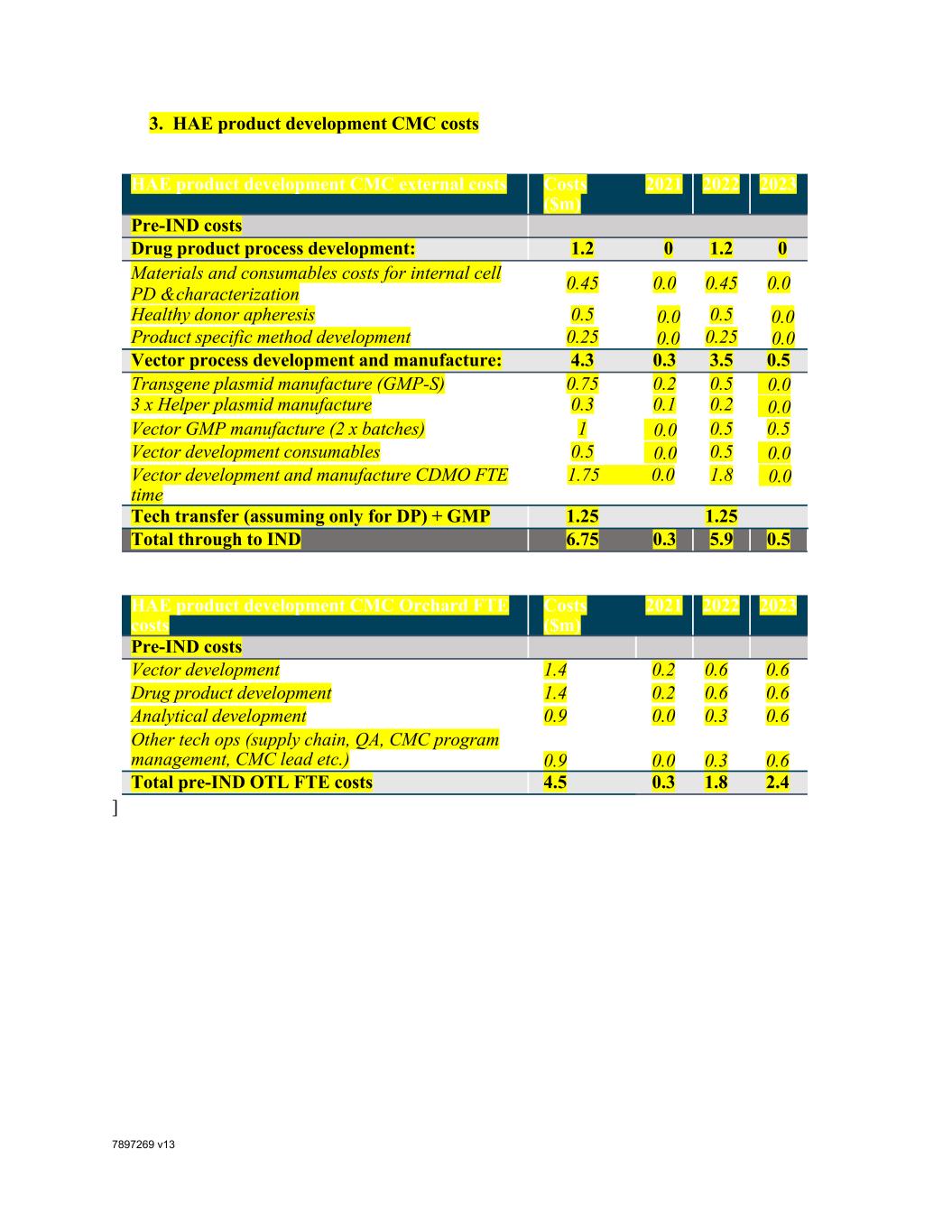
7897269 V13 3.HAE产品开发CMC成本HAE产品开发CMC外部成本(百万美元)2021 2022 2023前期IND成本药物产品过程开发:1.2 0 1.2 0内部细胞PD和鉴定的材料和消耗品成本0.45 0.0 0.45 0.0健康供体分离0.5 0.0 0.5 0.0产品特定方法开发0.25 0.0 0.25 0.0载体过程开发和制造:4.3 0.3 3.5 0.5转基因质粒制造(GMP-S)0.75 0.2 0.5 0.0 3 x辅助质粒制造0.3 0.1 0.2 0.0载体GMP制造(2个批次)1 0.0 0.5 0.5载体开发消耗品0.5 0.0 0.5 0.0载体开发和制造CDMO FTE时间1.75 0.0 1.8 0.0技术转让(仅针对DP)+GMP 1.25 1.25总计至IND 6.75 0.3 5。9 0.5 HAE产品开发CMC Orchard FTE成本(百万美元)2021 2022 2023前期Ind成本向量开发1.4 0.2 0.6 0.6药品开发1.4 0.2 0.6 0.6分析开发0.9 0.0 0.3 0.6其他技术运营(供应链,QA、CMC计划管理、CMC Lead等)0.9 0.0 0.3 0.6试运行前OTL FTE总成本4.5 0.3 1.8 2.4]
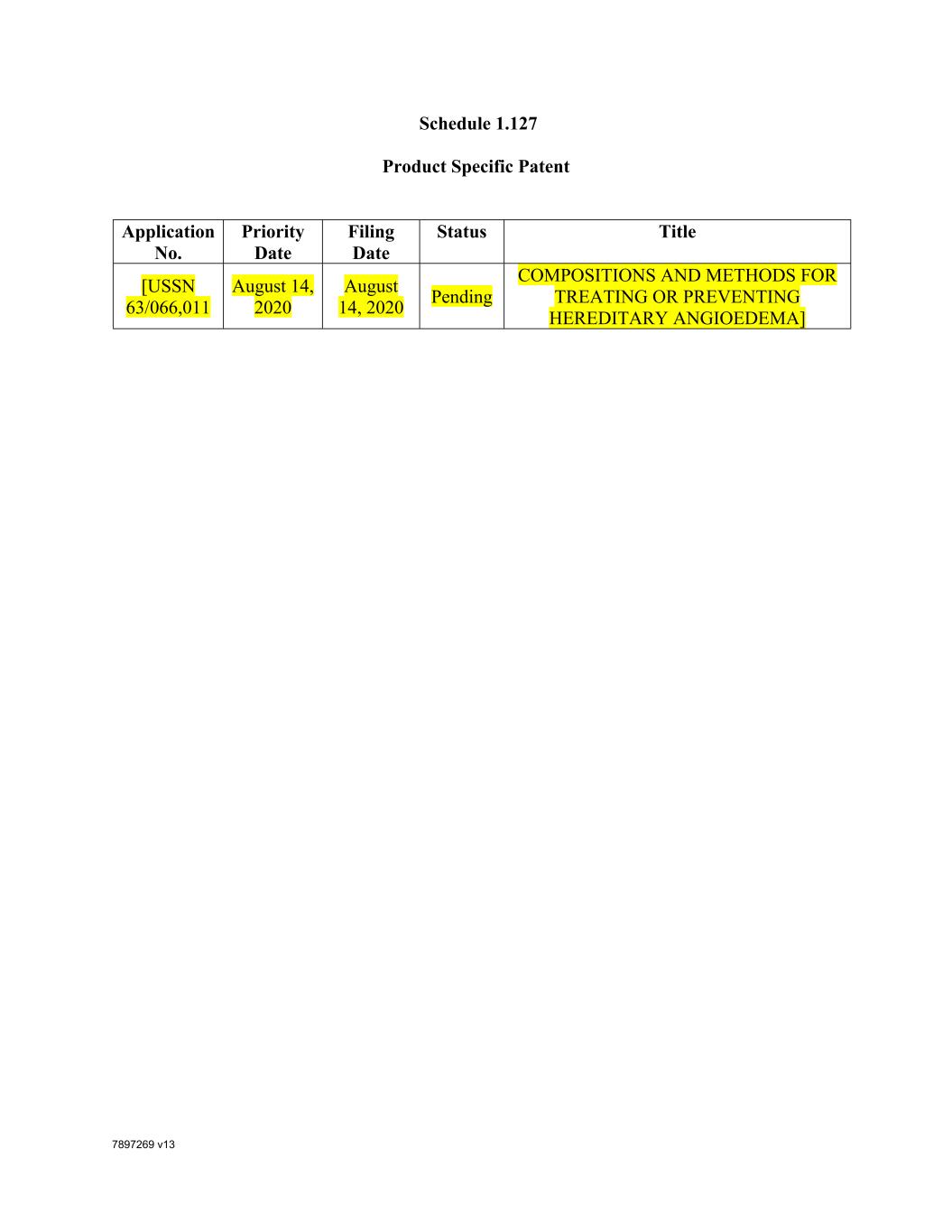
7897269 V13附表1.127产品特定专利申请号优先日期提交日期状态标题[USSN 63/066,011 2020年8月14日2020年8月14日待定的治疗或预防遗传性血管水肿的成分和方法]

7897269 V13附表1.84果园背景专利附表1.127所列的产品特定专利,以及要求该等产品特定专利或由该产品特定专利产生的优先权的所有专利。

附表12.4 Orchard Treeutics和Pharming Group宣布合作开发和商业化遗传性血管水肿的体外HSC基因疗法突出了Orchard的体外自体HSC基因治疗平台方法在新的和更大的适应症中的更广泛潜力加强了Pharming对HAE社区的承诺,并利用其相关的临床专业知识和全球商业化基础设施公司在上午8:00主持联合投资者电话会议。美国东部夏令时下午2:002021年7月1日,全球基因治疗领先者果园治疗公司(纳斯达克:ORTX)和全球商业阶段生物制药公司制药集团(泛欧交易所市场代码:PARM/纳斯达克:PHAR)今天宣布达成战略合作,研究、开发、制造和商业化OTL-105,这是一种新披露的试验性体外自体造血干细胞基因疗法,用于治疗遗传性血管水肿,这是一种危及生命的罕见疾病,会导致面部、喉咙、面部反复发作肿胀发作。四肢和腹部。OTL-105是一种研究中的HSC基因疗法,旨在增加HAE患者血清中的C1酯酶抑制物(C1-INH),以防止遗传性血管水肿发作。OTL-105将SERPING1基因的一个或多个功能拷贝插入患者自身的体外造血干细胞中,然后将其移植回患者体内,以产生潜在的持久的C1-INH。在临床前研究中,到目前为止,OTL-105通过慢病毒介导的转导在多个细胞系和原代人CD34+HSCs中显示出高水平的SERPING1基因表达。此外,该计划实现了通过临床验证的分析方法测量的功能性C1-INH蛋白的生产。根据合作条款, PURING已被授予OTL-105的全球权利,并将负责临床开发、监管申报和研究基因疗法的商业化,包括相关成本。Orchard将领导完成IND使能活动,并在临床前和临床开发期间监督OTL-105的制造,这将由Pharming提供资金。此外,两家公司还将探索与OTL-105给药一起使用的无毒调理疗法的应用。Orchard将获得1,750万美元的预付款,其中包括1,000万美元现金和Pharming的750万美元股权投资,溢价高于Orchard最近的股价。Orchard还有资格获得高达1.895亿美元的开发、监管和销售里程碑,以及未来全球销售的中位数至低两位数的特许权使用费。

Orchard Treeutics首席执行官鲍比·加斯帕说:“鉴于我们在HSC基因治疗方面的专业知识与Pharming的长期遗产和经验相结合,我们有潜力通过为这种危及生命的疾病患者提供一种单一管理的持续治疗来重新发明HAE的治疗模式。这一合作展示了HSC基因治疗平台的前景,以及它如何应用于患者人数更多的新治疗领域。我们相信,我们正在建设的HSC基因治疗管道可能继续成为未来生物学支持我们方法的领域合作伙伴关系的来源。““二十多年来,Pharming一直致力于HAE社区,”Pharming首席执行官、MBA西门·德·弗里斯医学博士说。我们已经与Orchard Treeutics合作,开发一种潜在的治疗HAE的方法。Orchard Treeutics是开发自体HSC基因疗法的领先者。根据Pharming在HAE中的经验,我们认为HSC基因治疗具有最高的成功几率。这种信心是基于Orchard的HSC基因治疗组合批准的治疗中观察到的效果和安全性的持久性,以及其他几个计划的阳性临床数据。这是为HAE开发一种可能具有变革性的一次性治疗方法的重要第一步。“在过去的15年里,HAE的治疗已经取得了很大的进步。然而,HAE仍然是一种严重的、使人衰弱的疾病,持续存在血管水肿症发作或慢性用药的负担“,加州大学美国遗传性血管水肿病协会中心医学和临床董事教授Marc Riedl博士说, 圣地亚哥。这项有希望的治疗工作有可能带来持久的长期临床益处,这是令人鼓舞的,也标志着对HAE社区的持续承诺。我期待着这些努力,以确定并谨慎地推进HAE的潜在治疗方法。“预计HAE市场在2021年将产生约20亿美元的销售额,目前每年增长8%。这对Pharming Group和Orchard Treeutics来说是一个重要的商业机会。网络直播链接:https://webcast.openbriefing.com/pharming-jul21/参与者拨入详情:英国0800 640 6441英国(当地)020 3936 2999美国(当地)1 646 664 1960荷兰085 888 7233所有其他地点+44 20 3936 2999访问代码:470719关于遗传性血管性水肿症是一种罕见的遗传性疾病。这种情况是由C1酯酶抑制蛋白缺乏引起的,C1酯酶抑制蛋白通常存在于血液中,有助于控制炎症(肿胀)和免疫系统的某些部分。缺乏C1抑制物不能充分发挥其调节功能,因此,可能会发生生化失衡,并产生不需要的多肽,诱导毛细血管向周围组织释放液体,从而导致肿胀或水肿。

HAE的特征是皮肤在身体不同部位以及在呼吸道和内脏自发和反复发作的肿胀(浮肿发作)。皮肤浮肿通常影响四肢、面部和生殖器。患有这种浮肿的患者往往会因为这些症状可能导致的毁容、不适和疼痛而退出他们的社交生活。几乎所有的HAE患者都会因肠壁肿胀而出现严重的腹痛、恶心、呕吐和腹泻。喉咙、鼻子或舌头的浮肿特别危险,可能危及生命,因为它会导致呼吸道阻塞。虽然目前还没有已知的治愈HAE的方法,但有可能治疗与血管水肿发作相关的症状。全球大约每10,000到50,000人中就有1人感染HAE。专家认为,许多患者仍在寻求正确的诊断:尽管(原则上)HAE很容易诊断,但它经常很晚才被发现,或者根本没有发现。HAE经常被误诊的原因是因为其症状类似于许多其他常见疾病,如过敏或阑尾炎。当它被正确诊断时,患者往往已经经历了漫长的磨难。Pharming Group N.V.是一家全球性的商业阶段生物制药公司,开发创新的蛋白质替代疗法和精准药物,用于治疗罕见疾病和未得到满足的医疗需求。我们投资组合的旗舰产品是我们的重组人C1酯酶抑制剂(RhC1INH)特许经营权。C1INH是一种自然产生的蛋白质,它下调补体和接触级联反应,以控制受影响组织的炎症。我们的主导产品RUCONEST®, 是第一种也是唯一一种无血浆的重组人C1INH蛋白替代疗法。它被批准用于治疗急性遗传性血管性水肿(HAE)发作。我们正在通过我们自己的销售和营销组织在美国、欧盟和英国将RUCONEST®商业化,并通过我们的分销网络在世界其他地区进行商业化。此外,我们正在研究重组人C1INH在治疗其他适应症方面的临床疗效,包括先兆子痫、急性肾损伤和新冠肺炎感染引起的严重肺炎。此外,我们正在利用我们的转基因制造技术来开发下一代蛋白质替代疗法,最引人注目的是治疗目前处于临床前开发中的庞培病。Orchard Treateutics是一家全球基因治疗领先企业,致力于通过开发具有潜在疗效的创新基因疗法来改变受严重疾病影响的人们的生活。我们的体外自体基因治疗方法利用了转基因血液干细胞的力量,并寻求在一次给药中纠正疾病的根本原因。2018年,Orchard收购了GSK的罕见病基因治疗组合,该组合源于GSK与意大利米兰的San Raffaele Telethon基因治疗研究所之间的开创性合作。Orchard现在拥有业内最深入和最先进的候选基因治疗产品管道之一,横跨多个治疗领域,在这些领域,儿童、家庭和照顾者的疾病负担巨大,目前的治疗选择有限或不存在。

Orchard的全球总部设在伦敦,美国总部设在波士顿。欲了解更多信息,请访问www.orchard-tx.com,并在Twitter和LinkedIn上关注我们。有关Orchard Treeutics投资者和其他人的其他信息的可用性应注意,Orchard通过公司网站(www.orchard-tx.com)、投资者关系网站(ir.orchard-tx.com)和社交媒体(Twitter和LinkedIn)与其投资者和公众进行沟通,包括但不限于投资者陈述和投资者情况说明书、美国证券交易委员会(SEC)文件、新闻稿、公开电话会议和网络广播。Orchard在这些渠道和网站上发布的信息可以被视为实质性信息。因此,Orchard鼓励投资者、媒体和其他对Orchard感兴趣的人定期查看这些渠道上发布的信息,包括投资者关系网站。这份渠道列表可能会在Orchard的投资者关系网站上不时更新,并可能包括其他社交媒体渠道。Orchard的网站或这些频道的内容,或可从其网站或这些频道访问的任何其他网站的内容,不应被视为通过引用纳入根据1933年证券法提交的任何文件。Orchard Treateutics公司的前瞻性陈述本新闻稿包含有关Orchard公司的战略、未来计划和前景的某些前瞻性陈述,这些陈述是根据“1995年私人证券诉讼改革法”的安全港条款作出的。前瞻性陈述包括与Orchard的业务战略和目标、Orchard的候选产品的治疗潜力有关的明示或暗示的陈述,包括本新闻稿中提到的候选产品, 以及未来里程碑或特许权使用费支付的可能性。这些陈述既不是承诺,也不是保证,会受到各种风险和不确定性的影响,其中许多风险和不确定性是Orchard无法控制的,这可能会导致实际结果与这些前瞻性陈述中预期的大不相同。特别是,这些风险和不确定性包括但不限于:从临床前研究或临床试验中观察到的先前结果,如安全性、活性或效果持久性的信号,将不会在正在进行的或未来涉及Orchard候选产品的研究或试验中复制或继续,将不足以支持美国或欧盟(视情况而定)的监管提交或上市批准,或者可能发现长期不利的安全发现;Orchard的任何一个或多个候选产品,包括本新闻稿中提到的候选产品,将不会获得批准、成功开发或商业化的风险;Orchard正在进行的或计划中的任何临床试验停止或延迟的风险;Orchard可能无法成功招募或招募足够数量的患者进行临床试验的风险;Orchard的任何监管提交的延迟;未能获得适用监管机构对Orchard的任何候选产品的上市批准或收到受限的上市批准;Orchard无法或面临延迟将其候选产品或LibMeldy在欧盟商业化的能力;LibMeldy或Orchard的任何候选产品的市场机会, 这些风险包括:风险可能低于预期;某些里程碑可能永远无法实现或特许权使用费可能永远无法赚取和支付的风险;新冠肺炎疫情对果园业务(包括临床开发、供应链和商业计划)影响的严重性。鉴于这些不确定性,建议读者不要过度依赖此类前瞻性陈述。

Orchard面临的其他风险和不确定因素包括Orchard在提交给美国证券交易委员会(美国证券交易委员会)的截至2021年3月31日的10-Q季度报告中在“风险因素”标题下确定的风险因素,以及随后提交给美国证券交易委员会的文件和报告。本新闻稿中包含的前瞻性陈述反映了Orchard截至本文发布之日的观点,Orchard不承担也特别不承担任何因新信息、未来事件或其他原因而公开更新或修改任何前瞻性陈述的义务,除非法律要求。本新闻稿包含前瞻性陈述,包括有关制药公司对其候选产品的临床前研究和临床试验的时间和进展、制药公司的临床和商业前景、制药公司克服新冠肺炎大流行对其业务行为构成的挑战的能力,以及制药公司对其预计的营运资金需求和现金资源的预期。这些陈述受许多风险、不确定性和假设的影响,包括但不限于,Pharming临床试验的进展和扩展及其成本的影响;以及临床、科学、监管和技术发展。鉴于这些风险和不确定性,以及在Pharming 2020年年度报告和提交给美国证券交易委员会的截至2020年12月31日的Form 20-F年度报告中描述的其他风险和不确定因素,此类前瞻性声明中讨论的事件和情况可能不会发生, 而Pharming的实际结果可能与预期或暗示的结果大不相同。任何前瞻性陈述仅在本新闻稿发布之日发表,并以截至本新闻稿发布之日Pharming可获得的信息为基础。内幕信息本新闻稿涉及符合或可能符合《欧盟市场滥用条例》第7(1)条含义的内幕信息的披露。Orchard Treeutics公司投资者关系部雷内·莱克·董事电话:+1 862-242-0764电子邮件:Renee.Leck@orchard-tx.com媒体本杰明·纳文·董事

Pharing Group N.V.联系人公司荷兰莱顿Pharming Group,首席执行官Susanne Embleton投资者关系经理Susanne Embleton Investor Relationship Manager+31 71 524 7400 Investor@pharming.com Media FTI Consulting,UK London,Victoria Foster Mitchell/Alex Shaw+44 203 727 1000 LifeSpring Life Science Communications,荷兰阿姆斯特丹Leon Melens电话:+31 6 53 81 64 27 Phing@Life espring.nl
