pharm-2021123100018283162021财年假象P1Y00018283162021-01-012021-12-310001828316Dei:商业联系人成员2021-01-012021-12-310001828316医药:美国存托凭证成员2021-01-012021-12-310001828316IFRS-FULL:普通共享成员2021-01-012021-12-3100018283162021-12-31Xbrli:共享ISO 4217:美元00018283162020-01-012020-12-3100018283162019-01-012019-12-31ISO 4217:美元Xbrli:共享00018283162020-12-3100018283162019-12-31ISO4217:欧元00018283162018-12-310001828316IFRS-Full:IssuedCapitalMembers2018-12-310001828316IFRS-Full:SharePremiumMembers2018-12-310001828316IFRS-FULL:重新评估盈余成员2018-12-310001828316IFRS-Full:SharePremiumMembers2019-01-012019-12-310001828316IFRS-Full:IssuedCapitalMembers2019-01-012019-12-310001828316IFRS-Full:IssuedCapitalMembers2019-12-310001828316IFRS-Full:SharePremiumMembers2019-12-310001828316IFRS-FULL:重新评估盈余成员2019-12-310001828316IFRS-Full:IssuedCapitalMembers2020-01-012020-12-310001828316IFRS-Full:SharePremiumMembers2020-01-012020-12-310001828316IFRS-Full:IssuedCapitalMembers2020-12-310001828316IFRS-Full:SharePremiumMembers2020-12-310001828316IFRS-FULL:重新评估盈余成员2020-12-310001828316IFRS-FULL:重新评估盈余成员2019-01-012019-12-310001828316IFRS-Full:IssuedCapitalMembers2021-01-012021-12-310001828316IFRS-Full:SharePremiumMembers2021-01-012021-12-310001828316IFRS-FULL:重新评估盈余成员2021-01-012021-12-310001828316IFRS-Full:IssuedCapitalMembers2021-12-310001828316IFRS-Full:SharePremiumMembers2021-12-310001828316IFRS-FULL:重新评估盈余成员2021-12-310001828316医药:参与利益保留成员2018-12-310001828316Pharm:ReserveOfCapitalizedDevelopmentCostsMember2018-12-310001828316Ifrs-full:ReserveOfExchangeDifferencesOnTranslationMember2018-12-310001828316IFRS-Full:RetainedEarningsMembers2018-12-310001828316IFRS-Full:RetainedEarningsMembers2019-01-012019-12-310001828316Ifrs-full:ReserveOfExchangeDifferencesOnTranslationMember2019-01-012019-12-310001828316Pharm:ReserveOfCapitalizedDevelopmentCostsMember2019-01-012019-12-310001828316医药:参与利益保留成员2019-12-310001828316Pharm:ReserveOfCapitalizedDevelopmentCostsMember2019-12-310001828316Ifrs-full:ReserveOfExchangeDifferencesOnTranslationMember2019-12-310001828316IFRS-Full:RetainedEarningsMembers2019-12-310001828316IFRS-Full:RetainedEarningsMembers2020-01-012020-12-310001828316Ifrs-full:ReserveOfExchangeDifferencesOnTranslationMember2020-01-012020-12-310001828316医药:参与利益保留成员2020-01-012020-12-310001828316Pharm:ReserveOfCapitalizedDevelopmentCostsMember2020-01-012020-12-310001828316医药:参与利益保留成员2020-12-310001828316Pharm:ReserveOfCapitalizedDevelopmentCostsMember2020-12-310001828316Ifrs-full:ReserveOfExchangeDifferencesOnTranslationMember2020-12-310001828316IFRS-Full:RetainedEarningsMembers2020-12-310001828316IFRS-Full:RetainedEarningsMembers2021-01-012021-12-310001828316Pharm:ReserveOfCapitalizedDevelopmentCostsMember2021-01-012021-12-310001828316Ifrs-full:ReserveOfExchangeDifferencesOnTranslationMember2021-01-012021-12-310001828316医药:参与利益保留成员2021-01-012021-12-310001828316医药:参与利益保留成员2021-12-310001828316Pharm:ReserveOfCapitalizedDevelopmentCostsMember2021-12-310001828316Ifrs-full:ReserveOfExchangeDifferencesOnTranslationMember2021-12-310001828316IFRS-Full:RetainedEarningsMembers2021-12-3100018283162022-03-31医药:股票0001828316药品:专利和许可证成员IFRS-FULL:底部范围成员2021-01-012021-12-310001828316药品:专利和许可证成员IFRS-Full:TopOfRangeMember2021-01-012021-12-310001828316Pharm:CapitalisedDevelopmentExpenditureRUCONESTForHAEEUMember2021-01-012021-12-310001828316Pharm:ReAcquiredCommercialRightsRUCONESTForHAEUSMember2021-01-012021-12-310001828316Pharm:ReAcquiredCommercialRightsRUCONESTForHAEEUMember2021-01-012021-12-310001828316IFRS-FULL:底部范围成员Pharm:CapitalisedDevelopmentExpenditureSoftwareExpensesMember2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMemberPharm:CapitalisedDevelopmentExpenditureSoftwareExpensesMember2021-01-012021-12-310001828316药品:专利和许可证成员2021-12-310001828316医药:地标改善会员2021-01-012021-12-310001828316医药:运营设施成员IFRS-FULL:底部范围成员2021-01-012021-12-310001828316医药:运营设施成员IFRS-Full:TopOfRangeMember2021-01-012021-12-310001828316IFRS-FULL:底部范围成员IFRS-Full:租赁改进成员2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMemberIFRS-Full:租赁改进成员2021-01-012021-12-310001828316IFRS-FULL:底部范围成员IFRS-Full:机器成员2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMemberIFRS-Full:机器成员2021-01-012021-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIFRS-FULL:底部范围成员2021-01-012021-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIFRS-Full:TopOfRangeMember2021-01-012021-12-310001828316IFRS-FULL:养老金定义福利计划成员2021-01-012021-12-310001828316医药:FirstRangeMembersIFRS-FULL:养老金定义福利计划成员2021-01-012021-12-31Xbrli:纯0001828316医药:Second RangeMemberIFRS-FULL:养老金定义福利计划成员2021-01-012021-12-310001828316IFRS-FULL:底部范围成员医药:Second RangeMemberIFRS-FULL:养老金定义福利计划成员2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMember医药:Second RangeMemberIFRS-FULL:养老金定义福利计划成员2021-01-012021-12-310001828316药房:第三名成员IFRS-FULL:养老金定义福利计划成员2021-01-012021-12-310001828316医药:NewLongTerm奖励计划成员医药:执行董事成员2021-01-012021-12-310001828316制药:OrchardTreeuticsMembers2021-07-010001828316制药:OrchardTreeuticsMembers2021-07-012021-07-010001828316国家:美国2021-01-012021-12-310001828316国家:美国2020-01-012020-12-310001828316国家:美国2019-01-012019-12-310001828316SRT:欧洲成员2021-01-012021-12-310001828316SRT:欧洲成员2020-01-012020-12-310001828316SRT:欧洲成员2019-01-012019-12-310001828316Pharm:RestOfTheWorldExcludingUSAndEuropeMember2021-01-012021-12-310001828316Pharm:RestOfTheWorldExcludingUSAndEuropeMember2020-01-012020-12-310001828316Pharm:RestOfTheWorldExcludingUSAndEuropeMember2019-01-012019-12-310001828316医药:RUCONEST成员国家:美国2021-01-012021-12-310001828316医药:RUCONEST成员国家:美国2020-01-012020-12-310001828316医药:客户集中度风险成员医药:收益基准成员2021-01-012021-12-310001828316医药:客户集中度风险成员医药:收益基准成员2020-01-012020-12-310001828316医药:客户集中度风险成员医药:收益基准成员2019-01-012019-12-310001828316医药:OTL105成员2021-01-012021-12-310001828316IFRS-Full:PropertyPlantAndEquipmentMember2021-01-012021-12-310001828316IFRS-Full:PropertyPlantAndEquipmentMember2020-01-012020-12-310001828316IFRS-Full:PropertyPlantAndEquipmentMember2019-01-012019-12-310001828316Ifrs-full:IntangibleAssetsOtherThanGoodwillMember2021-01-012021-12-310001828316Ifrs-full:IntangibleAssetsOtherThanGoodwillMember2020-01-012020-12-310001828316Ifrs-full:IntangibleAssetsOtherThanGoodwillMember2019-01-012019-12-310001828316IFRS-Full:ContingentConsiderationMembers2021-01-012021-12-310001828316IFRS-Full:ContingentConsiderationMembers2020-01-012020-12-310001828316IFRS-Full:ContingentConsiderationMembers2019-01-012019-12-310001828316Pharm:IntangibleAssetsOtherThanGoodwillRelatedToTemporaryDifferencesMember2021-12-310001828316Pharm:IntangibleAssetsOtherThanGoodwillRelatedToTemporaryDifferencesMember2020-12-310001828316Pharm:AccruedExpensesRelatedToTemporaryDifferencesMember2021-12-310001828316Pharm:AccruedExpensesRelatedToTemporaryDifferencesMember2020-12-310001828316Pharm:OtherAssetsRelatedToTemporaryDifferencesMember2021-12-310001828316Pharm:OtherAssetsRelatedToTemporaryDifferencesMember2020-12-310001828316IFRS-FULL:未使用的税收损失成员2021-12-310001828316IFRS-FULL:未使用的税收损失成员2020-12-310001828316Pharm:IntangibleAssetsOtherThanGoodwillRelatedToTemporaryDifferencesMember2019-12-310001828316Pharm:OtherFinancialAssetsLiabilitiesRelatedToTemporaryDifferencesMember2019-12-310001828316Pharm:AccruedExpensesRelatedToTemporaryDifferencesMember2019-12-310001828316Pharm:OtherAssetsRelatedToTemporaryDifferencesMember2019-12-310001828316IFRS-FULL:未使用的税收损失成员2019-12-310001828316Pharm:IntangibleAssetsOtherThanGoodwillRelatedToTemporaryDifferencesMember2020-01-012020-12-310001828316Pharm:OtherFinancialAssetsLiabilitiesRelatedToTemporaryDifferencesMember2020-01-012020-12-310001828316Pharm:AccruedExpensesRelatedToTemporaryDifferencesMember2020-01-012020-12-310001828316Pharm:OtherAssetsRelatedToTemporaryDifferencesMember2020-01-012020-12-310001828316IFRS-FULL:未使用的税收损失成员2020-01-012020-12-310001828316医药:TotalDeferredTaxAssetsMember2020-01-012020-12-310001828316Pharm:OtherFinancialAssetsLiabilitiesRelatedToTemporaryDifferencesMember2020-12-310001828316Pharm:IntangibleAssetsOtherThanGoodwillRelatedToTemporaryDifferencesMember2021-01-012021-12-310001828316Pharm:OtherFinancialAssetsLiabilitiesRelatedToTemporaryDifferencesMember2021-01-012021-12-310001828316Pharm:AccruedExpensesRelatedToTemporaryDifferencesMember2021-01-012021-12-310001828316Pharm:OtherAssetsRelatedToTemporaryDifferencesMember2021-01-012021-12-310001828316IFRS-FULL:未使用的税收损失成员2021-01-012021-12-310001828316医药:TotalDeferredTaxAssetsMember2021-01-012021-12-310001828316Pharm:OtherFinancialAssetsLiabilitiesRelatedToTemporaryDifferencesMember2021-12-310001828316国家:内华达州2021-01-012021-12-310001828316国家:内华达州2020-01-012020-12-310001828316制药公司:A2020成员国家:内华达州2021-01-012021-12-310001828316制药公司:A2020成员国家:内华达州2020-01-012020-12-310001828316制药:A2021和AfterMembers国家:内华达州2021-01-012021-12-310001828316制药:A2021和AfterMembers国家:内华达州2020-01-012020-12-310001828316国家:法国2021-01-012021-12-310001828316国家:法国2020-01-012020-12-310001828316IFRS-FULL:未使用的税收损失成员国家:内华达州2021-12-310001828316IFRS-FULL:未使用的税收损失成员国家:内华达州2020-12-310001828316国家:法国IFRS-FULL:未使用的税收损失成员2021-12-310001828316国家:法国IFRS-FULL:未使用的税收损失成员2020-12-310001828316Pharm:PropertyPlantAndEquipmentRelatedTemporaryDifferencesMember2021-12-310001828316Pharm:PropertyPlantAndEquipmentRelatedTemporaryDifferencesMember2020-12-310001828316Pharm:OtherLiabilitiesRelatedTemporaryDifferencesMember2021-12-310001828316Pharm:OtherLiabilitiesRelatedTemporaryDifferencesMember2020-12-310001828316Pharm:PropertyPlantAndEquipmentRelatedTemporaryDifferencesMember2019-12-310001828316Pharm:OtherLiabilitiesRelatedTemporaryDifferencesMember2019-12-310001828316Pharm:PropertyPlantAndEquipmentRelatedTemporaryDifferencesMember2020-01-012020-12-310001828316Pharm:OtherLiabilitiesRelatedTemporaryDifferencesMember2020-01-012020-12-310001828316医药:总延期纳税责任成员2020-01-012020-12-310001828316Pharm:PropertyPlantAndEquipmentRelatedTemporaryDifferencesMember2021-01-012021-12-310001828316Pharm:OtherLiabilitiesRelatedTemporaryDifferencesMember2021-01-012021-12-310001828316医药:总延期纳税责任成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:转基因技术成员2019-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:RUCONESTFOR HAEEUMembers2019-12-310001828316IFRS-Full:Gross CarryingAmount MemberIfrs-full:CapitalisedDevelopmentExpenditureMember2019-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-Full:Gross CarryingAmount Member2019-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:许可证成员2019-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:计算机软件成员2019-12-310001828316IFRS-Full:Gross CarryingAmount Member2019-12-310001828316医药:转基因技术成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember医药:RUCONESTFOR HAEEUMembers2019-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316药品:ReAcquiredRightsAnd许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316IFRS-Full:许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316IFRS-FULL:计算机软件成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316医药:转基因技术成员IFRS-FULL:累积影响成员2019-12-310001828316IFRS-FULL:累积影响成员医药:RUCONESTFOR HAEEUMembers2019-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIFRS-FULL:累积影响成员2019-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-FULL:累积影响成员2019-12-310001828316IFRS-Full:许可证成员IFRS-FULL:累积影响成员2019-12-310001828316IFRS-FULL:计算机软件成员IFRS-FULL:累积影响成员2019-12-310001828316IFRS-FULL:累积影响成员2019-12-310001828316医药:转基因技术成员2019-12-310001828316医药:RUCONESTFOR HAEEUMembers2019-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMember2019-12-310001828316药品:ReAcquiredRightsAnd许可证成员2019-12-310001828316IFRS-Full:许可证成员2019-12-310001828316IFRS-FULL:计算机软件成员2019-12-310001828316医药:转基因技术成员2020-01-012020-12-310001828316医药:RUCONESTFOR HAEEUMembers2020-01-012020-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMember2020-01-012020-12-310001828316药品:ReAcquiredRightsAnd许可证成员2020-01-012020-12-310001828316IFRS-Full:许可证成员2020-01-012020-12-310001828316IFRS-FULL:计算机软件成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:转基因技术成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:RUCONESTFOR HAEEUMembers2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIfrs-full:CapitalisedDevelopmentExpenditureMember2020-01-012020-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-Full:Gross CarryingAmount Member2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:许可证成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:计算机软件成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member2020-01-012020-12-310001828316医药:转基因技术成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember医药:RUCONESTFOR HAEEUMembers2020-01-012020-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316药品:ReAcquiredRightsAnd许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316IFRS-Full:许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316IFRS-FULL:计算机软件成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316医药:转基因技术成员IFRS-FULL:累积影响成员2020-01-012020-12-310001828316IFRS-FULL:累积影响成员医药:RUCONESTFOR HAEEUMembers2020-01-012020-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIFRS-FULL:累积影响成员2020-01-012020-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-FULL:累积影响成员2020-01-012020-12-310001828316IFRS-Full:许可证成员IFRS-FULL:累积影响成员2020-01-012020-12-310001828316IFRS-FULL:计算机软件成员IFRS-FULL:累积影响成员2020-01-012020-12-310001828316IFRS-FULL:累积影响成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:转基因技术成员2020-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:RUCONESTFOR HAEEUMembers2020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIfrs-full:CapitalisedDevelopmentExpenditureMember2020-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-Full:Gross CarryingAmount Member2020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:许可证成员2020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:计算机软件成员2020-12-310001828316IFRS-Full:Gross CarryingAmount Member2020-12-310001828316医药:转基因技术成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember医药:RUCONESTFOR HAEEUMembers2020-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316药品:ReAcquiredRightsAnd许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316IFRS-Full:许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316IFRS-FULL:计算机软件成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316医药:转基因技术成员IFRS-FULL:累积影响成员2020-12-310001828316IFRS-FULL:累积影响成员医药:RUCONESTFOR HAEEUMembers2020-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIFRS-FULL:累积影响成员2020-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-FULL:累积影响成员2020-12-310001828316IFRS-Full:许可证成员IFRS-FULL:累积影响成员2020-12-310001828316IFRS-FULL:计算机软件成员IFRS-FULL:累积影响成员2020-12-310001828316IFRS-FULL:累积影响成员2020-12-310001828316医药:转基因技术成员2020-12-310001828316医药:RUCONESTFOR HAEEUMembers2020-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMember2020-12-310001828316药品:ReAcquiredRightsAnd许可证成员2020-12-310001828316IFRS-Full:许可证成员2020-12-310001828316IFRS-FULL:计算机软件成员2020-12-310001828316医药:转基因技术成员2021-01-012021-12-310001828316医药:RUCONESTFOR HAEEUMembers2021-01-012021-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMember2021-01-012021-12-310001828316药品:ReAcquiredRightsAnd许可证成员2021-01-012021-12-310001828316IFRS-Full:许可证成员2021-01-012021-12-310001828316IFRS-FULL:计算机软件成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:转基因技术成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:RUCONESTFOR HAEEUMembers2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIfrs-full:CapitalisedDevelopmentExpenditureMember2021-01-012021-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-Full:Gross CarryingAmount Member2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:许可证成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:计算机软件成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member2021-01-012021-12-310001828316医药:转基因技术成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember医药:RUCONESTFOR HAEEUMembers2021-01-012021-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316药品:ReAcquiredRightsAnd许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316IFRS-Full:许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316IFRS-FULL:计算机软件成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316医药:转基因技术成员IFRS-FULL:累积影响成员2021-01-012021-12-310001828316IFRS-FULL:累积影响成员医药:RUCONESTFOR HAEEUMembers2021-01-012021-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIFRS-FULL:累积影响成员2021-01-012021-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-FULL:累积影响成员2021-01-012021-12-310001828316IFRS-Full:许可证成员IFRS-FULL:累积影响成员2021-01-012021-12-310001828316IFRS-FULL:计算机软件成员IFRS-FULL:累积影响成员2021-01-012021-12-310001828316IFRS-FULL:累积影响成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:转基因技术成员2021-12-310001828316IFRS-Full:Gross CarryingAmount Member医药:RUCONESTFOR HAEEUMembers2021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIfrs-full:CapitalisedDevelopmentExpenditureMember2021-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-Full:Gross CarryingAmount Member2021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:许可证成员2021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:计算机软件成员2021-12-310001828316IFRS-Full:Gross CarryingAmount Member2021-12-310001828316医药:转基因技术成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember医药:RUCONESTFOR HAEEUMembers2021-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316药品:ReAcquiredRightsAnd许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316IFRS-Full:许可证成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316IFRS-FULL:计算机软件成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316医药:转基因技术成员IFRS-FULL:累积影响成员2021-12-310001828316IFRS-FULL:累积影响成员医药:RUCONESTFOR HAEEUMembers2021-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberIFRS-FULL:累积影响成员2021-12-310001828316药品:ReAcquiredRightsAnd许可证成员IFRS-FULL:累积影响成员2021-12-310001828316IFRS-Full:许可证成员IFRS-FULL:累积影响成员2021-12-310001828316IFRS-FULL:计算机软件成员IFRS-FULL:累积影响成员2021-12-310001828316IFRS-FULL:累积影响成员2021-12-310001828316医药:转基因技术成员2021-12-310001828316医药:RUCONESTFOR HAEEUMembers2021-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMember2021-12-310001828316药品:ReAcquiredRightsAnd许可证成员2021-12-310001828316IFRS-Full:许可证成员2021-12-310001828316IFRS-FULL:计算机软件成员2021-12-310001828316医药:TransgenicRabbitModelsSASUMemberIfrs-full:CapitalisedDevelopmentExpenditureMember2014-01-012014-12-3100018283162014-12-31药品:产品_铅0001828316Ifrs-full:CapitalisedDevelopmentExpenditureMemberPharm:AlphaGalactosidaseForFabrysDiseaseAssetMember2014-01-012014-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMember医药:RUCONEST成员2019-01-012019-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMember医药:RUCONEST成员2020-01-012020-12-310001828316Ifrs-full:CapitalisedDevelopmentExpenditureMember医药:RUCONEST成员2021-01-012021-12-310001828316IFRS-Full:许可证成员制药:诺华成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member药房:LandandLandImprovations成员2019-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2019-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:租赁改进成员2019-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:机器成员2019-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIFRS-Full:Gross CarryingAmount Member2019-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:施工进度成员2019-12-310001828316药房:LandandLandImprovations成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2019-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:租赁改进成员2019-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:机器成员2019-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316IFRS-FULL:施工进度成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316药房:LandandLandImprovations成员2019-12-310001828316国际财务报告准则-完整:建筑业成员2019-12-310001828316IFRS-Full:租赁改进成员2019-12-310001828316IFRS-Full:机器成员2019-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMember2019-12-310001828316IFRS-FULL:施工进度成员2019-12-310001828316药房:LandandLandImprovations成员2020-01-012020-12-310001828316国际财务报告准则-完整:建筑业成员2020-01-012020-12-310001828316IFRS-Full:租赁改进成员2020-01-012020-12-310001828316IFRS-Full:机器成员2020-01-012020-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMember2020-01-012020-12-310001828316IFRS-FULL:施工进度成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member药房:LandandLandImprovations成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:租赁改进成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:机器成员2020-01-012020-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIFRS-Full:Gross CarryingAmount Member2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:施工进度成员2020-01-012020-12-310001828316药房:LandandLandImprovations成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2020-01-012020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:租赁改进成员2020-01-012020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:机器成员2020-01-012020-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316IFRS-FULL:施工进度成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member药房:LandandLandImprovations成员2020-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:租赁改进成员2020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:机器成员2020-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIFRS-Full:Gross CarryingAmount Member2020-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:施工进度成员2020-12-310001828316药房:LandandLandImprovations成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:租赁改进成员2020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:机器成员2020-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316IFRS-FULL:施工进度成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316药房:LandandLandImprovations成员2020-12-310001828316国际财务报告准则-完整:建筑业成员2020-12-310001828316IFRS-Full:租赁改进成员2020-12-310001828316IFRS-Full:机器成员2020-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMember2020-12-310001828316IFRS-FULL:施工进度成员2020-12-310001828316药房:LandandLandImprovations成员2021-01-012021-12-310001828316国际财务报告准则-完整:建筑业成员2021-01-012021-12-310001828316IFRS-Full:租赁改进成员2021-01-012021-12-310001828316IFRS-Full:机器成员2021-01-012021-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMember2021-01-012021-12-310001828316IFRS-FULL:施工进度成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member药房:LandandLandImprovations成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:租赁改进成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:机器成员2021-01-012021-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIFRS-Full:Gross CarryingAmount Member2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:施工进度成员2021-01-012021-12-310001828316药房:LandandLandImprovations成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2021-01-012021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:租赁改进成员2021-01-012021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:机器成员2021-01-012021-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316IFRS-FULL:施工进度成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member药房:LandandLandImprovations成员2021-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:租赁改进成员2021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-Full:机器成员2021-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIFRS-Full:Gross CarryingAmount Member2021-12-310001828316IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:施工进度成员2021-12-310001828316药房:LandandLandImprovations成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:租赁改进成员2021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMemberIFRS-Full:机器成员2021-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMemberIfrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316IFRS-FULL:施工进度成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316药房:LandandLandImprovations成员2021-12-310001828316国际财务报告准则-完整:建筑业成员2021-12-310001828316IFRS-Full:租赁改进成员2021-12-310001828316IFRS-Full:机器成员2021-12-310001828316Ifrs-full:OtherPropertyPlantAndEquipmentMember2021-12-310001828316IFRS-FULL:施工进度成员2021-12-310001828316医药:建设正在进行投资成员2021-01-012021-12-310001828316医药:库存成员IFRS-Full:机器成员2021-01-012021-12-310001828316医药:库存成员IFRS-Full:机器成员2020-01-012020-12-310001828316Pharm:OtherPropertyPlantAndEquipmentTransferredMember2021-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2019-12-310001828316IFRS-FULL:机动车辆成员IFRS-Full:Gross CarryingAmount Member2019-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2019-12-310001828316IFRS-FULL:机动车辆成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2019-12-310001828316国际财务报告准则-完整:建筑业成员2019-12-310001828316IFRS-FULL:机动车辆成员2019-12-310001828316国际财务报告准则-完整:建筑业成员2020-01-012020-12-310001828316IFRS-FULL:机动车辆成员2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2020-01-012020-12-310001828316IFRS-FULL:机动车辆成员IFRS-Full:Gross CarryingAmount Member2020-01-012020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2020-01-012020-12-310001828316IFRS-FULL:机动车辆成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-01-012020-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2020-12-310001828316IFRS-FULL:机动车辆成员IFRS-Full:Gross CarryingAmount Member2020-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2020-12-310001828316IFRS-FULL:机动车辆成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2020-12-310001828316国际财务报告准则-完整:建筑业成员2020-12-310001828316IFRS-FULL:机动车辆成员2020-12-310001828316国际财务报告准则-完整:建筑业成员2021-01-012021-12-310001828316IFRS-FULL:机动车辆成员2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2021-01-012021-12-310001828316IFRS-FULL:机动车辆成员IFRS-Full:Gross CarryingAmount Member2021-01-012021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2021-01-012021-12-310001828316IFRS-FULL:机动车辆成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-01-012021-12-310001828316IFRS-Full:Gross CarryingAmount Member国际财务报告准则-完整:建筑业成员2021-12-310001828316IFRS-FULL:机动车辆成员IFRS-Full:Gross CarryingAmount Member2021-12-310001828316Ifrs-full:AccumulatedDepreciationAndAmortisationMember国际财务报告准则-完整:建筑业成员2021-12-310001828316IFRS-FULL:机动车辆成员Ifrs-full:AccumulatedDepreciationAndAmortisationMember2021-12-310001828316国际财务报告准则-完整:建筑业成员2021-12-310001828316IFRS-FULL:机动车辆成员2021-12-310001828316IFRS-FULL:底部范围成员2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMember2021-01-012021-12-310001828316医药:BioConnectionBVMembers2019-04-072019-04-070001828316医药:BioConnectionBVMembers2019-04-070001828316医药:BioConnectionBVMembers2021-01-012021-12-310001828316医药:BioConnectionBVMembers2020-01-012020-12-310001828316医药:BioConnectionBVMembers2019-01-012019-12-310001828316医药:BioConnectionBVMembers2020-12-310001828316医药:BioConnectionBVMembers2019-12-310001828316医药:BioConnectionBVMembers2018-12-310001828316医药:BioConnectionBVMembers2021-12-310001828316制药:OrchardTreeuticsMembers2021-07-012021-12-310001828316制药:OrchardTreeuticsMembers2021-07-010001828316制药:OrchardTreeuticsMembers2021-07-012021-07-010001828316制药:OrchardTreeuticsMembers2021-12-310001828316制药:OrchardTreeuticsMembers2021-01-012021-12-310001828316制药:OrchardTreeuticsMembers2020-01-012020-12-310001828316制药:OrchardTreeuticsMembers2019-01-012019-12-310001828316制药:OrchardTreeuticsMembers2020-12-310001828316制药:OrchardTreeuticsMembers2019-12-310001828316制药:OrchardTreeuticsMembers2018-12-310001828316医药:调整NetRealisableValueMember2020-12-310001828316医药:调整NetRealisableValueMember2019-12-310001828316医药:调整NetRealisableValueMember2021-01-012021-12-310001828316医药:调整NetRealisableValueMember2020-01-012020-12-310001828316医药:调整NetRealisableValueMember2021-12-310001828316医药:成本库存成员2021-01-012021-12-310001828316医药:成本库存成员2020-01-012020-12-310001828316医药:成本库存成员2019-01-012019-12-310001828316Pharm:A2025Bonds125MillionConvertibleBondsMember2020-12-310001828316Pharm:A2025Bonds125MillionConvertibleBondsMember2019-12-310001828316Pharm:A2025Bonds125MillionConvertibleBondsMember2021-01-012021-12-310001828316Pharm:A2025Bonds125MillionConvertibleBondsMember2020-01-012020-12-310001828316Pharm:A2025Bonds125MillionConvertibleBondsMember2021-12-310001828316Pharm:A2025Bonds125MillionConvertibleBondsMember2020-01-210001828316Pharm:A2025Bonds125MillionConvertibleBondsMemberIFRS-FULL:固定利率成员2020-01-2100018283162020-01-21ISO4217:欧元Xbrli:共享0001828316Pharm:A2025Bonds125MillionConvertibleBondsMemberSRT:情景预测成员2023-02-132023-02-130001828316Pharm:A2025Bonds125MillionConvertibleBondsMember2023-02-132023-02-1300018283162020-01-212020-01-210001828316医药:Orbimed Advisors LoanMembers2020-12-310001828316医药:Orbimed Advisors LoanMembers2019-12-310001828316医药:Orbimed Advisors LoanMembers2021-01-012021-12-310001828316医药:Orbimed Advisors LoanMembers2020-01-012020-12-310001828316医药:Orbimed Advisors LoanMembers2021-12-310001828316医药:Orbimed Advisors LoanMembers2017-12-310001828316医药:Orbimed Advisors LoanMembers2017-01-012017-12-310001828316IFRS-Full:租赁责任成员2021-01-012021-12-310001828316IFRS-Full:租赁责任成员2020-01-012020-12-310001828316IFRS-Full:不晚于一年成员医药:最低支付成员2021-12-310001828316IFRS-Full:不晚于一年成员医药:PresentValueOfPayments成员2021-12-310001828316IFRS-Full:不晚于一年成员医药:最低支付成员2020-12-310001828316IFRS-Full:不晚于一年成员医药:PresentValueOfPayments成员2020-12-310001828316Ifrs-full:LaterThanOneYearAndNotLaterThanFiveYearsMember医药:最低支付成员2021-12-310001828316Ifrs-full:LaterThanOneYearAndNotLaterThanFiveYearsMember医药:PresentValueOfPayments成员2021-12-310001828316Ifrs-full:LaterThanOneYearAndNotLaterThanFiveYearsMember医药:最低支付成员2020-12-310001828316Ifrs-full:LaterThanOneYearAndNotLaterThanFiveYearsMember医药:PresentValueOfPayments成员2020-12-310001828316IFRS-Full:晚于五年成员医药:最低支付成员2021-12-310001828316IFRS-Full:晚于五年成员医药:PresentValueOfPayments成员2021-12-310001828316IFRS-Full:晚于五年成员医药:最低支付成员2020-12-310001828316IFRS-Full:晚于五年成员医药:PresentValueOfPayments成员2020-12-310001828316医药:最低支付成员2021-12-310001828316医药:PresentValueOfPayments成员2021-12-310001828316医药:最低支付成员2020-12-310001828316医药:PresentValueOfPayments成员2020-12-3100018283162021-05-202021-12-31医药:执行董事药业:非执行董事0001828316Pharm:FormerBoardOfManagementShareOptionPlanMember2021-01-012021-12-310001828316Pharm:FormerBoardOfManagementShareOptionPlanMember2020-01-012020-12-310001828316Pharm:FormerBoardOfManagementShareOptionPlanMember2019-01-012019-12-310001828316Pharm:SeniorManagementAndFormerMembersOfTheBoardOfManagementNonDirectorsShareOptionPlanMember2021-01-012021-12-310001828316Pharm:SeniorManagementAndFormerMembersOfTheBoardOfManagementNonDirectorsShareOptionPlanMember2020-01-012020-12-310001828316Pharm:SeniorManagementAndFormerMembersOfTheBoardOfManagementNonDirectorsShareOptionPlanMember2019-01-012019-12-310001828316医药:LongTermIncentivePlanMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember2020-01-012020-12-310001828316医药:LongTermIncentivePlanMember2019-01-012019-12-310001828316医药:BonusSharePlanMembers2021-01-012021-12-310001828316医药:BonusSharePlanMembers2020-01-012020-12-310001828316医药:BonusSharePlanMembers2019-01-012019-12-31药品:元素0001828316IFRS-FULL:底部范围成员医药:员工选项成员2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMember医药:员工选项成员2021-01-012021-12-310001828316IFRS-FULL:底部范围成员医药:员工选项成员2019-01-012019-12-310001828316IFRS-Full:TopOfRangeMember医药:员工选项成员2019-01-012019-12-310001828316医药:BoardOfManagementShareOptionPlanMembers2019-01-012019-12-310001828316IFRS-FULL:底部范围成员医药:员工选项成员2020-01-012020-12-310001828316IFRS-Full:TopOfRangeMember医药:员工选项成员2020-01-012020-12-31制药公司:公司0001828316国家:BE2021-12-310001828316国家:DK2021-12-310001828316国家:法国2021-12-310001828316国家:德2021-12-310001828316国家/地区:IT2021-12-310001828316国家/地区:否2021-12-310001828316国家:中国2021-12-310001828316国家:GB2021-12-310001828316医药:1级成员2021-01-012021-12-310001828316医药:2级成员IFRS-FULL:底部范围成员2021-01-012021-12-310001828316医药:2级成员IFRS-Full:TopOfRangeMember2021-01-012021-12-310001828316医药:2级成员2021-01-012021-12-310001828316IFRS-FULL:底部范围成员医药:3级成员2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMember医药:3级成员2021-01-012021-12-310001828316医药:3级成员2021-01-012021-12-310001828316IFRS-FULL:底部范围成员医药:4级成员2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMember医药:4级成员2021-01-012021-12-310001828316医药:4级成员2021-01-012021-12-310001828316IFRS-FULL:底部范围成员医药:5级成员2021-01-012021-12-310001828316IFRS-Full:TopOfRangeMember医药:5级成员2021-01-012021-12-310001828316医药:5级成员2021-01-012021-12-310001828316医药:6级成员2021-01-012021-12-310001828316医药:NewLongTerm奖励计划成员2021-01-012021-12-310001828316医药:NewLongTerm奖励计划成员2020-01-012020-12-310001828316医药:NewLongTerm奖励计划成员2019-01-012019-12-310001828316医药:LongTermIncentivePlanMember医药:CEOMembers2021-01-012021-12-310001828316Pharm:OtherExecutiveDirectorsAndOfficersMember医药:LongTermIncentivePlanMember2021-01-012021-12-310001828316Pharm:OtherExecutiveDirectorsAndOfficersMember医药:LongTermIncentivePlanMemberSRT:最小成员数2021-01-012021-12-310001828316Pharm:OtherExecutiveDirectorsAndOfficersMember医药:LongTermIncentivePlanMemberSRT:最大成员数2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:EqualToIndexMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:A10AboveIndexMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:A20AboveIndexMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:A40AboveIndexMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:A60AboveIndexMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:A80AboveIndexMember2021-01-012021-12-310001828316医药:A100AboveIndexMember医药:LongTermIncentivePlanMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:以下索引成员2021-01-012021-12-310001828316医药:LongTermIncentivePlanMemberIFRS-FULL:底部范围成员2021-01-012021-12-310001828316医药:LongTermIncentivePlanMemberIFRS-Full:TopOfRangeMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMemberIFRS-FULL:底部范围成员2020-01-012020-12-310001828316医药:LongTermIncentivePlanMemberIFRS-Full:TopOfRangeMember2020-01-012020-12-310001828316医药:LongTermIncentivePlanMember医药:CEOMembers2020-12-112020-12-11医药:格兰特0001828316医药:LongTermIncentivePlanMember医药:CEOMembers2020-12-11制药:部分0001828316医药:OptionPlanMembers2020-12-310001828316医药:OptionPlanMembers2019-12-310001828316医药:OptionPlanMembers2018-12-310001828316医药:OptionPlanMembers2021-01-012021-12-310001828316医药:OptionPlanMembers2020-01-012020-12-310001828316医药:OptionPlanMembers2019-01-012019-12-310001828316医药:OptionPlanMembers2021-12-310001828316医药:ExercisePriceRangeOneMembers医药:OptionPlanMembersIFRS-FULL:底部范围成员2021-12-310001828316医药:ExercisePriceRangeOneMembers医药:OptionPlanMembersIFRS-Full:TopOfRangeMember2021-12-310001828316医药:ExercisePriceRangeOneMembers医药:OptionPlanMembers2021-12-310001828316医药:ExercisePriceRangeOneMembers医药:OptionPlanMembers2020-12-310001828316医药:ExercisePriceRangeOneMembers医药:OptionPlanMembers2019-12-310001828316医药:ExercisePriceRangeTwoMember医药:OptionPlanMembersIFRS-FULL:底部范围成员2021-12-310001828316医药:ExercisePriceRangeTwoMember医药:OptionPlanMembersIFRS-Full:TopOfRangeMember2021-12-310001828316医药:ExercisePriceRangeTwoMember医药:OptionPlanMembers2021-12-310001828316医药:ExercisePriceRangeTwoMember医药:OptionPlanMembers2020-12-310001828316医药:ExercisePriceRangeTwoMember医药:OptionPlanMembers2019-12-310001828316医药:ExercisePriceRangeThree成员医药:OptionPlanMembersIFRS-FULL:底部范围成员2021-12-310001828316医药:ExercisePriceRangeThree成员医药:OptionPlanMembersIFRS-Full:TopOfRangeMember2021-12-310001828316医药:ExercisePriceRangeThree成员医药:OptionPlanMembers2021-12-310001828316医药:ExercisePriceRangeThree成员医药:OptionPlanMembers2020-12-310001828316医药:ExercisePriceRangeThree成员医药:OptionPlanMembers2019-12-310001828316医药:ExercisePriceRangeFourMember医药:OptionPlanMembersIFRS-FULL:底部范围成员2021-12-310001828316医药:ExercisePriceRangeFourMember医药:OptionPlanMembersIFRS-Full:TopOfRangeMember2021-12-310001828316医药:ExercisePriceRangeFourMember医药:OptionPlanMembers2021-12-310001828316医药:ExercisePriceRangeFourMember医药:OptionPlanMembers2020-12-310001828316医药:ExercisePriceRangeFourMember医药:OptionPlanMembers2019-12-310001828316医药:OptionPlanMembers医药:员工成员2021-01-012021-12-310001828316医药:OptionPlanMembers医药:员工成员IFRS-FULL:底部范围成员2021-01-012021-12-310001828316医药:OptionPlanMembers医药:员工成员IFRS-Full:TopOfRangeMember2021-01-012021-12-310001828316医药:OptionPlanMembers医药:员工成员2020-01-012020-12-310001828316医药:OptionPlanMembers医药:员工成员IFRS-FULL:底部范围成员2020-01-012020-12-310001828316医药:OptionPlanMembers医药:员工成员IFRS-Full:TopOfRangeMember2020-01-012020-12-310001828316医药:LongTermIncentivePlanMemberPharm:NonExecutiveMembersOfTheBoardOfDirectorsMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMemberPharm:NonExecutiveMembersOfTheBoardOfDirectorsMember2020-01-012020-12-310001828316医药:LongTermIncentivePlanMemberPharm:NonExecutiveMembersOfTheBoardOfDirectorsMember2019-01-012019-12-310001828316医药:LongTermIncentivePlanMemberPharm:NonExecutiveMembersOfTheBoardOfDirectorsMember2019-01-012021-12-310001828316医药:LongTermIncentivePlanMemberPharm:ExecutiveMembersOfTheBoardOfDirectorsMember2021-01-012021-12-310001828316医药:LongTermIncentivePlanMemberPharm:ExecutiveMembersOfTheBoardOfDirectorsMember2020-01-012020-12-310001828316医药:LongTermIncentivePlanMemberPharm:ExecutiveMembersOfTheBoardOfDirectorsMember2019-01-012019-12-310001828316医药:LongTermIncentivePlanMemberPharm:ExecutiveMembersOfTheBoardOfDirectorsMember2019-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:执行委员会成员2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:执行委员会成员2020-01-012020-12-310001828316医药:LongTermIncentivePlanMember医药:执行委员会成员2019-01-012019-12-310001828316医药:LongTermIncentivePlanMember医药:执行委员会成员2019-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:高级经理成员2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:高级经理成员2020-01-012020-12-310001828316医药:LongTermIncentivePlanMember医药:高级经理成员2019-01-012019-12-310001828316医药:LongTermIncentivePlanMember医药:高级经理成员2019-01-012021-12-310001828316医药:LongTermIncentivePlanMember2019-01-012021-12-310001828316医药:LongTermIncentivePlanMemberPharm:NonExecutiveMembersOfTheBoardOfDirectorsMember2018-01-012020-12-310001828316医药:LongTermIncentivePlanMemberPharm:NonExecutiveMembersOfTheBoardOfDirectorsMember2021-12-310001828316医药:LongTermIncentivePlanMemberPharm:ExecutiveMembersOfTheBoardOfDirectorsMember2018-01-012020-12-310001828316医药:LongTermIncentivePlanMemberPharm:ExecutiveMembersOfTheBoardOfDirectorsMember2021-12-310001828316医药:LongTermIncentivePlanMember医药:执行委员会成员2018-01-012020-12-310001828316医药:LongTermIncentivePlanMember医药:执行委员会成员2021-12-310001828316医药:LongTermIncentivePlanMember医药:高级经理成员2018-01-012020-12-310001828316医药:LongTermIncentivePlanMember医药:高级经理成员2021-12-310001828316医药:LongTermIncentivePlanMember2018-01-012020-12-310001828316医药:LongTermIncentivePlanMember2021-12-310001828316医药:LongTermIncentivePlanMember医药:CEOMembers2021-03-310001828316医药:LongTermIncentivePlanMember医药:CEOMembers医药:TotalShareholderReturnMembers2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:战略目标成员医药:CEOMembers2021-01-012021-12-310001828316医药:LongTermIncentivePlanMember医药:CEOMembersSRT:情景预测成员2022-12-31医药:层级0001828316制药公司:董事会主席董事成员2021-01-012021-12-310001828316医药:非执行董事成员2021-01-012021-12-310001828316医药:审计委员会主席成员2021-01-012021-12-310001828316医药:MemberAuditCommittee成员2021-01-012021-12-310001828316医药:主席任命委员会成员2021-01-012021-12-310001828316医药:MemberRemunerationCommittee成员2021-01-012021-12-310001828316制药:主席治理委员会成员2021-01-012021-12-310001828316医药:成员政府委员会成员2021-01-012021-12-310001828316医药:非执行董事成员医药:PSekhriMembers2021-01-012021-12-310001828316医药:非执行董事成员医药:PSekhriMembers2020-01-012020-12-310001828316医药:非执行董事成员医药:PSekhriMembers2019-01-012019-12-310001828316医药:非执行董事成员医药:BWardMembers2021-01-012021-12-310001828316医药:非执行董事成员医药:BWardMembers2020-01-012020-12-310001828316医药:非执行董事成员医药:BWardMembers2019-01-012019-12-310001828316医药:非执行董事成员医药:JEgbertsMembers2021-01-012021-12-310001828316医药:非执行董事成员医药:JEgbertsMembers2020-01-012020-12-310001828316医药:非执行董事成员医药:JEgbertsMembers2019-01-012019-12-310001828316医药:非执行董事成员药品:JHLErnstMembers2021-01-012021-12-310001828316医药:非执行董事成员药品:JHLErnstMembers2020-01-012020-12-310001828316医药:非执行董事成员药品:JHLErnstMembers2019-01-012019-12-310001828316医药:ADeWinterMember医药:非执行董事成员2021-01-012021-12-310001828316医药:ADeWinterMember医药:非执行董事成员2020-01-012020-12-310001828316医药:ADeWinterMember医药:非执行董事成员2019-01-012019-12-310001828316医药:非执行董事成员医药:MsDJornMembers2021-01-012021-12-310001828316医药:非执行董事成员医药:MsDJornMembers2020-01-012020-12-310001828316医药:非执行董事成员医药:MsDJornMembers2019-01-012019-12-310001828316医药:非执行董事成员医药:BYANNI Members2021-01-012021-12-310001828316医药:非执行董事成员医药:BYANNI Members2020-01-012020-12-310001828316医药:非执行董事成员医药:BYANNI Members2019-01-012019-12-310001828316医药:非执行董事成员医药:MPykettMembers2021-01-012021-12-310001828316医药:非执行董事成员医药:MPykettMembers2020-01-012020-12-310001828316医药:非执行董事成员医药:MPykettMembers2019-01-012019-12-310001828316制药公司:JVanderMeijsMembers医药:非执行董事成员2021-01-012021-12-310001828316制药公司:JVanderMeijsMembers医药:非执行董事成员2020-01-012020-12-310001828316制药公司:JVanderMeijsMembers医药:非执行董事成员2019-01-012019-12-310001828316医药:非执行董事成员医药:LKruimerMembers2021-01-012021-12-310001828316医药:非执行董事成员医药:LKruimerMembers2020-01-012020-12-310001828316医药:非执行董事成员医药:LKruimerMembers2019-01-012019-12-310001828316医药:非执行董事成员医药:SBaertMember2021-01-012021-12-310001828316医药:非执行董事成员医药:SBaertMember2020-01-012020-12-310001828316医药:非执行董事成员医药:SBaertMember2019-01-012019-12-310001828316医药:非执行董事成员2020-01-012020-12-310001828316医药:非执行董事成员2019-01-012019-12-310001828316医药:PSekhriMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2021-01-012021-12-310001828316医药:PSekhriMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2021-12-310001828316医药:PSekhriMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2020-01-012020-12-310001828316医药:PSekhriMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2020-12-310001828316医药:PSekhriMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2019-01-012019-12-310001828316医药:PSekhriMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2019-12-310001828316医药:PSekhriMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2018-01-012018-12-310001828316医药:PSekhriMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2018-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember医药:MsDJornMembers2021-01-012021-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember医药:MsDJornMembers2021-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember医药:MsDJornMembers2020-01-012020-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember医药:MsDJornMembers2020-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember医药:MsDJornMembers2019-01-012019-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember医药:MsDJornMembers2019-12-310001828316医药:ADeWinterMemberPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2021-01-012021-12-310001828316医药:ADeWinterMemberPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2021-12-310001828316医药:ADeWinterMemberPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2020-01-012020-12-310001828316医药:ADeWinterMemberPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2020-12-310001828316医药:ADeWinterMemberPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2019-01-012019-12-310001828316医药:ADeWinterMemberPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2019-12-310001828316医药:ADeWinterMemberPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2018-01-012018-12-310001828316医药:ADeWinterMemberPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2018-12-310001828316医药:JBWardMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2021-01-012021-12-310001828316医药:JBWardMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2021-12-310001828316医药:JBWardMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2020-01-012020-12-310001828316医药:JBWardMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2020-12-310001828316医药:JBWardMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2019-01-012019-12-310001828316医药:JBWardMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2019-12-310001828316医药:JBWardMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2018-01-012018-12-310001828316医药:JBWardMembersPharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2018-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2021-01-012021-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2021-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2020-01-012020-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2020-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2019-01-012019-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2019-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2018-01-012018-12-310001828316Pharm:LongTermIncentivePlanForBoardOfDirectorsAndFormerBoardOfSupervisoryDirectorsMember2018-12-310001828316医药:PSekhriMembersIfrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:普通共享类成员2021-12-310001828316医药:PSekhriMembersIfrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:认证OfSharesMember2021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:MsDJornMembers医药:普通共享类成员2021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:MsDJornMembers医药:认证OfSharesMember2021-12-310001828316医药:BYANNI MembersIfrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:普通共享类成员2021-12-310001828316医药:BYANNI MembersIfrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:认证OfSharesMember2021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:MPykettMembers医药:普通共享类成员2021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:MPykettMembers医药:认证OfSharesMember2021-12-310001828316制药公司:JVanderMeijsMembersIfrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:普通共享类成员2021-12-310001828316制药公司:JVanderMeijsMembersIfrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:认证OfSharesMember2021-12-310001828316医药:LKruimerMembersIfrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:普通共享类成员2021-12-310001828316医药:LKruimerMembersIfrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:认证OfSharesMember2021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:SBaertMember医药:普通共享类成员2021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:SBaertMember医药:认证OfSharesMember2021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:普通共享类成员2021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember医药:认证OfSharesMember2021-12-310001828316医药:SDeVriesMembers2021-01-012021-12-310001828316医药:SDeVriesMembers2020-01-012020-12-310001828316医药:SDeVriesMembers2019-01-012019-12-310001828316医药:Bruno Bianettie先生成员2021-01-012021-12-310001828316医药:Bruno Bianettie先生成员2020-01-012020-12-310001828316医药:Bruno Bianettie先生成员2019-01-012019-12-310001828316药业:罗宾·莱特先生2021-01-012021-12-310001828316药业:罗宾·莱特先生2020-01-012020-12-310001828316药业:罗宾·莱特先生2019-01-012019-12-310001828316药品有效期:22052024成员医药:SDeVriesMembers医药:BoardOfManagementShareOptionPlanMembers2018-12-310001828316药品有效期:22052024成员医药:SDeVriesMembers医药:BoardOfManagementShareOptionPlanMembers2021-01-012021-12-310001828316药品有效期:22052024成员医药:SDeVriesMembers医药:BoardOfManagementShareOptionPlanMembers2021-12-310001828316医药:董事会成员医药:SDeVriesMembers2021-12-310001828316医药:董事会成员医药:LongTermIncentivePlanMember医药:SDeVriesMembers2021-01-012021-12-310001828316医药:董事会成员医药:LongTermIncentivePlanMember医药:SDeVriesMembers2021-12-310001828316医药:董事会成员医药:LongTermIncentivePlanMember医药:SDeVriesMembers2020-01-012020-12-310001828316医药:董事会成员医药:LongTermIncentivePlanMember医药:SDeVriesMembers2020-12-310001828316医药:董事会成员医药:LongTermIncentivePlanMember医药:SDeVriesMembers2019-01-012019-12-310001828316医药:董事会成员医药:LongTermIncentivePlanMember医药:SDeVriesMembers2019-12-310001828316医药:董事会成员医药:LongTermIncentivePlanMember医药:SDeVriesMembers2018-01-012018-12-310001828316医药:董事会成员医药:LongTermIncentivePlanMember医药:SDeVriesMembers2018-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember2021-01-012021-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember2020-01-012020-12-310001828316Ifrs-full:KeyManagementPersonnelOfEntityOrParentMember2019-01-012019-12-310001828316医药:BioConnectionBVMembers2021-01-012021-12-310001828316医药:BioConnectionBVMembers2020-01-012020-12-310001828316医药:BioConnectionBVMembers2021-12-310001828316医药:BioConnectionBVMembers2020-12-310001828316IFRS-Full:ContingentConsiderationMembers2021-12-310001828316IFRS-Full:ContingentConsiderationMembers2020-12-310001828316IFRS-FULL:财务担保合同成员2021-12-310001828316IFRS-FULL:财务担保合同成员2020-12-310001828316医药:ValeantMembers2016-12-310001828316IFRS-Full:不晚于一年成员2021-12-310001828316Ifrs-full:LaterThanOneYearAndNotLaterThanTwoYearsMember2021-12-310001828316制药:诺华成员2021-12-310001828316制药:诺华成员2021-01-012021-12-310001828316货币:欧元2021-12-31ISO 4217:美元ISO4217:欧元0001828316货币:美元2021-12-310001828316IFRS-FULL:固定利率成员医药:可转换债券成员2021-12-310001828316Ifrs-full:LaterThanTwoYearsAndNotLaterThanThreeYearsMember2021-12-310001828316Ifrs-full:LaterThanThreeYearsAndNotLaterThanFourYearsMember2021-12-310001828316Ifrs-full:LaterThanFourYearsAndNotLaterThanFiveYearsMember2021-12-310001828316Ifrs-full:InvestmentsInEquityInstrumentsMeasuredAtFairValueThroughOtherComprehensiveIncomeMemberIFRS-FULL:第1级公允价值层次成员IFRS-Full:RecurringFairValueMeasurementMember2021-12-310001828316Ifrs-full:InvestmentsInEquityInstrumentsMeasuredAtFairValueThroughOtherComprehensiveIncomeMemberIFRS-Full:RecurringFairValueMeasurementMember2021-12-310001828316Ifrs-full:InvestmentsInEquityInstrumentsMeasuredAtFairValueThroughOtherComprehensiveIncomeMemberIFRS-FULL:第1级公允价值层次成员IFRS-Full:RecurringFairValueMeasurementMember2020-12-310001828316Ifrs-full:InvestmentsInEquityInstrumentsMeasuredAtFairValueThroughOtherComprehensiveIncomeMemberIFRS-Full:RecurringFairValueMeasurementMember2020-12-310001828316IFRS-FULL:第1级公允价值层次成员IFRS-Full:RecurringFairValueMeasurementMember2021-12-310001828316IFRS-Full:RecurringFairValueMeasurementMember2021-12-310001828316IFRS-FULL:第1级公允价值层次成员IFRS-Full:RecurringFairValueMeasurementMember2020-12-310001828316IFRS-Full:RecurringFairValueMeasurementMember2020-12-310001828316IFRS-Full:衍生品成员IFRS-Full:RecurringFairValueMeasurementMemberIFRS-Full:Level 3 of FairValueHierarchyMembers2021-12-310001828316IFRS-Full:衍生品成员IFRS-Full:RecurringFairValueMeasurementMember2021-12-310001828316IFRS-Full:衍生品成员IFRS-Full:RecurringFairValueMeasurementMemberIFRS-Full:Level 3 of FairValueHierarchyMembers2020-12-310001828316IFRS-Full:衍生品成员IFRS-Full:RecurringFairValueMeasurementMember2020-12-310001828316IFRS-Full:RecurringFairValueMeasurementMemberIFRS-Full:Level 3 of FairValueHierarchyMembers医药:其他财务责任成员2021-12-310001828316IFRS-Full:RecurringFairValueMeasurementMember医药:其他财务责任成员2021-12-310001828316IFRS-Full:RecurringFairValueMeasurementMemberIFRS-Full:Level 3 of FairValueHierarchyMembers医药:其他财务责任成员2020-12-310001828316IFRS-Full:RecurringFairValueMeasurementMember医药:其他财务责任成员2020-12-310001828316IFRS-Full:RecurringFairValueMeasurementMemberIFRS-Full:Level 3 of FairValueHierarchyMembers2021-12-310001828316IFRS-Full:RecurringFairValueMeasurementMemberIFRS-Full:Level 3 of FairValueHierarchyMembers2020-12-310001828316药品:预期成熟度测量输入成员IFRS-Full:RecurringFairValueMeasurementMember医药:保证书成员2021-12-310001828316药品:预期成熟度测量输入成员IFRS-Full:RecurringFairValueMeasurementMember医药:保证书成员2020-12-310001828316Ifrs-full:HistoricalVolatilityForSharesMeasurementInputMemberIFRS-Full:RecurringFairValueMeasurementMember医药:保证书成员2021-12-310001828316Ifrs-full:HistoricalVolatilityForSharesMeasurementInputMemberIFRS-Full:RecurringFairValueMeasurementMember医药:保证书成员2020-12-310001828316IFRS-Full:RecurringFairValueMeasurementMember医药:保证书成员IFRS-Full:InterestRateMeasurementInputMember2021-12-310001828316IFRS-Full:RecurringFairValueMeasurementMember医药:保证书成员IFRS-Full:InterestRateMeasurementInputMember2020-12-310001828316Pharm:CashAndCashEquivalentsIncludingRestrictedCashMemberIfrs-full:FinancialAssetsAtFairValueThroughProfitOrLossCategoryMember2021-12-310001828316Pharm:CashAndCashEquivalentsIncludingRestrictedCashMemberIfrs-full:FinancialAssetsAtFairValueThroughProfitOrLossCategoryMember2020-12-310001828316医药:贸易和其他应收账款成员Ifrs-full:FinancialAssetsAtFairValueThroughProfitOrLossCategoryMember2021-12-310001828316医药:贸易和其他应收账款成员Ifrs-full:FinancialAssetsAtFairValueThroughProfitOrLossCategoryMember2020-12-310001828316医药:可转换债券成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2021-12-310001828316医药:可转换债券成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2020-12-310001828316IFRS-Full:租赁责任成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2021-12-310001828316IFRS-Full:租赁责任成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2020-12-310001828316医药:其他财务责任成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2021-12-310001828316医药:其他财务责任成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2020-12-310001828316医药:贸易和其他可支付成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2021-12-310001828316医药:贸易和其他可支付成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2020-12-310001828316IFRS-Full:衍生品成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2021-12-310001828316IFRS-Full:衍生品成员Ifrs-full:FinancialLiabilitiesAtFairValueMember2020-12-310001828316IFRS-Full:不晚于一年成员医药:可转换债券成员2021-12-310001828316IFRS-Full:不晚于一年成员医药:可转换债券成员2020-12-310001828316IFRS-Full:晚于一年成员医药:可转换债券成员2021-12-310001828316IFRS-Full:晚于一年成员医药:可转换债券成员2020-12-310001828316IFRS-FULL:固定利率成员2021-12-310001828316IFRS-FULL:固定利率成员2020-12-310001828316医药:可转换债券成员2020-12-310001828316医药:可转换债券成员2021-01-012021-12-310001828316医药:可转换债券成员2021-12-310001828316医药:其他财务责任成员2020-12-310001828316医药:其他财务责任成员2021-01-012021-12-310001828316医药:其他财务责任成员2021-12-310001828316IFRS-Full:租赁责任成员2020-12-310001828316IFRS-Full:租赁责任成员2021-12-310001828316Ifrs-full:AssetsHeldToHedgeLiabilitiesArisingFromFinancingActivitiesMember2020-12-310001828316Ifrs-full:AssetsHeldToHedgeLiabilitiesArisingFromFinancingActivitiesMember2021-01-012021-12-310001828316Ifrs-full:AssetsHeldToHedgeLiabilitiesArisingFromFinancingActivitiesMember2021-12-3100018283162021-01-012021-04-0600018283162021-04-070001828316医药:LongTermIncentivePlanMember2021-01-012021-04-060001828316医药:LongTermIncentivePlanMember2021-04-07 UNITED STATES
美国证券交易委员会
华盛顿特区,20549
表格20-F
(标记一)
☐根据1934年《证券交易法》第12(B)或(G)条所作的登记声明
或
☒根据1934年《证券交易法》第13或15(D)条提交的年度报告
截至本财政年度止12月31日, 2021
或
☐根据1934年《证券交易法》第13或15(D)条提交的过渡报告
的过渡期 至
或
☐根据1934年《证券交易法》第13或15(D)条提交的空壳公司报告
需要本空壳公司报告的事件日期_
佣金文件编号001-39822
Pharing Group N.V.
(注册人的确切姓名载于其章程)
| | | | | | | | |
| | |
这个荷兰 | 2834 | 不适用 |
(注册成立或组织的司法管辖权) | (主要标准行业分类代号) | (注册人的译文 姓名翻译成英文) |
达尔文威格24号
2333 CR莱顿
这个荷兰
Tel: +31 (0)71 5247 400
(注册人主要执行办公室的地址,包括邮政编码和电话号码,包括区号)
Pharing Healthcare Inc.
独立大道10号,401号套房
沃伦, 新泽西 07059
+1 908524 0888
(服务代理商的名称、地址,包括邮政编码和电话号码,包括区号)
根据该法第12(B)条登记或将登记的证券。
| | | | | | | | | | | | | | |
每节课的标题 | | 交易代码 | | 注册的每个交易所的名称 |
美国存托股份,每股相当于10股普通股,每股面值0.01欧元
普通股,每股面值0.01欧元* | | 药剂 | | 纳斯达克股市有限责任公司
纳斯达克股市有限责任公司* |
根据该法第12(G)条登记或将登记的证券。无
根据该法第15(D)条规定有报告义务的证券。无
注明截至年度报告所述期间结束时发行人所属各类资本或普通股的流通股数量
648,749,000普通股,2021年12月31日每股面值0.01欧元。
如果注册人是证券法规则405中定义的知名经验丰富的发行人,请用复选标记表示。☐是☒不是
如果本报告是年度报告或过渡报告,请用勾号表示注册人是否不需要根据1934年《证券交易法》第13或15(D)节提交报告。☐是☒不是
用复选标记表示注册人(1)是否已在过去12个月内(或注册人被要求提交此类报告的较短时间内)提交了1934年《证券交易法》第13条或第15(D)条要求提交的所有报告,以及(2)在过去90天☒一直符合此类提交要求是 ☐ No
用复选标记表示注册人是否在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-T规则第405条(本章232.405节)要求提交的每个交互数据文件。☒是 ☐ No
用复选标记表示注册者是大型加速文件服务器、加速文件服务器、非加速文件服务器还是新兴成长型公司。请参阅《交易法》第12b-2条规则中“大型加速申报公司”、“加速申报公司”和“新兴成长型公司”的定义。
大型加速文件服务器☒加速文件服务器☐非加速文件服务器☐新兴成长型公司☐
如果一家新兴成长型公司按照美国公认会计原则编制其财务报表,用勾号表示注册人是否已选择不使用延长的过渡期来遵守†根据交易所法案第13(A)节提供的任何新的或修订的财务会计准则。☐
用复选标记表示注册人是否提交了一份报告,证明其管理层根据《萨班斯-奥克斯利法案》(《美国联邦法典》第15编,第7262(B)节)第404(B)条对其财务报告的内部控制的有效性进行了评估,该评估是由编制或发布其审计报告的注册会计师事务所进行的。☒
†新的或修订的财务会计准则是指财务会计准则委员会在2012年4月5日之后发布的对其会计准则编纂的任何更新。
用复选标记表示注册人在编制本文件所包括的财务报表时使用了哪种会计基础:
| | | | | | | | |
| 美国公认会计准则☐ | 国际财务报告准则由国际会计准则委员会☒发布 | 其他☐ |
如果在回答前一个问题时勾选了“其他”,请用勾号表示登记人选择遵循哪个财务报表项目。☐第17项☐第18项如果这是年度报告,请用复选标记表示注册人是否为空壳公司(如《交易法》第12b-2条所述)。☐是☒不是
.
| | | | | | | | |
| 目录 |
| | 页 |
| 有关前瞻性陈述的一般信息 | 5 |
| 第一部分 | | |
| 第1项。 | 董事、高级管理人员和顾问的身份 | 6 |
| 第二项。 | 报价统计数据和预期时间表 | 6 |
| 第三项。 | 关键信息 | 6 |
| A. [已保留] | 6 |
| B.资本化和负债 | 6 |
| C.提出和使用收益的理由 | 6 |
| D.风险因素 | 6 |
| 第四项。 | 公司信息 | 44 |
| A.公司的历史和发展 | 44 |
| B.业务概述 | 44 |
| C.组织结构 | 76 |
| D.财产、厂房和设备 | 76 |
| 项目4 A。 | 未解决的员工意见 | 77 |
| 第五项。 | 经营和财务回顾与展望 | 77 |
| A.经营业绩 | 77 |
| B.流动资金和资本资源 | 89 |
| C.研发、专利和许可证等 | 92 |
| D.趋势信息 | 92 |
| E. 关键会计估计 | 92 |
| 第六项。 | 董事、高级管理人员和员工 | 92 |
| A.董事和高级管理人员 | 92 |
| B.补偿 | 97 |
| C.董事会惯例 | 106 |
| D.员工 | 107 |
| E.股份所有权 | 107 |
| 第7项。 | 大股东及关联方交易 | 107 |
| A.大股东 | 107 |
| B.关联方交易 | 108 |
| C.专家和律师的利益 | 109 |
| 第八项。 | 财务信息 | 109 |
| A. 合并报表和其他财务信息 | 109 |
| B.重大变化 | 110 |
| 第九项。 | 报价和挂牌 | 110 |
| A.优惠和上市详情 | 110 |
| B.分配计划 | 110 |
| C.市场 | 110 |
| D.出售股东 | 110 |
| E.稀释 | 111 |
| F.发行的费用 | 111 |
| | | | | | | | |
| 第10项。 | 附加信息 | 111 |
| A.股本 | 111 |
| B.公司章程 | 111 |
| C.材料合同 | 111 |
| D.外汇管制 | 112 |
| E.课税 | 112 |
| F.股息和支付代理人 | 121 |
| G.专家的发言 | 121 |
| H.展出的文件 | 121 |
| 一、附属信息 | 121 |
| 第11项。 | 关于市场风险的定量和定性披露 | 121 |
| 第12项。 | 除股权证券外的其他证券说明 | 121 |
| A.债务证券 | 121 |
| B.认股权证及权利 | 121 |
| C.其他证券 | 121 |
| D.美国存托股份 | 122 |
| 第II部 | | |
| 第13项。 | 违约、拖欠股息和拖欠股息 | 122 |
| 第14项。 | 对担保持有人的权利和收益的使用作出实质性修改 | 122 |
| 第15项。 | 控制和程序 | 122 |
| 第16项。 | [已保留] | 125 |
| 项目16A。 | 审计委员会财务专家 | 125 |
| 项目16B。 | 道德准则 | 126 |
| 项目16C。 | 首席会计师费用及服务 | 127 |
| 项目16D。 | 豁免审计委员会遵守上市标准 | 127 |
| 项目16E。 | 发行人及关联购买人购买股权证券 | 127 |
| 项目16F。 | 更改注册人的认证会计师 | 127 |
| 项目16G。 | 公司治理 | 128 |
| 第16H项。 | 煤矿安全信息披露 | 128 |
| 项目16I。 | 关于妨碍检查的外国司法管辖区的披露 | 128 |
| 第三部分 | | |
| 第17项。 | 财务报表 | 128 |
| 第18项。 | 财务报表 | 128 |
| 项目19. | 展品 | 128 |
有关前瞻性陈述的一般信息
在本年度报告表格20-F(年度报告)中,除文意另有所指外,“Pharming”、“Pharming Group”、“Pharming Group N.V.”、“Pharming Healthcare Inc.”、“The Group”、“The Company”、“We”、“Us”及“Our”均指Pharming Group N.V.及其附属公司。
这份Form 20-F年度报告包含涉及重大风险和不确定因素的前瞻性陈述。在某些情况下,您可以通过“可能”、“可能”、“将”、“可能”、“将”、“应该”、“预期”、“打算”、“计划”、“目标”、“预期”、“相信”、“估计”、“预测”、“潜在”、“继续”和“正在进行”等词语或这些词语的否定或其他类似术语来识别前瞻性陈述。这些表述涉及已知和未知的风险、不确定性和其他重要因素,可能导致我们的实际结果、活动水平、业绩或成就与这些前瞻性表述中明示或暗示的信息大不相同。本Form 20-F年度报告中包含的前瞻性陈述和意见是基于截至本Form 20-F年度报告日期获得的信息,虽然我们认为这些信息构成了此类陈述的合理基础,但此类信息可能是有限或不完整的,我们的陈述不应被解读为表明我们已对所有可能获得的相关信息进行了详尽的调查或审查。前瞻性陈述包括有关以下方面的陈述:
•我们候选产品的开发,包括关于临床试验和相关准备工作的启动、完成和结果的声明,试验结果将在多长时间内公布,以及我们的研究和开发计划;
•我们有能力在我们计划开发的适应症中获得并保持对我们的候选产品的监管批准,以及批准的药物或疗法标签上的任何相关限制、限制或警告;
•我们与第三方合作的计划,或关于正在进行的合作的声明;
•我们计划对我们的候选产品进行研究、开发、制造和商业化;
•我们为我们的候选产品提交监管文件的时间;
•我们候选产品的市场规模和增长潜力;
•我们筹集额外资本的能力;
•我们的商业化、营销和制造能力和战略;
•我们对获得和维护知识产权保护能力的期望;
•我们吸引和留住合格员工和关键人员的能力;
•我们与第三方供应商和制造商签订合同的能力以及他们充分履行合同的能力;
•我们对未来收入、支出和额外融资需求的估计;
•我们相信,我们现有的现金、现金等价物和定期存款将足以满足我们目前预期的运营费用和资本支出要求;
•我们有能力克服新冠肺炎疫情对我们的业务行为构成的挑战;以及
•美国、荷兰、其他欧盟成员国和其他司法管辖区的监管动态,包括税务问题。
有关可能导致我们的实际结果与前瞻性陈述中明示或暗示的结果大不相同的重要因素的讨论,请参阅本年度报告中题为“第3.D项-风险因素”的章节。由于这些因素,我们不能向您保证本年度报告中20-F表格中的前瞻性陈述将被证明是准确的。此外,如果我们的前瞻性陈述被证明是不准确的,这种不准确可能是实质性的。鉴于这些前瞻性陈述中的重大不确定性,您不应将这些陈述视为我们或任何其他人对我们将在任何特定时间框架内或根本不会实现我们的目标和计划的陈述或保证。前瞻性声明仅在发布之日发表,我们不承担根据新信息或未来发展更新这些声明或公开发布任何修订的任何义务。
为了反映后来发生的事件或情况,或反映意外事件的发生,对这些声明进行了修改。
您应阅读此Form 20-F年度报告以及我们在此Form 20-F年度报告中引用的文件,这些文件已完全作为Form 20-F年度报告的证物存档,并了解我们未来的实际结果可能与我们预期的大不相同。我们通过这些警告性声明来限定我们所有的前瞻性声明。
这份Form 20-F年度报告包含关于我们的行业、我们的业务和我们的候选产品的市场的估计、预测和其他信息。基于估计、预测、预测、市场研究或类似方法的信息本身就会受到不确定因素的影响,实际事件或情况可能与本信息中假设的事件和情况大不相同。除非另有明文规定,我们从我们的内部估计和研究以及从市场研究公司和其他第三方(如投资银行分析师、行业、医疗和一般出版物、政府数据和类似来源)准备的报告、研究调查、研究和类似数据中获得本行业、商业、市场和其他数据。此外,由于各种因素,对我们和我们行业未来业绩的假设和估计必然会受到高度不确定性和风险的影响,其中包括标题为“3.D项-风险因素”一节中所述的那些因素。这些因素和其他因素可能会导致我们未来的业绩与我们的假设和估计大不相同。
国际财务报告准则的应用
我们采用了国际会计准则委员会发布的国际财务报告准则(IFRS)。除另有说明外,本报告所列所有资料均已根据国际财务报告准则编制,而所有前期金额均已根据国际财务报告准则编制。
通货
除非另有说明,在本年度报告的20-F表格中使用的“$”指的是美元,“欧元”指的是欧元。
项目1董事、高级管理人员和顾问的身份
不适用。
项目2报价统计和预期时间表
不适用。
项目3主要信息
A. [已保留]
B.资本化和负债。
不适用。
C.提供和使用收益的理由。
不适用。
D.风险因素。
我们的企业面临着重大的风险和不确定性。在决定投资或维持对我们的证券的投资之前,您应仔细考虑本年度报告以及我们提交给美国证券交易委员会的其他文件中列出的所有信息,包括以下风险因素。我们的业务以及我们的声誉、财务状况、经营结果和股价可能会受到任何这些风险以及其他我们目前不知道或目前不被认为是重大风险和不确定性的重大不利影响。
与我们的业务相关的选定风险摘要
•药品的开发和商业化竞争激烈。特别是,RUCONEST®面临着来自其他用于治疗遗传性血管水肿的产品的激烈竞争。美国和欧洲已经批准了几种用于治疗HAE攻击的产品。因此,我们可能无法通过RUCONEST®获得足够的市场渗透率或产品的足够销售水平来保持盈利。
•我们严重依赖RUCONEST®在美国和欧洲的销售。如果我们不能继续将RUCONEST®商业化,我们的业务可能会受到实质性的损害。此外,我们的开发流程在短期内仍然依赖于C1INH的特许经营权。
•任何当前或未来候选产品的商业成功将取决于医生、患者、付款人和医学界其他人对市场的接受程度。
•如果我们无法保持和发展我们的销售和营销能力,特别是在美国以外的地区,或者无法与第三方达成协议,在美国和欧洲以外的地区营销和销售我们的产品,我们的业务将受到不利影响。
•我们依赖RUCONEST®在某些尚未获得批准的地区的指定患者销售;然而,不能保证我们产品的指定患者销售将继续保持目前的水平,或者根本不能保证。
•我们候选产品的成功商业化将在一定程度上取决于政府当局和健康保险公司建立足够的保险范围、报销水平和定价政策的程度。如果我们的候选产品未能获得或维持承保范围并获得足够的报销,如果获得批准,可能会限制我们营销这些产品的能力,并降低创收能力。
•由于我们的许多候选产品处于早期开发阶段,由于可用资源有限,我们可能会放弃或推迟寻求某些计划或候选产品或后来被证明具有比我们候选产品更大商业潜力的指示。
•包括新冠肺炎在内的公共卫生疫情可能导致我们或我们的员工、承包商、供应商、分销商和其他合作伙伴以及治疗HAE患者的医生无限期地被禁止开展业务和患者护理活动,包括由于政府当局可能要求或强制实施的封锁和隔离。
•潜在临床试验、申请和批准的成本和时间,以及我们产品开发和商业化的潜在治疗范围涉及高度的不确定性和风险,这使得很难预测新方法的产品开发时间和成本。
•我们依赖第三方进行临床前研究和临床试验的重要方面,并打算在未来依赖第三方。如果这些第三方不能成功履行他们的合同义务,我们的业务可能会受到不利影响。
•我们在美国以外的地点为我们的某些候选产品进行临床试验。FDA可能不接受在这些地点进行的试验数据。
•我们可能无法获得或维持我们的产品或候选产品的孤立药物独家经营权。如果我们的竞争对手能够为他们的产品获得孤儿药物独家经营权,我们可能在很长一段时间内无法让竞争对手的产品获得适用的监管机构的批准。
•我们的临床试验结果可能不足以支持提交我们的候选产品的上市批准。在我们将我们的候选产品提交给市场批准之前,FDA和/或EMA可能会要求我们进行额外的临床试验或评估患者的额外随访期。
•我们重组产品制造过程中的任何污染、原材料短缺或我们的任何关键供应商未能交付必要的组件都可能导致我们的临床开发或营销计划的延误,并严重影响商业可用商品。
•在我们的候选产品和产品中使用的一些部件和材料,我们依赖于有限数量的供应商。这些材料供应的任何中断都可能对我们交付产品或完成临床试验的能力产生不利影响。如果供应中断,对候选产品的其他研究、监管应用或以及时和具有商业价值的方式将候选产品商业化,可能会受到不利影响。
•我们依赖第三方制造商生产重组人C1INH,用于RUCONEST®的商业供应和临床试验,以及我们用于临床试验的其他候选产品。供应中断可能会对销售造成实质性的不利影响。
•我们的成功取决于我们是否有能力获得和保护专有技术的权利,以及在不侵犯第三方专有权利的情况下开发我们的技术和产品。
•我们的专利可能会受到挑战、被视为不可执行、无效或被规避,如果我们不获得或保持对产品的专利保护,我们的业务可能会受到实质性损害。
•药品销售和营销领域的法律、法规、道德标准和国际药品规范,以及与政府官员、医疗保健利益相关者和第三方中介机构的互动,非常复杂,需要一个强有力的合规计划。如果不遵守这些法律法规,可能会对我们的业务、财务状况和运营结果产生实质性的不利影响。
•如果我们无法弥补财务报告内部控制中的重大缺陷,或如果我们发现未来存在更多重大缺陷,或未能维持有效的内部控制系统,我们可能无法准确或及时地报告我们的财务状况或运营结果,这可能对我们的业务和股票价格产生不利影响。
与我们的业务相关的风险
药品的开发和商业化竞争激烈。特别是,RUCONEST®面临着来自其他用于治疗遗传性血管水肿的产品的激烈竞争。美国和欧洲已经批准了几种用于治疗HAE攻击的产品。因此,我们可能无法通过RUCONEST®获得足够的市场渗透率或产品的足够销售水平来保持盈利。
药品的开发和商业化竞争激烈。特别是,RUCONEST®面临着来自其他用于治疗遗传性血管水肿的产品的激烈竞争。我们面临的风险是,RUCONEST®可能不再具有竞争力,不再被急性血吸虫病市场中的医生、患者、付款人和医疗界的其他人接受。预防治疗正变得越来越有效,这导致HAE患者需要的急性救援药物减少。RUCONEST®未被批准用于预防性使用。
美国和欧洲已经批准了几种用于治疗HAE攻击的产品,包括人类血浆来源的C1INH产品。用于预防HAE攻击的口服产品也在开发中。奥拉德约(Berotralstat)是一种口服产品,于2020年第四季度获得批准。它是由BioCryst推动的。到目前为止,它对RUCONEST®的影响很小,主要是因为它被指定用于预防。因此,它与预防性疗法竞争,而不是与急性疗法竞争。在急性市场上,我们面临着定价竞争,因为急性治疗Firayzr(icatibant注射)开始与2019年开始进入市场的仿制药竞争。因此,我们可能无法通过RUCONEST®获得足够的市场渗透率或产品的足够销售水平以使其保持盈利。来自竞争对手的新技术可能会使RUCONEST®、我们的一个或多个候选产品或我们的技术过时。
我们的竞争对手包括大型国际制药公司以及规模较小或地区性的专业制药和生物技术公司。我们的许多竞争对手比我们规模更大,在研发、制造、临床前测试、进行临床试验、获得监管批准、起诉知识产权和营销获得批准的产品方面拥有更多的财务资源和专业知识。这些竞争对手可能会更好地抵御经济和行业状况的变化。规模较小或处于早期阶段的公司也可能是重要的竞争对手,特别是通过
与大型老牌公司的协作安排。影响我们产品和我们开发或收购的任何其他产品商业成功的关键竞争因素可能是安全性、有效性、耐受性、可靠性、剂量的便利性、价格和报销。我们未来还可能面临来自销售我们产品的仿制药替代品的公司的竞争,在这些国家,我们没有专利覆盖范围、孤儿药物状态或其他形式的数据或营销排他性,或者专利覆盖范围、数据或营销排他性已经过期、没有强制执行,或者未来可能会受到挑战。
我们严重依赖RUCONEST®在美国和欧洲的销售。如果我们不能继续将RUCONEST®商业化,我们的业务可能会受到实质性的损害。此外,我们的开发流程在短期内仍然依赖于C1INH的特许经营权。
到目前为止,我们公司一直专注于RUCONEST®的开发和商业化,我们预计在短期内将继续主要依赖RUCONEST®的销售收入。任何与RUCONEST®的性质、疗效或安全性有关的不良事件或发现,或RUCONEST®制造的实质性限制,都可能对我们的财务业绩和运营产生实质性影响。
我们是否有能力在预期的时间内或根本不满足RUCONEST®的销售预期,从此类销售中获得收入,并从运营中获得并保持正的现金流,将取决于许多因素,其中包括:
•在美国、欧盟和其他经批准的适应症治疗的关键市场中,继续保持和提高RUCONEST®在医疗保健专业人员和患者中的市场接受度;
•我们有能力在关键市场保持监管审批,不受繁琐的限制或限制;
•我们有能力及时获得更多市场的监管批准,并使用商业上可行的标签;
•我们有能力在需要的情况下,及时获得适当水平的定价和补偿批准;
•存在与使用RUCONEST®相关的副作用或其他安全问题,可能需要我们或我们的分销商修改或停止商业化;
•监管机构是否会要求我们就RUCONEST®的安全性和有效性进行额外的研究,这是我们没有计划或预期的;
•来自竞争对手的竞争加剧;
•获得并维护与美国和欧洲以外的第三方分销商的商业分销协议;
•获得并维护专利保护和监管排他性;以及
•充分投资于支持我们商业化努力的制造、销售、营销、市场准入、医疗事务和其他职能。
此外,我们的近期候选产品流水线依赖于新配方和新适应症的rhC1INH的开发。如果我们遇到不利的市场接受度、监管、定价、知识产权或制造问题,用于新制剂和新适应症的rhC1INH的开发可能会受到不利影响。
任何当前或未来候选产品的商业成功将取决于医生、患者、付款人和医学界其他人对市场的接受程度。
我们的产品和候选产品的商业成功将在一定程度上取决于医学界、患者和付款人是否接受我们的候选产品是有效、安全和具有成本效益的。尽管历史上销售RUCONEST®产生的收入水平很高,但如果RUCONEST®或我们的候选产品没有达到足够的接受度,我们可能会难以继续产生可观的产品收入,而且未来可能不会从运营中产生任何利润。如果RUCONEST®或我们的候选产品获准用于商业销售,市场接受程度将取决于许多因素,包括:
•与替代疗法相比的潜在疗效和潜在优势;
•任何副作用的频率和严重程度,包括产品批准的标签中包含的任何限制或警告;
•使用我们候选产品的调理方案或后续要求所产生的任何副作用的频率和严重程度;
•管理相对方便和容易;
•目标患者群体尝试新疗法的意愿以及医生开出这些疗法的意愿;
•市场营销和分销支持的实力以及竞争产品进入市场的时机;
•关于我们的产品或竞争产品和治疗方法的宣传;以及
•足够的第三方保险覆盖范围或报销。
即使一种候选产品在临床前研究和临床试验中表现出良好的疗效和安全性,如果该产品被批准用于商业销售,市场对该产品的接受度也要等到它推出后才能知道。我们努力让医疗界和付款人了解我们的产品和候选产品的好处,这可能需要大量的资源,而且可能永远不会成功。这种教育市场的努力可能需要比我们的竞争对手销售的传统技术所需的更多的资源。
如果我们无法保持和发展我们的销售和营销能力,特别是在美国以外的地区,或者无法与第三方达成协议,在美国和欧洲以外的地区营销和销售我们的产品,我们的业务将受到不利影响。
自2020年1月起,我们从瑞典孤儿Biovitrum AB或SOBI手中重新获得了RUCONEST®在欧洲分销的商业权。建立和保持我们自己的销售和营销能力都涉及风险。例如,招聘和培训一家商业组织既昂贵又耗时,可能会推迟任何产品的发布。如果我们招募销售队伍并建立营销能力的候选产品的商业发布因任何原因而推迟或没有发生,我们将过早或不必要地产生这些商业化费用。这可能代价高昂,如果我们不能留住或重新定位我们的销售和营销人员,我们的投资将会损失。
可能会阻碍我们将候选产品商业化的因素包括:
•无法招聘、培训和留住足够数量的有效销售和营销人员;
•销售人员无法接触到医生或说服足够数量的医生开出我们可能开发的任何未来产品的处方;
•缺乏销售人员提供的补充治疗,这可能使我们相对于拥有更广泛产品线的公司处于竞争劣势;以及
•与创建独立的销售和营销组织相关的不可预见的成本和费用。
我们与第三方达成协议,在美国和欧洲以外的地区提供销售、营销和分销服务。此外,我们已经向中国上海医药工业研究所授予了在中国将RUCONEST®商业化的独家许可证,我们完全依赖于他们在该地区将RUCONEST®商业化的努力。我们可能会获得某些与监管和制造相关的里程碑,并且我们有资格从CSIPI或国药控股的其他附属公司在中国的销售中获得低至中个位数的版税。依赖分销安排和营销联盟将我们的产品在某些司法管辖区商业化,使我们面临许多风险。我们不能完全控制这样的第三方,他们中的任何一方都可能无法投入必要的资源和注意力来有效地销售和营销我们的产品。此外,此类第三方可能会遇到与合规相关的问题和相关的政府调查。如果此类第三方协议终止或到期,产品在该司法管辖区的营销和销售可能会中断,这可能会对我们的收入产生不利影响。此外,我们可能无法成功地与第三方达成销售和营销我们的候选产品的安排,或者可能无法以对我们有利的条款这样做。请参阅标题为“-我们受制于
美国和某些外国进出口管制、制裁、禁运、反腐败法和反洗钱法律法规。遵守这些法律标准可能会削弱我们在国内市场的竞争能力。我们可能会因违规行为而面临刑事责任和其他严重后果,这可能会损害我们的业务。
我们依赖RUCONEST®在某些尚未获得批准的地区的指定患者销售;然而,不能保证我们产品的指定患者销售将继续保持目前的水平,或者根本不能保证。
RUCONEST®目前在某些尚未获得批准的国家/地区以患者的名义提供。指定患者基础是指在尚未获得营销许可的地区对患者进行医生请求的治疗。不能保证指定的患者销售将继续在任何特定的国家/地区获得授权。即使他们获得授权,我们也很可能不被允许对以指定患者为基础销售的产品进行促销、营销或其他主动销售活动,这使得指定患者的销售更难预测,并且容易受到意外下降的影响。如果发现与我们的产品相关的任何违反法律或政府法规的行为,可能会提起重大的刑事或民事诉讼,或者可能开始调查。
我们候选产品的成功商业化将在一定程度上取决于政府当局和健康保险公司建立足够的保险范围、报销水平和定价政策的程度。如果我们的候选产品未能获得或维持承保范围并获得足够的报销,如果获得批准,可能会限制我们营销这些产品的能力,并降低创收能力。
如果获得监管部门的批准,政府医疗保健计划(如联邦医疗保险和医疗补助)、私人健康保险公司和其他第三方付款人提供的保险和报销的可用性和充分性对于许多患者能够负担得起RUCONEST®等处方药和潜在的候选产品至关重要。我们能否达到政府当局、私人健康保险公司和其他组织对产品的可接受承保和报销水平,从根本上影响RUCONEST®和候选产品的潜在成功。假设我们通过第三方付款人为我们的候选产品获得保险,由此产生的报销付款率可能不够高,或者可能需要患者认为不可接受的高得令人无法接受的共同付款。我们不能确保美国、欧盟成员国或其他地方的候选产品或我们可能开发的任何产品都可以获得保险和报销,而且未来可能会减少或取消任何可能获得的报销。健康保险公司越来越倾向于通过限制新治疗产品的保险范围和报销水平,以及在某些情况下拒绝提供完全保险来降低医疗费用。
由于承保和报销是在逐个付款人的基础上确定的,从第三方付款人那里获得承保和足够的报销并不能保证我们将从另一个第三方付款人那里获得类似的承保或报销。报销可能会影响我们获得市场批准的任何候选产品的需求或价格。如果无法获得或仅限于有限级别的报销,我们可能无法成功地将我们获得市场批准的任何产品商业化。第三方付款人未能为我们的产品确保或保持足够的承保范围或报销,或延迟处理这些付款人的审批,可能会导致销售损失、客户流失或声誉损害,这可能会对我们的业务、财务状况和运营利润产生实质性的不利影响。
此外,第三方付款人可能会将我们的候选产品视为替代产品,并只提出向患者报销价格较低的产品。在某些情况下,这可能涉及到要求患者首先尝试价格较低的产品,只有在患者使用价格较低的产品效果不佳后才批准其他疗法。即使与竞争对手销售的产品和主流护理标准相比,我们的候选产品显示出更好的疗效或给药便利性,现有疗法的定价仍可能限制我们可以收取的费用。第三方付款人可能拒绝或取消任何特定产品的报销状态,或为现有市场产品设定新的价格,从而阻碍我们在候选产品上实现适当的投资回报。如果无法获得报销或仅限量报销,我们可能无法成功地将我们的候选产品商业化,也可能无法获得令人满意的财务回报。
在美国以外,国际业务通常受到广泛的政府价格控制和其他市场监管,我们相信,欧洲、加拿大和其他国家对成本控制举措的日益重视已经并将继续给我们产品的定价和使用带来压力。在许多国家,作为国家卫生系统的一部分,医疗产品的价格受到不同的价格控制机制的制约。其他国家允许公司自行为医疗产品定价,
但要监控公司的利润。额外的外国价格管制或定价法规的其他变化可能会限制我们能够向我们的候选产品收取的费用。因此,在美国以外的市场,与美国相比,我们产品的报销可能会减少,可能不足以产生商业上合理的收入和利润。
由于我们的许多候选产品处于早期开发阶段,由于可用资源有限,我们可能会放弃或推迟寻求某些计划或候选产品或后来被证明具有比我们候选产品更大商业潜力的指示。
除了成功完成关键的2/3期研究的Leniolisib外,我们的rhC1INH项目和我们的非rhC1INH候选产品都处于较早的开发阶段。我们的候选基因治疗产品和我们的下一代酶替代疗法,或称ERT,正在进行临床前开发。我们在当前和未来研发项目上的支出可能不会产生任何商业上可行的候选产品。如果我们没有准确评估特定候选产品的商业潜力,我们可能会通过战略合作、许可或其他安排放弃对该候选产品有价值的权利,而在这种情况下,保留该候选产品的独家开发权和商业化权利对我们更有利。如果发生这些事件中的任何一种,我们可能会被迫放弃针对特定候选产品的开发工作,或者无法开发出可能成功的候选产品。
通过收购和/或许可证内增加新的后期资产,例如APDS的新计划Leniolisib,Pharming希望通过寻找更多新项目来进一步缩短开发时间。已经建立了专业的计划管理结构,以便对计划进行适当的监控,并满足需求。
包括新冠肺炎在内的公共卫生疫情可能导致我们或我们的员工、承包商、供应商、分销商和其他合作伙伴以及治疗HAE患者的医生无限期地被禁止开展业务和患者护理活动,包括由于政府当局可能要求或强制实施的封锁和隔离。
我们或我们的合作者和研究赞助商的临床试验,包括计划中的RUCONEST®在接受经皮冠状动脉介入治疗并进行对比增强检查的患者中的疗效的2b阶段研究,以及我们针对晚期先兆子痫的开放式、单臂、多阶段、多中心的1/2期研究,已受到延迟的影响,目前尚不确定这些临床试验将于何时恢复,也不确定新冠肺炎将对他们产生多大程度的影响。新冠肺炎的持续传播,以及受影响国家政府,特别是美国和荷兰政府采取的措施,也扰乱了供应链。RUCONEST®生产和供应的任何进一步延误或中断都可能导致我们计划的临床试验的延误,削弱我们满足新RUCONEST®处方需求的能力,并阻碍我们的临床试验招募、测试、监测、数据收集和分析以及其他相关活动。上述任何因素都可能对我们的业务、财务状况、营业利润、现金流和前景产生重大不利影响。
我们的经营业绩可能会受到全球经济和全球金融市场普遍状况的不利影响,包括通胀和供应中断。
国内或全球金融危机可能导致资本和信贷市场的极端波动和混乱。严重或长期的经济低迷可能是由最近俄罗斯军事干预乌克兰后各国对俄罗斯实施的全球制裁等事件造成的,可能会给我们的业务带来各种风险,包括对我们候选产品的需求减弱,或者无法以可接受的条件购买必要的供应,如果有的话。疲软或衰退的经济可能会给我们的供应商带来压力,可能导致供应中断,或者导致第三方付款人或我们的合作伙伴延迟支付我们的服务。此外,东欧的冲突对全球金融市场产生了重大影响,这可能会对我们以有利条件筹集资金的能力产生不利影响。上述任何一项都可能损害我们的业务,我们无法预见当前的经济气候和金融市场状况可能对我们的业务产生不利影响的所有方式。
潜在临床试验、申请和批准的成本和时间,以及我们产品开发和商业化的潜在治疗范围涉及高度的不确定性和风险,这使得很难预测新方法的产品开发时间和成本。
新产品的开发和现有产品的适应症扩展非常昂贵,涉及高度的不确定性和风险。只有少数研究和开发项目能使新产品实现商业化。此外,开发新的疾病治疗方法,包括以新的和创新的方式开展开发工作,也带来了更多的挑战和风险。临床试验数据和结果受到监管部门不同解释的影响。组织可以认为数据足以支持研究治疗的安全性、有效性和/或批准,监管机构可能不同意,可能需要额外的数据,可能限制批准的范围,或者完全拒绝批准。这些解读在不同市场的监管机构之间也可能有所不同。在整个监管审批机构中,可能很难预测治疗疾病的新方法的产品开发时间和成本。
临床前工作或早期临床试验的成功并不确保后期或更大规模的临床试验将取得成功。临床试验的结果可能表明,我们的候选产品缺乏疗效,有有害的副作用,导致意外的不良事件或引起其他担忧,可能会显著降低监管部门批准的可能性。这可能会导致终止计划、在批准的标签上对使用和安全警告进行重大限制、在治疗范例中放置不利位置或显著降低候选产品的商业潜力。
即使我们能够成功地开发新产品或适应症,我们也可能做出战略性决定,停止开发候选产品或适应症,例如,如果我们认为商业化相对于我们正在筹备的护理标准或其他机会将是困难的。
我们未来进行的任何收购都可能使我们面临可能对我们的业务产生不利影响的风险,我们可能无法实现收购业务或技术的预期好处。
作为我们增长战略的一部分,我们可能会对互补的业务、产品或研究进行额外的收购。未来的任何收购都将涉及许多风险以及运营、财务和管理挑战,其中任何一项都可能对我们的业务、财务状况或运营结果产生不利影响:
•对被收购公司的遗留系统的支持和用户知识有限;
•与我们的财务会计制度保持统一的程序、控制和政策的问题;
•管理地理上分散的业务的困难,包括与进入我们以前没有或有限经验的外国市场有关的风险;
•与我们的预期和我们支付的价格相比,任何收购的技术、产品或业务表现不佳;
•收购后对财务业绩的短期负面影响,包括与收购相关的收益费用;
•被收购公司的关键员工、客户和战略合作伙伴的潜在损失;
•被收购公司被解聘的员工、股东或与交易有关的其他第三方的债权;
•承担或产生额外的债务或费用,或使用我们的大部分现金;
•发行股权证券以融资或作为任何稀释我们股东所有权的收购的对价;
•任何合作、战略联盟和许可安排都可能要求我们放弃对我们的技术或产品候选者有价值的权利,或者以对我们不利的条款授予许可;
•与此类交易的另一方有关的风险和不确定性,包括该方及其现有产品或候选产品的前景和监管批准;
•将管理层的注意力和公司资源从现有的业务运营中转移出来;
•标准、控制、程序和政策不一致;
•因技术进步导致的无形资产减值,或者被收购公司业绩逊于预期;
•承担或暴露于被收购企业的历史负债,包括难以识别或准确量化的未知或有或类似负债;
•我们无法从获得的技术或产品中获得足够的收入,以实现我们进行收购的目标,甚至无法抵消相关的收购和维护成本;以及
•与收购知识产权相关的风险,包括关于被收购公司知识产权的潜在纠纷。
我们不能保证我们可能进行的任何收购都会成功,或者会或将继续盈利。我们未能成功应对上述风险,可能会阻止我们在合理的时间框架内实现任何收购的预期收益,或者根本无法实现。
负面舆论和加强对转基因制造技术的监管审查,或关于对我们牲畜的道德待遇的激进主义,可能会损害公众对RUCONEST®和我们候选产品的看法,这可能会对我们产品的销售和我们为我们候选产品获得营销批准的能力产生不利影响。
公众的认知可能会受到有关我们转基因制造技术的负面公开声明的影响。我们的转基因制造技术平台涉及生产重组蛋白的动物基因工程。食品和牲畜的转基因是一个共同的争论和负面宣传的主题。此外,动物权利活动家通常开展运动,以减少或消除在药品商业化中使用动物。
有关基因改造的负面宣传,特别是我们的转基因制造技术,或关于我们的牲畜治疗的激进主义,可能会导致市场对我们产品的接受度降低,政府监管增加,公众对我们不利的看法,在测试或批准我们潜在的候选产品时可能出现监管延误,对获得批准的候选产品提出更严格的标签要求,以及对任何此类候选产品的需求减少。如果发生任何此类不良事件,RUCONEST®的商业化或我们临床试验的进一步推进可能会停止或推迟,这将对我们的业务和运营产生重大不利影响。
我们依赖第三方进行临床前研究和临床试验的重要方面,并打算在未来依赖第三方。如果这些第三方不能成功履行他们的合同义务,我们的业务可能会受到不利影响。
我们依赖第三方进行临床前研究和临床试验的重要方面。这些第三方包括合同研究组织或CRO、医疗机构、临床研究人员和合同实验室。虽然我们为我们的候选产品设计临床试验,但我们依赖这些第三方来执行试验。我们对这些第三方的研发活动的依赖将减少我们对这些活动的控制,但不会解除我们的监管或合同责任。例如,我们将继续负责确保我们的每一项临床试验都按照试验的总体调查计划和方案进行。
我们所依赖的第三方可能无法成功履行他们的合同职责或无法满足预期的最后期限,这可能会导致我们的临床前和临床研究的进行延迟。
如果CRO没有以令人满意的方式进行临床前研究和临床试验,违反他们对我们的义务或未能遵守监管要求和其他合规义务,我们候选产品的开发、监管批准和商业化可能会延迟,我们可能无法获得监管批准并将我们的候选产品商业化,或者我们的开发计划可能受到实质性和不可逆转的损害。如果我们无法依赖CRO收集的临床前和临床数据,我们可能需要重复、延长或增加我们进行的任何临床试验的规模,这可能会显著推迟商业化,并需要显著增加支出。请参阅题为“-我们受到美国和某些外国进出口管制、制裁、禁运、反腐败法和反洗钱法律法规的风险因素”。遵守
这些法律标准可能会削弱我们在国内市场的竞争能力。我们可能会因违规行为而面临刑事责任和其他严重后果,这可能会损害我们的业务。
我们在美国以外的地点为我们的某些候选产品进行临床试验。FDA可能不接受在这些地点进行的试验数据。
我们和为我们的某些候选产品进行临床试验的研究人员研究了我们在美国以外的候选产品。例如,重组人C1INH治疗新冠肺炎、急性肾损伤或急性肾损伤和先兆子痫的临床试验包括美国以外的地点。尽管美国食品和药物管理局(FDA)可能会接受在美国境外进行的临床试验的数据,但这些数据的接受取决于FDA施加的条件。例如,临床试验必须由符合道德原则的合格研究人员精心设计、进行和执行。试验人群还必须充分代表美国人口,数据必须以FDA认为具有临床意义的方式适用于美国人口和美国医疗实践。
此外,虽然这些临床试验受制于适用的当地法律,但FDA是否接受这些数据将取决于其确定试验是否也符合所有适用的美国法律和法规。如果FDA不接受我们在美国境外进行的任何试验的数据,很可能会导致需要额外的试验,这将是昂贵和耗时的,并将推迟或永久停止我们开发适用的候选产品或适应症。此外,为了在美国开始临床试验,我们需要为我们的每个候选产品寻求FDA接受研究新药申请或IND。我们不能确定我们提交给FDA的任何IND或我们在其他国家提交的任何类似的CTA都会被接受。我们还可能被要求在为我们的任何候选产品提交IND之前进行额外的临床前测试,并且任何此类测试的结果可能都不是阳性的。因此,我们可能无法成功、高效地执行和完成必要的临床试验,从而导致我们的候选产品获得新药申请、NDA、生物制品许可证申请或BLA提交和批准。我们可能比我们的竞争对手需要更多的时间和更多的成本,并且可能无法成功地获得我们开发的候选产品的监管批准。未能开始或完成或推迟我们计划的临床试验,可能会阻止或推迟我们的候选产品商业化。
我们可能无法获得或维持我们的产品或候选产品的孤立药物独家经营权。如果我们的竞争对手能够为他们的产品获得孤儿药物独家经营权,我们可能在很长一段时间内无法让竞争对手的产品获得适用的监管机构的批准。
包括美国、欧盟和英国在内的一些司法管辖区的监管当局可能会将患者人数相对较少的药物指定为孤儿药物。我们从FDA获得了治疗急性HAE发作的孤儿药物名称。Leniolisib也从FDA和EMA获得了这一称号。一般来说,如果具有孤儿药物名称的产品随后获得了其具有该名称的适应症的第一次上市批准,则该产品有权享有一段市场排他期,除某些例外情况外,这段时间内,EMA不得批准类似医药产品的另一营销申请,FDA不得批准同一药物在该时间段内的另一营销申请。FDA将“同一药物”定义为含有相同活性部分并用于相同用途的药物或生物。在欧盟和英国,孤儿药物的适用市场专营期为10年,在美国为7年。如果一种药物不再符合指定孤儿药物的标准,包括如果该药物足够有利可图,以致市场排他性不再合理,则欧洲联盟和联合王国的排他性期限可缩短至六年。
在欧洲联盟和联合王国,“类似的医药产品”是指含有一种或多种类似活性物质的医药产品,该药物与目前批准的孤儿医药产品中所含的物质类似,并且打算用于相同的治疗适应症。为我们的候选产品获得孤儿药物独家专利权对候选产品的成功非常重要。如果竞争对手在我们之前获得了与我们的候选产品具有相同适应症的产品的孤立药物独家经营权,并且如果竞争对手的产品是与我们相同的药物或类似的医药产品,我们可能会在一段时间内被排除在市场之外。
即使我们获得了孤儿药物的排他性,我们也可能无法维持它。例如,如果与我们的产品或候选产品相同或相似的竞争产品被证明在临床上优于我们的产品或候选产品,如果适用,我们获得的任何孤立药物独家专利都不会阻止该竞争产品的批准。此外,如果FDA发现我们不能保证有足够数量的药物可供使用,以满足指定药物所针对的疾病或状况患者的需求,则孤立药物排他性不会阻止与我们的产品或候选产品相同的产品获得批准。
2017年8月签署成为法律的FDA重新授权法案授权FDA对寻求孤儿药物指定和/或儿科适应症的制造商施加额外的临床试验要求。
我们的临床试验结果可能不足以支持提交我们的候选产品的上市批准。在我们将我们的候选产品提交给市场批准之前,FDA和/或EMA可能会要求我们进行额外的临床试验或评估患者的额外随访期。
我们的临床试验结果可能不足以支持提交我们的候选产品的上市批准。FDA通常需要两次注册试验才能批准一种药物或生物制品,因此FDA可能要求我们在提交BLA或NDA之前对我们的候选产品进行额外的临床试验。FDA通常不认为单个临床试验足以作为注册试验,除非该试验得到很好的控制,并证明对死亡率、不可逆转的发病率或预防具有潜在严重后果的疾病具有临床意义,而且从实践或伦理上讲,验证性研究是不可能的。此外,尽管FDA认识到自然病史模型有可能在针对非常罕见疾病的药物试验中增加对安慰剂药物的需求,在这种情况下,试验招募可能特别具有挑战性,但FDA发现,在许多情况下,使用自然病史数据作为历史比较器不适合进行充分和良好控制的试验。FDA通常认为,只有当观察到的影响与病程的可变性相比,使用历史对照的试验才是可信的。
由于我们的候选产品旨在治疗的适应症的性质,以及患有这些疾病的患者数量有限,出于伦理和其他原因,安慰剂对照和盲法研究可能是不可行的。FDA可能不会考虑我们与自然病史数据的比较,如果有的话,也不会考虑历史移植数据,以提供临床上有意义的结果。此外,即使候选产品可能已经达到注册临床试验的主要终点,FDA或EMA也可能要求我们进行额外的注册试验,可能涉及更大的样本量或不同的临床试验设计,特别是如果FDA或EMA认为这些试验的结果没有足够的说服力来支持BLA/NDA或营销授权申请或MAA提交(如果适用)。FDA或EMA还可能要求我们在接受我们的BLA/NDA或MAA提交(视情况而定)之前,对使用我们的候选产品治疗的患者进行更长的随访期。
此外,从临床前和临床活动中获得的数据可能会受到不同的解释,这可能会推迟、限制或阻止监管部门的批准。我们不能保证FDA、EMA或其他外国监管机构会发现我们注册试验中的疗效终点或我们在未来注册试验中建议的任何疗效终点是充分验证和具有临床意义的,或者我们的候选产品将在当前或未来的注册试验中达到预先指定的终点,达到一定程度的统计意义,并具有可接受的安全性。我们还可能由于许多因素而遇到监管延误或拒绝,包括涉及我们的候选产品的严重不良事件、监管政策的变化或我们候选产品开发期间的要求变化。任何此类延误都可能对我们的业务、财务状况、运营结果和前景产生实质性的不利影响。
我们希望FDA和EMA在审查任何未来提交的BLA或NDA或MAA时,将评估我们候选产品的整体安全性和有效性数据。根据这一评估,FDA或EMA可能要求我们在提交或批准目标适应症的BLA或NDA或MAA之前进行额外的临床前研究或临床试验。
如果FDA或EMA需要额外的试验,我们将在上市审批过程中招致更多的成本和延误,这可能需要我们花费比可用的资源更多的资源。此外,FDA和EMA可能对成功的
BLA/NDA和MAA,这可能会导致我们改变开发、监管和/或商业化战略。
我们对普及率以及我们的产品和候选产品的潜在市场的假设和估计可能不准确,这可能对我们的收入和现金状况产生重大不利影响。
如果实际患者比估计的要少,或者如果任何产品的批准是基于对患者群体的更狭隘的定义,我们的收入和现金状况可能会受到实质性的不利影响。我们的产品治疗的疾病的患者人数非常少,网络、数据收集和支持渠道也不像那些更流行和更有研究的疾病适应症那样建立。有有限的病人登记和其他方法来精确地确定我们在任何地区现有的和潜在的未来适应症的实际病人数量。估计一种罕见疾病的流行率是困难的,因此我们必须依赖假设、信念和来自多个来源的信息的混合,从而可能导致报告不足或过多。不能保证我们的假设和信念是正确的,也不能保证所使用的方法和收集的数据已经或将继续产生准确的估计。因此,估计全球使用RUCONEST®治疗的潜在可寻址患者总数存在不确定性。此外,我们可能开发的候选产品的潜在市场机会很难准确估计,特别是考虑到目标药物市场的本质是相对未知的。我们对这些候选产品的潜在市场机会的估计是基于几个关键假设的,例如行业知识和出版物、第三方研究报告和其他调查。如果我们的任何假设被证明是不准确的,那么RUCONEST®或我们的其他或未来候选产品的实际市场可能会小于我们对潜在市场机会的估计。如果事实果真如此,我们的产品收入可能会受到限制, 我们可能无法实现或保持盈利,这可能对我们的业务、财务状况、运营结果和前景产生实质性的不利影响。
我们依赖我们的信息技术系统,由于通过数字技术加强全球互联,我们面临着受到网络攻击、数据隐私被侵犯或缺乏治理的风险,这可能会危及与我们业务相关的敏感信息的隐私、安全、完整性或机密性,或者阻止我们访问关键信息并使我们面临责任和声誉损害,这可能对我们的业务、运营结果和财务状况产生不利影响。
我们收集和维护开展业务所需的数据和信息,我们越来越依赖信息技术系统和基础设施来运营我们的业务,包括由我们的第三方供应商或提供商运营和维护的系统基础设施。在我们的正常业务过程中,我们收集、存储和传输大量的机密信息,包括知识产权、专有业务信息和个人信息。我们必须以安全的方式这样做,以维护此类机密信息的隐私、安全、机密性和完整性。我们已经制定了物理、电子和组织措施,以保护和保护我们的系统和设施,以防止信息泄露,并依靠商业上可用的系统、软件、工具和监控来为我们的信息技术系统以及数字信息的处理、传输和存储提供安全保障。我们还将我们的信息技术基础设施的组成部分外包出去,因此,一些第三方供应商可能或可能能够访问我们的机密信息。我们的内部信息技术系统和基础设施,以及我们当前和未来的任何合作者、承包商和顾问以及我们所依赖的其他第三方的系统和基础设施,都容易受到计算机病毒、恶意软件、自然灾害、恐怖主义、战争、电信和电气故障、拒绝服务攻击、网络攻击或互联网上的网络入侵、黑客攻击、网络钓鱼和其他社会工程攻击、电子邮件附件、组织内部人员(包括员工或承包商)、丢失或被盗设备或能够访问组织内部系统的人员的破坏或未经授权访问或使用。
数字技术以前所未有的方式连接了世界。新冠肺炎的爆发突显了人们对互联网工作、社交和购物的依赖程度。与此同时,人们对访问不平等、缺乏治理、数据隐私和日益复杂的网络攻击的担忧日益加剧。
网络犯罪总体上对公司构成越来越大的威胁,尤其是对金融系统,特别是在许多员工在家工作的时候。疫情导致的全球封锁也为犯罪分子继续以网络钓鱼攻击、身份盗窃和网络欺诈为目标的客户提供了机会。
此外,违反可能需要根据各种联邦、州和外国数据保护、隐私和安全法律、法规和指南(如果适用)通知政府机构、监督机构、信用报告机构、媒体或个人。这些可能包括州违规通知法和一般数据保护法规,或GDPR。因此,数据安全漏洞或侵犯隐私导致未经授权访问、披露或修改个人信息(包括受保护的健康信息),阻止访问个人信息或严重危害个人信息的隐私、安全或机密性,可能会导致罚款、成本增加或收入损失,我们可能会招致责任,我们的竞争地位可能会受到损害,我们候选产品的进一步开发和商业化可能会被推迟。此外,联邦、州和国际法律法规,如GDPR,可能使我们面临监管机构的执法行动和调查,如果我们的信息技术安全努力失败,可能会导致监管处罚和重大法律责任。
我们所有的质量控制程序都依赖第三方。
产品投放市场有赖于一套质量控制程序。其中一些程序虽然经过验证,但非常敏感和复杂(特别是对于蛋白质平台)。在确保和保持我们合作的CMO现场的良好制造规范或GMP活动的同时,我们没有自己的GMP认证分析实验室来执行产品发布所需的质量控制程序,我们依赖第三方来完成这项任务。Pharing已经开始建立自己的认证质量控制实验室,能够执行大多数必要的分析程序。
我们重组产品制造过程中的任何污染、原材料短缺或我们的任何关键供应商未能交付必要的组件都可能导致我们的临床开发或营销计划的延误,并严重影响商业可用商品。
我们使用活的哺乳动物作为我们重组蛋白质的来源。我们的转基因生产平台承担着由于生产的牛奶受到污染、生产牲畜的疾病或设施故障而发生故障的风险。任何污染都可能对我们按计划生产、发布或管理我们的重组产品的能力造成不利影响,因此可能损害我们的运营结果并造成声誉损害。此外,尽管我们的重组产品在释放前进行了污染测试,但如果给患者注射受污染的产品,可能会对患者造成伤害。原材料短缺、污染、召回或限制我们在产品生产中使用的产品可能会对商业生产或临床材料的生产产生不利影响或中断,这可能会对我们的临床开发时间表和用于商业用途的成品的可用性产生不利影响,影响患者的准入、我们的业务、财务状况、运营结果和前景。
在我们的候选产品和产品中使用的一些部件和材料,我们依赖于有限数量的供应商。这些材料供应的任何中断都可能对我们交付产品或完成临床试验的能力产生不利影响。如果供应中断,对候选产品的其他研究、监管应用或以及时和具有商业价值的方式将候选产品商业化,可能会受到不利影响。
我们依赖于有限数量的供应商提供某些基本材料,这些材料被整合到产品和候选产品的制造中,或用于制造。许多组件供应商位于欧洲,而RUCONEST®销售的很大一部分是在美国进行的。如果国际运输中断,我们可能无法供应足够数量的RUCONEST®在美国销售。这些材料供应的任何中断都可能对我们交付产品或完成临床试验的能力造成不利影响。如果供应中断,对候选产品的其他研究、监管应用或以及时和具有商业价值的方式将候选产品商业化,可能会受到不利影响。
我们不能确定这些供应商(包括那些受新冠肺炎影响的供应商)会继续经营下去,也不能确定这些供应商不会被我们的竞争对手或其他对继续生产这些材料用于我们的预期用途不感兴趣的公司收购。我们使用有限数量的原材料供应商,
零部件和成品使我们面临几个风险,包括供应中断、价格上涨、交货延迟以及无法满足客户需求。一般来说,这些部件的替代供应来源相对较少。这些供应商可能无法或不愿意满足我们未来对临床试验或商业销售的需求。为这些部件建立额外的或替换的供应商可能需要大量的时间,而且可能很难建立符合管理要求的替换供应商。任何供应商或制造地点的任何供应中断都可能导致供应延迟或中断,这将损害我们的业务、财务状况、运营结果和前景。
如果我们被要求更换供应商,我们的产品和候选产品的制造和交付可能会中断很长一段时间,对我们的业务造成不利影响。建立额外的或替代的供应商可能不会很快完成。如果我们能够找到替代供应商,替代供应商将需要合格,并可能需要额外的监管机构批准,这可能会导致进一步的延误。例如,如果我们依赖新的供应商,FDA或EMA可能需要额外的补充数据、制造数据和可比性数据。虽然我们寻求保持我们候选产品中使用的组件和材料的充足库存,但组件或材料供应的任何中断或延迟,或者我们无法及时以可接受的价格从替代来源获得组件或材料,都可能会削弱我们进行临床试验的能力,如果我们的候选产品获得批准,可能会损害我们满足客户需求并导致他们取消订单的能力。
此外,作为FDA批准我们的候选产品的一部分,FDA必须审查和批准我们生产过程中的各个组件,其中包括我们供应商的原材料、制造工艺和设施。我们对这些供应商的依赖使我们面临一系列风险,这些风险可能损害我们的声誉、业务和财务状况,其中包括:
•因供应商业务的变更或中断而导致的供应中断;
•因缺陷、可靠性问题或供应商在部件上的变化而导致的产品发货延迟;
•与我们的供应商缺乏关键部件的长期供应安排;
•无法及时获得足够的供应,或无法以商业上合理的条件获得足够的供应;
•及时为我们的部件寻找和确定替代供应商的难度和成本;
•与评估和测试替代供应商的产品有关的生产延误,以及相应的监管资格;
•由于我们的供应商优先考虑其他客户订单而导致交货延迟;
•供应商生产的有缺陷的部件对我们的声誉造成的损害;以及
•由于我们或其其他客户的需求变化,我们的供应商的交货量出现波动。
如果这些风险中的任何一个成为现实,成本可能会大幅增加,我们进行临床试验和满足产品需求的能力可能会受到影响。
我们依赖第三方制造商生产重组人C1INH,用于RUCONEST®的商业供应和临床试验,以及我们用于临床试验的其他候选产品。供应中断可能会对销售造成实质性的不利影响。
我们已经与赛诺菲和BioConnection等公司签订了RUCONEST®的(下游)制造和供应协议。这些供应商未能满足我们的需求将很难克服,因为及时收缩额外的制造能力可能很困难或不可能,并对我们的业务产生重大不利影响。
产品投放市场有赖于一套质量控制程序。其中一些程序虽然经过验证,但非常敏感和复杂。我们没有良好的制造规范或GMP认证的分析实验室,能够执行产品发布所需的质量控制程序,我们依赖第三方来完成这项任务。
我们未来的成功取决于我们是否有能力聘用和留住关键高管,以及吸引、留住和激励合格的人员。
我们未来的成功取决于我们吸引和留住关键管理人员、科学和技术人员的能力,特别是在生物制药行业。我们继续运营和实施战略的能力取决于留住、招聘和激励员工,特别是在我们的管理团队和研究人员方面。生物制药和生物技术行业经验丰富的员工需求量很大,对他们的人才竞争可能会很激烈,特别是在荷兰,我们在那里维持着我们的主要业务。我们已经与高管和其他关键员工签订了雇佣协议,但任何员工都可以随时终止他或她的雇佣关系,或可能无法继续担任其职务。任何高管或关键员工的流失,或无法招聘合适的候选人或无法找到足够的第三方以合理和及时的条件提供此类服务,都可能对我们的业务、财务状况、运营业绩和前景产生重大不利影响。如果我们不能吸引、留住和激励必要的人员来实现我们的业务目标,我们可能会遇到限制,这些限制可能会严重阻碍我们实现发展和商业目标的能力、我们筹集额外资本的能力以及我们实施业务战略的能力。
我们的业务、产品或产品定价可能会受到负面宣传的影响,这可能会对我们的声誉、业务、财务状况、运营结果、流动性和现金流产生重大不利影响。
近年来,制药业一直是公众对药品定价的投诉和重大宣传的对象,包括由于竞争对手和同行公司对新产品收取的价格,以及竞争对手和同行公司对公众认为过高的旧产品加价而产生的宣传和压力。由于要求降低药品成本的社会或政治压力,我们可能会面临RUCONEST®和任何其他未来批准产品的价格下调压力,这可能会减少我们的收入和未来的盈利能力。尤其是孤儿药物最近因其制造商对其收取的高价而受到负面宣传,因此,像我们这样的孤儿药物开发商可能会受到这种宣传和任何美国或其他政府监管回应的负面影响。由于这些因素,我们可能会在媒体报道中受到行业协会和立法者的公开批评和负面宣传。
上述任何事件或事态发展都可能导致声誉受损和市场对我们产品的接受度和需求下降,可能损害我们未来营销产品的能力,可能导致我们产生巨额费用,可能导致我们的高级管理层分心执行我们的业务战略,并可能对我们的业务、声誉、财务状况、运营结果、流动性、现金流和/或股价产生重大不利影响。
未来有关能源消耗和废物监管的立法可能会阻碍我们业务的效率。
我们的工厂在业务运营中消耗大量电力,我们的生产过程消耗大量消耗品和液体工艺废物。虽然我们在可能的情况下积极改进工艺,以减少能源使用和材料消耗,但我们减少能源消耗的努力可能不会成功。此外,我们还处理废物,如缓冲液中的化学物质和用于清洁设备的腐蚀性物质(需要在处置前中和)、牛奶废物、含有重金属的液体。与废物法规有关的立法,或要求我们的设施减少能源消耗的立法,可能会对我们的业务产生实质性影响。
无法招聘合适的候选人或找到合适的第三方以合理条款和及时提供此类服务,可能会对我们的业务、财务状况、运营结果和前景产生重大不利影响。
生物制药和生物技术行业的经验丰富的员工需求很高,对他们的人才的竞争可能会很激烈。无法招聘合适的候选人或找到合适的第三方以合理条款和及时提供此类服务,可能会对我们的业务、财务状况、运营结果和前景产生重大不利影响。我们已经与高管和其他关键员工签订了雇佣协议,但任何员工都可以随时终止他或她的雇佣关系,或可能无法继续担任其职务。
令人遗憾的是,失去任何高管或关键员工来执行此类服务,可能会对我们的业务、财务状况、运营结果和前景产生重大不利影响。
具体地说,在销售领域,风险是如果我们的营业额很高,我们就不能再有效地营销我们的产品。员工也不确定公司内部的增长以及在不久的将来销售其他产品的机会,这可能会增加人员流失的风险。
有关知识产权的风险
我们的成功取决于我们是否有能力获得和保护专有技术的权利,以及在不侵犯第三方专有权利的情况下开发我们的技术和产品。
我们依赖并将继续依赖与员工、顾问、合作者、顾问和其他第三方签订的专利、商标和保密协议的组合,以保护与我们当前和未来的候选产品相关的知识产权。我们使用专利和许可来保护我们的产品和技术。我们还谨慎地开发不侵犯第三方专有权的产品。目前,我们在美国、欧洲和日本等国已批准和正在审批的专利申请有数项。制药公司的专利地位可能是不确定的,可能涉及复杂的法律和事实问题。
我们现在拥有并拥有许可权的专利,或我们可能拥有的或未来可能拥有或许可中的专利和专利应用程序,可能不会在我们打算将此类产品商业化的相关司法管辖区保护我们当前和未来的候选产品。不能保证我们知道与未来专利申请有关的所有潜在相关的现有技术。因此,专利审查员可能会发现现有技术可以阻止专利从未决的专利申请中颁发。在专利审查过程中,我们可能被要求缩小未决权利要求以克服现有技术,这一过程可能会限制专利保护的范围。即使基于我们未来的专利申请成功地颁发了专利,即使颁发的专利涵盖了我们当前和未来的候选产品,包括它们的组成配方、制造方法和使用方法,第三方也可能会质疑我们颁发的专利的有效性、可执行性或范围,这可能会导致此类专利被缩小、无效或无法强制执行。任何对这些专利或我们拥有或授权给我们的任何其他专利的成功反对,都可能剥夺我们当前或未来任何候选产品成功商业化所必需的权利,如果获得批准的话。此外,如果我们在监管审批方面遇到拖延,我们可以在专利保护下销售候选产品的时间段可能会缩短。
如果我们可能拥有或许可的与我们当前和未来候选产品相关的专利申请未能发布,如果它们的保护广度或强度受到威胁,或者如果它们未能为我们当前或未来的任何候选产品提供有意义的排他性,这可能会阻止其他公司与我们合作开发未来的候选产品,并威胁到我们将当前和未来候选产品商业化的能力。值得注意的是,未决的专利申请不能针对实践此类申请中所要求的技术的第三方强制执行,除非和直到专利从此类申请中颁发。任何这样的结果都可能对我们的业务产生不利影响。
此外,我们的技术和产品可能会侵犯第三方知识产权。因此,我们可能面临与此类知识产权有关的诉讼或其他法律程序。这些过程可能既耗时又昂贵。如果在专利或知识产权诉讼中做出不利裁决,我们可能对第三方承担重大责任,或被要求停止开发、制造或销售受影响的产品或技术。这些结果中的每一个都可能对我们的财务状况产生不利影响。我们还可能面临这样的索赔,其主要目的是利用公开提出的索赔的滋扰价值。例如,一家竞争对手声称,我们因雇用一名员工而侵犯了他们的知识产权。虽然这一纠纷最终得到了对我们有利的解决,但我们不能保证今后不会有类似的索赔针对我们。为了防止侵犯第三方知识产权,我们可能需要为第三方持有的专利获得许可,以重新建立或维持其运营自由,可能是以不利的条款。第三方持有的专利未能获得许可,或未能以优惠条款获得许可,可能会对我们的财务和运营状况产生重大不利影响。
生物技术和制药公司的专利地位通常高度不确定,涉及复杂的法律和事实问题,近年来一直是许多诉讼的主题。此外,外国的法律可能不会像美国的法律那样保护我们的权利。例如,欧洲专利法对人体治疗方法的专利性限制超过
美国法律是这样做的。科学文献中的发现发表往往落后于实际发现,美国和其他司法管辖区的专利申请通常在申请18个月后才发表,有时甚至根本不发表。因此,我们不能确切地知道,我们是第一个在我们拥有或许可的专利或正在申请的专利申请中提出要求的发明,还是第一个为此类发明申请专利保护。因此,我们的专利权的颁发、范围、有效性、可执行性和商业价值都具有高度的不确定性。我们未来的专利申请可能不会导致颁发专利,保护我们的技术或产品的全部或部分,或有效地阻止其他人将竞争对手的技术和产品商业化。美国和其他国家专利法或专利法解释的变化可能会降低我们专利的价值或缩小我们专利保护的范围。
专利改革立法可能会增加围绕我们专利申请的起诉以及我们已发布专利的执行或保护的不确定性和成本。2011年9月16日,《莱希-史密斯美国发明法》或《莱希-史密斯法案》签署成为法律。《莱希-史密斯法案》对美国专利法进行了多项重大修改。这些条款包括影响在美国专利商标局(USPTO)起诉和挑战专利申请的方式的条款,也可能影响专利诉讼。美国专利商标局已经制定并继续制定新的法规和程序来管理《莱希-史密斯法案》的管理,与《莱希-史密斯法案》相关的专利法的许多实质性修改,特别是第一个提交条款的修改,于2013年3月16日生效。因此,尚不清楚Leahy-Smith法案、随后的规则制定以及对Leahy-Smith法案和法规的司法解释将对我们的业务运营产生什么影响。然而,Leahy-Smith法案及其实施可能会增加围绕我们专利申请的起诉以及我们已发布专利的执行或保护的不确定性和成本,所有这些都可能对我们的业务和财务状况产生不利影响。
此外,美国和外国司法管辖区专利法的未来变化可能会对我们或我们许可人的专利权的期限、范围、有效性和可执行性产生不利影响。例如,美国国会2019年的一项法案(终止权利挪用法案的延期,或期限法案,H.R.3199)旨在缩短某些药物专利的期限,以方便仿制药进入和增加竞争。不断变化的政治优先事项可能会推动更多此类举措。我们在许可中或将来可能拥有或在许可中拥有的专利的发明权和所有权可能会受到第三方的挑战。此类挑战可能导致失去此类专利的独家权利,这可能会限制我们阻止他人使用或商业化类似或相同的技术和产品的能力,或者要求我们以商业合理的条款从这些第三方获得许可以确保独家权利。如果对发明权或所有权提出任何此类挑战,就不能保证法院会裁定我们胜诉,也不能保证,如果我们选择寻求许可,我们将以可接受的条款获得此类许可,或者根本不能。此外,我们可能受到第三方向美国专利商标局提交的现有技术的发行前提交,或参与发行前和发行后的反对、派生、重新审查、各方之间的审查(IPR)、授予后审查或干扰程序,挑战我们的专利权或其他人的专利权。任何此类提交、诉讼或诉讼中的不利裁决可能会缩小我们专利权的范围或使其无效,允许第三方将我们的技术或产品商业化并直接与我们竞争,而无需向我们付款,或者导致我们无法在不侵犯第三方专利权的情况下制造或商业化产品。
此外,如果我们的专利和专利申请所提供的保护的广度或强度受到威胁,无论是现在或将来拥有的或未授权的,它可能会阻止公司与我们合作,授权、开发或商业化当前或未来的候选产品。
专利的颁发并不是关于其发明性、范围、有效性或可执行性的决定性因素,我们的许可专利可能会在美国的法院或专利局受到挑战。此类挑战可能导致失去独占性或经营自由,或专利主张全部或部分缩小、无效或无法执行,这可能限制我们阻止他人使用类似或相同技术和产品或将其商业化的能力,或限制我们技术和产品的专利保护期限。此外,专利的寿命是有限的。在美国,一项专利的自然失效时间一般是在该专利要求优先权的最早的非临时申请提交后20年。可能会有各种延期;然而,专利的有效期及其提供的保护是有限的。我们可能被要求放弃专利期的一部分,以克服专利局的双重专利拒绝,从而可能缩短我们的专有期。没有专利保护,我们目前或
对于未来的候选产品,我们可能会接受来自此类产品的仿制版本的竞争。考虑到新产品候选产品的开发、测试和监管审查所需的时间,保护这些候选产品的专利可能会在这些候选产品商业化之前或之后不久到期。因此,我们的许可专利组合可能不会为我们提供足够的权利,以排除其他公司将与我们相似或相同的产品商业化。
我们可能会卷入保护或强制执行我们的专利、许可人的专利或我们的其他知识产权的诉讼,这可能是昂贵、耗时和不成功的。
竞争对手可能会侵犯或以其他方式侵犯我们的专利、我们许可方的专利或我们的其他知识产权。为了对抗侵权或未经授权的使用,我们可能会被要求提出法律索赔,这可能是昂贵和耗时的。此外,在侵权诉讼中,法院可以裁定所主张的专利无效或不可强制执行,或者可以以所主张的专利不涵盖所涉技术为由拒绝阻止另一方使用所涉技术。任何诉讼或辩护程序中的不利结果可能会使一项或多项主张的专利面临被无效或狭义解释的风险,并可能使相关专利申请面临无法颁发的风险。对第三方发起索赔也可能导致第三方对我们提出反索赔,例如声称我们的专利无效或不可强制执行的索赔。在美国的专利诉讼中,被告声称无效或不可执行的反诉很常见。质疑有效性的理由可能是据称未能满足几项法定要求中的任何一项,包括缺乏新颖性、明显、不能实施或缺乏法定主题。不可执行性主张的理由可能是,与专利诉讼有关的人在起诉期间向美国专利商标局隐瞒了相关重要信息,或做出了具有重大误导性的声明。第三方也可以在授予后的程序中向美国专利商标局提出类似的有效性要求,例如单方面重新审查、当事各方之间的审查或授予后的审查,或反对或美国境外的类似程序, 与诉讼并行,甚至在诉讼范围之外。在法律上断言无效和不可执行之后的结果是不可预测的。我们不能确定没有无效的先前技术,我们和专利审查员在起诉期间没有意识到这一点。对于我们未来可能许可的专利和专利申请,我们可能有有限的权利或没有权利参与任何许可专利的辩护,以抵御第三方的挑战。如果被告在无效或不可强制执行的法律主张上获胜,我们将失去至少部分,甚至全部,对我们当前或未来的候选产品的任何未来专利保护。这种专利保护的丧失可能会损害我们的业务。
我们可能无法单独或与许可人一起发现或防止盗用我们的知识产权,特别是在那些法律可能不如美国充分保护这些权利的国家。如果在诉讼中胜诉的一方不以商业上合理的条款向我们提供许可证,我们的业务可能会受到损害。任何强制执行我们知识产权的诉讼或其他程序都可能失败,即使成功,也可能导致巨额成本,并分散我们的管理层和其他员工的注意力。
即使我们认定侵权行为成立,法院也可能决定不对进一步的侵权活动授予禁制令,而只判给金钱赔偿,这可能是也可能不是足够的补救措施。此外,由于知识产权诉讼需要大量的披露,在这类诉讼期间,我们的一些机密信息可能会因披露而被泄露。还可以公开宣布听证、动议或其他临时程序或事态发展的结果。如果证券分析师或投资者认为这些结果是负面的,可能会对我们的普通股价格产生不利影响。
美国专利法或其他国家或司法管辖区专利法的变化可能会降低专利的整体价值,从而削弱我们保护产品的能力。
美国最近颁布并实施了范围广泛的专利改革立法。美国最高法院和美国联邦巡回上诉法院近年来发布了许多先例意见,缩小了在某些情况下可获得的专利保护范围,或在某些情况下削弱了专利权人的权利。除了关于我们未来获得专利的能力的不确定性增加之外,这种事件的结合也造成了关于一旦获得专利的价值的不确定性。根据美国国会、联邦法院和美国专利商标局的行动,管理专利的法律和法规可能会以不可预测的方式发生变化,从而削弱我们获得新专利或执行我们已授权或未来可能获得的专利的能力。同样,
其他国家或司法管辖区专利法律和法规的变化,或执行它们的政府机构的变化,或相关政府当局执行专利法律或法规的方式的变化,可能会削弱我们获得新专利或执行我们已授权或未来可能获得的专利的能力。根据贝赫-多尔法案,美国联邦政府保留在其财政援助下生产的发明的某些权利。联邦政府出于自身利益保留了“非排他性的、不可转让的、不可撤销的、已付清的许可证”。贝赫-多尔法案也为联邦机构提供了“游行权利”。进行权允许政府在特定情况下要求承包商或专利所有权继承人向“负责任的一个或多个申请人”授予“非排他性、部分排他性或排他性许可”。如果专利所有者拒绝这样做,政府可以自己授予许可。
我们可能会侵犯或被指控侵犯他人的知识产权,这可能会阻止或推迟产品开发和商业化努力,要求我们将资源花费在诉讼或其他解决方案上,这可能会对我们的业务产生实质性的不利影响。
我们的成功在一定程度上将取决于我们在不侵犯第三方知识产权和其他专有权利的情况下运营的能力。识别可能与我们的产品和专有技术相关的第三方专利权是困难的,因为专利搜索由于专利之间的术语差异、不完整的数据库以及评估专利权利要求的含义或保护范围的困难和不确定性而不完善。可能会有我们知道或没有意识到我们的产品侵犯了的专利。也可能有一些我们认为我们没有侵犯的专利,但我们最终可能会被发现侵犯了。此外,在某些情况下,专利申请在专利颁发之前是保密的。科学或专利文献中发现的公布往往大大晚于基础发现和专利申请的提出日期。由于专利可能需要很多年的时间才能颁发,因此可能存在我们不知道的当前未决申请,这些申请可能会导致已颁发的专利被我们的产品侵犯。例如,可能存在提供支持的未决申请,或者可以修改为支持导致我们的产品侵犯已颁发专利的索赔。
涉及我们的专利或专利申请或其他人的诉讼程序可能:
•使我们的一项或多项专利面临被宣布无效、无法强制执行或狭义解释的风险;
•对与我们的产品相关的发明的可专利性产生不利影响;
•导致金钱损害、禁令救济或以其他方式损害我们的竞争地位,包括限制营销和销售活动、增加仿制药竞争的风险、限制开发和商业化活动或要求我们获得使用相关技术的许可(这些许可可能无法按商业合理的条款获得);以及
•否则,将对与产品相关的专利提供的保护的可执行性、有效性或范围产生负面影响。
我们可能没有足够的资源为此类索赔辩护,即使在任何此类诉讼中胜诉,我们也会产生巨额成本,并分散管理层在进行这些诉讼时的时间和注意力,进一步增加我们的资源压力,这可能对我们的业务、财务状况、运营结果和前景产生重大不利影响。如果我们无法避免侵犯他人的专利权,我们可能会被要求寻求许可,为侵权行为辩护,或在法庭或其他地点挑战专利的有效性。专利诉讼既昂贵又耗时。我们可能没有足够的资源来使这些行动取得成功。
此外,如果我们没有获得许可、开发或获得非侵权技术、未能成功抗辩侵权诉讼或被侵权的专利被宣布无效,我们可能:
•遭受重大金钱损失的;
•在扩大我们的产品市场方面遇到重大延误;以及
•禁止制造或销售任何产品;在任何情况下,这都可能对我们的业务、财务状况、运营结果和前景产生重大不利影响。
我们的专利可能会受到挑战、被视为不可执行、无效或被规避,如果我们不获得或保持对产品的专利保护,我们的业务可能会受到实质性损害。
生物技术和制药公司的专利地位涉及复杂的法律和事实问题,因此,不能确定地预测其有效性和可执行性。美国专利和专利申请还可能受到干扰程序、单方面复审、知识产权和授权后审查程序、派生程序和补充审查的影响,并可能在地区法院受到挑战。在某些其他国家授予的专利可能会遭到反对或在各个国家和地区专利局提起类似的诉讼。这些诉讼程序可能导致专利的丧失或专利申请的拒绝,或者专利或专利申请的一项或多项权利要求的范围的丧失或缩小。此外,这种干扰、复审、异议、授予后复审、知识产权、派生程序、补充审查或撤销程序可能代价高昂。我们只有在我们的专有技术被有效和可强制执行的专利覆盖或作为商业秘密有效地保留的范围内,才能保护我们的专有权利不被第三方未经授权使用。我们的产品和专有权利未来的保护程度是不确定的,不能保证:
•我们将能够在部分或全部相关专利或监管排他性到期之前,或在我们没有专利保护或排他性的国家或地区,成功地开发我们的产品或将其商业化;
•我们或我们的许可人是第一个做出每一项未决专利申请和专利所涵盖的发明的人;
•我们或我们的许可人最先为这些发明提交了专利申请;
•其他公司不会独立开发类似或替代技术或复制我们的任何技术;
•我们的任何未决专利申请或我们已授权的专利申请都将导致已颁发的专利;
•我们的任何专利或我们已授权的专利将是有效的或可强制执行的;
•我们将能够以商业上合理的条款或根本不许可执行或保护我们的专利权所必需或可取的专利或待处理的专利申请;
•向我们或我们的许可人或协作者颁发的任何专利将为任何其他商业上可行的产品提供基础,将为我们提供任何竞争优势,或不会受到第三方的挑战;
•我们将能够开发更多可申请专利的专有技术;
•例如,如果FDA在未来确定孤儿药物指定请求存在重大缺陷,或者如果制造商无法保证足够数量的药物来满足罕见疾病或疾病患者的需求,我们产品在美国的孤儿药物独家营销权将得到维护。此外,如果FDA或EMA得出结论认为后一种药物更安全、更有效,或者对患者护理有重大贡献,则FDA和欧盟的EMA随后可能会批准具有相同活性部分的产品用于相同的疾病。指定孤儿药物既不会缩短药物的开发时间或监管审查时间,也不会使该药物在监管审查或批准过程中具有任何优势;或
•其他人的专利不会对我们的业务产生不利影响。
就某些专利而言,我们只享有有限的地理保护。
提交和起诉专利申请,并保护覆盖世界所有国家候选产品的专利,费用将高得令人望而却步。竞争对手可以在尚未获得专利保护的司法管辖区使用我们和我们许可方的技术来开发自己的产品,或者可能向执法能力不如美国或欧盟的地区出口侵权产品。这些产品可能与我们的候选产品竞争,而我们的知识产权可能不能有效或不足以阻止此类产品竞争。专利申请可能在一些范围不同的非美国司法管辖区发布,也可能在某些司法管辖区被拒绝,例如在中国,中国对专利性有不同的要求。
在其他司法管辖区强制执行我们的专利权的诉讼,无论成功与否,都可能导致巨额成本,并转移人们对业务其他方面的努力和注意力。它们还可能使我们的专利和专利申请面临被宣布无效、被拒绝或狭义解释的风险,并可能引发第三方对我们提出索赔。我们可能不会在任何诉讼中获胜或获得损害赔偿或其他赔偿,或者此类损害赔偿或其他补救措施可能没有商业意义。因此,我们强制执行的知识产权可能不足以获得显著的商业优势,我们保护我们知识产权的努力可能不成功或不充分,这可能会对我们成功地将我们的候选产品商业化的能力产生不利影响,这可能对
我们的业务、财务状况、经营结果和前景。此外,虽然我们打算在我们预期的重要市场保护我们的知识产权,但我们不能确保我们能够在我们可能希望营销我们的候选产品的所有司法管辖区启动或保持类似的努力。因此,我们在这些国家保护我们的知识产权的努力可能不充分,这可能会对我们在所有预期的、重要的国际市场上成功地将我们的候选药物商业化的能力产生不利影响。
一些国家还制定了强制许可法,根据这些法律,专利权人可能被迫向第三方发放许可,或者有法律限制专利对政府机构或政府承包商的可执行性。在这些国家,专利权人的追索权可能有限,这可能会大幅降低此类专利的价值。如果我们或我们的任何许可人被迫向第三方授予与我们业务相关的任何专利的许可,我们的竞争地位可能会受到不利影响。
与政府监管合规、法律问题和声誉相关的风险
药品销售和营销领域的法律、法规、道德标准和国际药品规范,以及与政府官员、医疗保健利益相关者和第三方中介机构的互动,非常复杂,需要一个强有力的合规计划。如果不遵守这些法律法规,可能会对我们的业务、财务状况和运营结果产生实质性的不利影响。
药品销售和营销领域的法律法规,以及与医疗保健专业人员和患者的互动,都是复杂的,往往涉及主观评估。我们必须在我们开展业务的每个司法管辖区遵守此类法律。这些规定可能会发生变化。随着这些标准的发展和实施,我们可能无法达到这些标准。除了不断变化的监管要求,我们未能遵守适用的监管要求还可能导致禁令、产品召回、产品扣押、从政府计划中移除、我们股价下跌、管理层分心、声誉受损、失去利益相关者信任、失去员工敬业度、招聘困难、罚款和刑事起诉。
我们必须遵守各种法律和法规,包括监管、健康和安全、许可证要求、税收和公司治理法规。我们可能被要求为不遵守我们所受的当地、地区、国家、美国和欧盟当局的法律和法规而支付罚款。适用法律法规或其解释或执行的重大变化可能迫使我们改变我们的业务战略或运营,导致额外成本或收入减少,这可能对我们的业务产生不利影响。
我们与政府官员、医疗保健利益相关者(包括医疗保健专业人员、患者、患者组织和付款人)以及第三方中介机构(包括分销商、批发商和联合促销合作伙伴)进行互动。这些相互作用产生了与价值转移有关的潜在腐败风险。
我们受到美国和某些外国进出口管制、制裁、禁运、反腐败法和反洗钱法律法规的约束。不遵守这些法律标准可能会削弱我们在国内市场的竞争能力。我们可能会因违规行为面临刑事责任和其他严重后果,这可能会损害我们的业务。
我们受制于出口管制和进口法律法规,包括美国出口管理条例、美国海关条例、反垄断和竞争法、由美国财政部外国资产管制办公室实施的各种经济和贸易制裁条例、1977年修订的美国《反海外腐败法》(FCPA)、美国《美国法典》第18编第201节所载的美国国内贿赂法规、美国旅行法、美国爱国者法、荷兰刑法(Wetboek Van Strafrecht)下的某些禁令、荷兰经济犯罪法(Wet Op Economische Delicten)下的某些禁令,英国《反贿赂法》和其他州和国家的反贿赂和反洗钱法律,适用于我们开展活动的国家或与我们的活动相关的国家。反腐败法的解释很宽泛,禁止公司及其雇员、代理人、承包商和其他合作伙伴授权、承诺、提供或直接或间接向公共或私营部门的接受者支付或提供任何其他有价值的东西(与接受者的作为或不作为(将要或已经)有关)。我们可能与政府机构或政府附属医院、大学和其他组织的官员和员工有直接或间接的互动。我们可以被要求对
对于我们的员工、代理人、承包商和其他合作伙伴的腐败或其他非法活动,即使我们没有明确授权或实际了解此类活动,我们也可能参与与第三方的合作或关系,这些第三方的行为可能会使我们根据《反海外腐败法》、《反贿赂法》或当地反腐败法承担责任。我们还须遵守管理我们国际业务的其他法律和法规,包括由美国政府和欧盟当局管理的法规,包括适用的出口管制法规、对某些国家和人员的经济制裁和禁运、反洗钱法、进口和海关要求以及货币兑换法规,统称为贸易管制法。
任何违反上述法律和条例的行为都可能导致重大的民事和刑事罚款和处罚、监禁、返还、丧失进出口特权、取消资格、重新评估税款、违反合同和欺诈诉讼、名誉损害和其他后果。
如果我们未能遵守英国、欧盟或美国的隐私和数据安全法律法规,我们可能会受到民事和刑事处罚以及其他责任。
我们还受到有关数据隐私以及与健康相关的个人信息和其他个人信息保护的法律和法规的约束。隐私和数据保护的立法和监管格局继续发展,人们越来越关注可能影响我们业务的隐私和数据保护问题,包括我们运营的许多司法管辖区最近颁布的法律。欧盟个人健康数据的收集和使用受《一般数据保护条例》(EU)2016/679(GDPR)的规定管辖。该指令范围广泛,包括适用于位于欧盟以外的某些实体的治外法权规定,对个人数据涉及的个人的同意、向个人提供的信息、向主管国家数据保护机构通知数据处理义务以及个人数据的安全和保密提出了若干要求,并对违反数据保护规则的行为处以巨额罚款。GDPR还对将个人数据从欧盟转移到其他国家(包括美国)实施了严格的规则。不遵守GDPR的要求以及欧盟成员国和英国的相关国家数据保护法可能会导致巨额罚款和其他行政处罚:不遵守可能导致高达上一财年全球年营业额4%或2000万欧元的罚款, 违规行为被分成不同的级别,从而触发不同的最高罚款水平。在这种情况下,营业额不仅可以包括违约实体,还可以包括其他集团实体。最近针对跨国公司的执法行动导致了巨额罚款。随着英国于2020年1月31日正式脱离欧盟,英国进入了过渡期至2020年12月31日,在此期间,GDPR将与英国2018年数据保护法(DPA 2018)一起继续适用于英国。在过渡期结束时,联合王国与欧洲联盟在数据保护方面的未来关系存在不确定性。一旦英国脱离欧盟,过渡期届满,英国将成为数据保护法意义上的“第三国”。“第三国”是指除欧盟成员国和另外三个欧洲经济区国家(挪威、冰岛和列支敦士登)已通过实施GDPR的国内法的国家以外的国家。根据GDPR,个人数据只能在符合跨境数据转移的特定条件下转移到第三国。需要采取适当的保障措施,以便能够从欧洲联盟和欧洲经济区成员国转移个人数据。这一地位具有许多重大的实际后果,特别是对国际数据传输、主管监督当局和《全球发展报告》的执行。在联合王国,《2018年DPA》是对《GDPR》的补充,特别是规定了与“特殊类别的个人数据”处理有关的具体要求,包括与健康有关的个人数据, 与刑事犯罪或定罪有关的基因信息和个人数据。
根据GDPR的规定,我们被认为是数据处理的控制者,并受几项法律义务的约束。特别是,我们有义务重视收集和处理特殊类别的个人数据,就我们而言,这些数据是揭示基因数据或与健康有关的数据的数据。虽然我们已采取步骤遵守《GDPR》和《2018年DPA》,但我们不能向您保证,我们为实现并继续遵守《公约》所做的努力已经或将继续取得完全成功。GDPR法规和2018年DPA可能会对我们处理的个人数据施加额外的责任和责任,我们可能需要建立额外的机制,以确保遵守这些或新的数据保护规则。这可能是繁重的,并对我们的业务、财务状况、运营结果和前景产生不利影响。
此外,我们从大多数医疗保健提供者那里获取患者的健康信息,这些提供者规定了我们的产品和与我们合作的研究机构,他们受到1996年《健康保险可携带性和责任法案》(HIPAA)或美国HIPAA的隐私和安全要求的约束。尽管除提供某些员工福利外,我们不直接受到HIPAA的约束,但如果我们故意获取或披露由HIPAA覆盖的实体以未经HIPAA授权或允许的方式维护的个人身份健康信息,我们可能会受到刑事处罚。还有关于患者健康信息的州法律,如加州《医疗信息保密法》,我们更直接地受到它的约束。随着越来越多的州考虑实施这样的法律,我们可能会面临数据隐私监管的不断扩大的拼凑。
不遵守涉及数据隐私以及保护健康相关和其他个人信息的医疗法律和法律法规可能会导致政府执法行动,这可能包括民事或刑事处罚、私人诉讼和负面宣传,并可能对我们的业务、财务状况、运营结果和前景产生负面影响。
我们目前和未来与医疗保健专业人员、客户和第三方付款人的关系受到适用的反回扣、欺诈和滥用、隐私和安全、透明度和其他医疗保健法律和法规的约束,这可能使我们面临重大处罚,包括刑事制裁、民事处罚、合同损害、声誉损害以及利润和未来收入的减少。
在我们开展业务的司法管辖区内,我们必须遵守额外的医疗保健法律和法规要求,以及美国联邦政府、各州和外国政府的强制执行。第三方付款人在RUCONEST®处方的审批过程中扮演主要角色,并将对我们获得市场批准的任何候选产品执行此操作。我们目前和未来与第三方付款人、医疗从业者和患者的安排可能会使我们面临广泛适用的欺诈和滥用以及其他医疗法律和法规,这些法律和法规可能会限制我们用于研究以及营销、销售和分销我们获得营销批准的任何产品的业务或财务安排和关系。适用的联邦和州医疗保健法律法规的限制包括:
•除其他事项外,联邦反回扣法规禁止任何人故意或故意以现金或实物形式直接或间接地索取、提供、接受或支付报酬,以诱导或奖励个人推荐或购买、订购或推荐任何商品或服务,而这些商品或服务可根据联邦医疗保险和医疗补助等联邦医疗保健计划支付;个人或实体不需要实际了解该法规或具体意图即可违反该法规;
•联邦虚假申报法,包括《民事虚假申报法》,对故意或导致向联邦政府提交虚假或欺诈性付款索赔或作出虚假陈述以避免、减少或隐瞒向联邦政府支付金钱义务的个人或实体施加刑事和民事处罚,包括民事举报人或准诉讼;此外,政府可以断言,就《虚假申报法》而言,包括因违反联邦反回扣法规而产生的项目和服务的索赔构成虚假或欺诈性索赔;
•除其他事项外,HIPAA对以下行为施加刑事和民事责任:执行欺诈任何医疗福利计划的计划,或故意和故意伪造、隐瞒或掩盖重大事实,或就医疗福利、项目或服务的交付或付款做出任何重大虚假陈述;类似于联邦反回扣法规,个人或实体不需要实际了解法规或违反法规的具体意图即可实施违规;
•联邦医生支付透明度要求,有时被称为患者保护和平价医疗法案下的“阳光法案”,经2010年的“医疗保健和教育协调法案”(统称为“ACA”)修订,要求某些根据联邦医疗保险、医疗补助或儿童健康保险计划可报销的药品、设备、生物制品和医疗用品的制造商向联邦医疗保险和医疗补助服务中心(CMS)报告与此类法律定义的向医生支付和其他价值转移有关的信息,以及教学医院,以及医生及其直系亲属在此类制造商中的所有权和投资利益。从2022年开始,适用的制造商也将被要求报告有关其与医生助理、护士从业者、
前一年临床护士专科医生、注册麻醉师和注册助产士;
•经《健康信息技术促进经济和临床健康法》及其实施条例修订的《健康信息技术促进经济和临床健康法》,该法还规定,在保护个人可识别的健康信息的隐私、安全和传输方面,某些涉及使用或披露个人可识别的健康信息的服务,包括强制性合同条款,对某些受覆盖的实体医疗保健提供者、健康计划和医疗信息交换所及其业务伙伴及其分包商施加了义务;
•ACA、类似的州和外国法律法规,如州反回扣和虚假索赔法,可能适用于销售或营销安排以及涉及由非政府第三方付款人(包括私营保险公司)报销的医疗项目或服务的索赔;
•一些州法律要求制药公司遵守制药业的自愿合规指南和联邦政府颁布的相关合规指南,并可能要求制药商报告与向医生和其他医疗保健提供者或营销支出支付和其他价值转移有关的信息;
•要求药品销售代表注册的州和地方法律;
•在某些情况下,国家法律和外国法律还管理健康信息的隐私和安全,其中许多法律在很大程度上彼此不同,而且往往没有被HIPAA抢先一步,从而使遵守工作复杂化;以及
•《反海外腐败法》禁止任何美国个人或企业直接或间接向任何外国官员、政党或候选人支付、提供或授权支付或提供任何有价值的东西,目的是影响外国实体的任何行为或决定,以帮助该个人或企业获得或保留业务。
确保我们与第三方的业务安排符合适用的医疗法律和法规的努力可能会涉及巨额成本。政府当局可能会得出结论,我们的业务实践可能不符合当前或未来涉及适用欺诈和滥用或其他医疗保健法律和法规的现行或未来法规、法规或判例法。如果我们的运营被发现违反了这些法律或任何其他可能适用的政府法规,我们可能会面临重大的民事、刑事和行政处罚、损害赔偿、罚款、返还、监禁、被排除在政府资助的医疗保健计划之外,如联邦医疗保险和医疗补助、诚信监督和报告义务、合同损害、声誉损害、利润减少和未来收益,以及我们业务的削减或重组,任何这些都可能对我们的业务运营能力和我们的运营结果产生不利影响。如果我们预期与之开展业务的任何医生或其他医疗保健提供者或实体被发现不符合适用法律,他们可能会受到重大的刑事、民事或行政制裁,包括被排除在政府资助的医疗保健计划之外。
如果我们未能履行医疗补助药品回扣计划或我们参与的其他政府定价计划下的报告和付款义务,我们可能会受到额外的报销要求、处罚、制裁和罚款,这可能会对我们的业务、财务状况、运营结果和增长前景产生实质性的不利影响。
我们对医疗补助药品回扣计划负有一定的价格报告义务。根据医疗补助药品退税计划,我们必须为RUCONEST®向每个州的医疗补助计划支付退税,并预计对任何新批准的产品也是如此。这些回扣是基于我们必须每月和每季度向CMS报告的定价数据,CMS是管理医疗补助药品回扣计划的联邦机构。这些数据包括平均制造价格(AMP)和最优价格(BP),后者通常代表制造商在任何定价结构中可提供给美国任何实体的最低价格,计算结果包括所有销售和相关的返点、折扣和其他价格优惠。2020年6月17日,CMS发布了一项拟议的规则,其中将改变AMP和BP的计算和报告方法,以鼓励制造商和州政府达成基于价值的采购安排。虽然公众意见期已经结束,但我们不能保证拟议的规则将被采纳或采用公布的形式。我们对与我们提交的定价数据相关的错误以及对政府付款人的任何多收费用负责。例如,未能及时提交月度/季度AMP和BP数据可能会导致超过截止日期提交的每一天的民事罚款。未能进行必要的披露和/或识别多付款项可能导致根据《联邦虚假申报法》和其他法律法规对我们提出指控。任何要求退还给美国政府或回应政府调查或执法行动的退款
将是昂贵和耗时的,并可能对我们的业务、运营结果和财务状况产生实质性的不利影响。
联邦法律要求参加医疗补助药品回扣计划的任何公司也参加340B计划,以便联邦资金可用于医疗补助和联邦医疗保险B部分下制造商的药物。340B计划要求参与计划的制造商同意向法定定义的承保实体收取不超过制造商承保门诊药物的340B“最高价格”的费用。这些340B涵盖的实体包括从公共卫生服务获得卫生服务赠款的各种社区卫生诊所和其他实体,以及为低收入患者提供不成比例服务的医院。ACA扩大了覆盖实体的名单,包括某些独立的癌症医院、关键通道医院、农村转诊中心和唯一的社区医院,但免除了这些覆盖实体的“孤儿药物”的最高价格要求。340B上限价格是根据医疗补助药品回扣计划下计算的涵盖门诊药物的AMP和回扣金额使用法定公式计算得出的,一般来说,受医疗补助价格报告和回扣责任约束的产品也受340B上限价格计算和折扣要求的约束。根据ACA或其他法律或法规,未来对AMP的定义和Medicaid退税金额的任何额外更改都可能影响我们的340B最高价格计算,并对我们的结果产生负面影响。此外,可能会提出立法,如果获得通过,将进一步将340B计划扩大到更多的覆盖实体,或者将要求参与的制造商同意为住院环境中使用的药物提供340B的折扣定价。
RUCONEST®已获得美国食品和药物管理局、欧洲药品管理局和某些其他监管机构的批准,用于治疗HAE攻击。监管部门的批准仅限于已经批准的特定适应症,除非我们寻求监管部门对其他适应症的批准,否则我们将被禁止销售RUCONEST®用于其他适应症。如果我们被确定已经或正在推广RUCONEST®用于未经批准或“标签外”的用途,从而损害我们的声誉和业务,我们可能会受到巨额罚款、处罚或禁令。
RUCONEST®已获得美国食品和药物管理局、欧洲药品管理局和某些其他监管机构的批准,用于治疗HAE发作,但目前尚未被批准用于其他适应症的治疗。监管部门严格监管关于处方药的促销声明,RUCONEST®不得用于未经批准的用途,这反映在其批准的标签中。如果我们无法获得监管部门对我们的产品和候选产品的任何预期未来适应症的批准,我们有效营销和销售产品的能力可能会降低,我们的业务可能会受到不利影响。
虽然医生可以根据其独立的医学判断,为产品标签中未描述的用途以及与临床试验中测试并经监管机构批准的用途不同的用途开出处方,但我们被禁止营销和推广未经监管机构特别批准的适应症的产品。这些“标签外”的使用在医学专科中很常见,在不同的情况下可能构成对一些患者的适当治疗。美国和其他司法管辖区的监管机构通常不会限制或规范医生在医疗实践中选择治疗的行为。然而,监管机构确实限制生物技术或制药公司在标签外使用的通信。如果FDA或其他监管机构确定我们的促销活动构成了对标签外使用的促销,它可以要求我们修改我们的促销材料,并使我们受到监管或执法行动以及其他机构的行动,包括发布警告信或无标题信、暂停或从市场上撤回经批准的产品、强制性或自愿召回,并可能导致重大的刑事、民事和行政处罚,如民事罚款、返还资金、监禁、被排除在联邦医疗保健计划(如Medicare和Medicaid)之外、操作限制、如果我们受到公司诚信协议或类似协议、禁令或刑事起诉的约束,任何一项都可能严重损害我们的业务,则需要额外的报告要求和/或监督。
当前和未来的医疗立法改革措施可能会对我们的业务和运营结果产生实质性的不利影响。
在美国和一些外国司法管辖区,已经并可能继续进行一些立法和监管改革以及拟议的改革,旨在扩大获得医疗保健的机会,改善
提高医疗质量,控制或降低医疗成本。例如,2010年3月,ACA获得通过,它极大地改变了政府和私营保险公司为医疗保健融资的方式,并对美国制药业产生了重大影响。除其他事项外,ACA使生物制品受到较低成本生物仿制药的潜在竞争,扩大了符合340亿药品折扣计划的实体类型,解决了一种新的方法,即针对吸入、输液、滴注、植入或注射的药物,计算制造商在医疗补助药物折扣计划下的回扣,增加制造商在医疗补助药物回扣计划下的回扣,并将回扣计划扩大到登记在医疗补助管理的护理组织中的个人,对某些品牌处方药的制造商设定年费和税收,并创建新的联邦医疗保险D部分覆盖缺口折扣计划。其中,制造商必须同意在承保间隔期内向符合条件的受益人提供50%的销售点折扣(根据2018年两党预算法增加到70%,自2019年1月起生效),作为制造商的门诊药物纳入联邦医疗保险D部分保险的条件。
自颁布以来,对ACA的某些方面提出了许多司法、行政、行政和立法方面的挑战,我们预计未来还会对ACA提出更多的挑战和修正案。ACA的各个部分目前正在美国最高法院受到法律和宪法方面的挑战,国会议员提出了几项旨在大幅修订或废除ACA的立法。美国最高法院目前正在审查对ACA合宪性的法律挑战。目前尚不清楚美国最高法院将在何时或如何做出裁决。2021年2月10日,拜登政府撤回了联邦政府对推翻ACA的支持。尽管最高法院尚未就ACA的合宪性做出裁决,但在2021年1月28日,拜登总统发布了一项行政命令,启动了一项特别投保期,目的是通过ACA市场获得医疗保险,从2021年2月15日开始,一直开放到2021年8月15日。ACA的实施正在进行中,该法律似乎可能会继续对药品定价施加下行压力,特别是在医疗保险计划下,还可能增加我们的监管负担和运营成本。与ACA相关的诉讼和立法可能会继续,结果不可预测和不确定。
此外,自ACA颁布以来,美国还提出并通过了其他立法修改。例如,2011年8月,《2011年预算控制法案》等制定了国会削减开支的措施。具体地说,负责建议2013年至2021年期间至少削减1.2万亿美元赤字的赤字削减联合委员会无法达到所需目标,从而触发立法自动削减到几个政府计划。这包括从2013年4月开始实施的每财年向提供者支付的联邦医疗保险总额减少高达2%,由于随后的立法修订,除非采取额外的国会行动,否则将一直有效到2030年。然而,新冠肺炎的救济立法暂停了从2020年5月1日到2021年12月31日的2%的联邦医疗保险自动减支。2013年1月2日,《2012年美国纳税人救济法》签署成为法律,其中包括进一步减少了向包括医院、成像中心和癌症治疗中心在内的几家医疗服务提供者支付的医疗保险,并将政府追回向医疗服务提供者多付款项的诉讼时效从三年延长到五年。BBA还修订了ACA,自2019年1月1日起生效,提高了参加Medicare Part D的制药商所欠的销售点折扣,并缩小了大多数Medicare药物计划的覆盖缺口,通常被称为“甜甜圈洞”。
此外,政府对制造商为其销售的产品定价的方式进行了更严格的审查,这导致了几次国会调查和拟议的立法,这些立法旨在提高产品定价的透明度,审查定价与制造商患者援助计划之间的关系,并改革药品和生物制品的政府计划报销方法。在联邦一级,上届政府使用了几种手段来提出或实施药品定价改革,包括通过联邦预算提案、行政命令和政策倡议。例如,在2020年7月24日和2020年9月13日,前特朗普政府宣布了几项与处方药定价有关的行政命令,试图实施政府的几项提议。因此,FDA于2020年9月24日发布了最终规则,自2020年11月30日起生效,为各州制定和提交从加拿大进口药品的计划提供指导。此外,2020年11月20日,美国卫生与公众服务部(HHS)敲定了一项规定,取消了从制药商到联邦医疗保险D部分下的计划赞助商的降价安全港保护,直接或通过药房福利经理,除非法律要求降价。拜登政府已将该规则的实施从2022年1月1日推迟到2023年1月1日,以回应正在进行的诉讼。该规则还创建了一个
反映在销售点的降价的新避风港,以及药房福利经理和制造商之间某些固定费用安排的新避风港,这些安排的实施也被推迟到2023年1月1日。2020年11月20日,CMS发布了一项临时最终规则,实施最惠国模式,根据该模式,某些医生管理的药物和生物制品的联邦医疗保险B部分付款将根据人均国内生产总值类似的经济合作与发展组织国家的药品制造商收到的最低价格计算。最惠国示范条例要求确定的B部分提供者参与,并将适用于美国所有州和地区,期限为七年,从2021年1月1日起至2027年12月31日结束。然而,2020年12月28日,加利福尼亚州北部的美国地区法院发布了一项全国性的初步禁令,禁止执行临时最终规则。2021年1月13日,在美国马里兰州地区行业团体提起的另一起诉讼中,政府被告提出联合动议,要求搁置诉讼,条件是政府不会对美国加州北区地区法院授予的初步禁令提出上诉,并且最惠国临时最终规则所产生的任何最终规则的执行不得早于该规则在联邦登记册上公布后60天开始。此外,加拿大当局已经通过了旨在保护加拿大药品供应免受短缺的规定。如果实施的话, 从加拿大进口药品和最惠国模式可能会对我们的任何候选产品的价格产生重大和不利的影响。目前尚不清楚拜登政府是否会努力逆转这些措施,还是会采取类似的政策举措。此外,2021年7月9日,拜登总统发布了一项行政命令,指示FDA除其他外,继续澄清和改进仿制药的审批框架,并确定和解决任何阻碍仿制药竞争的努力。美国的个别州也越来越积极地通过立法和实施旨在控制药品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入的限制、营销成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家进口和批量购买。此外,地区医疗当局和个别医院越来越多地使用招标程序,以确定哪些药品和供应商将被纳入其处方药和其他医疗保健计划。很难预测医疗保健领域未来的立法格局及其对我们的业务、运营结果、财务状况和前景的影响。然而,我们预计未来将采取更多的州和联邦医疗改革措施,特别是考虑到新的总统政府。此外,政府有可能采取更多行动来应对新冠肺炎疫情。
在州一级,各州越来越积极地通过立法和实施旨在控制药品和生物制品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入的限制和营销成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家进口和批量购买。此外,区域卫生保健当局和个别医院越来越多地使用招标程序来确定哪些药品和哪些供应商将被纳入其处方药和其他保健方案。这些措施一旦获得批准,可能会降低对我们产品的最终需求,或者给我们的产品定价带来压力。
我们预计未来将采取更多的州和联邦医疗改革措施,其中任何一项都可能限制联邦和州政府为医疗产品和服务支付的金额,这可能会导致我们的合作伙伴对我们的服务或我们当前或未来的候选药物的需求减少。我们无法预测美国未来立法或行政行动可能产生的政府监管的可能性、性质或程度。如果我们或我们可能接触的任何第三方缓慢或无法适应现有要求的变化或采用新的要求或政策,或者如果我们或该等第三方无法保持监管合规性,我们的候选药物可能会失去可能已获得的任何监管批准,我们可能无法实现或维持盈利。
我们的产品和未来的候选产品可能会受到不利的定价法规、第三方报销做法或医疗改革举措的影响,这将损害我们的业务。
我们成功地将RUCONEST®或任何其他候选产品商业化的能力还将部分取决于政府卫生行政当局、私人健康保险公司和其他组织为这些产品和相关治疗提供保险和足够补偿的程度。政府当局和其他第三方付款人,如私人健康保险公司和健康维护组织,决定他们将支付哪些药物并建立报销水平。美国和欧盟医疗保健行业以及其他地方的一个主要趋势是控制成本。政府当局和其他第三方付款人试图通过限制保险范围和报销金额来控制成本
一些特殊的药物。越来越多的第三方付款人要求制药公司在标价的基础上向他们提供预定的折扣,并对医疗产品的定价提出挑战。我们不能确定RUCONEST®或我们商业化的任何其他产品是否继续提供保险和报销,如果有保险和报销,也不确定报销水平。报销可能会影响我们获得市场批准的任何候选产品的需求或价格。此外,第三方付款人可能会对价格更高的药品提出严格的报销要求,而任何竞争产品的推出都可能对最初收取的价格造成下行压力。如果无法获得报销或仅在有限程度上获得报销,我们可能无法成功地将我们获得营销批准的任何候选产品商业化。
在获得新批准的药物的承保和补偿方面可能会有很大的延误,并且承保范围可能比适用的监管当局批准该药物的目的更有限。此外,有资格获得保险和报销并不意味着在所有情况下都将支付任何药物的费用,或支付我们的成本,包括研究、开发、知识产权、制造、销售和分销费用。如果适用,新药的临时报销水平也可能不足以支付我们的成本,并且可能不会成为永久性的。报销率可能会根据药物的使用和临床环境的不同而有所不同,可能基于已经为较低成本药物设定的报销水平,并可能纳入其他服务的现有付款中。药品的净价可能会通过政府医疗保健计划或私人付款人要求的强制性折扣或回扣,以及未来任何限制从可能以低于美国价格销售的国家进口药品的法律的放松来降低。在美国,第三方付款人在设置自己的报销政策时通常依赖于联邦医疗保险覆盖政策和支付限制。在欧盟,参考定价制度和其他措施可能会导致成本控制和价格下降。我们无法迅速从政府资助和私人支付人那里为我们开发的任何经批准的产品获得保险和足够的报销率,这可能会对我们的运营利润、我们筹集开发候选产品和将产品商业化所需的资金的能力以及我们的整体财务状况产生实质性的不利影响。
我们面临着我们的员工和独立承包商,包括首席调查人员、顾问、任何未来的商业合作者、服务提供商和其他供应商可能从事不当行为或其他非法活动的风险。
我们的员工和独立承包商,包括主要调查人员、顾问、商业合作者、服务提供商和其他供应商,也可能从事不当行为或其他不当活动,包括不遵守监管标准和要求,这可能会对我们的运营结果产生不利影响。我们面临着我们的员工和独立承包商,包括首席调查人员、顾问、任何未来的商业合作者、服务提供商和其他供应商可能从事不当行为或其他非法活动的风险。这些当事人的不当行为可能包括故意、鲁莽和/或疏忽的行为或违反FDA和其他类似监管机构法律法规的其他未经授权的活动,包括要求向此类监管机构报告真实、完整和准确信息的法律;制造标准;美国联邦和州医疗保健欺诈和滥用法律、数据隐私和安全法律以及其他类似的非美国法律;或要求真实、完整和准确报告财务信息或数据的法律。特别是,医疗保健行业的销售、营销和商业安排受到旨在防止欺诈、不当行为、回扣、自我交易和其他滥用行为的广泛法律法规的约束。这些法律法规限制或禁止广泛的定价、折扣、营销和促销、销售佣金、客户激励计划等业务安排。此类不当行为还可能涉及对个别可识别信息的不当使用或错误陈述,包括但不限于在临床试验过程中获得的信息,在我们的临床前研究或临床试验中创造欺诈性数据,或非法挪用产品。, 这可能会导致监管制裁,并对我们的声誉造成严重损害。并非总是能够识别和阻止员工和其他第三方的不当行为,我们为发现和防止此类活动而采取的预防措施可能无法有效控制未知或未管理的风险或损失,或保护我们免受因不遵守此类法律或法规而引起的政府调查或其他行动或诉讼。此外,我们还面临这样一种风险,即一个人或一个政府可能会指控这种欺诈或其他不当行为,即使没有发生。如果对我们提起任何此类诉讼,而我们未能成功地为自己辩护或维护我们的权利,这些行动可能会对我们的业务和财务结果产生重大影响,包括但不限于施加重大的民事、刑事和行政处罚、损害赔偿、罚款、返还、可能被排除在参与Medicare、Medicaid和其他美国联邦医疗保健计划或其他医疗保健计划之外
在司法管辖区,诚信监督和报告义务,以解决违规、监禁、其他制裁、合同损害、声誉损害、利润减少和未来收益减少以及我们的业务缩减的指控,任何这些都可能对我们的业务运营能力和我们的运营结果产生不利影响。
作为“外国私人发行人”,我们不受美国证券法和“纳斯达克”规则的约束,而且我们被允许向美国证券交易委员会提交的信息比美国公司少。此外,我们被允许并预计将遵循某些母国的公司治理实践,以取代适用于国内发行人的某些纳斯达克要求。这可能会降低我们的美国存托凭证和普通股对投资者的吸引力。
我们是美国证券交易委员会规则和法规中定义的“外国私人发行人”,因此,我们不受适用于在美国境内组织的公司的所有披露要求的约束。例如,我们不受《交易法》下某些规则的约束,这些规则规范了与征集适用于根据《交易法》注册的证券的委托书、同意或授权有关的披露义务和程序要求。此外,我们的高级管理人员和董事在购买和销售我们的证券时,不受《交易法》第16条和相关规则的报告和“短期”利润回收条款的约束。此外,我们不需要像美国上市公司那样频繁或及时地向美国证券交易委员会提交定期报告和财务报表。因此,与美国上市公司相比,关于我们公司的公开信息可能更少。
作为在阿姆斯特丹泛欧交易所交易的外国私人发行人,我们被允许遵循某些母国的公司治理实践,而不是某些纳斯达克的要求。普通股持有人的权利,以及美国存托凭证持有人的某些权利,均受荷兰法律(包括《荷兰企业管治守则》的规定)及我们的组织章程所管限,这些条文所提供的保障可能不及适用于国内发行人的“纳斯达克”规则给予投资者的保障。
特别是,我们在以下方面遵循荷兰法律,而不是纳斯达克实践:
•我们不遵守纳斯达克第5620(C)条关于适用于股东大会的法定人数要求,只要我们不是国内发行人,并且没有其他强制性义务这样做的话。根据荷兰法律,这种法定人数要求并不是必需的。根据普遍接受的商业惯例,我们的组织章程规定了适用于股东大会的替代法定人数要求。
•我们不遵循纳斯达克规则5605(B)(2),该规则要求独立董事定期在只有独立董事出席的执行会议上开会。独立董事可酌情选择在执行会议上开会。
尽管我们可能依赖某些母国的公司治理实践,但我们必须遵守纳斯达克规则5625(违规通知)和规则5640(投票权)。此外,我们必须有一个符合第5605(C)(3)条的审计委员会,该条规定了审计委员会的职责和权力,并由符合第5605(C)(2)(A)(2)(2)(2)(2)(2)条的独立性要求的委员会成员组成。
我们打算采取一切必要行动,根据萨班斯-奥克斯利法案、美国证券交易委员会采用的规则以及纳斯达克的公司治理规则和上市标准的适用公司治理要求,保持作为外国私人发行人的合规。
辉瑞受到荷兰金融市场管理局(AFM)和美国证券交易委员会(美国证券交易委员会)的监管。不遵守荷兰和美国的报告义务可能会导致处罚、罚款,甚至被迫退市。
作为法明在阿姆斯特丹泛欧交易所和纽约纳斯达克上市的结果,它受到AFM和美国证券交易委员会的监管。因此,辉明必须遵守荷兰和美国的报告和备案/通知义务以及AFM、纳斯达克和美国证券交易委员会的规则和规定。不遵守规定可能会导致处罚、罚款,甚至被迫退市。它还可能导致其投资者/股东的索赔。辉瑞与经验丰富的荷兰和美国法律顾问合作,就(潜在的)AFM、纳斯达克和美国证券交易委员会的备案/通知义务和规章制度提供建议。
如果我们不能纠正财务报告内部控制中的重大弱点,或者如果我们在未来发现更多的重大弱点,或者未能维持有效的
在内部控制方面,我们可能无法准确或及时地报告我们的财务状况或经营结果,这可能会对我们的业务和股票价格产生不利影响。
我们已发现财务报告的内部控制存在重大弱点,涉及实体层面COSO框架每个组成部分的原则,并相应地涉及公司的业务和IT流程。虽然公司确实有监督和合规流程,但这些流程目前还没有作为控制措施充分正规化,以识别和解决重大错报风险和信息技术引起的风险。此外,如果控制活动依赖于控制执行者用来执行控制的信息(IUC),公司不执行或记录控制以确定该信息的完整性和准确性。我们也没有适当的控制措施来监测控制活动,并发现了控制缺陷。如果我们无法弥补这些重大弱点,或者如果我们在未来发现更多的重大弱点,或者以其他方式未能维持有效的内部控制系统,我们可能无法准确或及时地报告我们的财务状况或运营结果,这可能会对我们的业务和股票价格产生不利影响。
我们正在纠正已发现的重大弱点,包括进一步制定和实施与我们的财务报告有关的正式政策、流程、内部控制和文件。我们目前还在最后确定风险评估框架和范围,以确定需要设计和实施更多强化控制的关键程序和控制措施。
根据萨班斯-奥克斯利法案第404(A)条或第404(A)条,我们必须提交一份由管理层提交的报告,其中包括关于我们对财务报告的内部控制的有效性的年度报告。这项评估包括披露我们管理层在财务报告内部控制方面发现的任何重大弱点。在我们最近的评估和测试过程中,我们发现了我们的财务报告内部控制的重大弱点,本年度报告中包括的我们管理层的财务报告内部控制年度报告描述了这些重大弱点,并包括我们的结论,即截至本年度报告涵盖的期间结束时,我们的内部控制没有有效。虽然我们已经对我们的财务报告流程建立了一定的程序和控制,包括启动针对重大弱点的补救措施,但我们不能向您保证,这些努力将防止我们的财务报表在未来重述。萨班斯-奥克斯利法案第404(B)条或第404(B)条要求我们的独立注册会计师事务所发布一份年度报告,说明我们对财务报告的内部控制的有效性。在截至2021年12月31日的年度报告中包含了对我们财务报告内部控制的负面意见。
重大弱点的存在可能会导致财务错误、财务报告延迟,这可能需要我们重述我们的经营业绩,或者我们的审计师可能被要求出具一份有保留的审计报告,如本年度报告中所述。在评估我们遵守第404(A)条的情况时,我们可能找不到内部控制中的一个或多个重大弱点。为了保持和提高我们对财务报告的披露控制和程序以及内部控制的有效性,我们将需要花费大量资源并提供重要的管理监督。对我们的内部控制实施任何适当的改变可能需要对我们的董事和员工进行专门的合规培训,需要大量成本来修改我们现有的会计制度,需要相当长的时间才能完成,并转移管理层对其他业务事项的注意力。然而,这些变化可能不能有效地维持我们内部控制的充分性。
如果我们无法得出结论认为我们对财务报告实施了有效的内部控制(目前的情况就是这样),或者在适当的时候,我们的独立审计师无法根据第404(B)条的要求提供关于我们财务报告内部控制有效性的无保留意见报告,投资者可能会对我们的财务报告的准确性或完整性失去信心,我们的美国存托凭证或普通股价格可能会下跌,我们可能会受到诉讼、制裁或监管机构的调查,包括美国证券交易委员会和纳斯达克。如果不能纠正我们在财务报告内部控制方面的任何重大缺陷,或者未能维持上市公司所需的其他有效控制系统,也可能会限制我们未来进入资本市场的机会。此外,如果我们无法满足404节的要求,我们可能无法继续在纳斯达克上市。
与金融状况、市场环境和经济大趋势有关的风险
由于我们业务的国际范围,汇率的波动,特别是欧元与美元之间的波动,可能会对我们产生不利影响。
虽然我们总部设在荷兰,但我们从欧盟以外的几个国家采购以当地货币支付的材料、产品和服务。由于RUCONEST®在美国和欧盟以外的其他国家的商业化,我们还将收到以美元和其他货币支付的款项并产生成本。因此,我们的业务可能会受到欧元对美元以及其他货币之间汇率波动的影响。
由于Pharming的大部分销售额是以美元开具发票和支付的,而其大部分成本和负债是以欧元计价的,因此相关汇率的任何变化都意味着销售额的欧元价值和欧元贷款余额的相应变化。Pharing Group N.V.有美元现金存款。由于荷兰制药实体的功能货币是欧元,美元/欧元汇率的任何变化都意味着美国现金存款的欧元价值也会发生相应的变化。
由于组织内部或外部人员的欺诈行为,我们可能面临意想不到的财务风险、物质风险或声誉损失。
欺诈风险是由于组织内部或外部人员的欺诈行为而造成的意外的财务、物质或声誉损失。由于Pharming还没有健全的控制措施,也没有监测和评估与欺诈相关的活动的手段,因此该组织发生欺诈的可能性增加。该公司目前正在规划控制措施,以建立欺诈治理程序,创建和实施健全的反欺诈文化,并保持明确的预防和侦查欺诈控制。
不利的资本和信贷市场状况可能会显著影响满足流动性需求的能力、获得资金的途径和资金成本。
辉瑞正在投资多个业务开发项目,其中RUCONEST®的现金流将投资于未来的项目。长期面临流动资金风险或无法为范围内的项目创造足够的收入,可能导致无法履行财政义务,从而增加破产风险。
辉瑞正在改进现金流预测,以提供更准确的流动性信息。建立了公司财务预测模型,该模型构成了中长期(15年前)这一信息的基础。任何新的业务发展项目都需要包括在模型中,以了解对现金流和流动性的影响。融资(股权和债务)将根据公司的流动性需求进行调整。
与我们美国存托凭证相关的风险
如果证券或行业分析师没有发表关于我们业务的研究或报告,或者如果他们对ADS的建议做出了不利的改变,我们的ADS的价格和/或交易量可能会受到影响。
我们美国存托凭证的交易市场可能会受到行业或证券分析师发布的关于我们或我们业务的研究和报告的影响。如果一个或多个跟踪我们或我们行业的分析师下调了研究报告中的股票评级,股票的市场价格可能会下降,如果这些分析师中的一个或多个停止对我们的报道或未能定期发布关于我们的报告,我们可能会在金融市场失去可见性,这可能导致股票的市场价格和/或交易量下降。
如果我们记录的与收购相关的无形资产和商誉受损,我们可能不得不对收益进行重大减记。
在我们收购的会计方面,可能会确认无形资产的重大价值,包括与收购的产品线相关的发展技术和客户关系,以及商誉。根据《国际财务报告准则》,我们必须至少每年评估一次,并可能更频繁地评估无形资产和商誉的价值是否已经减值。无形资产和商誉将被评估为
在出现减损指标时的减值。无形资产和商誉价值的任何减值或减值都将导致从收益中扣除,这可能会对我们未来的运营业绩和股东权益产生重大不利影响。
我们的全球业务使我们面临重大的税务风险。
在我们运营的司法管辖区,我们受税务规则的约束。税率、税收减免和税法的变化、相关税务机关实践或法律解释的变化、相关税务机关越来越多的挑战或任何未能充分管理税务风险的情况都可能导致收费增加、经济损失、处罚和声誉损害。税务机关可以根据对税法的追溯修改积极征收附加税,这可能导致其税务立场的重大重述。这些因素中的任何一个都可能对我们的业务、财务状况、运营结果和前景产生负面影响。
汇率波动可能会对我们的美国存托凭证的价格产生不利影响。
我们的普通股在阿姆斯特丹泛欧交易所以欧元报价,我们的美国存托凭证将在纳斯达克以美元报价。欧元/美元汇率的变动可能会对纳斯达克上美国存托凭证的美元价格或阿姆斯特丹泛欧交易所的欧元价格产生不利影响。例如,如果欧元对美元走弱,我们的美国存托凭证的美元价格可能会下降,即使我们的欧元普通股价格上升或保持不变。
我们的美国存托凭证和普通股的价格和交易量可能会波动,购买我们的美国存托凭证或普通股的人可能会遭受重大损失。
我们的美国存托凭证的市场价格可能会波动,可能会大幅下降。一般的股票市场,特别是生物技术和新兴制药公司的市场,经历了极端的波动,这种波动往往与特定公司的经营业绩无关。我们的美国存托凭证和普通股的市场价格可能受到各种因素的影响,包括:
•财务状况和营业利润的实际或预期变化;
•相对于竞争对手,我们增长率的实际或预期变化;
•我们或我们的竞争对手宣布技术合作伙伴关系、创新或新产品;
•有竞争力的产品或技术的成功;
•管理层和董事会成员的变动;
•改变证券分析师的财务估计或建议;
•我们在纳斯达克上的美国存托凭证和我们在阿姆斯特丹泛欧交易所的普通股交易量的变化;
•高管或股权证券的未来持有者出售我们的美国存托凭证或普通股;
•宣布或预期将采取更多债务或股权融资措施;
•意外事件导致的意外损失或收益,包括与我们的临床试验或监管批准的成功相关的事件;
•由我们或我们的竞争对手进行或涉及的重大收购或业务合并、战略合作伙伴关系、合资企业或资本承诺;
•我们的会计政策或做法的变化;
•与专有权有关的纠纷或其他发展,包括专利、诉讼事项和我们为我们的技术获得专利保护的能力;
•政府法规的变化,包括可能影响定价或报销的任何变化;以及
•金融市场状况或总体经济状况的变化。
这些以及其他市场和行业因素可能会导致我们的美国存托凭证和普通股的市场价格和需求大幅波动。
此外,生命科学公司的股票以及整个股票市场不时经历极端的价格和成交量波动,这些波动可能与任何特定公司的经营业绩无关或不成比例。此外,由于新冠肺炎疫情的影响,其他生物制药公司普通股的交易价格也出现了高度波动。新冠肺炎疫情持续快速演变。疫情可能影响我们业务的程度,以及我们的美国存托凭证和
普通股将取决于未来的发展,这是高度不确定的,不能有信心地预测。
由于我们的美国存托凭证在美国上市,我们的普通股在荷兰阿姆斯特丹泛欧交易所上市,我们的成本将会增加,我们的高级管理层将被要求投入大量时间来实施新的合规举措和公司治理实践。
作为一家其证券在美国公开上市的公司,我们将产生巨额的法律、会计和其他费用,这是我们以前没有发生的,尽管我们的普通股承认在阿姆斯特丹泛欧交易所进行交易。例如,2002年的萨班斯-奥克斯利法案、多德-弗兰克华尔街改革和消费者保护法、纳斯达克的上市要求以及其他适用的美国证券规则和法规对非美国上市公司提出了各种要求,包括建立和维持有效的披露、财务控制和公司治理做法。我们的高级管理层和其他人员将需要投入大量时间来实施这些合规倡议。此外,这些规则和法规将增加我们的法律和财务合规成本,并将使一些活动更加耗时和昂贵。例如,我们预计这些规章制度可能会使我们更难和更昂贵地获得董事和高级管理人员责任保险,这反过来可能会使我们更难为董事会吸引和留住合格的高级管理人员或成员。
然而,这些规则和条例往往受到不同的解释,在许多情况下是因为它们缺乏特殊性,因此,随着监管机构和理事机构提供新的指导意见,它们在实践中的适用可能会随着时间的推移而演变。这可能导致关于遵守事项的持续不确定性,以及不断修订披露和治理做法所需的更高成本。
此外,作为一家美国上市公司和一家荷兰上市公司,普通股获准在阿姆斯特丹泛欧交易所交易,这会影响信息披露,并要求遵守两套适用的规则。有时,这可能会导致合规事项的不确定性,并导致双重法律制度的法律分析、持续修订披露和遵守加强的治理做法所必需的更高成本。由于美国证券法加强了披露要求,我们报告的商业和金融信息被广泛传播,投资者高度可见,我们认为这可能会增加威胁或实际诉讼的可能性,包括竞争对手和其他第三方的诉讼,即使不成功,也可能转移我们的财务资源以及我们管理层和关键员工的注意力。
未来出售我们的普通股或美国存托凭证,或认为可能发生此类出售,可能会压低该等普通股或美国存托凭证的价格。
在公开市场上出售我们大量的美国存托凭证,或认为这些出售可能会发生,可能会压低美国存托凭证的市场价格,并可能削弱我们通过出售额外股权证券筹集资金的能力。我们无法预测此类销售可能对我们的美国存托凭证的现行市场价格产生的影响。
我们的美国存托凭证持有人比我们的股东拥有更少的权利,并受到某些额外风险的影响。
美国存托股份的持有者不直接持有普通股,因此除其他外,还面临以下额外风险:
•作为美国存托股份的持有者,我们不会将您视为我们的股东之一,您将不能行使股东权利,除非您通过存款协议允许的托管银行,并且您将拥有出席我们股东大会的会议权利;
•由您的美国存托凭证代表的普通股的分配将支付给存托管理人,在存托人代表您的美国存托凭证向您进行分配之前,必须支付的任何费用和支出,包括预扣税,都将被扣除。此外,如果汇率在保管人无法兑换外币期间波动,您可能会损失部分或全部分配价值;以及
•吾等和托管银行可在未征得美国存托股份持有人同意的情况下,以可能损害美国存托股份持有人的方式修改或终止存款协议。
我们证券的活跃和流动性市场可能无法发展,这可能会损害我们的美国存托凭证的市场价格。
目前,我们的美国存托凭证或普通股在美国国家证券交易所没有公开市场。尽管我们的美国存托凭证已获准在纳斯达克上市,但活跃的美国存托凭证交易市场可能永远不会发展或持续下去。如果我们的美国存托凭证没有一个活跃的交易市场,投资者可能无法在他们想要出售的时间出售他们的美国存托凭证。
我们是一家荷兰上市有限责任公司。我们股东和美国存托股份持有者的权利可能不同于受美国司法管辖区法律管辖的公司的股东权利,可能不会以美国司法管辖区注册所提供的类似方式保护投资者。
我们是一家根据荷兰法律成立的上市公司(Naamloze Vennootschap)。我们的公司事务受我们的公司章程、我们董事会的规则以及管理在荷兰注册的公司的法律管辖。然而,不能保证荷兰法律未来不会改变,也不能保证它会以美国公司法原则所提供的类似方式保护投资者,这可能会对投资者的权利产生不利影响。
股东和美国存托股份持有人的权利和董事的责任可能与受美国司法管辖区法律管辖的公司的股东、美国存托股份持有人和董事的权利和义务不同。根据荷兰法律,我们的董事在履行职责时必须考虑公司、股东、员工和其他利益相关者的利益,在任何情况下都必须遵守合理和公平的原则。这些参与者中的一些人可能会拥有与您作为美国存托股份持有者的利益不同的利益,或者除了您的利益之外的利益。
有关荷兰公司法和我们的公司章程的相关规定的更多信息,请参阅“股本和公司章程说明”和“荷兰公司法和美国公司法的比较”。
我们的公司章程或荷兰公司法的条款可能会阻止对我们有利的收购要约,并阻止、推迟或挫败任何更换或罢免我们董事会成员的尝试。
根据荷兰法律,在荷兰法律和荷兰判例法规定的范围内,各种保护措施是可能和允许的。
我们的公司章程的某些条款可能会使第三方更难或更不具吸引力地获得对我们的控制权或对我们的董事会进行变动。这些规定包括:我们的董事是根据我们的董事会准备的具有约束力的提名任命的,只有代表我们已发行股本至少三分之一的简单多数投票才能推翻该提名;我们的董事只能由股东大会以代表我们已发行股本至少三分之一的简单多数票罢免;以及要求某些事项,包括对我们公司组织章程的修订,只能在我们董事会的提议下提交给我们的股东进行表决。目前,我们没有这样的保护措施。
股东和美国存托股份持有者可能无法行使优先购买权,因此在未来发行普通股时可能会遭遇大幅稀释。
如发行普通股,除若干例外情况外,每名股东将按其持有人所持普通股的总面值按比例享有优先购买权。这些优先购买权可通过股东大会的决议或由股东大会指定的另一公司机构加以限制或排除。这可能会导致现有股东在我们的权益大幅稀释。
我们没有义务也没有义务遵守《荷兰公司治理守则》的所有最佳实践条款。
我们受《荷兰公司治理守则》(DCGC)的约束。DCGC包含有关董事会、股东和股东大会、核数师、披露、合规和执行标准的原则和最佳做法规定。作为一家在证券交易所上市的荷兰公司,我们必须遵守荷兰政府会计准则,并必须在我们的年度董事会报告中披露我们在多大程度上遵守了香港会计准则的原则和最佳实践条款,以及我们在哪里不符合(例如,由于纳斯达克的要求相互冲突或其他原因),我们必须在年报中说明我们偏离的原因和程度。我们并不遵守DCGC的所有最佳实践条款。见“股本和公司章程说明”。这可能会影响您作为股东或美国存托股份持有者的权利,并且您可能不会获得与完全遵守DCGC的荷兰公司的股东或美国存托股份持有者相同的保护水平。
自从我们的普通股在阿姆斯特丹泛欧交易所上市以来,我们从未宣布或支付过普通股的股息,我们预计在可预见的未来也不会支付股息。
自从我们的普通股在阿姆斯特丹泛欧交易所上市以来,我们从未宣布或支付过普通股的现金股息。我们打算保留任何收益用于我们的业务,目前不打算为我们的普通股支付股息。受适用法律的限制,未来支付股息或其他分派的任何决定将由我们的董事会酌情决定,并将取决于许多因素,包括我们的运营结果、现金需求、财务状况、未来前景、合同限制、任何未来债务协议、适用法律下的限制以及我们董事会可能认为相关的其他因素。我们预计在可预见的未来不会为我们的普通股支付任何现金股息或其他分配。因此,只有在我们的普通股价格上涨的情况下,任何投资才会产生回报。
如果将我们的美国存托凭证提供给美国存托股份持有人是非法或不切实际的,美国存托股份持有人可能不会收到我们的美国存托凭证代表的普通股的分派或此类分派的任何价值。
虽然我们预计在可预见的将来不会就我们的普通股支付任何股息或其他分派,但如果宣布此类股息或分派,美国存托凭证的托管人已同意向您支付其或托管人从我们的普通股或其他存款证券上收到的现金股息或其他分派,扣除其费用和支出,包括预扣税。您将获得与您的美国存托凭证所代表的普通股数量成比例的这些分配。然而,根据存款协议中规定的限制,向美国存托股份持有者提供分销可能是非法或不切实际的。我们没有义务采取任何其他行动,允许将美国存托凭证、普通股、权利或其他任何东西分发给我们的美国存托凭证持有人。这意味着,如果将普通股提供给您是非法或不切实际的,您可能不会收到我们对普通股进行的分发或从普通股获得的任何价值。这些限制可能会对您的美国存托凭证的价值产生实质性的不利影响。
我们在普通股或美国存托凭证上分配给低税司法管辖区某些关联方的股息,未来可能需要缴纳额外的荷兰股息预扣税。
根据荷兰现行税法,普通股或美国存托凭证支付的股息原则上应按《1965年荷兰股利预提税法》(1965年后的湿润评论),除非适用国内或条约豁免或削减。在2020年5月29日致荷兰议会的一封信中,荷兰财政国务大臣宣布,荷兰政府打算从2024年1月1日起,对公司税率低于9%的司法管辖区或欧盟不合作司法管辖区黑名单上的司法管辖区和某些滥用情况下向相关实体支付的股息引入额外的预扣税。荷兰政府已于2021年3月24日公布了这项立法提案。根据该提案,股息支付的有条件预扣税将是根据荷兰《2021年预扣税法》(湿支气管镜2021),自2021年1月1日起生效。该税率将与支付股息时荷兰最高的企业所得税税率(目前为25%)一样高,这将是适用于向公司税率低于9%的司法管辖区的相关实体或欧盟不合作司法管辖区黑名单上的司法管辖区、混合实体和某些滥用情况下的相关实体支付利息和特许权使用费的法定税率。与此同时,目前的荷兰人
预计预提股息税制度将继续存在。但是,如果股利预提税额和股息条件预提税额累计,则条件预提税额将被征收的股利预提税额减去。因此,如果作为关联实体的股东是在公司税率低于9%的司法管辖区设立的,或者在欧盟非合作司法管辖区黑名单上的司法管辖区设立的,股息税率可能从15%上升到25%。
美国存托股份持有者必须通过托管机构行使投票权,因此可能无法及时行使投票权。
我们不会将美国存托凭证持有人(而不是美国存托凭证相关普通股)视为股东,他们将不能行使股东权利,除非通过我们的托管银行,并且美国存托股份持有人将拥有出席我们股东大会的会议权利。托管银行将是美国存托凭证相关普通股的持有人,而美国存托股份持有人将只能根据与美国存托凭证相关的存托协议,才能对美国存托凭证所代表的普通股行使投票权。美国存托股份持有者行使投票权的能力受到实际限制,因为与这些持有者沟通涉及额外的程序步骤。例如,我们普通股的持有者将能够通过亲自出席股东大会或委托代表投票来行使他们的投票权。相比之下,美国存托股份持有者不会直接收到我们的任何通知。相反,根据存款协议,吾等将尽商业上合理的努力,向任何此类股东大会的托管人提供至少30天的通知,并在会议日期之前提供有关待表决事项的细节。如吾等有此指示,托管银行将在接获吾等有关任何该等会议的通知后,尽快将会议通知及持有人作出投票指示的方式的声明邮寄给美国存托股份持有人。为了行使投票权,美国存托股份持有者必须指示托管机构对其美国存托凭证代表的普通股进行投票。由于这些程序步骤涉及保管人, 美国存托股份持有者行使投票权的过程可能比普通股持有者需要更长时间。存托机构未及时收到表决指示的美国存托凭证所代表的普通股将不予表决。
我们的普通股在阿姆斯特丹泛欧交易所的交易以及我们的美国存托凭证在纳斯达克的交易可能会对我们的美国存托凭证的流动性和价值产生不利影响。
我们的普通股在阿姆斯特丹泛欧交易所交易,我们的美国存托凭证已获准在纳斯达克上市。我们无法预测此次上市对我们普通股和美国存托凭证价值的影响。然而,这些安排可能会稀释这些证券在一个或多个市场的流动性,并可能对美国存托凭证或阿姆斯特丹泛欧交易所普通股的活跃交易市场的发展产生不利影响。我们的美国存托凭证的价格也可能受到阿姆斯特丹泛欧交易所普通股交易的不利影响,而我们在阿姆斯特丹泛欧交易所交易的普通股价格也可能受到纳斯达克美国存托凭证交易的不利影响。美国存托凭证被转换为普通股,然后在阿姆斯特丹泛欧交易所交易,反之亦然,这种速度可能会导致美国存托股份的市场价与普通股的市场价之间的差异。投资者可能会在证券交易所之间进行仲裁,以利用这种差异,加剧我们市场价格的潜在波动。
美国存托股份持有人在向本公司和美国的某些董事或高级管理人员在荷兰执行美国判决或在荷兰法院执行美国证券法方面可能存在困难。
我们是在美国境外注册成立的,我们的某些董事和高级管理人员也在美国境外。因此,美国存托股份持有人可能无法在美国境内向所有此等人士或本公司送达法律程序文件,或获取相关文件和/或证人的证词。在美国的美国存托股份持有人也可能难以在美国以外的法院执行在美国法院获得的针对本公司或本公司董事的判决(包括根据美国证券法民事责任条款提起的诉讼)。美国存托股份持有者在最初在美国以外的司法管辖区提起的法律诉讼中,也可能难以根据美国证券法执行责任。
美国存托股份持有者可能会受到美国存托凭证转让的限制。
美国存托凭证只能在托管机构的账簿上转让。但是,保管人在其认为与履行职责有关的情况下,可随时或不时关闭其转让账簿。此外,当我们的账簿或托管人的账簿关闭时,或者如果我们或托管人认为出于法律或任何政府或政府机构的任何要求、或根据存款协议的任何规定或任何其他原因,在任何时候这样做是可取的,则托管人可以拒绝交付、转让或登记美国存托凭证的转让。
我们利用我们的净营业亏损结转和实现我们的递延税项资产的能力可能有限。
截至2021年12月31日,我们在荷兰结转的净运营亏损为2540万美元,在美国结转的净运营亏损为440万美元,在法国为零。截至2021年12月31日,这些损失反映在780万美元的递延税项资产中。能够利用这些亏损需要公司有足够的盈利,还需要依赖于集团实体的独立业绩,因为亏损是被圈护起来的。
2018年底,该集团进行了内部重组,以恢复荷兰的部分税务损失:集团内部转移了某些无形资产和活动,导致税务账面价值较高,并就已转移的资产在一家荷兰公司进行了相关的递延税项资产。荷兰税务当局可能不同意交易和适用的估值,在这种情况下,例如(部分)递延税项资产可能不得不注销。茶点计划已在财务报表附注中披露。可用于结转的亏损总额以及相应的递延税项资产金额以及与无形固定资产相关的递延税项资产金额取决于对上述交易的接受程度。
在我们在美国发生净营业亏损的情况下,我们利用联邦净营业亏损结转的能力可能会受到修订后的1986年国内税法第382节或该法典的限制。这些限制适用于我们经历“所有权变更”的情况,“所有权变更”通常被定义为在三年的滚动期间,某些股东对我们股权的所有权(按价值计算)变化超过50个百分点。州税法的类似规定也可能适用于限制我们国家净营业亏损结转的使用。我们没有评估以前是否发生过这样的所有权变更。如果我们自注册成立以来的任何时间经历了所有权变更,我们利用现有净营业亏损结转抵销应纳税收入的能力可能已经受到限制。此外,我们股票所有权的未来变化可能不在我们的控制范围内,可能会引发所有权变化,从而导致守则第382条的限制。因此,如果或当我们赚取应课税收入净额时,我们使用变动前营业亏损结转净额抵销该等应税收入的能力可能会受到限制,这可能会对我们未来的现金流产生不利影响。
我们不能向您保证,在任何课税年度,出于美国联邦所得税的目的,我们不会成为被动的外国投资公司或PFIC,这可能会给我们普通股的持有者带来不利的美国联邦所得税后果。
一家非美国公司在任何纳税年度将被称为被动型外国投资公司,条件是:(I)该年度至少75%的总收入由某些类型的“被动型”收入构成,或(Ii)该年度至少50%的资产价值(通常基于资产季度价值的平均值)可归因于产生被动型收入或为产生被动型收入而持有的资产。如果在任何课税年度,美国股东(如“重大所得税考量--重大美国联邦所得税考量”所定义)持有我们的普通股,而我们是PFIC,则美国股东可能要承担不利的税收后果,包括(1)将处置收益的全部或部分视为普通收入,(2)对此类收益和某些股息征收利息费用,以及(3)遵守某些报告要求。根据我们对2020年的收入、资产和市值的估计,我们预计2020年我们不太可能成为一家PFIC。我们是否被视为PFIC是一个事实决定,必须在每个纳税年度结束后每年作出决定。这一决定将取决于除其他事项外,我们的收入和资产的所有权和组成,以及我们的资产价值(可能随我们的市值波动)和我们子公司的资产不时。美国国税局或法院可能不同意我们的期望。因此,我们不能向您保证,在本课税年度或未来任何课税年度,我们都不会成为PFIC。
如果一名美国人被视为至少拥有我们普通股价值或投票权的10%,该持有人可能会受到不利的美国联邦所得税后果的影响。
根据美国人被视为(直接、间接或建设性)拥有的我们普通股的总价值和投票权,我们可能被视为受控外国公司,或称CFC。此外,由于我们的集团包括一个或多个美国子公司,我们的某些非美国子公司可以被视为氟氯化碳,无论我们是否被视为氟氯化碳。如果一名美国人(根据1986年修订的《美国国税法》的定义)被视为(直接、间接或建设性地)拥有我们股票价值或投票权的至少10%,该人可能被视为我们集团中每个氟氯化碳(如果有)的“美国股东”,这可能会使该人承担不利的美国联邦所得税后果。具体地说,氟氯化碳的美国股东可能被要求每年报告其在每个氟氯化碳的“F分部收入”、“全球无形低税收入”和氟氯化碳在“美国财产”中的投资收益的比例,并将其按比例列入其美国应税收入中,无论我们是否将氟氯化碳的利润或收入分配给该美国股东。如果您被视为CFCs的美国股东,不遵守这些报告义务可能会使您受到巨额罚款,并可能阻止您应报告的年度的美国联邦所得税申报单的诉讼时效。另外, 非公司美国股东通常不能就其收入获得某些税收减免或外国税收抵免,否则美国公司的美国股东可能会被允许这样做。我们不能保证我们将协助普通股持有人确定我们或我们的任何非美国子公司是否被视为CFCs,或者我们普通股的任何持有人是否就任何此类CFCs被视为美国股东,我们也不希望向任何美国股东提供遵守前述报告和纳税义务所需的信息。美国国税局(IRS)对投资者可能依赖公开信息来履行其关于外国控制的氟氯化碳的报告和纳税义务的情况提供了有限的指导。我们普通股的美国持有者应该咨询他们的顾问,了解这些规则在他们对我们普通股的投资中的潜在应用。
美国存托股份持有者可能无权就存款协议下的索赔进行陪审团审判,这可能会导致任何此类诉讼中对原告不利的结果。
管理我们美国存托凭证的存款协议规定,在适用法律允许的最大范围内,在因存款协议或美国存托凭证而引起或与之相关的任何法律程序中,包括美国联邦证券法下的索赔,美国存托凭证的所有人和持有人不可撤销地放弃接受陪审团审判的权利。由于豁免涉及与美国存托凭证有关的合约事宜而产生的申索,吾等相信,就该条款的解释而言,豁免很可能会继续适用于从美国存托股份融资中提取美国存托凭证所代表的普通股的美国存托股份持有人(涉及撤回之前产生的申索),而豁免很可能不适用于其后从美国存托股份融资中提取美国存托凭证所代表的普通股(涉及撤回后产生的申索)的美国存托股份持有人。然而,据我们所知,合同纠纷前陪审团对根据联邦证券法提出的索赔的审判豁免的可执行性尚未得到美国最高法院的最终裁决。如果这一陪审团审判豁免条款被适用法律禁止,诉讼仍然可以根据陪审团审判的存款协议的条款进行。尽管我们不知道是否有具体的联邦决定在美国联邦证券法的背景下解决陪审团审判豁免的可执行性问题,但我们的理解是,陪审团审判豁免通常是可执行的。此外,在存款协议受纽约州法律管辖的范围内,纽约州法律同样承认在适当情况下陪审团审判豁免的有效性。在决定是否执行陪审团审判豁免条款时, 纽约法院和联邦法院将考虑协议中陪审团审判豁免条款的可见性是否足够突出,以至于一方当事人故意放弃任何由陪审团审判的权利。我们认为,存款协议和美国存托凭证就是这种情况。
此外,纽约法院不会强制执行陪审团免审条款,以阻止可行的欺诈抵销或反索赔,或基于债权人疏忽而未能应担保人的要求清算抵押品的索赔,或在故意侵权索赔的情况下(相对于合同纠纷)。存款协议或美国存托凭证的任何条件、规定或规定,均不构成美国存托凭证的任何持有人或实益拥有人或我们或托管机构放弃遵守美国联邦证券法及其颁布的规则和法规的任何规定。
如果吾等美国存托凭证的任何拥有人或持有人,包括二级市场交易中的美国存托凭证购买者,就存款协议或美国存托凭证项下所产生的事项,包括根据美国联邦证券法提出的索赔,向吾等或托管银行提出索赔,该拥有人或持有人可能会招致更多索赔费用,并且可能无权就该等索赔进行陪审团审讯,这可能会限制和阻止针对吾等或托管银行的诉讼。美国存托凭证的托管人或任何美国存托凭证持有人或实益拥有人因存款协议、美国存托凭证、美国存托凭证或其中拟进行的交易而对吾等提起或涉及吾等的任何法律诉讼、诉讼或法律程序,只能在纽约州或纽约的任何州或联邦法院提起。任何因存款协议、美国存托凭证、美国存托凭证或其中拟进行的交易或因此而引起或基于存托协议、美国存托凭证或美国存托凭证的任何法律诉讼、诉讼或法律程序,只能在纽约州或纽约州的联邦法院提起。
项目4.关于Pharming Group N.V.的信息
A.公司的历史和发展
我们于1988年11月11日根据荷兰法律成立为私人有限责任公司(Besloten Vennootschap Met Beperkte Aansprakelijkheid),更名为GENFARM B.V.。1997年5月29日,Pharming从一家私人有限责任公司(Besloten Vennootschap Met Beperkte Aansprakelikheid)转变为上市公司(Naamloze Vennootschap)Pharming Holding N.V.。从1998年7月2日起,Pharming Holding N.V.更名为Pharming Group N.V.。
PURING在荷兰商会注册,编号为28048592。我们的普通股在阿姆斯特丹泛欧交易所挂牌交易,交易代码为“PHAMM”。截至2020年12月22日,我们的美国存托凭证获准在纳斯达克上市,交易代码为PHAR,并开始在纳斯达克全球市场交易。我们在美国的流程服务代理是Pharming Healthcare Inc.。Pharming Healthcare Inc.办公室位于新泽西州沃伦独立大道10号Suite401,Warren,07059。电话号码是+1 908 524 0888。
截至2021年12月31日、2020年和2019年12月31日的年度,我们的实际资本支出分别为1070万美元、470万美元和260万美元。我们的资本支出主要包括房地产、厂房和设备,例如在荷兰的新生产设施和机器设备的投资。
我们在www.pharming.com上有一个网站。对本网站的引用仅为非活跃的文本参考,本网站中包含的信息或可通过本网站访问的信息不是本20-F表格年度报告的一部分。美国证券交易委员会维护着一个互联网网站,其中包含我们以电子方式向美国证券交易委员会提交的报告和其他信息,网址为http://www.sec.gov.
B.业务概述
概述
辉瑞是一家全球性生物制药公司,开发和商业化创新的蛋白质替代疗法和精准药物,用于治疗罕见疾病和未得到满足的医疗需求。
我们的主要产品RUCONEST®是一种无血浆的重组人C1INH蛋白替代疗法。它被批准用于治疗急性遗传性血管性水肿或HAE发作。我们正在通过我们自己的销售和营销组织在美国、欧盟和英国将RUCONEST®商业化,并通过我们的分销网络在世界其他地区进行商业化。该产品在尚未获得营销授权的其他地区以患者命名的方式提供。
我们还在开发用于后续适应症的重组人C1INH,包括先兆子痫和急性肾损伤(AKI)。此外,我们正在利用我们的转基因制造技术来开发下一代蛋白质替代疗法,最引人注目的是我们针对庞培病的候选产品,该疾病处于临床前阶段。
我们致力于开发治疗HAE的创新疗法,并于2021年7月授权OTL-105在全球范围内使用OTL-105,这是Orchard Treeutics治疗HAE的一种一流的、临床前阶段、体外、自体造血干细胞疗法(HSCT);这代表着一种潜在的一次性治疗HAE的方法。
此外,根据最近注册启用2/3阶段研究的积极结果,我们正在努力向美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)提交我们治疗APDS的口服精密药物Leniolisib(一种磷脂酰肌醇3-激酶增量,或PI3K Delta,抑制剂)的注册申请。根据相关卫生当局的批准,我们预计将于2023年第一季度推出Leniolisib。
我们正在积极寻求进一步利用RUCONEST®商业化带来的现金流、我们强劲的资产负债表以及我们进入欧洲(阿姆斯特丹泛欧交易所)和美国(纳斯达克)资本市场的机会,通过许可或收购更多罕见或极罕见疾病的近市场资产来扩大我们的商业化组合。
我们的投资组合
下表汇总了我们的产品和我们的主要候选产品组合的状态。
RUCONEST®治疗高血压性脑出血急性发作
我们的主要产品RUCONEST®是第一个也是唯一一个被批准用于治疗急性血液病发作的重组人C1INH蛋白替代疗法。HAE是一种罕见的遗传性疾病,在全球范围内大约每10,000人中有1人到50,000人中有1人发生。在美国,HAE治疗的市场估计在7000至8000名患者之间,无论是急性治疗还是预防性治疗。HAE是由蛋白质C1INH缺乏引起的。这种缺陷导致补体级联的不受控制的激活,导致一些介质的过度产生,导致液体从血管泄漏到组织间隙。HAE发作的最常见症状是由于缓激肽启动蛋白激肽释放酶过度产生,从而导致液体过度渗入组织间隙(浮肿或肿胀)。患者可能会出现一阵阵剧烈的腹痛、恶心和呕吐,肠壁肿胀会加剧这些症状。
呼吸道或喉部肿胀特别危险,可导致窒息死亡。如果不治疗,HAE发作可持续48至120小时,并可能致命。
在截至2021年、2020年和2019年12月31日的年度内,我们出售RUCONEST®的收入分别为1.98亿美元、2.122亿美元和1.894亿美元。我们目前通过自己的销售队伍在美国、英国和欧盟销售RUCONEST®,并通过我们的经销商网络在韩国、以色列和某些中南美洲国家销售RUCONEST®。
RUCONEST®已被证明可使HAE患者的C1INH效应正常化。将C1INH活性水平恢复到正常水平已被证明在HAE发作治疗中具有临床意义。治疗HAE发作的标准定位学是每公斤重组产品50个单位。RUCONEST®通过缓慢静脉注射(IV)给药。一小瓶装2100 U冻干品,与14毫升注射用水重新组合。RUCONEST®不可逆地与几个靶分子结合,包括重要的凝血因子FXII和蛋白激肽释放酶(当未结合时)将血浆蛋白裂解成缓激肽和其他产物。通过与这些分子的结合和化学失活,RUCONEST®停止了缓激肽和所有其他介质的产生,从而阻止了HAE的攻击。
关于RUCONEST®,公司已决定不再进一步投资,试图为RUCONEST®提供替代交付机制,这一决定并不是轻率做出的,主要是因为缺乏医疗需求和市场机会。我们已经认识到,RUCONEST®的主要好处之一是静脉应用,例如,大剂量重组人C1INH蛋白替代疗法的快速和完全生物利用度。
RUCONEST®在欧盟的监管排他性将于2025年到期,在美国的生物制品参考产品排他性将于2026年7月16日到期。
2021年7月20日,我们与新桥制药公司(“新桥”)就RUCONEST®在中东和北非(“中东和北非”)的分销达成了独家许可协议。
海尔(Hae)
遗传性血管性水肿(HAE)是一种使人衰弱并可能危及生命的疾病。在最常见的形式中,它是由一种名为c1-抑制物(c1-INH)的血浆蛋白功能缺陷引起的。因此,治疗的方法最初集中在用外源性的C1-抑制物来取代缺失的蛋白质,这些抑制物可以是从混合血浆中收集的,也可以是从重组的来源中获得的。最近,随着对发病机制的更多了解,已经开发出阻断接触和补充系统的治疗方法。
在美国,有四种治疗HAE发作的疗法和另外四种预防HAE发作的疗法。这些疗法改变了HAE患者的生活。早期的治疗目标集中在限制发作的后果上,很少有患者使用预防性药物。随着预防治疗水平的提高,现在许多患者使用了这一疗法,并取得了显著的效益。
两种这种疗法(HAEGARDA®和TAKHZYRO®)的试验数据表明,大约50%的患者仍有突破性发作。此外,根据一种新的口服预防药物的临床试验公布的数据,只有10%的患者没有发作。这些已公布的数据可根据要求提供。最后,许多患者需要重新给予不能解决潜在的c1-异烟肼缺乏的急性治疗。
RUCONEST®是一种重组的C1酯酶抑制剂,或C1INH,可跨多个途径阻止缓激肽的产生(见下图)。缓激肽是脑血栓形成中肿胀的关键介质。作为一种静脉注射的重组C1抑制剂,RUCONEST®是立即和完全的生物利用度,可以阻止HAE攻击的进展。
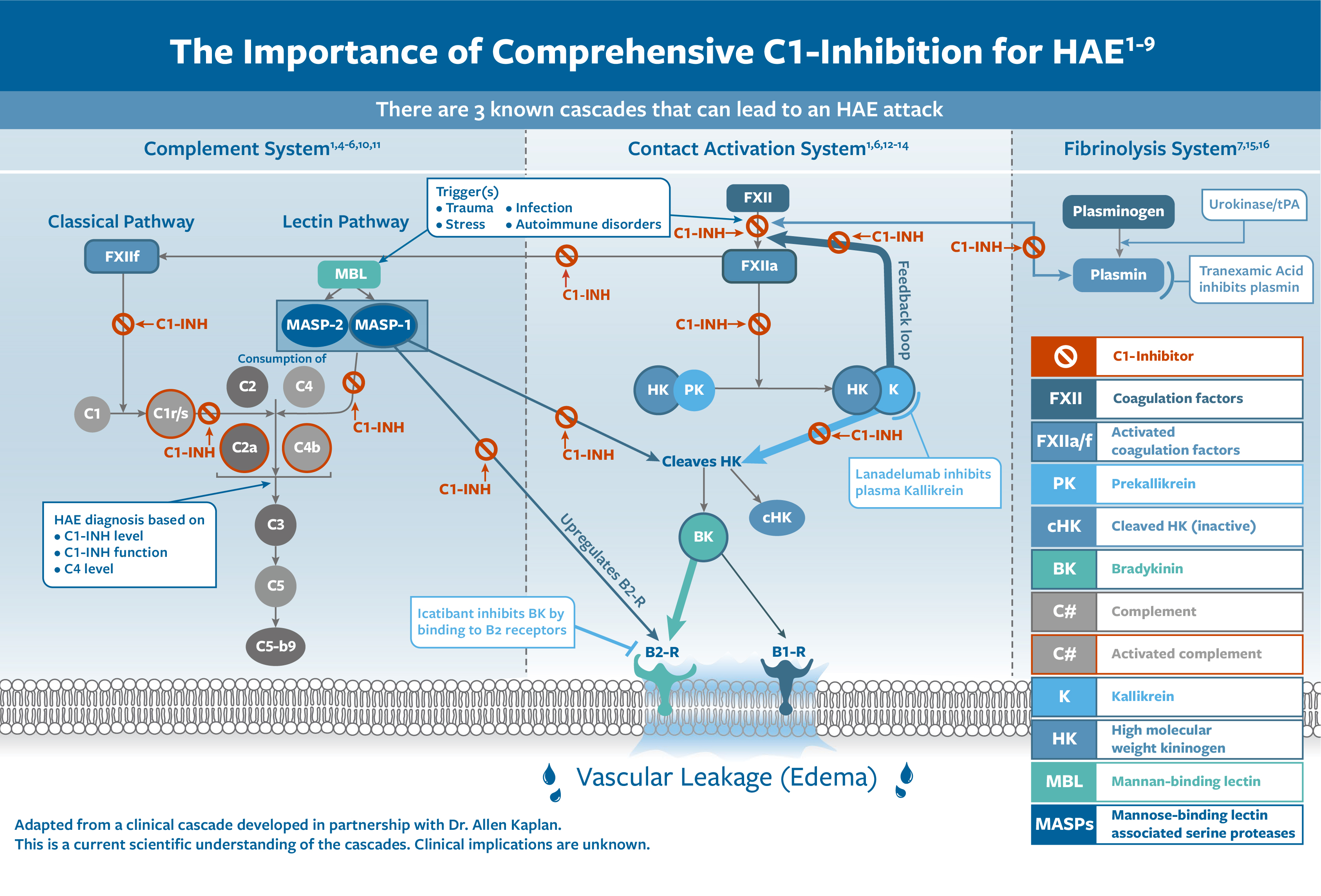 上图显示了补体级联中C1INH的重要性及其对HAE的意义
上图显示了补体级联中C1INH的重要性及其对HAE的意义
重组人C1INH的其他开发计划
C1INH蛋白生物学
在体内,C1INH通过抑制补体系统顶端和接触途径中最重要的复合体的形成来发挥作用。补体系统,有时被称为补体级联,是免疫系统的主要组成部分,负责某些免疫介导的炎症反应,包括大多数导致血管浮肿的反应。炎症使免疫细胞能够通过血浆血管渗漏进入正常情况下难以接近的组织。炎症还会升高局部温度,激活免疫防御机制,抑制病原体化学。补体级联和接触激活途径也增强了抗体和吞噬细胞(一种白细胞)清除体内微生物和受损细胞的能力,并攻击病原体的细胞膜。
补体系统可以被抗体和适应性免疫系统产生的其他挑战触发物招募并发挥作用。补体系统由许多在血液中发现的复杂蛋白质组成,通常由肝脏合成,通常作为非活性前体循环。当受到几种诱因之一的刺激时,被称为蛋白酶的酶会裂解特定的蛋白质,释放被称为细胞因子的活性片段,从而启动进一步裂解的放大级联反应。补体激活级联的最终结果是刺激吞噬细胞清除异物和受损物质,炎症吸引并使额外的吞噬细胞移动,以及激活细胞杀伤膜攻击复合体。
超过30种蛋白质和蛋白质片段组成了补体系统,包括血浆蛋白和特定的细胞膜受体。一旦补体级联被触发,身体还会产生一种反蛋白C1INH,以开始减缓反应。减慢反应的速度是恒定的,因为人体只能产生最高水平的C1INH。这意味着严重的触发事件比轻微的触发事件需要更长的时间来解决,因为血浆中存在的C1INH水平以及新的产物可以比主要释放更快地满足轻微释放细胞因子的需求。
最强烈的细胞因子释放,有时被称为“细胞因子风暴”,发生得如此之快,以至于在C1INH的产生能够控制释放之前,致命的“休克”反应或对器官的严重损害就会发生。这种动态被认为在许多疾病和伤害情况下发挥着重要作用,炎症或血管渗漏失控是导致这些情况的许多症状的原因。可能正是这些由此产生的症状造成了最大的损害。
重组人C1INH在人体从缺氧状态中恢复过来也是有用的,在缺氧情况下,血液无法正常循环,将氧气输送到各种组织。这种缺氧的不利影响在血液再灌流时会因再灌流本身引起的补体级联的局部激活而加剧。因此,在其中一些情况下,外用C1INH可能会发挥作用,可以更快地使情况正常化,允许身体有更少的危险或更有节制的反应,或者完全预防症状。虽然C1INH不太可能治愈潜在的问题,但这种额外的供应可能会减少造成的损害,甚至减少和/或延迟足够长的时间来解决问题,无论是自然还是通过患者医生团队的干预。
我们已经开发出了唯一的无血浆重组人C1INH商品化产品。我们的rhC1NH产品已被批准用于治疗急性HAE发作,我们和我们的合作者正在研究rhC1INH用于治疗其他大的和未满足的适应症,包括某些AKI和先兆子痫。
新冠肺炎
自从新冠肺炎大流行开始,我们就开始研究重组人C1INH用于治疗严重新冠肺炎感染的可能性。新冠肺炎是由新型冠状病毒SARS-CoV-2引起的疾病。全身炎症亢进是新冠肺炎更严重阶段的特征,会导致急性呼吸窘迫综合征、机械通气和最终死亡。我们认为,补体激活可能会导致细胞因子风暴,这是一个危险的生化过程,会加剧新冠肺炎感染的并发症,如器官衰竭和死亡。由于C1INH介导补体级联并抑制激肽释放酶-激肽系统,我们认为重组人C1INH可能通过抑制MASP-1(一种人类酶)诱导的血栓形成和凝血因子XII放大的血栓炎症,抑制补体失控激活和伴随的肺损伤,减少毛细血管渗漏和随后的肺水肿,减少微血栓的产生。
2021年9月,我们宣布了两项随机、开放标签、受控的新冠肺炎住院患者使用RUCONEST®预防严重新冠肺炎感染的临床试验的主要结果。这两项研究的主要终点都是第7天世卫组织序数表中7分的疾病严重程度。世卫组织建议将这一终点用于新冠肺炎患者的临床试验,因为它衡量了一段时间内的疾病严重程度。
这些试验是在瑞士巴塞尔大学医院的一项同情使用计划之后进行的,该计划在因新冠肺炎相关的严重肺炎住院后接受RUCONEST®治疗的患者中看到了令人鼓舞的结果,尽管接受了包括羟氯喹和洛比那韦/利托那韦在内的标准治疗,但他们的病情并没有改善。在接受RUCONEST®治疗后,5名患者中有4名在48小时内退烧,C-反应蛋白和炎症细胞因子IL-6水平显著下降。此后不久,五名患者中的四名完全康复出院。一名患者的需氧量增加,最终被转移到ICU进行插管,但自那以来也已完全康复。这些结果于2020年4月首次公布,随后于2020年8月发表在《免疫学前沿》杂志上。一个研究合作伙伴于6月向美国FDA提交了一份研究新药申请,并于2020年8月由Pharming接管。
根据同情使用计划的结果,开始了两项随机、开放标签的试点临床试验,这些试验是在新冠肺炎住院的患者中使用RUCONEST®(重组人C1抑制剂)来预防严重的SARS-CoV-2感染。这两项针对新冠肺炎住院患者的临床研究都试图确定额外给予C1INH是否可以控制或阻止全身性高炎症综合征(或细胞因子风暴)。这两项研究的主要终点都是第7天世卫组织序数表中7分的疾病严重程度。世卫组织建议将这一终点用于新冠肺炎患者的临床试验,因为它衡量了一段时间内的疾病严重程度。
在这项在Pharming IND下进行的美国研究中,在中期分析时包括了32名患者,接受RUCONEST®加护理标准治疗的患者在第7天的世界卫生组织疾病严重程度评分(平均1.83,SD0.65)低于那些只接受标准护理的患者(平均3.22SD1.86;p=0.0056)。次要终点和生物标记物评估的数据与主要终点的结果一致。
这项由研究人员领导的研究在瑞士、巴西和墨西哥进行,也是瑞士国家科学基金会国家研究计划“新冠肺炎”的一部分,在中期分析时包括83名患者,在治疗组之间没有观察到主要变量的差异。然而,在基线,即治疗前,两组之间的疾病严重程度存在显著差异。具体地说,RUCONEST®组的患者比标准护理组的患者有更严重的疾病(p=0.0324)。
虽然这两项研究使用了类似的设计,并且都招募了因新冠肺炎感染而严重肺炎入院的患者,但使用了不同的RUCONEST®剂量方案。在研究人员领导的研究中,RUCONEST®在接受的护理标准之外再服用三天,而在美国的研究中是四天。此外,在纳入的患者群体和实施的护理方案标准方面也存在差异。RUCONEST®耐受性良好,在两项研究中都没有观察到与药物相关的严重不良反应。这两项研究现在都已经结束,结果将发表在同行评议的医学期刊上。
鉴于新冠肺炎医疗需求和治疗管理的快速变化,以及现在开发治疗所需的巨额投资,我们不打算对住院的新冠肺炎患者进行任何使用重组人C1INH的进一步研究。我们对这些研究的结果感到鼓舞,包括在急性病患者中的整体安全性概况,同时我们考虑在其他严重疾病患者中进一步发展重组人C1INH,但需求尚未得到满足。
急性肾损伤(AKI)
我们正在开发一种rhC1INH疗法,用于预防和治疗因使用造影剂而导致的AKI,该造影剂是作为造影剂增强程序的一部分注射的,例如经皮冠状动脉介入治疗(PCI)。尤其是在肾功能受损的患者中,清除注射的造影剂的困难可能会导致进一步的肾脏损害,这可能是不可逆转的,可能需要永久透析或肾移植。AKI经常导致长期住院或重症监护,这是极其昂贵的,往往会导致患者较差的长期结果,甚至死亡。
造影剂损伤是导致医院获得性肾功能不全的11%的原因,是继肾功能受损之后导致肾功能衰竭的第三大常见原因。急性心肌梗死影响到1%到2%的普通人群,以及高达50%的冠脉造影术或经皮冠状动脉介入治疗后的高危人群。
2018年10月,我们宣布了一项由研究者发起的第二阶段研究,在75名有肾病风险的患者中进行了一项双盲、安慰剂对照的临床试验,取得了积极的结果。这项研究是由瑞士巴塞尔大学医院的迈克尔·奥斯托夫博士领导的。在这项研究中,患者被给予重组人C1INH(84公斤:4200U)或安慰剂(0.9%氯化钠)。在接受经皮冠状动脉介入治疗(如支架置入术)的患者亚组(n=38)中,这组患者的意向治疗分析显示,接受重组人C1INH的患者48小时内尿中性粒细胞明胶酶相关脂结合蛋白(NGAL)峰值浓度的中位数增加了1.8ngL,而安慰剂组增加了26.2ng.mL(p=0.038)。如下所述,这对应于48小时内尿NGAL峰值变化的中位数百分比明显不同,rHC1INH组为11.3%,安慰剂组为205.2%(p=0.001)。
在这一积极的结果之后,我们已经完成了新的2b期研究的准备工作,该研究旨在研究RUCONEST®对接受经皮冠状动脉介入治疗并伴有对比增强检查的患者的影响。2021年4月22日,我们宣布第一位患者已在瑞士巴塞尔大学医院参加了IIb期双盲随机对照研究,以评估RUCONEST®预防非ST段抬高心肌梗死后急性心肌梗死的疗效。
这项双盲、随机、对照研究旨在评估RUCONEST®预防非ST段抬高心肌梗死后急性心肌梗死的疗效。主要目的是通过检测尿NGAL(尿中性粒细胞明胶酶)峰值升高来评价非STEMI患者经皮冠状动脉介入治疗(PCI)后应用重组人C1INH与安慰剂的疗效。
相关的Lipocalin)治疗后24小时内。此外,这项研究将寻求为未来的潜在研究确定合适的剂量方案。这项研究的其他终点包括血管造影术后72小时内血清肌酐升高定义的急性肾功能衰竭的发生率,以及6个月的心血管和肾脏事件以及与住院相关的医疗资源利用情况。这项研究正在瑞士各地的不同中心进行,可能还会在全球其他地方进行。
子痫前期(PE)
我们正在开发一种用于治疗先兆子痫的重组人C1INH蛋白替代疗法。子痫前期(PE)是一种妊娠期间危及生命的多系统疾病,会导致孕产妇和新生儿的死亡和发病率,通常首先通过母亲高血压的证据发现。蛋白尿是一种常见的症状。胎盘螺旋动脉发育异常或受损可能是补体级联反应的触发因素。治疗方法可能包括堕胎或早产,后者往往与高死亡率有关。对患有PE的孕妇的姑息护理和对早产儿的新生儿护理可能会导致先兆子痫患者的治疗和护理成本高昂。出生后的并发症可能很严重,在这些情况下影响到所有新生儿的50%以上,并伴有生长受限、学习困难和中度至重度残疾。
全世界每年报告的先兆子痫病例近250万例,在发达国家的所有妊娠中,发病率在3%至10%之间。仅在美国,估计每年的先兆子痫病例就超过12万例。据记录,每年有50,000例产妇死亡,这些患者的PE过程中没有成功的医疗干预。
如下表所示,一项对孕妇C1INH水平的研究表明,患有PE的妇女循环中的C1INH水平降低。
正常妊娠、子痫前期和非妊娠妇女的分析数据(平均值±1SD)
| | | | | | | | | | | | | | |
| (A)
正常
妊娠
(n=20) | (B)
温和的
先兆子痫
(n=17) | (C)
中度子痫前期
(n=10) | (D)
非孕妇女
(n=20) |
| C1-异烟肼活动(%) | 74.3 ± 15.5 | 64.4 ± 14.0 | 55.5 ± 15.8 | 95. ± 10.8 |
| C1-异烟肼抗原(%) | 68.2 ± 10.4 | 62.7 ± 13.3 | 53.1 ± 8.8 | 86.5 ± 12.2 |
我们认为,用重组人C1INH进行蛋白质替代治疗可能会减缓病情的进展速度,从而降低它对母亲和未出生婴儿造成的损害水平。
我们正在荷兰和澳大利亚进行一项开放标签、单臂、多阶段、多中心的晚期子痫前期1/2期研究。最近,这项研究扩大到包括毛里求斯的一个中心。这项研究最初将评估30名中晚期症状性PE患者使用RUCONEST®治疗的耐受性和安全性。这项研究于2019年获批,但因新冠肺炎而暂停。
额外的管道开发
雷尼奥西布治疗激活的肌醇磷脂3-激酶-Delta综合征
我们正在开发Leniolisib(一种磷脂酰肌醇3-激酶Delta,或PI3K Delta抑制剂),用于治疗激活的PI3K Delta综合征,或APDS。与诺华公司合作,我们目前正在进行一项双盲、安慰剂对照、随机、启用登记的2/3阶段试验,该试验最近已完成。这项研究之后是一项开放标签延伸安全试验,目前正在美国和欧洲的临床地点招募患者。
APDS于2013年被发现,是一种罕见的、遗传的、临床上不同的疾病,可导致终末器官损害和早期死亡。APDS是一种进行性的原发免疫缺陷和调节障碍,没有批准的治疗方法。APDS的特征是严重的、反复的鼻窦肺部感染;持续的、严重的或反复的疱疹病毒感染,特别是EBV和CMV;淋巴结病、肝肿大、脾肿大和/或
结节性淋巴组织增生症;自身免疫性细胞减少症;肠病;支气管扩张症;可能的恶性病变;B细胞和T细胞功能失调。尽管自2013年发现APDS以来,人们对APDS的认识有所提高,但在专家没有看过的患者中,这种疾病仍然可能被误诊。需要对医生进行更多的教育,以帮助早期诊断和准确治疗。未经治疗的APDS可能与显著增加的发病率和死亡率有关。随着时间的推移,诊断延迟可能会导致损害的积累,包括支气管扩张。由于淋巴的无节制增殖,APDS患者发生淋巴瘤的风险也很大。APDS的治疗通常包括预防性抗生素、免疫球蛋白替代、免疫抑制、淋巴瘤化疗或干细胞移植等治疗。其中许多药物会引起严重的副作用,移植的发病率和死亡率也很高。
Leniolisib是IA类PI3K催化亚基的一种异构体的小分子抑制剂。它具有免疫调节和潜在的抗肿瘤活性。Leniolisib抑制磷脂酰肌醇-3-4-5-三磷酸(PIP3)的产生。PIP3是一种重要的细胞信使,通过PDK1特异性激活蛋白-丝氨酸/苏氨酸激酶AKT,调节多种细胞功能,如增殖、分化、细胞因子产生、细胞存活、血管生成和代谢。与普遍表达的PI3Kα和PI3Kβ不同,PI3K Delta和PI3K Gamma主要在起源于造血细胞的细胞中表达。PI3K Delta在调节获得性免疫系统细胞(B细胞和T细胞)以及天然免疫系统(中性粒细胞、肥大细胞和巨噬细胞)的多种功能中的中心作用强烈表明PI3K Delta是几种免疫疾病的有效和潜在有效的治疗靶点。
与诺华公司合作,我们目前正在研究来尼西布,以评估其在APDS患者中的有效性和安全性。关键研究是第2/3阶段潜在登记使能研究,由两个连续部分组成。第一部分包括6名患者,在一项开放标签剂量递增研究中,旨在评估来尼利西布的安全性、耐受性、药效学和药代动力学;这项剂量发现研究已经完成。
研究的第一部分显示,口服来尼利西可剂量依赖性地降低PI3K/AKT通路的活性,并改善免疫失调。观察循环中过渡性和幼稚B细胞的正常化,PD-11CD41和CD571CD42 T细胞的减少,血清免疫球蛋白M和炎症标志物干扰素-g、肿瘤坏死因子、CXCL13和CXCL10的升高。治疗12周后,所有患者的淋巴组织增殖均有改善,淋巴结大小缩小39%(平均26%~57%),脾体积缩小40%(平均13%~65%)。Leniolisib耐受性良好,改善了APDS的实验室和临床参数,支持特异性抑制PI3Kd作为APDS和其他以PI3Kd途径过度激活为特征的疾病的潜在疗法。(血。2017;130(21):2307-2316。)
第二部分是一项随机、盲目、安慰剂对照的研究,纳入了31名12岁或以上的APDS患者。患者被随机分成2:1,每天两次服用莱尼利西布70毫克,或服用安慰剂,为期12周。在此之后,患者被允许转入开放标签扩展研究,以评估长期安全性、耐受性和有效性。这项随机研究的共同主要终点旨在评估淋巴结大小的缩小和免疫缺陷的纠正。
初步疗效结果显示,与安慰剂相比,来尼利西布的临床疗效显著,淋巴结大小显著减少(p=0.0005),免疫功能障碍正常化,幼稚B细胞比例增加(p
在研究的第二部分,Leniolisib总体上是安全的,耐受性良好。两个治疗组报告的大多数不良事件都被归类为中度至轻度。没有发生导致停止研究治疗的不良事件,没有死亡病例,而且莱尼利西布组严重不良事件(SAE)的发生率低于安慰剂组。没有一例SAE被怀疑与研究治疗有关。
2020年10月,我们宣布,基于EMA孤儿药品委员会(COMP)的积极意见,欧盟委员会已批准Leniolisib为孤儿药物,用于治疗激活的磷脂酰肌醇3-激酶增量综合征(APDS)。Leniolisib此前于2018年1月被美国食品和药物管理局批准为孤儿药物,用于治疗激活的PI3Kδ综合征(APDS)或p110δ激活突变导致衰老T细胞、淋巴结病和免疫缺陷(PASLI)。
2021年3月2日,我们宣布启动一项赞助的基因检测计划,名为“NavigateAPDS”,旨在帮助临床医生识别患有APDS的患者及其家人,这可能会导致更早的诊断。APDS是一种由基因突变引起的极罕见的原发免疫缺陷疾病,每百万人中约有一至两人受到影响。患者经常被误诊为其他免疫缺陷或自身免疫性疾病,而且往往需要漫长的病程才能获得正确的诊断。只有通过基因测试才能做出明确的诊断。目前的治疗一般仅限于支持疗法,如抗生素和免疫球蛋白替代疗法的使用。目前还没有被批准的治疗APDS的方法,然而,临床试验目前正在进行中,包括法明公司正在开发的Leniolisib关键阶段开发计划,Leniolisib是一种小分子磷脂酰肌醇3-激酶增量(PI3Kẟ)抑制剂,正在由诺华和辉明公司开发,用于治疗APDS患者。
Phing对该计划的支持将促进对美国和加拿大符合条件的个人进行免费的基因测试和咨询。“导航APDS”将使用Invitae初级免疫缺陷(PI)小组,该小组分析多达407个与免疫系统遗传性疾病有关的基因。除了为那些可能提供已知与APDS相关的临床照片的个人提供基因检测外,NavigateAPDS还将通过第三方提供检测前和检测后的遗传咨询,所有被发现患有APDS变异的患者的血缘亲属都有资格通过该计划进行检测。通过提供对完整PI面板的访问,医生和患者更有可能确定其疾病状态和潜在诊断的潜在原因,而不需要额外的扩展患者测试。
2022年1月,欧洲药品管理局(EMA)对Leniolisib的儿科调查计划(PIP)做出了积极决定。为了在欧盟注册新的医药产品,生物制药公司被要求提供一份PIP,其中概述了在儿科人群中研究新医药产品的战略。来自EMA的儿科委员会(PDCO)的积极的PIP意见为我们提供了一条可能在欧盟提交Leniolisib治疗成人和青少年APDS的上市授权申请(MAA)的途径。
在成功完成商定的PIP后,Leniolisib将有资格在其欧盟孤儿药物指定获得市场批准后的十年欧盟市场独家经营权的基础上,再获得最多两年的欧盟市场独家经营权。
根据这些研究的结果,Pharming打算开始获得监管部门的批准,将用于APDS的Leniolisib商业化,首先是在2022年年中向FDA提出新药申请(NDA),然后是EMA的MAA以及世界各地的其他应用。
OTL-105体外自体基因治疗C1INH缺乏性遗传性血管性水肿
2021年,Pharming和Orchard Treeutics签署了OTL-105的许可协议,OTL-105是一种体外自体基因疗法,用于治疗由于缺乏C1酯酶抑制剂(C1INH)而导致的HAE患者。这种新的方法具有治愈的潜力,使HAE患者能够过上正常的生活,而不依赖于急性或预防性使用HAE药物。
OTL-105是基于Orchard Treeutics的体外自体基因治疗方法,该方法旨在使用HAE患者自己的血液干细胞,并将经过纠正以产生C1INH的基因的工作副本插入这些细胞中。更具体地说,从患者的血液中分离CD34+干细胞,并用编码人类SERPING1基因的慢病毒载体进行转导。一旦这些经过基因修正的干细胞被送回患者体内,干细胞衍生的白细胞就开始产生经过修正的基因产物。在临床前概念验证研究中,OTL-105表达了SERPING-1基因,经基因修正的干细胞产生了相应的活性C1-酯酶抑制剂。
使用腺相关病毒(AAV)载体治疗HAE靶向肝细胞的其他基因治疗方法。由于肝细胞持续缓慢的自我更新和对病毒衣壳的免疫反应,转导的肝细胞比例缓慢下降。我们相信,肝脏导向的基因疗法不会提供根治HAE的方法,除非载体DNA稳定地整合到肝细胞的DNA中。虽然已知肝脏产生大量天然的C1INH,但在其他细胞中也发现了C1INH的产生,包括白细胞。因此,我们认为体外自体基因治疗可能提供了一种治疗HAE的方法,可以稳定地增加白细胞中C1INH的产量。
治疗庞贝病的新一代酶替代疗法:α-葡萄糖苷酶
我们正在开发下一代α-葡萄糖苷酶替代疗法,用于治疗庞贝病。庞贝病,也被称为酸性麦芽糖酶缺乏症或第二型糖原储存疾病,是一种遗传性肌肉肌肉病,由体内细胞中一种名为糖原的聚合物糖积聚引起。它影响到大约每40,000人中就有1人,不同种族之间的情况各不相同。庞贝病是一种罕见的多系统遗传性疾病,其特征是溶酶体酶α-葡萄糖苷酶或GAA缺失或缺失。这种酶是分解或代谢复杂的碳水化合物糖原并将其转化为单糖葡萄糖所必需的。未能实现其适当的分解会导致溶酶体糖原在细胞中大量积累,特别是在心肌、平滑肌和骨骼肌细胞中。
婴儿型的特点是严重的肌肉无力和不正常的肌肉张力降低或低张力,没有肌肉萎缩,通常在生命的最初几个月表现出来。其他异常可能包括心脏增大(心脏增大)、肝脏增大(肝脏增大)和/或舌头增大(巨舌症)。
我们目前正在研究我们的α-葡萄糖苷酶疗法,以支持IND的研究。
制造业
我们的转基因生产技术平台
我们专有的转基因制造技术平台是我们建立公司的基础。我们已经开发了一种独特的、可扩展的、可重复的、当前良好的制造实践或cGMP验证方法,用于生产高质量的重组人蛋白。我们的制造过程利用转基因动物在它们的牛奶中生产人类重组蛋白。这一过程能够在动物的乳汁中产生蛋白质,而不会使动物遭受痛苦或在其生物学的其他方面发生改变。我们正在利用这一工艺生产RUCONEST®,并为我们的重组人C1INH和其他候选蛋白质替代疗法产品提供临床试验用品。
我们的制造设施
一旦动物品系(兔子和牛)被生产出来,我们就在专门的设施中饲养它们,这些设施包括保护它们免受环境污染、高标准的畜牧业和安全。在这些设施中,对动物的一致和规范的处理受到仔细的监测。由此产生的牛奶要经过cGMP过程的几个阶段。“下游”过程包括提纯,涉及各种层析和过滤步骤等标准技术,然后配制和无菌填充到瓶装冻干粉产品中,准备重新构建。随着对RUCONEST®的需求和我们临床试验的需求持续增加,我们已经并将继续大幅投资,以扩展所有这些能力。我们已经增加了一个属于我们自己的“上游”制造设施。我们已经与赛诺菲续签了生产RUCONEST®的药物--重组人C1INH的下游制造和供应协议,并与BioConnection签订了生产RUCONEST®的药物产品的协议。。随着我们不断扩大产能和产品范围,我们正在
不确定我们能否以及在多大程度上能够在可接受的条件下及时缔结这种伙伴关系或协议。我们建立了一个新的合同和供应商关系管理程序,以促进新承包商及时上岗或扩大现有承包商的合同。即使缔结了伙伴关系或协议,这些伙伴也有可能未能履行与他们达成的协议,或者我们无法维持这些协议。未能及时开发和/或充分收缩额外的制造能力可能会对我们的业务、财务状况、运营结果和前景产生重大不利后果,因此也可能对我们的股票市场价格产生负面影响。
我们的战略
辉瑞的愿景是成为一家全球生物制药公司,专注于罕见和超罕见疾病领域的变革性药物。我们的使命是通过我们全面整合和可持续的药物开发和商业化,为未得到满足的医疗需求的患者提供创新的治疗选择。
我们打算通过利用我们的核心优势、临床开发和罕见病药物商业化来创造长期价值。为了保持长期的额外增长,我们的目标是将我们的渠道从单纯依赖我们的rhC1INH技术平台转变为包括更广泛的各种收购和授权技术。
我们的战略是履行我们的使命,并相应地为公司及其利益相关者创造长期价值;通过成功推出通过我们自己的研发努力获得的创新产品,利用我们在临床开发和罕见病药物商业化方面的核心优势;以及通过授权/收购罕见和超罕见疾病的产品。在这样做的过程中,我们适用于较高的道德、环境和动物福利标准。
我们2021年的主要目标:
我们2021年的目标是基于我们的三大支柱战略;
1.通过在全球所有主要市场扩大用于海航的RUCONEST®的商业化,扩大我们的商业基础设施。
2.通过现有技术和新技术(通过内部许可或收购)扩展我们的产品组合,包括全面研究新适应症中的生命周期管理机会,包括rhC1INH和PI3Kδ。
3.增强我们的患者识别能力,并在此过程中发现市场机会,为未得到满足的医疗需求的患者开发创新疗法。
竞争
生命科学产业的特点是技术进步迅速,竞争激烈,高度重视专有产品。我们面临着来自许多不同来源的潜在竞争,包括主要的制药、专业制药和生物技术公司、学术机构、政府机构以及公共和私人研究机构。我们成功开发和商业化的任何候选产品都将与现有产品和未来可能推出的新产品展开竞争。这些竞争对手还在招聘和留住合格的科学和管理人员、建立临床研究站点和临床研究患者注册以及在获取补充或必要于我们项目的技术方面与我们竞争。
在竞争对手可能获得显著竞争优势之前完成临床试验、获得卫生局批准并开始药物商业销售的公司,如果竞争对手开发和商业化比我们可能开发和商业化的任何产品更安全、更有效、副作用更少或更少、更方便或更便宜的产品,我们的商业机会可能会减少或消失。我们的竞争对手也可能比我们更快地获得FDA、欧盟委员会(EC)或其他监管机构对其产品的批准,这可能会导致我们的竞争对手在我们能够进入市场之前,为产品或特定的适应症建立强大的市场地位。因此,由我们的研发努力或我们与合作伙伴共同努力产生的药物可能在商业上与我们竞争对手的现有产品或正在开发的产品不具竞争力。
我们认为有几家公司是我们目前和未来在HAE领域的竞争对手,包括但不限于BioCryst、KalVista、CSL Behring和武田。然而,其他公司也可能为我们已经确定的可能使用rhC1INH治疗的疾病开发替代疗法。如果这些替代疗法更有效、更便宜、更方便或副作用更少,我们的市场机会就会减少。
关于Leniolisib的竞争,我们目前不知道有任何正在进行的APDS开发计划,然而,由于几个计划在开发的早期阶段被停止,这些计划可能随时重新启动,并可能提供如果有效和安全的产品,可以成功地与Leniolisib竞争,并可能显著减少我们未来的市场机会。
我们预计,随着新产品和疗法进入市场,先进技术在HAE领域和即将到来的流水线项目中都可用,我们将面临激烈和日益激烈的竞争。我们预计,我们开发和商业化的任何治疗方法都将以疗效、安全性、交付、患者便利性、价格以及政府和其他第三方付款人是否可以报销为基础进行竞争。
知识产权
专利
专利、技术诀窍、商业秘密和其他知识产权对我们业务的成功非常重要。我们使用专利和许可来保护我们的产品和技术,并谨慎地开发不侵犯第三方知识产权的产品。目前,我们在包括美国、欧洲和日本在内的司法管辖区有几项已批准和正在审批的专利申请。制药公司的专利地位可能是不确定的,可能涉及复杂的法律和事实问题。
目前尚不确定未决的专利申请是否会成功,这些专利是否能提供足够的保护,以及现有专利是否不会受到挑战。未能获得专利可能会导致昂贵和旷日持久的诉讼,以捍卫我们的专有权。我们公司的成功在一定程度上还取决于我们的许可人获得、维护和执行其知识产权的能力,以达到我们开发和商业化我们产品所需的程度。
我们积极寻求保护我们认为对我们的业务重要的知识产权和专有技术,包括寻求、维护、强制执行和捍卫专利权,并保护我们的技术平台和相关疗法和过程的专有技术,无论是内部开发的还是授权给第三方或从第三方获得的。我们的成功将取决于我们获得和维护专利和其他保护的能力,包括对我们的候选产品和平台技术的数据/市场排他性,保护
在不侵犯第三方的有效和可强制执行的专利和专有权利的情况下,对我们的专有技术和运营进行保密。见本年度报告的“风险因素--与知识产权有关的风险”一节。
我们的政策是寻求及早保护我们的专利地位,通常是通过向欧洲专利局提交初始优先权申请。其次是根据《专利合作条约》(PCT)提交国际专利申请,要求优先于最初的申请,然后在包括美国和欧洲在内的地区和国家提交专利授予申请。在每种情况下,我们都会在与我们的专利律师讨论后确定所需的战略和地区,并在适用的情况下与合作伙伴进行讨论,以便我们在对我们的技术和产品候选具有重要商业意义的地区获得相关的覆盖范围。对于我们打算在正常业务过程中开发和商业化的候选产品和相关方法,我们将寻求包括配方、指示用途和给药方法在内的专利保护。如果可能,我们还可以在制造和药物开发过程中寻求专利保护。我们还打算依赖数据独占性、市场独占性、其他法规独占性和专利期延长(如果可用)。我们还依赖于与我们的底层平台技术和候选产品相关的商业秘密和技术诀窍。在每一种情况下,我们都寻求在专利保护的价值和保密专有技术的优势之间取得平衡。
已颁发的专利可以在不同的时间段内对要求保护的标的物提供排他性,通常从专利授予之日开始,到授予专利的国家的专利法定期限结束时到期。自提交申请之日起,临时保护适用于后来准予的索赔范围。一般而言,专利提供的排他性权利自特定国家的非临时专利申请的申请日起20年,或PCT国际专利申请的国际申请日起20年,假设所有维护费均已支付。在某些情况下,专利期限可以增加或减少,这取决于授予专利的国家或司法管辖区的法律法规。在美国,如果一项专利因另一项专利而被最终放弃,或者由于专利权人延迟专利诉讼,专利期限可能会缩短。美国专利的有效期可以通过专利期限调整来延长,该调整可以补偿专利权人因美国专利商标局在授予专利时的行政延误而造成的损失。欧洲专利的专利期为自申请之日起20年,与美国不同,欧洲专利不会像美国专利那样受到专利期调整的影响。在使用优先权申请时,可以在申请之日起20年的专利期中加上优先权年;因此,专利期可以是优先权之日起21年。
专利提供的保护程度可能有所不同,并取决于许多因素,包括专利的类型、其权利要求的覆盖范围、授予专利的国家或地区的权利要求解释和专利法、这些法律规定的专利的有效性和可执行性,以及每个特定国家是否有法律补救办法。
在某些地区或国家,可以使用与监管相关的专利延期来延长要求批准的产品或方法的专利的期限。基于监管的专利期限延长允许专利权人重新获得由于产品候选的监管审查期限而实际上失去的部分专利期限。例如,涵盖FDA批准的药物或生物的美国专利的期限可能有资格获得专利期限延长,这允许恢复专利期限,作为对FDA监管审查过程中丢失的专利期的补偿。1984年的《药品价格竞争和专利期限恢复法》或《哈奇-瓦克斯曼法案》允许专利期限在专利到期后最多延长五年。专利延期不能将一项专利的剩余期限从产品批准之日起总共延长14年,并且只能延长一项适用于经批准的药物的专利。欧洲、日本和其他司法管辖区也有类似的规定,以延长涵盖经批准的药物的专利的期限,例如欧洲的补充保护证书。特别是,在欧洲,对于受基本专利保护的医药产品的有效成分或活性成分组合,如果存在有效的营销授权(这必须是将该产品作为医药产品投放市场的第一次授权),并且该产品尚未成为补充保护的对象,则可获得最长五年半的补充保护。将来,如果我们的其他产品获得FDA批准, 我们预计将为涵盖这些产品的专利申请监管专利期限延长。我们预计,我们的一些已颁发专利可能有资格在某些司法管辖区基于经批准的产品或方法获得专利期延长,但此类延长可能不可用,因此其商业垄断可能仅限于专利期。
截至2021年12月31日,我们独家拥有140项已授权专利,其中8项是美国颁发的,34项正在申请的专利,其中2项是美国正在申请的专利。我们持有已发布或未决专利申请的商业或战略上重要的非美国司法管辖区包括(除欧洲外):英国、中国、日本、加拿大、以色列、澳大利亚和新西兰。我们还拥有诺华211项专利和与leniolisib相关的专利申请的独家许可。
我们已批准的专利和正在申请的专利包括在转基因哺乳动物的牛奶中制造C1INH。此外,我们悬而未决的专利申请还包括C1INH在先兆子痫中的使用要求。
我们目前的专利申请系列针对转基因哺乳动物牛奶中的C1INH,根据专利期限延长,在美国将于2026年到期;在世界其他地区的常规到期日期为2021年;在欧洲,一些国家的专利期限延长至2025年。我们目前的专利家族涵盖了C1INH在先兆子痫中的使用,如果获得批准,预计至少要到2039年才会到期。
商标
我们目前在欧盟、美国和主要国际市场拥有注册商标,我们打算重点关注我们的公司名称“Pharming”及其相关标志“RUCONEST®”及其相关标志,以及Leniolisib的潜在品牌名称,即Joenja。我们已经获得了其他商标的商标保护,包括某些正在开发的产品的潜在名称的商标。在外部律师的协助下,我们定期评估我们应该注册哪些商标以及在哪里注册,我们有有效的制度来确保及时提交续展申请。我们还维持手表服务,确保我们的商标不会在国际上受到侵犯。
政府管制与产品审批
美国
在美国,FDA根据联邦食品、药物和化妆品法案(FDCA)及其实施条例对药品进行监管。获得监管批准和随后遵守适当的联邦、州、地方和非美国法律和法规的过程需要花费大量的时间和财力。在药物开发过程、批准过程或批准后的任何时候,如果申请人未能遵守适用的美国要求,可能会受到各种行政或司法制裁,例如FDA拒绝批准未决的NDA或BLA、撤回批准、实施临床暂停、发布警告或无标题信件、产品召回、产品扣押、完全或部分暂停生产或分销、禁令、罚款、拒绝政府合同、恢复原状、退货或民事或刑事处罚。
FDA在一种药物可以在美国上市之前所要求的程序通常包括:
•完成临床前实验室测试、动物研究和配方研究,符合FDA的良好实验室规范或GLP规定;
•向FDA提交IND,该IND必须在人体临床试验开始之前生效;
•在每个临床试验开始之前,由一个独立的机构审查委员会或IRB在每个临床地点批准;
•根据良好的临床实践或GCP要求,进行充分和良好控制的临床试验,以确定每个适应症的拟议药物的安全性和有效性;
•如适用,支付使用费;
•向FDA提交注册申请(即NDA或BLA);
•令人满意地完成FDA对生产产品的一个或多个制造设施的检查,以评估符合cGMP要求的情况,并确保设施、方法和控制足以保持药物的特性、强度、质量和纯度;
•令人满意地完成FDA对选定临床地点的检查,以确保符合GCP和临床数据的完整性;
•令人满意地完成FDA咨询委员会的审查;如果适用,以及
•FDA对注册备案的审查和批准。
临床前研究
临床前研究包括对产品化学、毒性和配方的实验室评估,以及评估潜在安全性和有效性的动物研究。IND赞助商必须将非临床试验的结果与生产信息、分析数据和任何可用的临床数据或文献等一起提交给FDA,作为IND的一部分。即使在提交IND后,一些非临床测试也可能继续进行。IND在FDA收到后30天自动生效,除非在此之前FDA对一项或多项拟议的临床试验提出担忧或问题,并将临床试验搁置。在这种情况下,IND赞助商和FDA必须在临床试验开始之前解决任何悬而未决的问题。因此,提交IND可能不会导致FDA允许临床试验开始。
临床试验
临床试验涉及在符合GCP要求的合格研究人员的监督下,将正在研究的新药或生物给药给人类受试者,其中包括要求所有研究对象以书面形式提供参与任何临床试验的知情同意书。临床试验是在详细说明试验目标、用于监测安全性的参数和将要评估的有效性标准的方案下进行的。作为IND的一部分,必须向FDA提交每项临床试验的方案和任何后续的方案修正案。此外,参与临床试验的每个机构的内部评审委员会必须在该机构开始临床试验之前审查和批准任何临床试验的计划,并且在临床试验进行期间,内部评审委员会必须继续监督临床试验。人体临床试验通常分三个连续阶段进行,这三个阶段可能重叠,也可能合并。在第一阶段,药物或生物药物最初被引入健康的人体受试者或患有目标疾病或状况的患者,并对安全性、剂量耐受性、吸收、代谢、分布、排泄进行测试,如果可能的话,获得其有效性的初步迹象。在第二阶段,药物或生物制剂用于有限的患者群体,以确定可能的不良反应和安全风险,初步评估该产品对特定目标疾病的疗效,并确定剂量耐受性和最佳剂量。在第三阶段,药物或生物制剂在良好控制的临床试验中,通常在地理上分散的临床试验地点,给更多的患者群体使用,以产生足够的数据,以统计方式评估产品的安全性和有效性,以获得注册批准。, 建立产品的总体风险-收益概况,并为产品的标签提供足够的信息。
详细说明临床试验结果的进展报告必须至少每年提交给FDA,如果发生SAE,则更频繁地提交。第一阶段、第二阶段和第三阶段临床试验可能不会在任何指定的时间内成功完成,或者根本不会成功完成。此外,FDA或赞助商可随时以各种理由暂停或终止临床试验,包括发现研究对象面临不可接受的健康风险。同样,如果一项临床试验不是按照该委员会的要求进行的,或者如果该药物与患者受到意外的严重伤害有关,IRB可以暂停或终止对其所在机构的临床试验的批准。
临床试验中使用的药物或生物制品必须按照cGMP生产。
在产品开发过程中,FDA提供了就开发计划进行对话和指导的机会。有几种类型的正式会议取决于开发阶段和产品类型。FDA的建议通常是基于有关质量(化学、制造和对照测试)、非临床测试和临床研究的问题提供的。这种建议对有关产品未来的任何注册申请没有法律约束力,但有助于产品开发和了解FDA的期望。
上市审批
假设成功完成所需的临床测试,临床前研究和临床试验的结果,以及与产品的化学、制造和控制相关的详细信息,以及建议的标签等,将作为NDA或BLA的一部分提交给FDA,请求批准将该产品用于一个或多个适应症的市场。在大多数情况下,提交保密协议或BLA需要缴纳高额的申请使用费。根据目前生效的《处方药使用费法案》(PDUFA)指南,FDA的目标是自提交标准NDA或BLA之日起10个月内
新的分子实体或生物实体,并对提交的此类实体进行审查并采取行动。这项审查通常需要12个月的时间,从NDA或BLA提交给FDA之日起算,因为FDA有大约两个月的时间来做出“备案”决定。
FDA还可能要求提交风险评估和缓解战略,或REMS计划,以确保药物的好处大于其风险。REMS计划可能包括药物指南、医生沟通计划、评估计划和/或确保安全使用的要素,如受限分配方法、患者登记或其他风险最小化工具。
FDA在接受所有NDA或BLA之前,在提交后的第一个60天内对它们进行初步备案审查,以确定它们是否足够完整,允许进行实质性审查。FDA可能会要求提供更多信息,而不是接受NDA或BLA的申请。在这种情况下,申请必须连同附加信息一起重新提交。重新提交的申请在FDA接受备案之前也要进行审查。一旦提交的申请被接受,FDA就开始进行深入的实质性审查。FDA审查NDA或BLA,以确定药物是否安全有效,以及其制造、加工、包装或持有的设施是否符合旨在确保产品持续安全、质量和纯度的标准。
FDA可能会将申请提交给咨询委员会。咨询委员会是由包括临床医生和其他科学专家在内的独立专家组成的小组,负责审查、评估申请并就是否应批准申请以及在何种条件下提供建议。FDA不受咨询委员会建议的约束,但它在做出决定时会仔细考虑这些建议。
在批准NDA或BLA之前,FDA通常会检查生产该产品的一个或多个设施。FDA将不会批准申请,除非它确定制造工艺和设施符合cGMP要求,并足以确保产品在所要求的规格下一致生产。此外,在批准NDA或BLA之前,FDA通常会检查一个或多个临床试验地点,以确保符合GCP要求。
可批准的保密协议或BLA的测试和数据获取过程需要大量的时间、精力和财政资源,并需要数年时间才能完成。从临床前和临床试验中获得的数据并不总是决定性的,可能会受到不同解释的影响,这可能会推迟、限制或阻止监管部门的批准。FDA可能不会及时批准NDA或BLA,或者根本不批准。
在评估了NDA或BLA和所有相关信息后,包括咨询委员会的建议(如果有)以及关于制造设施和临床试验地点的检查报告,FDA可能会出具批准信,在某些情况下,可能会出具完整的回复信。一封完整的回复信通常包含为确保NDA或BLA的最终批准而必须满足的特定条件的声明,并可能需要额外的临床或临床前测试,以便FDA重新考虑申请。即使提交了这一补充信息,FDA最终也可能决定该申请不符合批准的监管标准。如果这些条件得到了FDA的满意,FDA通常会签发一封批准信。批准函授权该药物的商业营销,并提供特定适应症的具体处方信息。
即使FDA批准了一种产品,它也可以限制批准的产品使用适应症,要求在产品标签中包括禁忌症、警告或预防措施,要求进行批准后的研究,包括第四阶段临床试验,以在批准后进一步评估药物的安全性,要求测试和监督计划在产品商业化后对产品进行监控,或施加其他条件,包括分销和使用限制或REMS下的其他风险管理机制,这可能会对产品的潜在市场和盈利能力产生重大影响。FDA可以根据上市后研究或监测计划的结果,阻止或限制产品的进一步营销。批准后,对批准的产品的某些类型的更改,如增加新的适应症、制造更改和额外的标签声明,将受到进一步的测试要求和额外的FDA审查和批准程序的约束。
孤儿药物名称
根据《孤儿药品法》,FDA可以将一种用于治疗罕见疾病或病症的药物授予孤儿药物称号,这种疾病或病症在美国影响不到20万人,或者如果影响超过20万人,则没有合理的期望认为该药物在美国的销售将足以抵消在美国开发和提供药物的成本。在提交NDA或BLA之前,必须申请指定孤儿药物。指定孤儿药物不会在监管审查和批准过程中传递任何优势,也不会缩短监管审查和批准过程的持续时间。如果FDA批准了赞助商对用于治疗指定罕见病或疾病的指定孤儿药物的营销申请,该赞助商有资格获得七年的市场排他期,在此期间,FDA不得批准另一赞助商对与批准的孤儿药物具有相同活性部分并用于相同用途或适应症的药物的营销申请,除非在有限的情况下,如后续赞助商证明其产品在临床上优越。然而,在赞助商的罕见药专营期内,参赛者可以批准活性部分不同的药物与批准的孤儿药物相同的适应症,或者批准活性部分与批准的孤儿药物相同的药物,但批准的适应症不同。如果竞争对手获得了用于相同适应症的具有相同活性部分的药物的批准,则孤立药物独占性可能会在七年内阻止我们的产品获得批准,除非我们能够证明存在撤销孤立药物独占性的理由,或者我们的产品具有临床优势。进一步, 如果一种指定的孤儿药物获得了上市批准,其适应症的范围比它获得孤儿药物指定的罕见疾病或疾病的适应症更广,它可能没有资格获得排他性。
儿科发展
根据《儿科研究公平法》,某些新药、BLA或新药或BLA的补充剂必须包含足够的数据,足以评估药物在所有相关儿科亚群中声称的适应症的安全性和有效性,并支持对产品安全有效的每个儿科亚群的剂量和给药。FDA可以主动或应申请人的要求,批准推迟提交部分或全部儿科数据,直到批准该产品用于成人,或完全或部分免除儿科数据要求。除非法规另有要求,否则儿科数据要求不适用于具有孤儿称号的产品。
数据独占性
在美国,仿制小分子药物的申请可能不需要包括临床前和临床试验的结果,而是可以参考监管数据排他性已经到期的参考产品的上市授权中包含的数据。
在美国,简化的新药申请(或ANDA)包含提交给FDA的数据,以供审查和可能批准的小分子仿制药产品。一旦获得批准,申请者可以生产和销售仿制药产品,以提供安全、有效、成本较低的替代其引用的品牌药物。
审批后要求
根据FDA批准生产或分销的药品须受到FDA普遍和持续的监管,其中包括与记录保存、定期报告、产品抽样和分销、广告和促销以及报告产品不良反应有关的要求。批准后,对已批准产品的更改,如增加新的适应症、制造更改或其他标签声明,必须遵守进一步的测试要求,在许多情况下还需事先获得FDA的审查和批准。此外,市场上销售的产品和制造此类产品的机构仍需缴纳年度使用费,临床数据补充应用的申请费也将继续征收。即使FDA批准了一种产品,它也可以限制批准的产品使用适应症,要求在产品标签中包括禁忌症、警告或预防措施,包括方框警告,要求进行批准后的研究,包括第四阶段临床试验,以进一步评估批准后药物的安全性,要求测试和监督计划,以监测商业化后的产品,或施加其他条件,包括销售限制或REMS下的其他风险管理机制,这可能对产品的潜在市场和盈利能力产生重大影响。FDA可以根据上市后研究或监测计划的结果,阻止或限制产品的进一步营销。此外,制造商和其他参与制造和分销经批准的药品或
生物制品要接受FDA的定期突击检查,以确保符合cGMP要求。对制造工艺的更改受到严格监管,通常需要FDA事先批准才能实施。FDA的规定还要求调查和纠正与cGMP的任何偏差,并对赞助商和赞助商可能决定使用的任何第三方制造商提出报告和文件要求。因此,制造商必须继续在生产和质量控制领域花费时间、金钱和精力,以保持cGMP合规性。
一旦批准,如果没有保持对监管要求和标准的遵守,或者如果产品上市后出现问题,FDA可能会撤回批准。
后来发现以前未知的产品问题,包括意料之外的严重程度或频率的不良反应,或制造工艺,或未能遵守法规要求,可能会导致强制修订批准的标签以添加新的安全信息;实施上市后研究或临床试验以评估新的安全风险;或根据REMS计划实施分销或其他限制。除其他外,其他潜在后果包括:
•限制产品的销售或制造,完全从市场上撤回产品或召回产品;
•对批准后的临床试验处以罚款、警告信或暂停;
•FDA拒绝批准待批准的NDA、BLAS或对已批准的NDAS的补充、BLAS或暂停或撤销产品批准;
•扣押、扣留产品,或者拒绝允许产品进出口的;
•禁制令或施加民事或刑事处罚。
FDA对投放市场的产品的营销、标签、广告和促销进行严格监管。药品或生物制品只能针对批准的适应症并根据批准的标签的规定进行推广,尽管医生在医学实践中可能会为未经批准的适应症开出批准的产品。FDA和其他机构积极执行禁止推广标签外用途的法律法规,被发现不当推广标签外用途的公司可能会承担重大责任。
此外,处方药产品的分销受《处方药营销法》(PDMA)的约束,该法案在联邦一级管理药品和药品样品的分销,并为各州对药品分销商的注册和监管设定了最低标准。PDMA和州法律都对处方药产品样本的分发进行了限制,并要求确保分发中的责任。
联邦和州欺诈和滥用、数据隐私和安全以及透明度法律和法规
除了FDA对药品营销的限制外,联邦和州医疗保健法律法规还限制生物制药行业的商业行为。这些法律可能会影响我们当前和未来的业务运营,包括我们的临床研究活动,以及销售、营销和教育计划,并约束我们通过其营销、销售和分销RUCONEST®和我们获得营销批准的其他产品的业务或财务安排以及与医疗保健提供商和其他方的关系。这些法律包括反回扣和虚假声明法律法规、数据隐私和安全以及透明度法律法规,包括但不限于下述法律。
除其他事项外,联邦反回扣法规禁止故意提供、支付、索取或接受报酬,以诱导或作为购买、租赁、订购、安排或推荐购买、租赁或订购根据Medicare、Medicaid或其他联邦医疗保健计划可报销的任何物品或服务的回报。“报酬”一词被广泛解释为包括任何有价值的东西。反回扣法规被解释为适用于药品制造商与处方者、购买者和处方管理人之间的安排。虽然有一些法定豁免和监管避风港保护一些常见的活动免受起诉,但豁免和避风港的范围很窄。涉及报酬的做法如果不符合豁免或避风港的资格,可能会受到审查,因为这些做法可能被指控旨在诱使开处方、购买或推荐。几个法院已经解释了这项法规的意图
要求意味着,如果涉及薪酬的安排的任何一个目的是诱导转介联邦医疗保健覆盖的业务,则违反了法规。
个人或实体不需要实际了解这一法规或违反该法规的具体意图即可实施违规行为。此外,政府可以断言,包括违反联邦反回扣法规的物品或服务的索赔,根据联邦民事虚假索赔法案或民事罚款法规的目的,构成虚假或欺诈性索赔,该法规对任何被确定向或导致向联邦卫生计划提交索赔的人施加处罚,该人知道或应该知道该人针对的项目或服务没有按照索赔提供,或者是虚假或欺诈性的。
联邦虚假索赔法律,包括联邦民事虚假索赔法案,禁止任何个人或实体故意向联邦政府提交或导致提交虚假索赔,或故意制作、使用或导致制作或使用虚假记录或陈述,对虚假或欺诈性索赔具有重要意义。索赔包括对提交给美国政府的金钱或财产的“任何请求或要求”。根据这些法律,制药和其他医疗保健公司已被起诉,罪名包括涉嫌向客户免费提供产品,并预期客户将为产品向联邦计划收费。此外,制药公司和其他公司也被起诉,因为这些公司营销产品用于未经批准的、因此不可报销的用途,从而导致提交虚假索赔。
1996年的联邦健康保险携带和责任法案,或HIPAA,制定了额外的联邦刑法,禁止明知和故意执行或试图执行诈骗任何医疗福利计划的计划,包括私人第三方付款人,明知和故意伪造、隐瞒或掩盖重大事实,或作出任何与提供或支付医疗福利、项目或服务有关的重大虚假、虚构或欺诈性陈述。此外,许多州都有类似的欺诈和滥用法律或法规,适用于根据医疗补助和其他州计划报销的项目和服务,或者在几个州,无论付款人如何,都适用。
此外,我们可能受到联邦政府和我们开展业务所在州的数据隐私和安全法规的约束。HIPAA经《促进经济和临床健康的健康信息技术法案》(HITECH)及其各自的实施条例修订后,对某些类型的个人和实体,包括承保实体(健康计划、健康信息交换中心和某些医疗保健提供者)及其商业伙伴及其分包商,提出了与个人可识别健康信息的隐私、安全和传输有关的具体要求。除其他事项外,HITECH使HIPAA的安全标准直接适用于“商业伙伴”,商业伙伴被定义为与为覆盖实体或代表覆盖实体提供服务相关的创建、接收、维护或传输受保护健康信息的独立承包商或代理。HITECH还增加了对覆盖实体、商业伙伴和可能的其他人施加的民事和刑事处罚,并赋予州总检察长新的权力,可以向联邦法院提起民事诉讼,要求损害赔偿或禁制令,以执行联邦HIPAA法律,并寻求与提起联邦民事诉讼相关的律师费和费用。此外,州法律在某些情况下管理健康信息的隐私和安全,其中许多没有得到HIPAA的先发制人,在很大程度上彼此不同,可能不会产生相同的效果,从而使合规工作复杂化。
联邦医生支付阳光法案要求某些药品、设备、生物制品和医疗用品的制造商每年向联邦医疗保险和医疗补助服务中心(CMS)报告与向医生(如该法律定义的)和其他医疗保健专业人员(如医生助理和护士从业者)、教学医院、适用的制造商和适用的团购组织支付或以其他方式转移价值有关的信息,以便每年向CMS报告,以及医生及其直系亲属持有的所有权和投资权益。
我们还可能受到州法律的约束,州法律要求制药公司遵守制药行业的自愿合规指南和联邦政府颁布的相关合规指南,以及州法律要求药品制造商报告与向医生和其他医疗保健提供者或营销支出支付和其他价值转移有关的信息。此外,某些州和地方法律要求药品销售代表注册。
由于这些法律的范围广泛,而现有的法定和监管豁免范围很窄,我们的一些商业活动可能会受到一项或多项此类法律的挑战。如果我们的业务被发现违反了上述任何联邦和州法律或适用于我们的任何其他政府法规,我们可能会受到惩罚,包括刑事和重大民事罚款、损害赔偿、罚款、监禁、额外的报告要求和监督,如果我们受到公司诚信协议或类似协议的约束,以解决有关违反这些法律的指控、合同损害、声誉损害、利润减少和未来收益、返还、被排除在政府医疗保健计划之外以及削减或重组我们的业务,任何这些都可能对我们的业务运营能力和我们的运营结果产生不利影响。如果我们的任何产品在国外销售,我们可能会受到类似的外国法律法规的约束,其中可能包括,例如,适用的上市后要求,包括安全监控、反欺诈和滥用法律、实施公司合规计划以及向医疗保健专业人员报告付款或价值转移。
《反海外腐败法》、荷兰反贿赂法等法律
《反海外腐败法》禁止任何美国个人或企业直接或间接向任何外国官员、政党或候选人支付、提供或授权支付或提供任何有价值的东西,目的是影响外国实体的任何行为或决定,以帮助该个人或企业获得或保留业务。《反海外腐败法》还要求证券在美国上市的公司遵守会计规定,要求公司保存准确和公平地反映公司(包括国际子公司)所有交易的账簿和记录,并为国际业务设计和维护适当的内部会计控制系统。违反《反海外腐败法》的活动,即使完全发生在美国以外,也可能导致刑事和民事罚款、监禁、交还、监督和取消政府合同的资格。
我们的业务还受非美国反腐败法律的约束,例如《荷兰刑法》(Wetboek Van Strafrecht)中所载的荷兰反贿赂法律。这些法律一般禁止公司和个人(包括我们和我们的雇员)和中间人直接或间接地向国内或外国政府官员提供、提供、请求或接受礼物承诺或服务或任何其他有价值的东西,或向或从受雇或以代理人身份行事的其他人提供礼物承诺或服务或任何其他有价值的东西,这些礼物承诺或服务是与在官员办公室内作出或已经作出的作为或不作为有关的,或者如果涉及其他受雇人员或代理人,违反了其他人的职责。
我们还须遵守管理我们国际业务的其他法律和条例,包括由荷兰和美国政府以及欧洲联盟当局管理的条例,例如,包括适用的出口管制条例、对某些国家、个人、团体、实体、项目或活动的贸易和经济制裁和禁运、反洗钱法、进口和海关要求以及货币兑换条例,统称为贸易管制法。
如果不遵守《反海外腐败法》、荷兰反贿赂法以及其他反腐败法和贸易管制法,我们和其他涉案人员可能会受到刑事和民事处罚、返还和其他制裁和补救措施,以及法律费用。
欧盟
EMA和EC在医药产品上市前所要求的流程类似于FDA所描述的流程,通常包括:
•完成临床前实验室测试、动物研究和配方研究,符合良好实验室规范或GLP;
•CTA提交,必须在人体临床试验开始之前获得批准;
•在每个临床试验开始之前,由一个独立的伦理委员会发表积极的意见,或在未来至少有一个独立的伦理委员会;
•根据良好的临床实践或GCP要求,进行充分和良好控制的临床试验,以确定建议药物对每个适应症的疗效;
•提交销售授权申请(MAA);
•满意地完成对生产产品的一个或多个制造设施的检查,以评估是否符合GMP要求,并确保设施、方法和控制足以保持药物的特性、强度、质量和纯度;
•令人满意地完成对选定临床地点的检查,以确保符合GCP和临床数据的完整性;
•EMA评估和意见;以及
•欧共体根据EMA建议授予营销授权(MA)。
此外,包括高级治疗药物产品在内的医药产品在上市前和上市后都受到欧盟和国家监管机构的广泛监管。ATMP包括基因治疗产品、体细胞治疗产品和组织工程产品,这些产品是经过大量操作的细胞或组织,用于人体组织的再生、修复或替换。RUCONEST®在欧盟被作为ATMP进行监管。
此外,在欧洲联盟一级有关于采集和测试人类血液和血液成分的质量和安全标准的立法,这些标准适用于我们的人类血液和/或基于细胞的产品的制造。许多欧洲联盟成员国都有国家立法,这可能比欧洲联盟的立法更具限制性。欧盟成员国不同的国家要求可能会使建立合规的跨境供应链具有挑战性。
临床前研究
临床前研究包括对产品化学、毒性和配方的实验室评估,以及评估潜在安全性和有效性的动物研究。赞助商必须将非临床试验的结果与生产信息、分析数据和任何可用的临床数据或文献等一起提交给临床试验申请或CTA。即使在CTA之后,一些非临床测试也可能继续进行。CTA赞助商和相关成员国主管当局必须在临床试验开始之前解决任何悬而未决的问题。因此,提交CTA可能不会导致允许临床试验开始。
临床试验
在欧盟,医疗产品的临床试验必须根据欧盟和国家法规以及国际协调会议(ICH)、良好临床实践指南(GCP)进行。欧盟委员会的其他GCP指南,特别是对可追溯性的关注,适用于ATMP的临床试验。发起人必须购买临床试验保险单,在大多数欧盟成员国,发起人有责任向在临床试验中受伤的任何研究对象提供“无过错”赔偿。
在开始临床试验之前,赞助商必须获得主管当局的临床试验授权,以及独立伦理委员会的积极意见。临床试验授权的申请除其他事项外,必须包括一份试验方案的副本和一份包含被调查药品的生产和质量信息的调查药品档案。
目前,临床试验授权申请可根据欧盟个别成员国与《临床试验指令》相关的国家实施法律的要求提交,或根据《临床试验条例》提交。根据新的欧盟临床试验条例(CTR),从2022年1月31日起,赞助商可以使用该条例,并将在2023年启动新的临床试验时成为强制性的,将有一个集中的申请程序。欧盟CTR将允许赞助商向主管当局(CA)和道德委员会提交一份关于欧盟国家打算通过中央系统参与特定试验的所有试验点的综合CTA。申请将需要一个两部分的过程,其中第一部分是由报告成员国(RMS)协调的科学评估,第二部分是成员国的具体评估。临床试验批准将作为单一成员国的意见发布,遵循CA和道德委员会对每个国家的评估,而不是根据个别国家的流程和时间表,目前由特定国家的CA批准和道德委员会的意见。最好的情况是,这种效率将浓缩欧盟网站激活的里程碑。
临床试验中使用的药品必须按照GMP生产。其他国家和欧盟范围的监管要求也适用。
在医药产品的开发过程中,欧洲药品管理局和欧盟内的国家医药产品监管机构提供机会,就开发计划进行对话和指导。在EMA层面,这通常是以科学建议的形式进行的,这是由人用药品委员会(CHMP)的科学建议工作组提供的。每一个科学建议程序都会产生一笔费用。EMA的建议通常是基于质量(化学、制造和控制测试)、非临床测试和临床研究以及药物警戒(也称为药物安全)计划和风险管理计划等问题提供的。根据EMA政策,这种科学建议对有关产品未来的任何营销授权申请不具有法律约束力,但有助于产品开发和了解EMA的期望。
孤儿药物的指定和排他性
根据(EC)第847/2000号条例实施的条例(EC)第141/2000号规定,产品可被欧盟委员会指定为孤儿药物,前提是其赞助商能够证明:该产品旨在诊断、预防或治疗(1)在提出申请时在欧盟影响不超过万分之五的危及生命或长期衰弱的疾病,或(2)在欧盟危及生命、严重虚弱或严重和慢性的疾病,并且如果没有激励措施,该药物在欧盟的销售不太可能产生足够的回报,以证明必要的投资是合理的。对于上述任何一种情况,申请者必须证明没有欧盟授权的令人满意的诊断、预防或治疗该疾病的方法,或者,如果存在这种方法,该药物必须与针对该疾病的产品相比具有显著的益处。
在欧盟,被指定为孤儿产品的申请可以在MAA提交之前的任何时间提出。孤儿药品指定使申请者有权获得诸如费用减免、礼仪援助和进入集中MA程序等激励措施。在批准MA后,孤儿药品有权获得批准的治疗适应症的十年市场专营期,这意味着EMA不能接受另一项MA,或批准MA,或接受将同一适应症的类似产品的MA延长十年的申请。对于也符合商定的儿科调查计划(PIP)的孤儿药品,市场排他期延长两年。任何补充保护证书不得根据有关孤儿症状的儿科研究予以延期。孤儿药品指定不会在监管审查和批准过程中传达任何优势,也不会缩短监管审查和批准过程的持续时间。
但是,如果在第五年结束时确定该产品不再符合其获得孤儿医药产品目的地所依据的标准,则市场专营期可缩短至六年,包括能够根据现有证据证明原始孤儿医药产品的利润足够高而不足以证明维持市场专营性是合理的,或者疾病的流行率已超过门槛。此外,在以下情况下,在十年期间,可向具有相同孤儿适应症的类似医药产品授予MA:(I)授权产品的MA持有人同意第二次最初的孤儿医药产品申请,(Ii)原始孤儿医药产品的制造商无法供应足够的数量;或(Iii)第二申请人可以证明其产品虽然相似,但更安全、更有效或在临床上优于授权孤儿医药产品。公司可以自愿将一种产品从孤儿产品登记册中删除。“类似医药产品”的定义是含有与批准的孤儿医药产品中所含的一种或多种类似活性物质的医药产品,其目的是用于相同的治疗适应症。
营销授权
为了在欧盟获得产品的营销授权或MA,申请人必须提交营销授权申请或MAA,要么是根据欧洲药品管理局或EMA管理的中央程序,要么是根据欧盟成员国主管当局管理的程序之一
国家(分散程序、国家程序或相互承认程序)。MA只能授予在欧盟成立的申请者。
中央程序规定由欧盟委员会授予对所有欧盟成员国都有效的单一并购。根据(EC)第726/2004号条例,对于特定产品,包括(I)生物技术产品,(Ii)被指定为孤儿药物的产品,(Iii)高级治疗药物(ATMP),以及(Iv)含有用于治疗艾滋病毒/艾滋病、癌症、神经退行性疾病、糖尿病、自身免疫和其他免疫功能障碍以及病毒疾病的新活性物质的产品,必须实行集中管理程序。对于含有用于治疗其他疾病的新活性物质的产品,以及具有高度创新性或通过授权进行集中处理有利于患者利益的产品,在相关批准时,集中处理是可选的。
根据中央程序,EMA的人用药品委员会(CHMP)负责对产品进行初步评估。CHMP还负责几项授权后和维护活动,例如对现有MA的修改或扩展进行评估。
在欧盟的中央程序下,MAA评估的最长时限为210天,不包括申请人在回答CHMP问题时提供补充信息或书面或口头解释的时间停顿。在特殊情况下,如果从公共卫生的角度,特别是从治疗创新的角度,预计一种针对未得到满足的医疗需求的医药产品具有重大利益,则CHMP可以批准加速评估。如果CHMP接受加速评估的请求,210天的时限将减少到150天(不包括时钟停顿)。然而,如果CHMP认为不再适合进行加速评估,它可以恢复到集中程序的标准时限。
对于诸如RUCONEST的ATMP的评估,高级治疗委员会或CAT与CHMP一起负责评估。CAT主要负责对ATMP的科学评估,并就提交上市授权申请的每一种ATMP的质量、安全性和有效性起草意见草案。然后,在考虑到所确定的利益和风险的平衡情况下,CHMP在给出其对产品授权的最终意见时,将考虑禁止酷刑委员会的意见。尽管禁止酷刑委员会的意见提交给CHMP进行最终批准,但如果CHMP提供了详细的科学依据,CHMP可能会偏离该意见。CHMP和CAT还负责提供有关ATMP的指南,并发布了许多指南,包括关于基因疗法和细胞疗法的具体指南。这些指南就EMA将考虑的与开发和评估ATMP有关的因素提供了额外的指导,其中包括确定ATMP的特征所需的临床前研究;应在上市授权申请中提交的制造和控制信息;以及监测患者和评估ATMP的长期疗效和潜在不良反应所需的批准后措施。
与集中授权程序不同,分散的MA程序需要单独向产品销售所在的每个欧盟成员国的主管当局提出申请,并由其单独批准。这一申请与将通过中央程序提交给环境管理机构进行授权的申请相同。欧盟参考成员国在收到有效申请后120天内编写评估草案和相关材料草稿。由此产生的评估报告将提交给有关欧盟成员国,这些成员国必须在收到评估报告和相关材料后90天内决定是否批准该报告和相关材料。如果相关欧盟成员国出于对公共卫生潜在严重风险的担忧而不能批准评估报告和相关材料,争议内容可能会提交给药品机构负责人相互认可和下放程序协调小组(CMDH)进行审查。欧盟委员会随后的决定对所有欧盟成员国都具有约束力。
互认程序允许已经在一个欧盟成员国拥有授权的医药产品的公司申请这一授权,以获得其他欧盟成员国的主管当局的承认。与权力下放程序一样,相互承认程序的基础是欧盟成员国的主管当局接受其他欧盟成员国的主管当局对医药产品的认可。国家管理机构持有人可向主管机关提出申请。
一个欧盟成员国请求该机构承认另一个欧盟成员国主管机构提交的MA。
MA的初始有效期原则上为5年。MA可在五年后续签,其依据是EMA或最初授予MA的欧盟成员国的主管国家当局对风险-收益平衡进行重新评估。为支持申请,MA持有者必须在MA失效前至少9个月向EMA或主管国家当局提供ECTD(通用技术文件)的综合版本,提供有关产品质量、安全性和有效性的最新数据,包括自授予MA以来引入的所有变化。欧盟委员会或欧盟成员国主管当局可基于与药物警戒有关的正当理由,决定将MA的续展期再延长5年。一经其后最终续期,金融管理专员的有效期为无限期。任何授权之后,如果没有在授权失效后三年内将医药产品实际投放到欧盟市场(进行集中的MA)或授权的欧盟成员国的市场上(所谓的日落条款)。
针对未得到满足的医疗需求并有望对公众健康有重大影响的创新产品可能有资格获得一些快速开发和审查计划,如优先药品计划,该计划提供类似于美国突破性治疗指定的激励措施。PRIME是一项自愿计划,旨在加强EMA对针对未得到满足的医疗需求的医疗产品开发的支持。符合条件的产品必须针对存在未得到满足的医疗需求的情况(欧盟没有令人满意的诊断、预防或治疗方法,或者,如果有,新的医疗产品将带来重大的治疗优势),并且它们必须展示通过引入新的治疗方法或改进现有方法来满足未得到满足的医疗需求的潜力。具有Prime称号的候选产品的赞助商将获得好处,包括但不限于,及早与EMA进行积极主动的监管对话,频繁讨论临床试验设计和其他开发计划要素,以及在提交档案后可能加快MAA评估。
在欧盟,在尚未获得所有所需的安全性和有效性数据的情况下,可能会授予“有条件的”MA。如果证明符合以下所有标准,欧盟委员会可批准医药产品的有条件并购:(I)医药产品的效益-风险平衡为正;(Ii)申请人很可能能够在授权后提供全面的数据;(Iii)医药产品满足未得到满足的医疗需求;以及(Iv)患者可立即获得医药产品的好处大于仍需要额外数据的固有风险。有条件的MA必须满足生成丢失数据或确保增加安全措施的条件。它的有效期为一年,必须每年续签,直到所有相关条件都满足为止。一旦提供了任何悬而未决的研究,条件MA就可以转换为传统MA。然而,如果这些条件没有在EMA设定的时间框架内得到满足并得到欧盟委员会的批准,MA将停止续签。
在“特殊情况下”,如果申请人能够证明,即使在产品获得授权和实施特定程序后,它也无法提供有关正常使用条件下的疗效和安全性的全面数据,也可以授予MA。这些情况尤其可能发生在预期的适应症非常罕见,而且在当时的科学知识状况下,不可能提供全面的信息,或者当生成数据可能违反普遍接受的伦理原则时。与有条件的MA一样,在特殊情况下授予的MA是指拟被授权用于治疗罕见疾病或未得到满足的医疗需求的医药产品,而申请人并不持有授予标准MA所需的完整数据集。不过,与有条件收购不同的是,在特殊情况下申请认可的申请人其后无须提供遗失的数据。虽然“在特殊情况下”的MA是最终批准的,但医药产品的风险-收益平衡每年都会得到审查,如果风险-收益比率不再有利,MA将被撤回。
除了MA之外,各种其他要求也适用于制造和投放到欧盟市场的医药产品。在欧盟制造医药产品需要制造授权,而向欧盟进口医药产品需要允许进口的制造授权。制造授权持有人必须遵守适用的欧盟法律、法规和指南中规定的各种要求。这些要求包括在制造时符合欧盟GMP标准
医药产品和原料药,包括在欧盟以外制造原料药,打算将原料药进口到欧盟。同样,医药产品在欧盟境内的分销必须遵守适用的欧盟法律、法规和准则,包括要求持有欧盟成员国主管当局授予的适当的分销授权。如果MA持有者和/或制造和进口授权者,或MIA持有者和/或分销授权者,在不遵守欧盟或欧盟成员国适用于医药产品制造的要求的情况下,可能受到民事、刑事或行政制裁,包括暂停制造授权。
欧盟成员国可通过国家立法,禁止或限制销售、供应或使用含有、组成或源自特定类型的人类或动物细胞,如胚胎干细胞的任何医药产品。虽然我们正在开发的产品不使用胚胎干细胞,但某些欧盟成员国的国家法律可能会禁止或限制我们将产品商业化,即使它们已获得欧盟营销授权。
儿科发展
在欧盟,开发新医疗产品的公司必须同意覆盖所有儿科人群的儿科调查计划或PIP,并必须根据该PIP进行儿科临床试验,除非适用延期或豁免(例如,因为相关疾病或状况只发生在成人中)。产品的营销授权申请必须包括根据PIP进行的儿科临床试验的结果,除非适用豁免或已批准延期,在这种情况下,儿科临床试验必须在晚些时候完成。根据PIP进行的儿科临床试验获得上市授权的产品有资格根据补充保护证书(如果在批准时有效)获得六个月的保护延长,或者对于孤儿医药产品,有资格将孤儿市场排他性延长两年。这一儿科奖励受到特定条件的制约,在开发和提交符合PIP的数据时不会自动获得。
数据和市场排他性
欧盟为与MA相关的数据和市场排他性提供机会。创新医药产品一般有权享受8年的数据独占权和10年的市场独占权。如果授予数据排他性,欧盟监管机构在自创新产品授权之日起八年内不得参考创新者的数据来评估仿制药应用或生物相似应用。在这一期限结束后,可以提交仿制药或生物相似药的MAA,并可以参考创新者的数据。市场排他期阻止成功的仿制药或生物相似申请者在欧盟将其产品商业化,直到从欧盟参考产品的初始MA起十年后。如果在十年的头八年中,MA持有者获得了一个或多个新的治疗适应症的授权,在授权之前的科学评估期间,这些适应症被认为与现有疗法相比能够带来显著的临床益处,则十年的市场专营期偶尔可以再延长一年,最长可达11年。然而,不能保证产品会被欧盟监管机构视为新的化学/生物实体,产品可能没有资格获得数据排他性。
审批后要求
与美国的审批后流程类似,根据欧盟营销授权生产或分销的药品或生物制品受到持续监管,其中包括与定期报告、产品抽样和分销、广告以及产品不良反应的宣传和报告有关的要求。授权后,对批准的产品的更改,如增加新的适应症、制造更改或其他标签声明,须遵守进一步的测试要求和事先的EMA审查和/或EC批准。
此外,上市授权的持有者必须建立和维护药物警戒系统,并任命一名个人合格的药物警戒人员,或QPPV,负责监督该系统。主要义务包括加快报告疑似严重不良反应,并定期提交安全更新报告。
所有新的营销授权申请必须包括风险管理计划或RMP,该计划描述了公司将实施的风险管理系统,并记录了防止或将与产品相关的风险降至最低的措施。监管部门也可以规定特定的义务作为上市授权的条件。这种风险最小化措施或授权后义务可能包括额外的安全监测,更频繁地提交PSURs,或进行额外的临床试验或授权后的安全性研究。RMP和PSURs通常可供请求访问的第三方使用,但需要进行有限的编辑。
广告监管
在欧盟,医药产品的广告和促销都受到欧盟和欧盟成员国关于医药产品促销、与医生和其他医疗保健专业人员的互动、误导性和比较性广告以及不公平商业做法的法律的约束。虽然药品广告和促销的一般要求是根据欧盟指令制定的,但细节由欧盟成员国的法规管理,各国可能会有所不同。例如,适用的法律要求与医药产品有关的促销材料和广告符合主管当局批准的与MA有关的产品特性摘要或SmPC。SmPC是向医生提供有关安全和有效使用产品的信息的文件。不符合SmPC的促销活动被认为是标签外的,在欧盟是被禁止的。欧盟也禁止直接面向消费者的处方药产品广告。
英国的监管审批
2020年1月31日,英国脱离欧盟(俗称脱欧),因此不再是欧盟成员国。过渡期从2020年2月1日开始,在此期间,欧盟制药法仍然适用于英国,但这一过渡期于2020年12月31日结束。由于英国涵盖医疗产品的质量、安全性和有效性、临床试验、营销授权、商业销售和分销的监管框架源自欧盟法规,英国退欧已经并可能进一步实质性地影响适用于英国产品的监管制度和对候选产品的批准,因为英国的立法现在有可能与欧盟立法背道而驰。从长远来看,英国退欧将如何影响英国对产品候选和产品的监管要求,还有待观察。由于联合王国不再是欧盟成员国,联合王国不再参与欧洲药品监管网络,联合王国药品和保健产品监管机构(MHRA)承担了以前由欧盟机构在联合王国市场上承担的人类药物机构的职能(北爱尔兰除外,根据关于爱尔兰/北爱尔兰的议定书,北爱尔兰仍与欧盟的法规保持一致)。由于过渡期已经结束,MHRA最近发布了详细的指导意见,供行业和组织从2021年1月1日起遵循,这些指导意见将随着英国对医药产品的监管立场随着时间的推移而更新。
MHRA提供了新的评估程序,因为英国不再受欧盟针对MA的集中程序的覆盖。这些程序可能会导致在英国(英格兰、苏格兰和威尔士)、英国或北爱尔兰获得营销授权,具体取决于程序和先前存在的授权,如下所述。新的评估包括:
•欧盟委员会决定信赖程序将持续到2023年1月1日,它是对含有新活性物质或生物仿制药的产品的新申请进行的有针对性的评估,这些产品之前已通过欧盟委员会的集中程序获得授权。MHRA将在67天内审查申请、CHMP评估报告和申请者对CHMP的答复,从而在欧盟委员会授权后尽快在英国授予营销授权。欧盟的集中销售授权将允许相关产品在北爱尔兰销售;
•作为国家授权的全面评估,该行业可以选择新的活性物质,时限不超过150天(不包括要求提供进一步信息的休止期),这可能导致在大不列颠、联合王国或北爱尔兰获得上市授权。如果申请包括北爱尔兰,则必须符合欧盟的相关要求;
•北爱尔兰已经通过欧盟程序或通过北爱尔兰国家路线批准的药品的不受限制的获取程序,如果成功,将导致英国的销售授权;
•分散和相互承认的销售授权依赖程序,其中MHRA有权考虑以前在欧洲经济区内通过分散或相互承认程序在一国境内授予的销售授权。可接受的营销授权计划在营销授权申请经MHRA验证后67天内授予,如果成功,将导致英国或英国营销授权;以及
•对新的活性物质和生物仿制药进行“滚动审查”,这将允许公司在整个产品开发过程中分阶段提出申请,以更好地管理开发风险,这可能导致在英国、联合王国或北爱尔兰获得营销授权。如果申请包括北爱尔兰,则必须符合欧盟的相关要求。
世界其他地区(ROW)监管路径
与美国和欧洲类似,世界各国都有自己的卫生局、药品监管的法律基础以及独立的临床试验和注册程序和过程。符合和遵守国际人用药品技术要求协调理事会(ICH)在世界各国通常是可以接受的,但有额外的当地细节。
一般来说,从临床试验的角度来看,进行试验的要求类似于美国和欧盟的要求,包括临床试验申请和伦理委员会审查。
在美国和欧盟,对于生物仿制药,即与参考医药产品高度相似但不符合仿制药定义的生物医药产品,都有专门的监管途径,例如,由于此类生物系统中存在固有的生物差异。对于此类产品,必须提供适当的临床前或临床试验结果,FDA或EMA的指南详细说明了为提交高度相似的生物制品而提供的额外非临床、临床和CMC数据的类型。考虑到与仿制药途径相比,生物相似途径要求的复杂性,全球获得生物相似途径的批准有限,然而,随着创新公司利用这一过程开发和销售自己的生物产品的生物仿制药,这一途径似乎正在获得势头。
欧盟和英国的数据隐私
2018年5月,欧盟通用数据保护条例(EU)2016/679,或GDPR,在欧洲经济区(EEA)生效。GDPR对(I)欧洲经济区和(Ii)英国的个人信息处理施加了严格的数据保护要求,因为GDPR在联合王国或英国GDPR继续成为法律的一部分(根据经修订的2018年欧盟(退出)法案第3条(包括各种数据保护、隐私和电子通信(修正案等)(欧盟退出条例)),联合王国迄今增加了我们的合规负担,例如要求:仅为收集个人数据的特定、明确和合法目的处理个人数据,为处理个人数据建立法律基础;在某些情况下,管制员和处理者有义务任命数据保护员;增加管制员对数据当事人的透明度义务(包括以简明、易懂和易于获取的形式提供某些信息,说明他们的个人数据是如何使用的,以及他们对该数据及其使用的权利);引入在某些情况下进行所谓数据保护影响评估的义务;通过“数据最小化”和“存储限制”原则确立对收集和保留个人数据的限制;确立实施“设计隐私”的义务;规定尊重数据主体更多权利的义务(例如个人被“遗忘”的权利、数据可携带性的权利, 在某些情况下的对象权等);正式确立数据当事人同意的更高和更明确的标准;确定实施某些技术和组织保障措施的义务,以保护个人数据的安全和机密性;引入义务,同意某些具体的合同条款,并在聘用第三方处理器和联合控制人时采取某些措施;引入义务,就某些重大的个人数据泄露事件向
有关的监督当局和受影响的个人;在某些情况下授权任命联合王国和/或欧洲联盟的代表。处理敏感的个人数据,如健康信息,可能会增加GDPR下的合规负担,这是外国监管机构积极感兴趣的话题。GDPR增加了我们对在欧洲(包括欧洲经济区、英国和瑞士)进行的临床试验的义务,明确扩大了个人数据的定义,将“假名”或密钥编码的数据包括在内,并要求改变知情同意做法,并向临床试验受试者和研究人员发出更详细的通知。
与以前的数据保护法相比,GDPR还规定了更强有力的监管执法和对违规行为的更大惩罚,包括高达2000万欧元的罚款或任何违规公司上一财年全球年收入的4%,以金额较高者为准。除了行政罚款外,主管监督当局还可以对潜在和涉嫌违反GDPR的行为行使各种其他潜在的执法权力,包括广泛的审计和检查权,以及下令暂时或永久禁止不合规行为者对所有或部分个人数据进行处理的权力。GDPR还赋予数据主体和消费者协会一项私人诉讼权利,可以向监管当局提出投诉,寻求司法补救,并就违反GDPR造成的损害获得赔偿。
欧洲数据保护法律,包括GDPR,一般限制将个人数据从欧洲经济区、英国和瑞士转移到美国和大多数其他国家,除非转移各方已实施具体的保障措施来保护转移的个人数据。允许美国公司从欧洲进口个人数据的主要保障措施之一是通过由美国商务部管理的欧盟-美国隐私盾牌和瑞士-美国隐私盾牌框架。然而,欧盟和美国的隐私盾牌在2020年7月被欧盟法院(CJEU)宣布无效,这起案件被俗称为“Schrems II”。在这一决定之后,瑞士联邦数据保护和信息专员(FDPIC)宣布,瑞士-美国隐私盾牌没有为个人数据从瑞士传输到美国的目的提供足够的保障。虽然FDPIC无权宣布瑞士-美国隐私盾牌制度无效,但FDPIC的声明令人怀疑瑞士-美国隐私盾牌作为未来瑞士-美国数据传输合规机制的可行性。CJEU在Schrems II案中的决定也引发了人们的疑问,即欧盟委员会的标准合同条款是否可以合法地用于将个人数据从欧洲转移到美国或其他不在欧盟委员会充分性决定范围内的第三国。虽然CJEU坚持《Schrems II》中标准合同条款原则上的充分性, 它明确指出,仅依靠这些条款并不一定在所有情况下都足够。现在必须在逐案的基础上评估标准合同条款的使用情况,同时考虑到目的地国适用的法律制度,特别是适用的监督法和个人对所转移数据的相关权利。在任何特定转让的情况下,如果目的地国家适用的法律制度可能或确实与标准合同条款和/或适用的欧洲法律的预期运作相冲突,则Schrems II中的决定和欧洲数据保护委员会(EDPB)随后的指导草案将要求转让各方实施某些补充的技术、组织和/或合同措施,以标准合同条款作为合规的“转让机制”。然而,2020年11月10日通过的EDPB关于补充转让工具以确保遵守欧盟保护个人数据水平的措施的第01/2020号建议得出结论,这种措施的任何组合都不足以允许在向公共当局获得转让数据的权力超出“民主社会必要和相称”的范围的国家的接受者“明文”转让个人数据时,有效依赖标准合同条款--这可能是在CJEU在Schrems II中关于美国公共当局的相关权力的结论以及EDPB指南草案中的评注之后,在某些情况下包括美国(例如,在美国《外国情报监视法案》第702条适用的情况下)。
Schrems II的决定也影响到从英国到美国的转账。因此,如果我们无法为从欧洲转移个人数据实施有效的解决方案,包括例如获得个人明确同意将其个人数据从欧洲转移到美国或其他国家,我们将面临更多的监管行动、巨额罚款和禁止处理来自欧洲的个人数据的禁令。无法从EEA、英国或瑞士导入个人数据也可能会限制我们在欧洲的临床试验活动;限制我们与合同合作的能力
研究机构以及受欧洲数据保护法律约束的其他服务提供商、承包商和其他公司;并要求我们以高昂的成本提高我们在欧洲的数据处理能力。此外,欧洲以外的其他国家已经或正在考虑制定类似的跨境数据传输限制和要求本地数据驻留的法律,这可能会增加我们提供服务和运营业务的成本和复杂性。我们在欧洲面临的挑战类型可能也会出现在其他司法管辖区,这些司法管辖区采用在结构上类似于GDPR的法律或同等复杂的监管框架。
GDPR适用于整个欧洲经济区,并凭借联合王国的GDPR,以大致统一的方式适用。然而,GDPR规定,欧洲经济区国家可以制定自己的进一步法律和法规,以引入与处理“特殊类别的个人数据”有关的具体要求,包括与健康有关的个人数据、用于唯一身份识别目的的生物识别数据和基因信息;以及与刑事犯罪或定罪有关的个人数据--在英国,2018年联合王国数据保护法在这方面对英国GDPR进行了补充。这一事实可能会导致欧洲经济区和/或英国在适用于处理此类数据类型的法律上存在更大分歧,在适用的情况下,遵守这些法律可能会增加我们的成本,并可能增加我们的总体合规风险。此类针对特定国家的法规还可能限制我们在我们的欧洲经济区和/或英国机构(无论在哪里进行任何处理)中收集、使用和共享数据的能力,和/或可能导致我们的合规成本增加,最终对我们的业务产生不利影响,并损害我们的业务和财务状况。
此外,联合王国投票支持退出欧盟和联合王国正在发生的事态发展给联合王国的数据保护监管带来了不确定性。在联合王国于2020年1月31日退出欧洲联盟之后,根据联合王国和欧洲联盟之间商定的过渡安排,GDPR继续在联合王国的法律上有效,并持续到2020年12月31日,就此目的而言,就好像联合王国仍然是欧盟成员国一样。在2020年12月31日及该等过渡期安排届满后,GDPR的数据保护义务继续适用于联合王国,涉及根据英国GDPR以基本不变的形式和方式处理个人数据。然而,未来,联合王国和欧洲经济区在适用、解释和执行数据保护法方面的差异将越来越大。此外,联合王国和欧洲经济区在数据保护法的某些方面的关系仍然不清楚。然而,2021年6月28日,欧盟委员会通过了一项关于英国的充分性决定。这一决定允许个人数据从欧洲经济区自由流动到英国,在那里它受益于基本上与欧盟法律保障的保护水平相同的保护水平。然而,这一充分性决定的期限为四年,这意味着该决定将在这一期限之后自动失效。在期限届满后,只有在联合王国继续确保适当的数据保护水平的情况下,才会延长充分性决定。此外,如上所述,, 联合王国已从2021年1月起通过英国GDPR将GDPR转变为联合王国国内法,这可能使我们面临两个平行的制度,每一个制度都可能授权对某些违规行为进行类似的罚款和其他可能不同的执法行动。
此外,欧洲以外的其他国家已经或正在考虑制定类似的跨境数据传输限制和要求本地数据驻留的法律,这可能会增加我们提供服务和运营业务的成本和复杂性。
GDPR或其他有关隐私和数据保护的法律法规的解释和应用可能会因司法管辖区的不同而不一致,或与我们当前的政策和做法不一致,遵守此类法律和法规可能要求我们以不利于我们业务的方式改变我们的业务做法和合规程序。我们不能保证我们遵守所有这些适用的数据保护法律和法规,我们也不能确定这些法规将如何解释、执行或应用于我们的运营。此外,欧洲经济区以外的其他司法管辖区也同样引入或加强隐私和数据安全法律、规则和法规,这可能会增加我们的合规成本和与不合规相关的风险。这些法律的解释和应用可能与我们的做法不一致,我们遵守不断演变的数据保护规则的努力可能不会成功。我们不能保证我们、我们的第三方合作伙伴或我们的供应商遵守所有适用的数据保护和隐私法律法规,无论它们是现在执行还是在发展中执行。此外,例如,我们的隐私政策可能是
不足以保护我们收集的任何个人信息,或可能不符合适用法律。我们的不遵守可能会导致政府施加罚款或命令,要求我们改变我们的做法,这可能会对我们的业务产生不利影响。除了与执法活动和潜在合同责任相关的风险外,我们在联邦和州一级不断努力遵守不断变化的法律和法规的努力可能代价高昂,需要不断修改我们的政策、程序和系统。此外,如果我们不能适当地保护受保护的健康信息的隐私和安全,我们可能被发现违反了我们的合同。
我们实际或被认为未能充分遵守与隐私和数据保护相关的适用法律和法规,或未能保护我们处理或维护的个人数据和其他数据,可能会导致针对我们的监管执法行动,包括罚款、处罚、要求改变我们做法的命令、额外的报告要求和/或监督、监禁公司官员和公众谴责、受影响个人的损害索赔、其他诉讼或声誉和损害,所有这些都可能对我们的业务、财务状况、运营结果和增长前景产生实质性影响。
定价和报销
美国
RUCONEST®未来的商业成功,以及我们的候选产品或我们的任何合作伙伴将任何获得批准的候选产品成功商业化的能力,将部分取决于联邦和州一级的政府付款人计划,包括联邦医疗保险和医疗补助、私人健康保险公司和其他第三方付款人为我们的候选产品提供保险并建立足够的报销水平的程度。政府卫生行政部门、私人健康保险公司和其他组织通常决定他们将支付哪些药物,并建立医疗保健的报销水平。尤其是在美国,私人健康保险公司和其他第三方付款人通常根据政府通过联邦医疗保险或医疗补助计划为此类治疗提供补偿的水平来为产品和服务提供补偿。在美国、欧盟和我们的候选产品的其他潜在重要市场,政府当局和第三方付款人越来越多地试图限制或监管医疗产品和服务的价格,特别是新的和创新的产品和疗法,这往往导致平均销售价格低于正常情况下的销售价格。此外,美国对管理型医疗保健的日益重视将给产品定价、报销和使用带来额外的压力,这可能会对我们未来的产品销售和运营结果产生不利影响。这些压力可能来自管理型医疗集团的规则和实践、与联邦医疗保险、医疗补助和医疗改革、药品覆盖和报销政策以及总体定价相关的司法裁决和法律法规。
第三方付款人越来越多地对医疗产品的覆盖范围和补偿水平施加额外要求和限制。例如,联邦和州政府以低于平均批发价的不同费率报销承保的处方药。这些限制和限制影响了医疗保健服务和产品的购买。第三方付款人可以将承保范围限制在批准的清单或配方表上的特定产品,其中可能不包括FDA批准的特定适应症的所有产品。第三方付款人越来越多地挑战价格,审查医疗产品和服务的医疗必要性和成本效益,以及它们的安全性和有效性。我们可能需要进行昂贵的药物经济学研究,以证明我们产品的医疗必要性和成本效益,以及获得FDA批准所需的成本。我们的候选产品可能不被认为是医学上必要的或具有成本效益的。付款人决定为药品提供保险并不意味着将批准适当的报销率。此外,一个付款人决定为一种药品提供保险并不能保证其他付款人也会为该药品提供保险。可能无法获得足够的第三方报销,使我们能够维持足够的价格水平,以实现我们在药物开发方面的投资的适当回报。此外,保险政策和第三方报销费率可能随时发生变化。因此,即使获得了有利的承保和报销状态, 未来可能会实施不太优惠的覆盖政策和报销费率。改革医疗保健或降低政府保险计划下成本的立法提案可能会导致RUCONEST®和候选产品的报销减少,或者将RUCONEST®或我们的候选产品排除在保险范围之外。医疗保健支付者和提供者正在实施的成本控制措施以及任何医疗改革都可能显著减少我们销售任何经批准的候选产品的收入。我们不能保证我们会
能够获得并维护RUCONEST®和我们的候选产品的全部或部分第三方保险或适当的报销。
在过去的几年里,美国政府采取了几项举措来资助和激励某些比较有效性研究,包括根据2010年的《患者保护和平价医疗法案》(Patient Protection And Affordable Care Act)创建了以患者为中心的结果研究所,该法案经2010年的《医疗保健和教育协调法案》(Health Care And Education Consolation Act)修订,或统称为ACA。也有可能的是,比较有效性研究表明竞争对手的产品具有好处,这可能会对我们候选产品的销售产生不利影响。如果第三方付款人不认为RUCONEST®或我们的候选产品一旦获得批准,与其他可用的疗法相比具有成本效益,他们可能不会将这些产品作为其计划下的福利覆盖,或者,如果他们认为支付水平可能不足以让我们在有利可图的基础上销售我们的产品。
此外,美国联邦和州各级已经并将继续采取一些举措,寻求降低医疗费用。此外,政府加强了对特殊药品定价做法的审查,这导致了几次国会调查和行政命令,目的之一是提高药品定价的透明度,审查定价与制造商患者计划之间的关系,以及改革政府计划的药品报销方法。
在联邦和州一级,寻求降低药品价格、增加竞争、降低患者自付药品成本、增加患者获得较低成本的仿制药和生物相似药的立法提案无处不在,这是一个持续不断的主题,需要审查和重新审查,以适应管理部门的变化,以及与关键利益攸关方保持一致。
美国国内的这些和其他医疗改革举措可能会导致联邦医疗保险或其他医疗资金的进一步减少,这可能会影响我们为新开发的适应症和/或产品实现所需定价的能力。
欧盟
在欧盟,不同国家的定价和补偿方案差别很大。一些国家规定,只有在商定了补偿价格之后,才能销售产品。一些国家可能要求完成额外的研究,将特定候选产品的成本效益与目前可用的疗法进行比较(所谓的卫生技术评估),以获得报销或定价批准。总体而言,各国政府通过其定价和报销规则以及对国家医疗体系的控制来影响欧盟医疗产品的价格,这些体系为消费者支付了这些产品的大部分成本。一些法域实行正面清单和负面清单制度,只有在商定了补偿价格后,才能销售产品。为了获得报销或定价批准,其中一些国家可能要求完成临床试验,将特定候选产品的成本效益与目前可用的疗法进行比较。其他欧盟成员国允许公司固定自己的医药产品价格,但监控公司利润。总体上,医疗成本,特别是处方药的下行压力变得非常大。因此,对新产品的进入设置了越来越高的壁垒。
在欧盟各成员国,不断采取削减成本的措施,例如降低最高价格、降低或缺乏报销范围以及鼓励使用更便宜的产品作为替代产品。在一些欧盟成员国,包括代表主要市场的国家,医疗产品的卫生技术评估(HTA)正在成为定价和报销程序中越来越常见的部分。目前由这些国家的国家法律管辖的HTA程序是根据该程序对在个别国家的国家医疗保健系统中使用特定医疗产品的公共健康影响、治疗影响以及经济和社会影响进行评估的程序。关于特定医药产品的HTA的结果往往会影响欧盟个别成员国主管当局给予这些医药产品的定价和补偿地位。2018年1月31日,欧盟委员会通过了一项关于卫生技术评估法规(HTA法规)的提案。2021年12月,HTA条例通过,并于2022年1月11日生效。它将从2025年起适用。该条例旨在促进欧盟成员国在评估包括新医药产品在内的卫生技术方面的合作,并为在这些领域进行联合临床评估的欧盟层面的合作提供基础。本规例开始适用
可以规定更严格和更详细的程序,要求MAHs遵守与其产品有关的HTA行为,这可能会影响相关的定价和补偿决定。
美国和欧盟以外的地区
在美国和欧盟以及我们的分销商活跃的地区之外,如上所述,除了以患者的名义提供产品外,不存在任何商业化。
C.组织结构
辉瑞集团是一家有限责任上市公司。Pharing Group N.V.是Pharming Group的最终母公司。下表提供了子公司列表,其中概述了我们在2021年12月31日的子公司和少数股权投资:
| | | | | | | | | | | | | | |
| 实体 | | 注册办事处 | | 所有权百分比 |
| PURING B.V. | | 荷兰 | | 100 | % |
| Pharing America B.V. | | 荷兰 | | 100 | % |
| 盗版知识产权B.V. | | 荷兰 | | 100 | % |
| Phing Technologies B.V. | | 荷兰 | | 100 | % |
| 制药研究与开发公司 | | 荷兰 | | 100 | % |
| BioConnection B.V. | | 荷兰 | | 44 | % |
| 布鲁克曼研究所B.V. | | 荷兰 | | 100 | % |
| 辉瑞医疗保健公司。 | | 美国 | | 100 | % |
| ProBio,Inc. | | 美国 | | 100 | % |
D.财产、厂房和设备
我们的设施
在荷兰莱顿,我们的行政办公室(包括实验室)和行政管理办公室分别位于莱顿2333 CR达尔文韦格24号和莱顿2332 AA 2332号冯德兰47号。在莱顿的设施中,我们占据:
•约1,877平方米(相当于约20,204平方英尺)的办公空间,租约的初始期限将于2029年6月1日到期,可续期5年。
•根据将于2026年6月30日到期的租约,约1,295平方米(相当于约13,939平方英尺)的实验室空间将自动续期5年。
•根据将于2026年6月30日到期的租约,约76平方米(相当于约818平方英尺)的存储空间将自动续签5年。
此外,在荷兰的Noord Brabant省,我们占据了约3,459平方米(相当于约37,232平方英尺),其中2,405平方米(相当于约25,887平方英尺)是生产空间,926平方米(相当于约9,967平方英尺)是办公空间,128平方米(相当于约1,378平方英尺)用于支持用途。
在我们位于荷兰诺德布拉班特省的另一家生产工厂,我们拥有约950平方米(相当于约10,226平方英尺)的生产、仓库和办公空间。
在荷兰Zuid Holland省的(牛)设施,我们占用了大约150平方米(相当于约1,615平方英尺)的存储空间,租约的到期日为2026年9月1日,但将续签5年。
根据一份2026年2月28日到期的租约,我们在法国巴黎附近的研发设施占用了约884平方米(相当于约9,515平方英尺)的办公空间。根据2027年8月31日到期的租约,我们还占用了约214平方米的实验室空间(相当于约2,303平方英尺)。
在美国新泽西州,我们租用了约1,732.64平方米(相当于约18,650平方英尺)的办公空间,租期至2025年。
公司于2021年投资1,070万美元,主要投资于营运设施、研发设施及实验室设备(2020年:470万美元)。该公司决定在俄亥俄州的Pivot Park完成新大楼的建设,但不再追求实现其下游产能。Pharing将继续将在建的建筑用于其他用途。随着业务的扩大,我们可能需要更多的空间和设施。
项目4A。未解决的员工意见
不适用。
项目5经营和财务回顾及展望
你应阅读以下“营运及财务回顾及展望”,以及本年度报告其他部分所载的我们的财务报表及附注。以下讨论基于我们根据国际会计准则编制的财务资料,由国际会计准则委员会发出。
本次讨论中有关我们业务计划和战略的陈述,包括对我们未来流动性和资本资源的预期,以及其他非历史性陈述,均为前瞻性陈述。这些前瞻性陈述会受到许多风险和不确定因素的影响,包括本年度报告中题为“风险因素”一节所述的风险和不确定因素。我们的实际结果可能与任何前瞻性陈述中包含或暗示的结果大不相同。
A.经营业绩
一般信息
截至2021年1月1日,我们的呈报货币由欧元改为美元(“美元”)。以下管理层为截至2021年12月31日的年度准备的讨论和分析是对我们的运营、当前财务状况和前景的回顾,应与我们截至2021年12月31日的年度经审计财务报表及其附注一起阅读。2020年和2019年的信息已被追溯重述。
概述
我们是一家全球性的商业阶段生物制药公司,开发创新的蛋白质替代疗法和精准药物,用于治疗罕见疾病和未得到满足的医疗需求。我们投资组合的旗舰产品是我们的重组人C1酯酶抑制剂,或rHC1INH特许经营权。C1INH是一种自然产生的蛋白质,它下调补体级联,以控制受影响组织的肿胀。我们的主导产品RUCONEST®是第一种也是唯一一种无血浆重组人C1INH蛋白替代疗法。它被批准用于治疗急性遗传性血管性水肿或HAE发作。我们还在开发用于后续适应症的重组人C1INH,包括先兆子痫和AKI。我们已经调查了重组人C1INH在新冠肺炎的临床疗效,虽然这些研究的结果令人鼓舞,但鉴于新冠肺炎医疗需求和治疗管理的快速变化,我们不打算进行任何进一步的研究。此外,治疗APDS的口服精密药物leniolisib(一种磷脂酰肌醇3-激酶Delta,或PI3K Delta抑制剂)刚刚完成注册,使美国和欧洲的2/3期研究成为可能。此外,我们还利用我们的转基因制造技术来开发下一代蛋白质替代疗法,最引人注目的是治疗处于临床前阶段的庞培病。
在截至2021年、2020年和2019年12月31日止年度,我们销售RUCONEST®用于治疗急性血吸虫病的收入分别为1.98亿美元、2.122亿美元和1.894亿美元。
我们目前通过自己的销售队伍在美国、英国和欧盟销售RUCONEST®,并通过我们的经销商网络在韩国、以色列和某些中南美洲国家销售RUCONEST®。
影响我们业绩的关键因素
我们有能力扩大重组人C1INH的批准适应症和市场
我们正在努力通过临床研究扩大rhC1INH的特许经营权。特别是,我们正在开发用于先兆子痫和AKI等适应症的重组人C1INH。我们还在开发用于治疗APDS的Leniolisib,并应用我们的转基因制造技术开发用于治疗Pompe病的ERT。我们能否从这些潜在的新迹象和市场中创造收入,取决于我们能否成功完成此类产品和候选产品的开发和商业化,这将需要投入大量时间和资源,以及监管部门的批准,最终可能不会成功。
如果获得批准,我们将leniolisib商业化的能力
2019年8月,我们与瑞士跨国制药公司诺华制药达成合作,获得了Leniolisib的全球营销权。在达成合作协议后,我们向诺华公司支付了2000万美元的leniolisib计划预付款。最近,在美国和欧洲进行的针对APDS患者的Leniolisib 2/3期临床试验最近完成。根据这些研究的结果,Pharming打算开始获得监管部门的批准,将用于APDS的Leniolisib商业化,首先是2022年年中向FDA提出的新药申请(NDA),然后是EMA的MAA以及世界各地的其他申请。2022年1月,EMA通过了关于Leniolisib的儿科调查计划(PIP)的积极决定。如果获得批准,我们计划在2023年第一季度通过我们现有的商业基础设施开始将该药物商业化。如果商业化的努力需要超过我们预期的最低限度的增加,我们的财务业绩可能会受到影响。
考虑到当前新冠肺炎大流行的影响,我们有能力保持和增长我们现有商业产品RUCONEST®的收入
展望未来,我们认为,由于全球新冠肺炎疫情及其相关市场波动,不确定性仍在继续。虽然如果商务旅行在很长一段时间内继续受到严格限制,销售增长可能会略低于预期,但我们患者的潜在需求预计不会改变。如果大流行继续下去,某些费用可能会推迟或根本不发生。到目前为止,我们的供应链没有遇到任何值得注意的中断,公司的(外部)生产设施/销售地点也没有关闭。有关更多信息,请参阅“风险因素”。
国际业务和外币兑换
我们在全球范围内运营,在世界各地设有办事处、销售和活动。由于RUCONEST®在美国、欧盟和英国重新获得商业化权利,以及我们在美国、欧盟和英国的商业组织随后持续扩张,我们在全球的业务和销售额都有所增加。我们的全球业务使我们的财务业绩受到以下因素的影响:外币汇率的波动,我们开展业务的国家的一般经济和政治条件的变化,特别是由于外国司法管辖区内持续的经济不稳定,对与关税或贸易协议有关的政府行动的敏感性,复杂和限制性的就业和劳工法律法规,以及工会和工会的限制,对世界各地司法管辖区税法或裁决变化的敏感性,某些地区客户较长的支付周期,以及法律合规成本和风险。
我们有能力将罕见疾病资产添加到我们的投资组合中
识别、收购和开发新产品和候选产品以创造股东价值,是我们成为治疗罕见疾病的全球领先者的目标的关键。我们未来的盈利能力和增长将取决于我们是否有能力以有利的条款收购和许可候选产品。
我们能够将营销努力和销售从第三方分销商转移到我们的内部基础设施
我们已经将RUCONEST®在主要国际市场的商业化完全过渡到我们自己的销售队伍,目前我们通过我们的内部基础设施在美国、英国和欧盟营销RUCONEST®。我们通过我们的第三方分销商网络在韩国、北非、中东、以色列和某些中美洲和南美洲国家销售RUCONEST®。我们有能力继续将RUCONEST®在其他司法管辖区的营销和销售从第三方分销商转移到我们的内部基础设施,这可能需要大量投资并影响我们的业务。
我们运营结果的组成部分
收入
我们的收入主要来自通过我们自己的销售和营销组织在美国、欧盟和英国销售RUCONEST®的瓶装产品,以及通过我们的分销网络在世界其他地区销售RUCONEST TMD。根据“国际财务报告准则”第15条,收入在客户获得货物控制权时确认。根据我们的合同,客户在产品装运后立即获得产品控制权,产品在短时间内到达客户手中。我们与客户签订的大部分收入合同都受到与客户有关的退款、折扣和/或回扣或政府或保险付款人的报销要求的影响,我们以估计净额为基础进行核算,任何实际的折扣和回扣都将在适当的时候用于完善估计。该等可变因素将从本公司于2021年12月31日及2020年12月31日的年度财务报表及截至2021年12月31日止三年期间的年度财务报表(“年度财务报表”或“经审核综合财务报表”)中进一步描述的会计政策中扣除,而相关销售则根据本公司的会计政策入账。
销售成本
销售成本包括与实际产品销售相关的产品销售成本和库存减值。减值源于存货相对于较低的可变现净值的估值。
其他收入
其他收入包括荷兰和法国政府为我们在这些国家开展的研究和发展活动提供的年度工资税补偿形式的赠款。
研究和开发成本
研发成本与我们的候选产品生命周期的准备和启动相关。当我们能够证明下列标准得到满足时,就可以将发展支出确认为无形资产:
•完成资产以供出售的技术可行性;
•完成资产的使用或者出售;
•使用或销售的能力是明确的;
•未来经济效益的可能性很大(该产品有一个现有的市场,一旦该产品准备好投放市场,该市场可能就会出现);
•完成开发的资源是否可用是不成问题的;
•可靠地衡量项目支出的能力是不成问题的。
符合这些标准的发展支出将被资本化。不符合这些标准的支出在损益表中记为费用。
一般和行政活动的费用
包括与行政资源相关的成本、服务费、法律和尽职调查成本(与Orchard和Novartis的交易相关)以及物业、厂房和设备以及无形资产的减值和折旧成本。此外,随着公司的持续增长,我们预计未来我们的一般和行政成本将进一步增加。
营销和销售活动的成本
这些成本与产品商业化所产生的所有费用有关。
其他财务费用
其他财务支出主要包括2025年到期的可转换债券支付的利息、或有对价和租赁付款拨备以及外币结果。
使用权益法在联营公司中的净利润份额
联营公司的净利润份额包括我们对BioConnection BV(BioConnection)的投资所产生的利润。2019年,我们收购了我们的Fill and Finish合作伙伴BioConnection BV 43.85%的股权。根据管理委员会的判断,对BioConnection的投资构成对一个未合并的结构化实体的投资,因为我们对BioConnection具有重大影响力,但并不控制BioConnection。特别是,BioConnection的股东被禁止影响双方之间的任何活动,而这些活动与投资前双方之间存在的关系有任何重大不同。我们不控制实体的投票权或经济利益。因此,我们对BioConnection的投资采用权益法核算,并不将该实体合并为子公司。
所得税抵免(费用)
所得税抵免反映所得税的抵免/(费用)。本期所得税支出或抵免是指根据每个司法管辖区适用的所得税税率,经可归因于暂时性差异和未用税项损失的递延税项资产和负债变动调整的当期应纳税所得额。递延税项资产的变现取决于未来应税收入的产生,其金额和时间受到不确定因素的影响。考虑到本年度的持续利润,未来我们很可能能够使用前几年的所有剩余营业税净亏损。在截至2021年、2020年和2019年12月31日的年度内,我们在美国发生了州和联邦所得税,在该司法管辖区,我们没有剩余的税收损失,而在荷兰,我们继续用完我们累积的税收损失。这些剩余税项损失的避税效果在资产负债表上显示为递延税项资产。递延税项资产的使用方式是在每个报告期减记税费金额,而不是用现金支付应缴税款。一旦税项损失全部用完,与这些损失相关的递延税项资产将完全清偿,此后应缴纳的税款将予以缴纳。
经营成果
下表列出了我们在本报告所述期间的业务成果。2021年,本公司的列报货币由欧元改为美元,因此,2020和2019年的信息已追溯重述。
综合损益表
| | | | | | | | | | | | | | | | | |
| 截至十二月三十一日止的年度, |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 收入 | 198,871 | | | 212,174 | | | 189,389 | |
| 销售成本 | (21,142) | | | (23,539) | | | (23,928) | |
| 毛利 | 177,729 | | | 188,635 | | | 165,461 | |
| 其他收入 | 2,620 | | | 1,829 | | | 487 | |
| 研发 | (70,369) | | | (38,519) | | | (31,786) | |
| 一般和行政 | (36,974) | | | (24,085) | | | (21,192) | |
| 市场营销和销售 | (59,445) | | | (51,604) | | | (44,724) | |
| 其他运营成本 | (166,788) | | | (114,208) | | | (97,702) | |
| 营业利润 | 13,561 | | | 76,256 | | | 68,246 | |
| 重估衍生工具的公允价值损益 | 114 | | | 69 | | | (234) | |
| 其他财务收入 | 14,894 | | | 715 | | | 1,133 | |
| 其他财务费用 | (6,185) | | | (33,308) | | | (17,098) | |
| 财务成本,净额 | 8,823 | | | (32,524) | | | (16,199) | |
| 使用权益法在联营公司中的净利润份额 | 694 | | | 362 | | | 257 | |
| 税前利润 | 23,078 | | | 44,094 | | | 52,304 | |
| 所得税费用 | (7,082) | | | (6,348) | | | (11,747) | |
| 本年度利润 | 15,996 | | | 37,746 | | | 40,557 | |
| 基本每股收益(美元) | 0.025 | | 0.058 | | 0.065 |
| 稀释后每股收益(美元) | 0.023 | | 0.055 | | 0.061 |
截至2021年12月31日和2020年12月31日的年度比较
收入
收入从截至2020年12月31日的年度的2.122亿美元下降至截至2021年12月31日的年度的1.98亿美元,降幅为6.3%。收入下降的主要原因是RUCONEST®在美国市场的销售额下降(2021年为1.934亿美元,而2020年为2.027亿美元)。正如之前宣布的那样,新冠肺炎疫情的蔓延已经导致收入季度波动,原因是接触客户的渠道有限,以及订购模式的阶段性。在美国,新冠肺炎病例在2020年底和2021年出现激增,这导致一些患者在2020年第四季度预先填写了RUCONEST®处方。它还导致大多数医生办公室暂时关闭,导致例行和诊断性病人就诊减少,每年更新处方的速度放缓。这些因素的结合导致从2020年第四季度起仍在使用额外RUCONEST®库存的患者的处方补充率较低,以及2021年第一季度第一季度新患者登记人数的减少。在今年剩下的时间里,随着新患者登记人数的显著增加,这些趋势发生了逆转。
2021年,欧洲的收入从2020年的820万美元降至490万美元。这一下降主要是由于有序的阶段性造成的。该公司继续建设其在欧盟的商业基础设施,并向新的地区扩张。2021年,连续收入(不包括欧洲)减少到50万美元(2020年为130万美元)。
2021年,两家美国客户(即专业批发公司)占我们收入的1.566亿美元(79%)。2020年,这两家美国客户占我们收入的1.617亿美元(76%)。这些批发公司专门从事HAE病区的药品分销。
| | | | | | | | | | | | |
| 截至十二月三十一日止的年度, |
| 金额,以美元为单位‘000 | 2021 | | 2020 | |
美国 | 193,419 | | | 202,684 | | |
欧洲 | 4,933 | | | 8,232 | | |
世界其他地区 | 519 | | | 1,258 | | |
收入 | 198,871 | | | 212,174 | | |
销售成本
销售成本从截至2020年12月31日的年度的2,350万美元下降至截至2021年12月31日的年度的2,110万美元,降幅为240万美元或10.2%。2021年与产品销售相关的销售成本为1,910万美元(2020年:2,350万美元)。2021年剩余的成本(200万美元)来自指定用于商业活动的库存的减值费用。该等减值费用并不适用于2020年。
下表汇总了截至2021年12月31日和2020年12月31日的年度销售成本。
| | | | | | | | | | | |
| 截至十二月三十一日止的年度, |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 销售成本 | (19,107) | | | (23,539) | |
| 陈旧库存减值 | (2,035) | | | — | |
| 总计 | (21,142) | | | (23,539) | |
毛利
毛利由截至2020年12月31日的1.886亿美元下降至截至2021年12月31日的1.777亿美元,下降1,090万美元或5.8%。这主要是由于美国和欧盟的销售额减少以及随之而来的销售成本下降所致。
下表汇总了截至2021年12月31日和2020年12月31日的年度毛利润的地理细分。
| | | | | | | | | | | |
| 截至十二月三十一日止的年度, |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 我们 | 176,266 | | | 184,024 | |
| 欧洲 | 1,049 | | | 3,534 | |
| 划 | 414 | | | 1,077 | |
| 毛利总额 | 177,729 | | | 188,635 | |
其他收入
与赠款相关的其他收入增加了80万美元,即43.2%,从截至2020年12月31日的年度的180万美元增加到截至2021年12月31日的年度的260万美元。这些赠款是荷兰和法国政府为我们在这些国家实际开展的研究和开发活动提供的年度工资税补偿。
研究和开发成本
研发营运开支由截至2020年12月31日止年度的3,850万美元增至截至2021年12月31日止年度的7,040万美元,增幅达82.7%。成本主要用于投资OTL-105,准备和启动重组人C1INH治疗子痫前期和AKI的临床研究,2/3期研究,治疗激活的肌醇磷脂3-激酶Delta
使用Pharming技术在新冠肺炎上进行症状和临床试验。成本增加主要是由于OTL-105产生的成本1,310万美元,以及与开发RUCONEST®以更方便患者的形式相关的无形资产减值损失470万美元(请参阅本文件其他部分包含的综合年度财务报表附注9)。增加的其余部分与增加的工资支出和rh C1INH在先兆子痫和AKIy的临床研究费用有关,2/3期研究Leniolisib。
一般和行政活动的费用
一般和行政活动的费用增加了1,290万美元,或53.5%,从截至2020年12月31日的年度的2,410万美元增加到截至2021年12月31日的年度的3,700万美元。一般及行政活动的成本增加主要与取消我们在俄亥俄州Pivot Park的下游产能(见附注10)而产生的减值亏损5,400,000美元有关,以及为支持本公司不断增长的商业及营运活动而增加的行政资源,以及与最近在美国纳斯达克上市相关的合规及控制成本增加所致。
营销和销售活动的成本
营销和销售活动的成本增加了780万美元,或15.2%,从截至2020年12月31日的年度的5,160万美元增加到截至2021年12月31日的年度的5,940万美元。增加的成本主要与美国和欧洲的商业组织和基础设施的进一步扩张有关。
雇员福利
根据每个员工提供的服务的性质,员工福利包括在研发成本、一般和行政成本以及营销和销售成本中。因此,雇员福利没有在综合收益表中作为单独的项目列报,而是在年度财务报表附注中单独披露。
员工福利增加940万美元,或18.3%,从截至2020年12月31日的年度的5,140万美元增加到截至2021年12月31日的年度的6,080万美元。这一增长主要是由于整个公司的整体业务增长。
下表汇总了截至2021年12月31日和2020年12月31日的年度的员工福利。
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 薪金 | (44,202) | | | (36,811) | |
| 社会保障费用 | (5,318) | | | (4,302) | |
| 养老金成本 | (2,179) | | | (1,844) | |
| 基于股份的薪酬 | (9,055) | | | (8,405) | |
| 总计 | (60,754) | | | (51,362) | |
其他财务收入
其他财务收入增加1,420万美元,或1983.1%,由截至2020年12月31日止年度的0.7万美元增至截至2021年12月31日止年度的1,490万美元。这一增长主要是由于2021年期间美元对欧元汇率的大幅上升。美元现金结存产生了显著的有利汇率影响(1,480万美元)。
下表汇总了截至2021年12月31日和2020年12月31日的年度我们的其他财务收入。
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 利息收入 | 53 | | 715 | |
| 外币业绩 | 14,841 | | — | |
| 其他财务收入 | 14,894 | | 715 | |
其他财务费用
其他财务开支减少2,710万美元,或81.4%,由截至2020年12月31日止年度的3,330万美元下降至截至2021年12月31日止年度的620万美元。这一下降主要是由于美元对欧元汇率在2021年期间大幅上升,如上文题为“其他财政收入”的部分所述。此外,在2020年偿还了430万美元的和解费用和支出,并完全取消了Orbimed Advisors的贷款。2021年,没有支付任何和解费用。最后,作为RUCONEST®北美商业权重新收购交易一部分的或有对价的最后里程碑于2020年第四季度触发,并于2021年第二季度支付,2021年相关财务支出减少3.7百万美元。
下表汇总了截至2021年12月31日和2020年12月31日的年度的其他财务支出。
| | | | | | | | | | | |
| 金额(单位:$‘000) | 2021 | | 2020 |
| 贷款结算 | — | | | (4,313) | |
| 外币业绩 | — | | | (19,233) | |
| 利息贷款和借款 | (5,296) | | | (5,178) | |
| 利息租约 | (795) | | | (766) | |
| 或有对价 | — | | | (3,744) | |
| 其他财务费用 | (94) | | | (74) | |
| 其他财务费用 | (6,185) | | | (33,308) | |
使用权益法在联营公司中的净利润份额
采用权益法的联营公司净利润由截至2020年12月31日止年度的40万美元增加至截至2021年12月31日止年度的0.7万美元,增幅为91.7%。这是BioConnection B.V.利润增加的结果。
所得税费用
所得税支出从截至2020年12月31日的年度的630万美元增加至截至2021年12月31日的年度的710万美元,增幅为11.6%,尽管2021年的税前利润低于2020年。增加是由于外国税率差异增加(百万美元)、非应纳税所得额变动增加(三百一十万美元)、影响递延税项开支的法定适用税率变动增加(二百三十万美元)及其他较小的差异(六十万美元)所致。这些增长被较低的应税收入(530万美元)所抵消。
下表总结了截至2021年12月31日和2020年12月31日的年度Pharming的所得税支出。
| | | | | | | | | | | |
| 金额(单位:$‘000) | 2021 | | 2020 |
| 当期税费总额 | (1) | | | (1,208) | |
| 递延税金(费用)收益总额 | (7,081) | | | (5,140) | |
| 所得税抵免(费用) | (7,082) | | | (6,348) | |
截至2020年12月31日的年度与2019年12月31日的年度比较
收入
收入由截至2019年12月31日的1.894亿美元增加至截至2020年12月31日的2.122亿美元,增幅为2,280万美元,增幅为12.0%。收入的增长主要是由于RUCONEST®在美国市场的销售额增加,从截至2019年12月31日的年度的1.823亿美元增加到2020年截至12月31日的年度的2.027亿美元。世界其他地区(不包括欧洲)的收入从2019年的140万美元降至130万美元,主要原因是以色列的销售额下降。2020年,欧洲的收入增至820万美元(2019年为560万美元)。这一增长主要是由于本公司在2020年1月从SOBI手中重新收购RUCONEST®的欧盟权利后,继续建设其在欧盟的商业基础设施,并向新地区扩张。
两家美国客户(即专业批发公司)占我们2020年收入的1.617亿美元(76%)。2019年,这两家美国客户占我们收入的1.466亿美元(77%)。这些批发公司专门从事HAE病区的药品分销。
2019年,收入包括170万美元的递延许可收入,反映了Sobi支付的许可费。
在2020年内,由于与SOBI的许可协议在2019年12月重新获得RUCONEST®在欧洲所有其余国家的商业化权利时终止,因此Pharming不再收到许可费付款,这笔交易的生效日期为2020年1月。
下表按地理分区汇总了本公司每个时期的收入:
| | | | | | | | | | | |
| 截至十二月三十一日止的年度, |
| 金额(单位:$‘000) | 2020 | | 2019 |
| 美国 | 202,684 | | | 182,294 | |
| 欧洲 | 8,232 | | | 5,648 | |
| 世界其他地区 | 1,258 | | | 1,447 | |
| 收入 | 212,174 | | | 189,389 | |
销售成本
销售成本由截至2019年12月31日的2,390万美元下降至截至2020年12月31日的2,350万美元,降幅为1.6%。销售成本与实际产品销售有关。2020年的销售成本低于2019年,主要是因为2020年新的生产设施经过验证并全面投入运营,使Pharming能够实现更大和更高效的生产。
陈旧存货减值源于存货相对于较低的可变现净值的估值。2019年与指定用于商业活动的库存有关的减值费用为90万美元。于2020年并无因终止与SOBI的分销协议而产生减值费用。本公司自有产品销售额具有较高的可变现净值。
下表汇总了截至2020年12月31日和2019年12月31日的销售成本。
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2020 | | 2019 |
| 销售成本 | (23,539) | | | (23,068) | |
| 陈旧库存减值 | — | | | (860) | |
| 总计 | (23,539) | | | (23,928) | |
毛利
毛利由截至2019年12月31日止年度的1.655亿美元增加至截至2020年12月31日止年度的1.886亿美元,增幅为2,320万美元或14.0%。这一增长主要是由于RUCONEST®在美国市场的销售增加。
下表汇总了截至2020年12月31日和2019年12月31日的年度毛利润的地理细分。
| | | | | | | | | | | |
| 金额(单位:$‘000) | 2020 | | 2019 |
| 美国 | 184,024 | | | 162,226 | |
| 欧洲。 | 3,534 | | | 2,141 | |
| 世界其他地区 | 1,077 | | | 1,094 | |
| 毛利 | 188,635 | | | 165,461 | |
其他收入
与赠款有关的其他收入由截至2019年12月31日止年度的5,000,000美元增至截至2020年12月31日止年度的1,800,000美元,增幅为275.2%。这些赠款是荷兰和法国政府为我们在这些国家实际开展的研究和开发活动提供的年度工资税补偿。
研究和开发成本
研发营运开支由截至2019年12月31日止年度的3,180万美元增至截至2020年12月31日止年度的3,850万美元,增幅为670万美元或21.2%。增加的主要原因是准备和启动重组人C1INH治疗子痫前期和急性肾损伤的临床研究、Leniolisib的2/3期研究、新冠肺炎的临床试验以及使用制药技术继续制备和生产治疗庞培病的α-葡萄糖苷酶的相关成本。
一般和行政活动的费用
随着收入增长,一般及行政活动的成本增加290万美元,或13.7%,由截至2019年12月31日止年度的2,120万美元增至截至2020年12月31日止年度的2,410万美元。一般和行政活动费用增加的主要原因是增加了行政资源,以支持我们日益增长的商业和业务活动。
营销和销售成本
由于收入增长,营销和销售活动的成本增加了690万美元,即15.4%,从截至2019年12月31日的年度的4470万美元增加到截至2020年12月31日的年度的5160万美元。增加的成本主要与美国和欧洲的商业组织和基础设施的进一步扩张有关。
雇员福利
根据每个员工提供的服务的性质,员工福利包括在研发成本、一般和行政成本以及营销和销售成本中。因此,雇员福利不会在综合损益表中作为单独的项目出现,而是在年度财务报表附注中单独披露。
员工福利增加1,130万美元,或28.2%,由截至2019年12月31日的年度的4,010万美元增至截至2020年12月31日的年度的5,140万美元。这一增长主要是由于组织的扩张,与截至2019年12月31日的年度相比,截至2020年12月31日的年度员工基数增加了21.1%。
下表汇总了截至2020年12月31日和2019年12月31日的年度员工福利。
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2020 | | 2019 |
| 薪金 | (36,811) | | | (29,540) | |
| 社会保障费用 | (4,302) | | | (3,769) | |
| 养老金成本 | (1,844) | | | (1,767) | |
| 基于股份的薪酬 | (8,405) | | | (4,985) | |
| 总计 | (51,362) | | | (40,061) | |
其他财务收入
其他财务收入减少约40万美元,或36.9%,由截至2019年12月31日止年度的110万美元减少至截至2020年12月31日止年度的70万美元,原因是美国利率下降导致现金结余利息下降。没有来自外币换算的其他财政收入。外币折算结果仅限于下文“其他财务支出”中披露的其他财务支出。
下表汇总了截至2020年12月31日和2019年12月31日的年度我们的其他财务收入。
| | | | | | | | | | | |
| 金额(单位:$‘000) | 2020 | | 2019 |
| 利息收入 | 715 | | | 1,133 | |
| 其他财务收入 | 715 | | | 1,133 | |
其他财务费用
其他财务开支由截至2019年12月31日止年度的1,710万美元增至截至2020年12月31日止年度的3,330万美元,增幅达1,620万美元或94.8%。这一增长主要是因为这一增长主要是由于贷款结算和外币业绩。2020年的其他财务支出包括430万美元的和解费用以及与Orbimed Advisors全额偿还我们的贷款相关的支出。2020年的其他财务支出还包括外币损失,这主要是由于投资于美国证券的大量美元现金头寸,以及美元在2020年期间的疲软。利息贷款和借款减少是由于可转换债券和与以前融资的利率差异所致。请参阅年度财务报表附注18。
下表汇总了截至2020年12月31日和2019年12月31日的年度的其他财务支出。
| | | | | | | | | | | |
| 金额(单位:$‘000) | 2020 | | 2019 |
| 贷款结算 | (4,313) | | | — | |
| 外币业绩 | (19,233) | | | (515) | |
| 利息贷款和借款 | (5,178) | | | (12,611) | |
| 利息租约 | (766) | | | (742) | |
| 或有对价 | (3,744) | | | (3,230) | |
| 其他财务费用 | (74) | | | — | |
| 其他财务费用 | (33,308) | | | (17,098) | |
使用权益法在联营公司中的净利润份额
采用权益法的联营公司净利增加10万美元,或40.9%,由截至2019年12月31日止年度的30万美元增至截至2020年12月31日止年度的40万美元,这是BioConnection B.V.溢利增加的结果。
所得税抵免(费用)
所得税支出由截至2019年12月31日止年度的1,170万美元减少至截至2020年12月31日止年度的630万美元,减幅为540万美元或46.0%。当期税项支出和递延税项支出的减少是由于2020年账簿对联邦和州纳税申报单的真实调整以及税前利润的减少。
下表汇总了Pharming在截至2020年12月31日和2019年12月31日的年度的所得税抵免(费用)。
| | | | | | | | | | | |
| 金额(单位:$‘000) | 2020 | | 2019 |
| 当期税费总额 | (1,208) | | | (4,564) | |
| 递延税金(费用)收益总额 | (5,140) | | | (7,183) | |
| 所得税抵免(费用) | (6,348) | | | (11,747) | |
关键业务和非GAAP财务指标
Pharming的成功体现在其迄今的运营和财务记录上。我们使用EBIT、EBITDA、调整后的EBITDA、净债务和营业利润作为衡量标准,以持续评估和管理我们的业务。我们相信,这些措施有助于投资者比较报告期内和报告期之间的关键财务数据。具体地说,我们认为EBIT、EBITDA和调整后的EBITDA为投资者提供了对我们经营业绩的补充衡量标准,并突出了我们核心业务的趋势,否则这些趋势在仅依赖IFRS衡量标准时可能不会显现。此外,我们认为,计入净债务是适当的,以向投资者提供关于我们使用现金和现金等价物偿还债务的能力的信息。
其中一些计量没有按照国际财务报告准则计算,我们统称为非公认会计准则财务计量。它们的定义如下:
•息税前收益-息税前收益。定义为调整后不包括所得税(费用)和财务成本的年度利润,净额
•EBITDA-扣除利息、税项、折旧和摊销前收益。定义为调整后的年度利润,不包括所得税(费用)、财务成本、财产、厂房和设备的净额和折旧以及无形资产的摊销。
•调整后EBITDA-定义为调整后的年度利润,不包括所得税(费用)、财务成本、净额、物业、厂房和设备的折旧、无形资产的摊销和定义的某些资本化开发费用的减值/(冲销)。
•净债务-定义为流动贷款和借款加上流动和非流动可转换债券减去现金和现金等价物减去流动和非流动限制性现金。
为了向投资者提供有关我们财务业绩的更多信息,我们提供了以下EBIT、EBITDA和调整后EBITDA的对账,以实现本年度的利润,这是最直接可比的IFRS财务指标。
我们将EBIT、EBITDA和调整后的EBITDA包括在我们的年度报告中,因为我们相信这些衡量标准对于投资者比较报告期内和报告期之间的关键财务数据很有用。具体地说,我们认为,这些措施为投资者提供了对我们经营业绩的补充衡量,并突出了我们核心业务的趋势,否则这些趋势在仅依靠国际财务报告准则衡量时可能不会显现。特别是,在计算调整后的EBITDA时剔除某些费用可以为我们的核心业务的期间与期间的比较提供有用的衡量标准。
我们使用EBIT、EBITDA和调整后EBITDA作为一种分析工具有局限性,您不应孤立地考虑它或将其作为IFRS报告的我们业绩分析的替代品。其中一些限制是:
•虽然折旧和摊销是非现金费用,但正在折旧和摊销的资产将来可能需要更换,EBITDA和调整后的EBITDA不反映此类更换或新的资本支出要求的现金资本支出要求;
•它们不反映我们营运资金需求的变化或现金需求;
•这并不反映我们所缴交的税款可能会减少;以及
•其他公司,包括我们行业的公司,可能会以不同的方式计算这些衡量标准,这降低了其作为比较指标的有效性。
下表列出了非公认会计准则计量与本公司年度报告中披露的计量之间的对账:
| | | | | | | | | | | | | | | | | |
| 截至十二月三十一日止的年度, |
| 金额(单位:$‘000) | 2021 | | 2020 | | 2019 |
| 本年度利润 | 15,996 | | | 37,746 | | | 40,557 | |
| 所得税费用 | (7,082) | | | (6,348) | | | (11,747) | |
| 财务成本,净额 | (8,823) | | | 32,524 | | | 16,199 | |
| 息税前利润 | 14,255 | | | 76,618 | | | 68,504 | |
增列:折旧及摊销 | 6,390 | | | 6,052 | | | 4,995 | |
| EBITDA | 20,645 | | | 82,670 | | | 73,499 | |
增列:减损(1) | 10,438 | | | — | | | 2,120 | |
添加:减值冲销(1) | — | | | — | | | (2,940) | |
| 调整后的EBITDA | 31,083 | | | 82,670 | | | 72,679 | |
(1)2019年290万美元的一次性冲销涉及2018年减值资本化开发成本的冲销。鉴于另一条发展轨道上存在210万美元的(无关)减值费用,2019年的减值费用净额为80万美元(290万美元减去210万美元)。2021年的减值费用1,040万美元包括与取消下游设施IS Oss有关的减值费用540万美元,以及与RUCONEST新变种的暂停开发计划有关的500万美元减值费用® 以及法布里病的α-半乳糖苷酶的剥夺发展轨迹。有关详情,请参阅本年度报告其他部分的年度财务报表附注9及附注10。
为了向投资者提供有关我们财务业绩的更多信息,我们在下表中披露了非公认会计准则财务指标--净债务。我们提供了以下当前贷款和借款与净债务的对账,这是最直接可比的国际财务报告准则财务指标。债务净额是反映本公司负债、财务灵活性及资本结构的有用指标,因为它显示在计入本集团业务内可用于偿还未偿还借款的现金及现金等价物后的借款水平。
| | | | | | | | | | | | | | | | | |
| 截至十二月三十一日止的年度, |
| 金额(单位:$‘000) | 2021 | | 2020 | | 2019 |
| 活期贷款和借款 | — | | | — | | | 51,125 | |
| 新增:当前可转换债券 | 1,879 | | | 2,040 | | | — | |
| 新增:非流动可转换债券 | 139,007 | | | 149,727 | | | — | |
| 减去:现金和现金等价物 | (191,924) | | | (205,159) | | | (74,348) | |
| 减去:流动和非流动受限现金 | (1,039) | | | (1,505) | | | (2,543) | |
净债务 (2) | (52,077) | | | (54,897) | | | (25,766) | |
(二)按资产负债表折现的价值。
B.流动资金和资本资源
流动性与资本资源
截至2021年12月31日,现金和现金等价物(不包括限制性现金)为1.919亿美元。我们主要通过销售我们的商业产品以及发行债券和股票的收益来为我们的业务提供资金。我们希望我们的营销和销售、研发以及一般和
在可预见的未来,随着我们批准的产品继续商业化并推进我们候选产品的临床开发,管理成本将会增加。我们预计,由于为我们的候选产品和我们获得或开发的任何新产品候选进行临床试验,以及为我们的候选产品在欧洲、美国和其他司法管辖区寻求营销批准的成本,我们的研发和销售、一般和管理成本将会增加。
展望未来,我们认为,在新冠肺炎爆发和市场波动之后,不确定性依然存在。在编制财务报表时,作为采纳持续经营企业的一部分,考虑了全球新冠肺炎疫情的未来影响。特别是,执行董事和高级管理人员评估了当前新冠肺炎疫情影响公司收入、成本或其他活动的可能性,其程度使公司因到期而无法履行所有债务的可能性降低,并得出结论,这种情况在未来12个月内发生的可能性不大。虽然如果长期严格限制商务旅行,销售增长可能会略低于预期,但我们患者的潜在需求预计不会以任何方式改变,因此需求至少应该保持在当前水平。如果疫情继续下去,某些费用可能会推迟或根本不发生。
除上述情况外,风险因素、未来可能采取的行动和其他不确定因素依然存在,目前无法可靠地估计其对公司未来的影响。虽然尚不确定,但我们不相信新冠肺炎病毒的影响会对我们的财务状况或流动性产生实质性的不利影响,我们预计能够履行我们的财务义务。
预计2021年年末现金余额(不包括限制性现金)1.919亿美元将为本公司提供超过12个月的资金,自本报告日期起计。此外,在支付了截至2022年3月31日的正常成本和支出后,加上来自客户的正常销售收入和正常成本,公司截至2022年3月31日的现金余额增加到约189.7美元。向我们在拉丁美洲、韩国和以色列的合作伙伴商业供应产品的收入以及在美国和欧洲直接销售的收入目前产生的现金比公司日常开支和供应这些销售所需的现金更多,因此产生的盈余现金将进一步支持我们的资本支出计划和财务储备。
Pharing在2017年前有过运营亏损的历史。董事会和官员预计,在2022年期间,RUCONEST®将继续(直接或由我们的合作伙伴)出售,使Pharming从此类销售中获得的收益足以满足我们的运营成本、财务成本和包括资本支出在内的所有其他现金需求,就像2021年的情况一样。
然而,目前无法就未来利润的时间或规模或在此基础上能否保持一致的净利润做出进一步保证。此外,如果本公司需要通过增发股份筹集资金,股东的股权在投票权方面可能会被稀释,而他们的价值利益将取决于发行该等股票的价格。本公司认为不再需要筹集资本以支持其目前的业务,但可能会抓住机会通过发行股票或通过扩大现有可转换债券或筹集债务,或通过该等工具的组合来支持收购或许可额外资产,前提是能够获得符合股东最佳利益的适当条款。
现金流
下表提供了截至2021年12月31日、2020年和2019年12月31日止年度的部分现金流信息。
| | | | | | | | | | | | | | | | | |
| 金额(单位:$‘000) | 2021 | | 2020 | | 2019 |
| 经营活动产生的现金流量净额 | 37,842 | | | 83,626 | | | 74,149 | |
| 用于投资活动的现金流量净额 | (21,305) | | | (15,629) | | | (28,256) | |
| 融资活动产生(用于)的现金流量净额 | (27,947) | | | 60,686 | | | (63,473) | |
| 汇率效应 | (1,825) | | | 2,128 | | | 60 | |
| 现金和现金等价物净变化 | (13,235) | | | 130,811 | | | (17,520) | |
经营活动
截至2021年12月31日的年度,经营活动产生的净现金流为3780万美元,而截至2020年12月31日的年度为8360万美元。减少4,580万美元主要是由于截至2021年12月31日止年度的营业利润由截至2020年12月31日止年度的7,630万美元减少至1,360万美元。这与截至2021年12月31日的年度收入下降和运营成本上升的情况一致。
截至2020年12月31日止年度,营运活动产生的净现金流为8,360万美元,而截至2019年12月31日止年度则为7,410万美元。增加950万美元主要是由于营业利润由截至2019年12月31日止年度的6820万美元增至截至2020年12月31日止年度的7630万美元,主要由于收入增加及毛利相应增加所致。
投资活动
截至2021年12月31日的年度,用于投资活动的净现金流为2,130万美元,而截至2020年12月31日的年度为1,560万美元。增加570万美元主要是由于截至2021年12月31日止年度的资本开支为1,070万美元(2020年:470万美元)。这些资本支出主要用于投资新的生产设施和机器设备。
截至2020年12月31日止年度,用于投资活动的净现金流量为1,560万美元,而截至2019年12月31日止年度则为2,830万美元。减少1,270万美元主要是由于于2019年从诺华收购了leniolisib的许可证。2020年的主要投资现金流为860万美元,涉及终止与Sobi的许可证和重新获得的商业权,以及470万美元的物业、厂房和设备资本支出。
融资活动
在融资活动方面,截至2021年12月31日的年度,公司的现金净流出为2,790万美元,而截至2020年12月31日的年度,融资活动的现金净流入为6,070万美元。这8,860万美元的变动主要与2021年1月发行的可转换债券的收益不存在有关,而2020年1月的收益为1.428亿美元。此外,2020年1月,本公司偿还并完全取消了Orbimed的贷款。2021年期间没有达成任何新的贷款和借款协议。
在融资活动方面,本公司截至2020年12月31日止年度的现金净流入为6,070万美元,而截至2019年12月31日止年度的融资活动现金净流出为6,350万美元。这1.242亿美元的变动主要与2020年1月发行可转换债券的收益(1.428亿美元)有关。此外,我们偿还了5720万美元的贷款和借款,这也有助于降低贷款和租赁的利息支付。
流动资金来源
可转换债券
2020年1月21日,该公司发行了本金总额为1.25亿欧元的3.00%可转换债券,2025年到期。发行债券所得款项净额用于全额赎回Orbimed Advisors贷款余额5,100万美元。净收益的剩余部分将用于支持与扩大公司商业化和制造基础设施有关的资本支出,如果获得批准,还将用作推出Leniolisib以及其他收购/许可机会的资金。债券按面值发行,利息为年息3.00%,每半年支付一次,等额分期付款。除非之前转换、赎回或购买并注销,否则债券将于2025年1月21日到期。我们可以使用多种资源组合来偿还债券,如经营活动产生的现金、银行融资和债券。当我们越来越接近债券的到期日时,我们将确定正确的组合。
这些债券可转换为该公司的普通股,初始转换价格为2.0028欧元。这一初始转换价格受惯例调整条款的约束。最初作为债券基础的普通股数量为62,412,622股。任何导致换股股份数目增加的换股价格调整,可能需要本公司获得本公司股东的进一步授权,以发行股份、授予认购股份的权利及不包括优先购买权。本公司有权随时按面值加应计利息以现金赎回所有未偿还债券,条件是:(A)在2023年2月13日或之后,在连续30个交易日内至少20个交易日中的每个交易日的平价价值超过本金的130%;或(B)如果在任何时候,最初发行的债券本金总额的85%或以上已被转换和/或回购并注销。
可转换债券由两部分组成。第一个组成部分是金融负债,它代表我们的合同义务,即交付现金或其他金融资产以支付利息和本金,如果不转换的话。第二部分是股本工具,因为它代表一项书面认购期权,授予持有人在指定期间将其转换为固定数量的本公司普通股的权利。
关于负债组成部分的代价的公允价值按没有任何相关股权转换选择权的类似负债的公允价值计量(IFRS 9第5.1.1段)。这是负债组成部分在初始确认时的账面金额。
权益部分将按没有任何相关权益转换选择权的类似负债的面值和公允价值之间的剩余差额计量(国际会计准则第32段)。初始确认时入账的原始权益部分为160万美元。
C.研发、专利和许可证等。
本公司研发活动及开支的详细资料载于本年度报告内第4项及本第5项“经营业绩”的说明内。
D.趋势信息
见本年度报告第5项内的“经营业绩”。
E.关键会计估计数
我们的年度财务报表是根据国际会计准则委员会发布的国际财务报告准则编制的。在适用会计政策时,需要对资产和负债的价值作出某些判断、估计和假设,而这些判断、估计和假设没有明确的第三方参照。估计数和相关假设是基于历史经验和其他被认为相关的因素。实际结果可能与这些估计不同。我们会不断检讨这些估计和假设。对会计估计的修订,如果修订仅影响该期间,则在修订估计的期间确认;如果修订影响本期和未来期间,则在修订期间和未来期间确认。关于我们在编制财务报表时使用的估计和假设的讨论,请参阅截至2021年12月31日的年度财务报表附注2。
项目6董事、高级管理人员和雇员
A.董事和高级管理人员
董事会结构
自2020年12月11日起,我们实行一级董事会结构,由执行董事和非执行董事组成的单一董事会。我们的首席执行官担任我们的高管董事。
我们的管理团队由我们的执行董事和我们的执行官员组成,并被称为执行委员会。
行政人员及董事
下表列出了截至2021年12月31日我们的高管和董事的信息,包括他们的年龄。2021年离职的董事和行政人员也包括在内。我们的执行董事也是执行官员。
| | | | | | | | | | | |
| 名字 | 年龄 | 职位 | 任期即将届满 |
| 执行董事: | | | |
| 西门·德·弗里斯,医学硕士 | 62 | 执行委员会主席兼首席执行官 | 2025 |
| 行政人员: | | | |
| 阿努拉格·雷兰 | 49 | 首席医疗官 | 不适用 |
| 杰伦·瓦克曼 | 52 | 首席财务官 | 不适用 |
| 罗伯特·弗里森 | 57 | 首席科学官 | 不适用 |
| Mireille Sanders,理学硕士 | 53 | 首席运营官 | 不适用 |
| 斯蒂芬·图尔 | 50 | 首席商务官兼总经理美洲 | 不适用 |
| 路德·范·奥特斯特普 | 57 | 首席道德和合规官 | 不适用 |
安妮-玛丽·德·格鲁特,硕士(7) | 40 | 首席道德和合规官 | 不适用 |
Bruno M.L.Gianneti,医学博士(8) | 69 | 首席医疗官 | 2021 |
| 非执行董事: | | | |
J·巴里·沃德博士(4)(5)(9) | 83 | 董事 | 2021 |
法学院温特分校(1)(6)(9) | 68 | 董事 | 2021 |
保罗·塞克里(6) | 63 | 主席 | 2023 |
黛博拉·乔恩,MBA(2)(3) | 63 | 副主席 | 2023 |
芭芭拉·扬尼(2)(6) | 67 | 董事 | 2024 |
马克·派克特(4) | 58 | 董事 | 2024 |
伦纳德·克鲁默(1) | 55 | 董事 | 2025 |
贾宾·范德梅斯(2)(5) | 55 | 董事 | 2025 |
史蒂文·巴特(4)(6) | 47 | 董事 | 2025 |
备注:
(1)审计委员会主席
(2)审计委员会成员
(3)薪酬委员会主席
(4)薪酬委员会委员
(5)企业管治委员会主席
(6)企业管治委员会成员
(7)辞去执行委员会首席道德和合规官职务,自2021年5月1日起生效。
(8)辞去执行委员会首席医疗官职务,自2021年5月19日起生效。
(9)董事非执行董事及委员会成员的任期于2021年5月19日举行的股东周年大会上届满。
执行董事
西门·德·弗里斯,医学硕士。De Vries博士自2008年起担任我们的首席执行官,并于2020年5月至2020年11月16日Wakkerman先生开始担任首席财务官期间担任临时首席财务官。De Vries博士于2021年5月19日举行的股东大会上再度获委任,任期四年,至2025年股东周年大会结束。在加入Pharming之前,德·弗里斯博士是4-抗体和MorPhochem股份公司的首席执行官。德·弗里斯博士还曾在诺华公司、诺华眼科公司和SmithKline Beecham制药公司担任高级商业和商业职位。德·弗里斯博士拥有阿姆斯特丹大学的医学博士学位和阿什里奇管理学院(英国)的一般管理MBA学位。德弗里斯博士是制药公司Fill&Finish Partner BioConnection B.V.的董事会成员,也是米达泰克制药公司的非执行董事。
行政主任
阿努拉格·雷兰。在2021年6月被任命为首席医疗官之前,Relan先生一直担任Pharming临床研究和医疗事务副总裁,在过去15年中在公司内担任过几个职位。在Pharming工作之前,他在临床实习,同时也在教授住院医师/学生。Relan先生拥有加州大学洛杉矶分校的医学博士和公共卫生硕士学位,以及加州大学伯克利分校的经济学学士学位。
杰伦·瓦克曼。Wakkerman先生自2020年11月以来一直担任我们的首席财务官。从2015年到2020年,瓦克曼担任动物营养和水产饲料领域的全球领先者Nutreco N.V.的首席财务官。在此之前,Jeroen曾在SHV Energy N.V.担任首席财务官,在卡洛尔天然气公司(英国)担任财务董事,还曾在联合利华和荷兰合作银行担任过多个财务和商业职位。Jeroen拥有格罗宁根大学商业经济学硕士学位,是特许财务主管(英国)和特许管理会计师(英国)。
罗伯特·弗里森。弗里森博士于2021年8月被任命为我们的首席科学官。他在药物发现和开发方面有20多年的经验。此前,弗里森曾担任Kiadis Pharma和Ablynx的首席技术官,直到这两家公司被赛诺菲收购。在加入赛诺菲之前,Friesen博士是ProQR研究高级副总裁,也是强生公司旗下Janssen R&D公司的副总裁兼生物研究主管。在加入Janssen研发之前,Friesen博士曾在AM-Pharma、Morphy Sys和Crucell担任过高级研发职位。弗里森博士在高影响力的科学期刊上发表了几篇文章,并参加了许多受邀的讲座。他还在生物技术领域获得了多项专利。弗里森博士在乌得勒支大学获得生物学硕士学位,在德克萨斯大学医学分校获得生物化学博士学位。
Mireille Sanders,理学硕士在2020年12月15日被任命为首席运营官之前,桑德斯女士自2019年以来一直担任我们的运营高级副总裁。从2016年到2019年,桑德斯在强生旗下的扬森制药公司担任临床供应链战略管理和系统负责人。在加入Janssen之前,桑德斯在2007年至2015年期间在MSD/Merck担任高级职位。她拥有荷兰埃因霍温技术大学的化学工程硕士学位。
斯蒂芬·图尔。在2020年12月15日被任命为首席商务官兼美洲总经理之前,Toor先生自2020年以来一直担任我们的美国业务Pharming Healthcare的总裁兼总经理。2017年至2020年,Toor先生担任博世健康(前身为Valeant)美国高级副总裁兼总经理。在加入Pharming之前,Toor先生于2013年至2016年担任博世健康(前身为Valeant)董事免疫、孤儿和成熟品牌销售和营销高级副总裁。在2013年之前,Toor先生曾在Pharmacia/Pfizer和ScheringPlough/Merck任职。他拥有曼彻斯特大都会大学的欧美历史荣誉学士学位。
路德·范·奥特斯特普。在2021年5月1日被任命为首席道德和合规官之前,van Outersterp先生从2020年4月1日起担任我们的公司秘书。在加入Pharming之前,van Outersterp先生在荷兰银行及其前身担任过多个高级领导职位,包括法律和公司秘书全球主管,以及前荷兰飞机制造商Fokker的高级法律顾问。范·奥特斯特普先生也是一家医疗保健机构的监事会成员,并在荷兰德里卑尔根的治理大学任教。他在阿姆斯特丹Vrije大学获得法律硕士学位。
布鲁诺·M·L·吉安内蒂医学博士Giannetti博士自2021年5月19日起辞去执行委员会首席医疗官一职。Giannetti博士自2019年以来一直担任我们的首席医疗官。2006年至2019年,Giannetti博士担任我们的首席运营官。在2006年加入Pharming之前,Giannetti博士是AM Pharma B.V.的首席执行官,CRM临床试验有限公司(现为Topcro GmbH)的总裁兼创始人,以及Verigen AG的总裁兼首席执行官。他曾在Coopers&Lybrand(瑞士和英国)担任药物研发项目的高级管理顾问。Giannetti博士也是奥地利免疫公司的全球营销和医疗信息副总裁和Madaus AG的临床研究主管。Giannetti博士拥有波恩大学的化学博士和医学博士学位,并被任命为西班牙塞维利亚大学药学院的客座教授。
安妮-玛丽·德·格鲁特,硕士德·格鲁特女士于2021年5月1日辞去执行委员会首席道德与合规官一职,在2020年12月15日被任命为首席道德与合规官之前,德·格鲁特女士自2016年起担任我们负责组织发展的高级副总裁。从2014年到2015年,德·格鲁特女士担任我们董事的企业发展部部长。2014年前,德·格鲁特曾在兰德斯塔德、扬森制药和Pharming担任过多个职位。她拥有莱顿大学社会工作学士学位和人力资源管理学士学位。
非执行董事
保罗·塞克里。Sekhri先生自2016年以来一直担任我们的董事会主席(或前监事会至2020年12月),并从2015年开始担任董事。Sekhri先生于2019年1月被任命为eGenesis,Inc.的总裁兼首席执行官。在加入eGenesis,Inc.之前,Sekhri先生在2015年2月至2018年12月期间担任Lycera Corp.的总裁兼首席执行官。2014年4月至2015年1月,Sekhri先生担任赛诺菲综合护理高级副总裁。2013年5月至2014年3月,Sekhri先生在Teva制药工业有限公司担任集团执行副总裁、全球业务发展和首席战略官。在加入Teva之前,Sekhri先生在TPG Capital的生命科学风险投资部门TPG Biotech担任了五年的运营合伙人和生物技术运营小组负责人。从2004年到2009年,Sekhri先生是Cerimon制药公司的创始人、总裁兼首席执行官。在创立Cerimon之前,Sekhri先生是ARIAD制药公司的总裁兼首席业务官。此前,Sekhri先生在诺华公司工作了四年,担任诺华制药公司的高级副总裁和全球搜索和评估、业务发展和许可主管。Sekhri还为诺华制定了疾病区战略,确定了该公司将重点关注的具体治疗领域。Sekhri在诺华的第一个职位是担任早期商业开发部全球主管。Sekhri先生在马里兰大学医学院完成了神经科学的研究生课程,并在那里获得了动物学学士学位。Sekhri先生目前也是长板制药公司Compugen Ltd.的董事会主席,也是Veeva系统公司和益普森公司的董事会成员。作为狂热的古典音乐爱好者,Sekhri先生是大都会欧朋公司的董事会成员, 骑士队和卡内基音乐厅赞助人委员会。
黛博拉·乔恩,MBA。乔恩自2019年以来一直担任董事的一员。2016年至2018年,乔恩女士担任Eyepoint制药公司负责企业和商业发展的执行副总裁。在加入Eyepoint之前,她是博世健康公司(前身为Valeant制药公司)的执行副总裁兼集团公司董事长,负责皮肤病、胃肠病和HAE业务。在博士伦2013年被博士伦健康公司收购之前,Jorn女士曾担任博士伦首席全球营销官,在博士伦领导了几款新产品的推出,并在收购后整合了Ista PharmPharmticals。在此之前,在先灵葆雅被默克公司收购之前,她曾担任先灵葆雅公司妇女保健和生育集团副总裁(2008年至2010年)和过敏与呼吸集团副总裁(2004年至2008年)。乔恩女士还曾在强生担任内科和早期商业投入全球副总裁。她的职业生涯始于默克公司,并在研发、监管以及销售和营销等多个职能领域担任了20多年的进步责任职位。如今,乔恩女士还在ViveveMedical,Inc.和DAURNAL集团的董事会任职。2016年5月至2018年7月,她担任Orexigen治疗公司的董事会成员。
芭芭拉·扬尼。自2020年12月以来,雅尼一直担任董事的一员。从2001年11月到2014年3月退休,Yanni女士一直担任制药公司默克公司的副总裁兼首席许可官。在此之前,Yanni女士在默克公司担任过各种职务,包括企业发展、财务评估和税务。Yanni女士目前在另外三家上市生物技术公司的董事会任职:Oncorus,Inc.、Trevena,Inc.和Vaccinex,Inc.。Yanni女士也是加拿大私营生物技术公司Mesentech,Inc.的董事会成员。雅尼女士在斯坦福大学法学院获得法学博士学位,在韦尔斯利学院获得文学学士学位。她还拥有纽约大学的税务法学硕士学位。在1985年加入默克之前,芭芭拉是纽约市的一名税务律师。
马克·派克特,VMD,博士。自2020年12月以来,派克特博士一直担任董事的职务。派克特博士之前是PTC治疗公司的首席科学官。从2014年起,派克特博士一直担任安捷利斯生物治疗公司的总裁兼首席执行官,直到2018年被PTC治疗公司收购。在加入安捷利斯之前,派克特博士曾担任Navidea生物制药公司的首席执行官、Alseres制药公司的总裁、Cygenics公司的总裁以及Cytomatrix的总裁兼首席执行官。派克特博士目前在私营公司Myrtelle、InFlectis BioSciences和Exubrion Treeutics的董事会任职。派克特博士拥有分子科学博士学位
她拥有宾夕法尼亚大学生物学学士学位、宾夕法尼亚大学兽医学院VMD学位、阿默斯特学院生物学学士学位和东北大学MBA学位。
伦纳德·克鲁默。克鲁默先生在企业融资、规划和战略方面拥有30多年的经验,其中包括在私营和上市生物技术公司担任高级管理职位20年。1997年至2011年,他担任Crucell N.V.的首席财务官。在加入克鲁塞尔之前,他是通用电气资本旗下的董事欧洲公司TIP预告片的管理人员。克鲁默也是麦肯锡公司的顾问和纽约普华永道公司的审计师。克鲁默先生目前是瑞典生物发明国际公司(BINV.ST)的董事会主席。此外,他还是哥本哈根的新西兰制药公司和卡尔加里的Oncolytics公司(纳斯达克市场代码:ONCY)的董事会成员。他是AI Global Investments(荷兰)PCC Ltd.的董事,并在Karmijn Kapitaal的投资咨询委员会任职。克鲁默先生拥有哈佛商学院工商管理硕士学位,是纽约州的注册公共会计师。
贾宾·范德梅斯。Van der Meijs女士于2017年至2021年3月底担任皇家史基浦集团执行副总裁兼首席财务官。在此之前,她在荷兰皇家壳牌集团(ENXTAM:RDSA)工作了25年,主要担任财务领导职位,但也在荷兰、苏格兰、英格兰、文莱和澳大利亚担任人力资源和战略职位。在壳牌的最新职位上,范德梅斯是壳牌项目和技术业务的财务项目副总裁。Van der Meijs女士目前是Kendrion N.V.(ENXTAM:KENDR)监事会成员,担任审计委员会主席。她是Koole Terminals Holding B.V.的监事会成员,担任员工和薪酬委员会主席,也是丹麦私营公司Grundfos Holding A/S的董事会成员。在Grundfos,她担任审计委员会成员、并购委员会成员和人力资源委员会成员。她也是CHDR(人类药物研究中心)监事会的成员,CHDR是一个独立的早期临床药物研究机构,她是那里的审计委员会成员。此前,贾宾曾担任多个董事会的非执行董事,包括法国巴黎机场公司(EnxTPA:ADP)和澳大利亚布里斯班机场公司。贾宾拥有乌得勒支大学的理学硕士(药学)和药学博士(药学D)学位,并在英国特许管理会计师学会(ACMA)完成了她的专业会计学位。
史蒂文·巴特。在2022年3月之前,Baert先生是旗舰先锋公司的执行合伙人兼首席人力资本官,这是一家总部位于马萨诸塞州剑桥市的生命科学风险投资公司,投资于生物技术、生命科学、健康和可持续发展公司。他曾在2014年至2021年6月担任诺华公司的首席人事官和执行委员会成员。并曾在公司内部担任过多个领导职务,包括新兴增长市场人力资源主管、美国和加拿大人力资源主管以及诺华肿瘤学人力资源全球主管。在加入诺华之前,他曾在百时美施贵宝公司和联合利华担任高级人力资源职位。他还在WeSeeHope USA的董事会任职,这是一家专注于赋予非洲因贫困而孤立的儿童赋权的慈善机构。Baert先生拥有根特Vlerick商学院的工商管理硕士学位、鲁汶Katholieke大学的法律硕士学位和布鲁塞尔Katholieke大学的法学学士学位。
J·巴里·沃德博士。于2021年5月19日召开的董事股东周年大会上,沃德博士作为非执行董事的任期届满。鉴于目前关于他任期的最佳做法建议,他无法获得连任。自2007年以来,沃德博士一直担任董事的职务。沃德博士曾在英国、美国和新加坡的几家制药和生物技术公司担任高级管理职务,其中包括葛兰素史克集团研究有限公司、病毒研究所公司、先锋免疫疗法公司和库多斯制药有限公司,还曾在癌症研究技术有限公司、Spigen SARL、CellCenteric有限公司和BerGenBio AS担任董事职务。他最近的高级管理职位是kudos PharmPharmticals Ltd的首席执行官,该公司于2006年被出售给阿斯利康。沃德先生拥有英国巴斯大学微生物学博士学位。
阿德·德温特法学院阿德·德温特先生作为董事非执行董事的任期于2021年5月19日召开的股东周年大会上届满。鉴于目前关于他任期的最佳做法建议,他无法获得连任。德温特自2009年以来一直担任董事的一员。德温特于1980年在AMRO银行开始了他的职业生涯。他在资本市场、投资银行和机构投资者关系管理领域工作。1990年,德温特先生
成为NIBC(前国家投资银行)的企业和机构融资高级顾问。1998年,德温特先生在阿姆斯特丹的纽约-泛欧交易所(现为泛欧交易所)工作,负责为公司在阿姆斯特丹的证券交易所以董事上市与发行者关系公司的身份提供咨询和接纳。从2009年1月到2015年7月,德温特先生是第一荷兰资本公司阿姆斯特丹的副合伙人,从2008年到2013年底,他是荷兰金融中心中国和印度工作组的成员,该工作组的重点是吸引中国和印度公司在阿姆斯特丹泛欧交易所(交叉)上市。自2010年以来,他一直是Nederlandsche Participatie Exchange(Npex)的副合伙人,这是一个为中小企业证券提供创新的在线融资和交易平台。德温特先生在帮助公司为各种资本市场工具在证券交易所上市方面拥有30多年的经验。他拥有鹿特丹伊拉斯谟大学的法律学位,专攻公司法。
B.补偿
我们的薪酬政策概述
根据荷兰法律,董事和执行干事的薪酬待遇由董事会决定,执行董事不参与有关其自身薪酬的审议和决策。董事会获授权根据股东大会每四年通过一次的薪酬政策,决定执行董事及非执行董事的薪酬福利。
在我们的美国存托凭证在纳斯达克上市之前,股东大会通过了一项更新的薪酬政策,该政策已与修订后的欧盟股东权利指令(“SRD II”)和普遍的最佳做法保持一致。尽管已采纳政策,每次以股份或认购股份的权利作出的安排仍须经股东于股东大会上批准。
我们的薪酬政策旨在支持我们的持续努力,旨在改善整体业绩、促进增长和可持续成功,并提高我们公司的其他长期价值和利益,提供具有竞争力的薪酬待遇,以吸引所需的高管和非执行人才和专业知识,以根据长期战略实现这些目标。
薪酬政策基于一个总体原则,即执行董事及高级管理人员的平均总薪酬水平与本公司相对于与我们相关的基准集团的地位一致。定期与同级组进行比较。每两年,一名独立顾问会进行一次市场比较(薪酬基准)。每一次的同行组都由一组活跃在生命科学领域的欧美综合和商业期上市公司组成,反映了我们公司的运营区域和与招聘和留住顶尖人才最相关的市场,包括重要的美国市场。
欧盟和美国基准组织:
| | | | | | | | |
| 公司所在地 | | 位置 |
| 欧洲 | | |
| 阿尔克-阿尔贝罗 | | 霍肖姆,丹麦 |
| 联合制药 | | 英国切本纳姆 |
| Avadel制药公司 | | 爱尔兰都柏林 |
| 罗勒药用 | | 瑞士巴塞尔 |
| 巴伐利亚北欧 | | 海勒鲁普,丹麦 |
| Bio Gaia | | 瑞典斯德哥尔摩 |
| 生物测试 | | 德雷伊奇,德国 |
| 卡穆鲁斯 | | 瑞典隆德 |
| 科斯莫制药公司 | | 爱尔兰都柏林 |
| 梅鲁斯 | | 荷兰乌得勒支 |
| 密特拉制药公司 | | 比利时列日 |
| 果园治疗学 | | 联合王国,伦敦 |
| 奥利克索 | | 瑞典乌普萨拉 |
| 牛津生物医学 | | 牛津,英国 |
| UniQure | | 荷兰阿姆斯特丹 |
| 瓦尔尼瓦 | | 法国南特 |
| Vecture Group | | 英国切本纳姆 |
| 新西兰制药公司 | | 丹麦哥本哈根 |
| 美国 | | |
| 艾瑞制药 | | 北卡罗来纳州达勒姆 |
| 木通治疗学 | | 马萨诸塞州剑桥 |
| 安妮卡治疗公司 | | 马萨诸塞州贝德福德 |
| 克洛维斯肿瘤学 | | 博尔德 |
| 科莱姆药业 | | 马萨诸塞州斯托顿 |
| Corcept治疗公司 | | 加利福尼亚州门洛帕克 |
| 埃南塔制药公司 | | 马萨诸塞州沃特敦 |
| 苍鹭治疗学 | | 加利福尼亚州圣地亚哥 |
| 铁木制药 | | 马萨诸塞州波士顿 |
| 配基制药公司 | | 加利福尼亚州圣地亚哥 |
| Omeros | | 华盛顿州西雅图 |
| 帕西拉生物科学公司 | | 新泽西州帕西帕尼 |
| RADIUS健康 | | 马萨诸塞州沃尔瑟姆 |
| 回溯 | | 加利福尼亚州圣地亚哥 |
| 瑞格尔制药公司 | | 加利福尼亚州旧金山南部 |
| Supernus制药公司 | | 马里兰州罗克维尔 |
| 万达制药 | | 华盛顿特区 |
适用于全体员工的一致和具有竞争力的薪酬结构是我们薪酬政策的另一项核心原则,以促进共同目标和业绩的文化,使所有执行董事、执行董事和所有员工专注于履行我们的使命、愿景和战略,并创造长期利益相关者价值。
根据适用的规则和法规,我们在公司年报中披露支付给执行董事和非执行董事的薪酬信息。根据荷兰法律,支付给高管的薪酬金额不需要披露。支付给高管的薪酬总额为660万美元。
执行董事和高级职员
执行董事和高级管理人员的薪酬包括:
•以年度基本工资形式支付的固定报酬
•以业绩为基础的可变薪酬,形式如下:
◦短期奖励,形式为年度现金奖金占固定部分的百分比;以及
◦以授予限制性股票的形式提供长期激励;以及
•其他福利,包括缴交养恤金保费、旅费津贴和假期津贴。
以下分别解释了固定薪酬和浮动薪酬要素:
历史薪酬
下表反映了在截至2021年12月31日的年度内支付给董事高管的薪酬金额(以美元为单位):
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额(美元) | 固定报酬 | | 短期变量:年度奖金 | | 基于股份的支付 | | 离职后福利 | | 其他 | | 总计 |
| 首席执行官西门·德·弗里斯 | 681,000 | | 357,000 | | 1,264,000 | | 120,000 | | 38,000 | | 2,460,000 |
上表所列短期浮动奖金以2022年支付的2021年年薪为基础。2021年的短期可变奖金(357,000美元)是以2021年的年薪(681,000美元)为基础,并于2022年支付。
根据荷兰法律,除上述个人外,支付给高管的薪酬金额不需要披露,因此不在此披露。
股票期权计划
下表为高管董事2021年期权持有量变动、行权价及到期日纵览:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2021年1月1日 | | 授予2021年 | | 在2021年实施 | | 2021年被没收/过期 | | 2021年12月31日 | | 行权价格(美元) | | 到期日 |
| 西门·德弗里斯先生 | | 2,800,000 | | — | | — | | — | | 2,800,000 | | 0.912 | | 22/05/2024 |
| 总计 | | 2,800,000 | | — | | — | | — | | 2,800,000 | | | | |
长期激励计划
董事高管有资格参加我公司的长期激励计划,直至2019年。根据该计划,参与者将获得我们公司的股票,股票数量取决于Pharming在三年内的股价表现,与欧洲生物科技公司的同行相比。
下表反映了2018年至2021年期间授予首席执行官的LTIP股票数量:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 年 | | 授与 | | 已解决 | | 没收 | | 未归属的 | | 预留至2021年12月31日 |
| 西门·德弗里斯先生 | | 2021 | | 1,337,888 | | | — | | | — | | | — | | | 1,337,888 |
| 2020 | | — | | | — | | | — | | | — | | | — | |
| 2019 | | 201,050 | | | — | | | — | | | — | | | 201.050 | |
| 2018 | | 130,131 | | | (130,131) | | | — | | | — | | | — | |
2021年批出的LTIP股票数量和总数以及每股公允价值奖励概述如下:
| | | | | |
| 参与者类别 | 2021 |
| 董事会非执行董事 | — | |
| 董事会执行成员 | 1,337,888 | |
| 执行委员会 | 6,301,400 | |
| 高级管理人员 | 812,500 | |
| 总计 | 8,451,788 | |
| 每股公允价值奖励(美元) | 0.887 | |
下表概述了2019年至2021年授予、没收或发行的LTIP股票,以及截至2021年12月31日保留的LTIP股票数量:
| | | | | | | | | | | | | | | | | | | | | | | |
| 参与者类别 | 授与 | | 没收 | | 未归属的 | | 预订时间为2021年12月31日 |
| 董事会非执行董事 | 205,000 | | (115,000) | | (72,000) | | 18,000 |
| 董事会执行成员 | 1,538,938 | | 0 | | (160,840) | | 1,378,098 | |
| 执行委员会 | 6,733,207 | | 0 | | (1,179,259) | | 5,553,948 | |
| 高级管理人员 | 3,572,500 | | (180,000) | | (1,380,000) | | | 2,012,500 | |
| 总计 | 12,049,645 | | | (295,000) | | | (2,792,099) | | | 8,962,546 | |
2018年的股份在归属期限结束时(2020年12月31日)确实归属了,总共发行了50%的已授予LTIP股份。在2020年12月31日保留的LTIP股份涉及2019年和2020年可供仍在服务的参与者使用的股份。2019年的股份确实在归属期限结束时(2021年12月31日)归属,共发行了20%的已授予LTIP股份。
由于不包括前管理委员会和前监事会,长期奖励计划支出减少。
本年度薪酬
固定薪酬
下表反映了截至2021年财政年度执行董事的年度基本工资(固定薪酬):
| | | | | | | | | | | |
| 职位 | | 固定报酬金额(美元‘000) | 固定薪酬金额(000欧元) |
| 首席执行官 | | 681,000 | 574,000 |
董事会可以在没有执行董事参与的情况下,根据薪酬委员会的提议,决定在薪酬政策规定的范围内增加执行董事和高级管理人员的基本工资,但增加的幅度不得超过本公司员工的平均加薪幅度。根据最近的一项基准分析,已决定在2023年底之前分多个(基准)年度阶段提高董事首席执行官/高管的个人固定薪酬,以弥合与中值之间的10%差距。
可变薪酬
执行董事和高级管理人员薪酬的浮动部分与我们每一位高级管理人员和董事相对于一套符合并支持我们公司战略和长期利益的财务和非财务目标的表现挂钩。目标设定中也嵌入了风险协调,以促进健全和有效的风险管理。在相关业绩期间结束时,董事会将在没有执行董事参与的情况下确定目标是否已实现。我们在每一份年度报告所包含的薪酬报告中提供了针对前一年设定的目标的实际业绩的回溯性解释。从2020年起浮动薪酬的构成部分如下。
短期激励
自2020财政年度起,首席执行官的个人目标奖金定为年薪总额的70%,其他执行董事和高级管理人员的奖金定为年薪总额的50%。首席执行官和高管的最高年薪总额为140%。
长期激励
执行董事和高级管理人员还将参与修订后的(执行)长期激励(LTI)计划。根据这一计划,Pharming的普通股被授予,条件是实现预先定义的以长期战略为导向的业绩目标和目标,这些目标应用定义的权重,这些目标是在三年业绩期间开始时设定的。业绩目标包括股东总回报(权重40%)和长期战略导向目标的实现(权重60%)。用于确定股东总回报的同行组由被纳入AMX指数和纳斯达克生物技术指数的公司组成,分别以IBB ETF为代表,权重相等。
对于执行董事而言,在业绩期间开始时根据LTI授予的(限制性)股份的目标价值被设定为首席执行官年薪总额的300%,其他执行董事和高级管理人员的目标价值为200%。根据LTI,可以授予的股票的最高价值被设定为首席执行官年薪总额的450%,其他执行董事和高级管理人员的300%。执行董事必须保留根据LTI授予的股份,自授予之日起至少五年。
LTI计划下新的三年归属计划的实施对现有执行董事和高管截至2023年期间的现行薪酬福利产生重大影响,因为授予他们的股份的首次归属定于2024年第一季度进行。
根据二零一九年授出的购股权数目,按现行方案及计划于此三年期间以股份为基础的薪酬将产生三项购股权授予,并保证在三年期间继续任职的基础上授予行政总裁合共8,400,000份购股权。此外,首席执行官将有资格获得三次年度长期激励计划限制性股票奖励,金额最高可达基本工资的30%。
为减轻上述影响,吾等已同意于美国存托股份于纳斯达克上市前召开的股东大会上批准与首席执行官作出一次过的交接安排。这项一次过的过渡安排规定(I)将向首席执行官授予的8,400,000份期权总数转换为总数量为4,200,000股的一次授予,归属将受新LTI计划的业绩标准管辖,以及(Ii)将于2020年授予首席执行官的业绩股份,分三个年度分批授予首席执行官,分别于2021年第一季度、2022年和2023年第一季度。自2020年起,首席执行官将放弃股票期权和长期激励计划下的所有(合同和其他)权利和权利,这一安排将受到限制。2021年与执行干事商定了一项类似的一次性过渡安排,即
由于根据新LTI计划授予行政人员的股份首次归属于2021年第一季度,而行政人员不再享有年度购股权及授予LTIP股份的权利于2021年生效,因此,于2021年,行政人员不再享有年度购股权及授予LTIP股份。根据一次过过渡安排于2021年授予行政人员的限制性股份将分别于2022年第一季度及2023年第一季度分成两批等额归属。
非执行董事
非执行董事的酬金是固定的,与本公司的表现无关,以确保根据现行最佳做法,独立履行其监督任务及责任。在2020年前,前监事会成员(截至2020年12月11日为非执行董事)有权参与本公司的LTIP计划。从2020年起,原监事会成员将不再参加LTIP。
我们非执行董事的历史薪酬
下表概述了截至2021年12月31日的年度向非执行董事(前监事会成员)支付的薪酬(以美元为单位,注意美元薪酬是按当年适用的年平均汇率换算的(2021:1:1,1860)):
| | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 年 | | BOSD/BOD | | 股份支付 | | 总计 |
| | | | | | | |
| Paul Sekhri先生 | 2021 | | 77 | | | 55 | | | 132 | |
| 2020 | | 74 | | | 59 | | | 133 | |
| 2019 | | 56 | | | 37 | | | 93 | |
| 巴里·沃德先生 | 2021 | | 23 | | | 20 | | | 43 | |
| 2020 | | 62 | | | 46 | | | 108 | |
| 2019 | | 44 | | | 30 | | | 74 | |
| Jan Hendrik Egberts先生 | 2021 | | — | | | — | | | — | |
| 2020 | | — | | | 5 | | | 5 | |
| 2019 | | 18 | | | — | | | 18 | |
| 尤尔根·恩斯特先生 | 2021 | | — | | | 6 | | | 6 | |
| 2020 | | 57 | | | 42 | | | 99 | |
| 2019 | | 47 | | | 29 | | | 76 | |
| 阿德·德温特先生 | 2021 | | 26 | | | 21 | | | 47 | |
| 2020 | | 65 | | | 46 | | | 111 | |
| 2019 | | 50 | | | 31 | | | 81 | |
| Deb Jorn女士 | 2021 | | 64 | | | 42 | | | 106 | |
| 2020 | | 62 | | | 40 | | | 102 | |
| 2019 | | 29 | | | 6 | | | 35 | |
| Barbara Yanni女士 | 2021 | | 60 | | | 36 | | | 96 | |
| 2020 | | 35 | | | 24 | | | 59 | |
| 2019 | | — | | | — | | | — | |
| 马克·派克特先生 | 2021 | | 57 | | | 36 | | 93 | |
| 2020 | | 35 | | | 24 | | | 59 | |
| 2019 | | — | | | — | | | — | |
| 贾宾·范德梅斯女士 | 2021 | | 47 | | | 24 | | 71 | |
| 2020 | | — | | | — | | | — | |
| 2019 | | — | | | — | | | — | |
| 里昂·克鲁默先生 | 2021 | | 47 | | | 24 | | 71 | |
| 2020 | | — | | | — | | | — | |
| 2019 | | — | | | — | | | — | |
| 史蒂文·巴特先生 | 2021 | | 45 | | | 24 | | 69 | |
| 2020 | | — | | | — | | | — | |
| 2019 | | — | | | — | | | — | |
| 总计 | 2021 | | 446 | | | 288 | | | 734 | |
| 2020 | | 390 | | | 286 | | | 676 | |
| 2019 | | 226 | | | 133 | | | 359 | |
下表概述了截至2021年12月31日的一年中,董事会非执行成员和/或前监事会成员在任期间LTIP股票数量的变动情况:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | | 年 | | 授与 | | 已解决 | | 没收 | | 未归属 | | 预订时间为2021年12月31日 |
| P.Sekhri | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 50,000 | | | (10,000) | | | — | | | (40,000) | | | — | |
| | 2018 | | 30,000 | | | (15,000) | | | — | | | (15,000) | | | — | |
| D.乔恩 | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 40,000 | | | (8,000) | | | — | | | (32,000) | | | — | |
| A·德温特 | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 40,000 | | | — | | | (40,000) | | | — | | | — | |
| | 2018 | | 25,000 | | | (12,500) | | | — | | | (12,500) | | | — | |
| J.B.沃德 | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 35,000 | | | — | | | (35,000) | | | — | | | — | |
| | 2018 | | 25,000 | | | (12,500) | | | — | | | (12,500) | | | — | |
| 总计 | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 165,000 | | | (18,000) | | | (75,000) | | | (72,000) | | | — | |
| | 2018 | | 80,000 | | | (40,000) | | | — | | | (40,000) | | | — | |
本年度非执行董事薪酬
考虑到非执行董事作为本公司一级董事会成员的责任和时间承诺,2020年及以后,非执行董事有权获得以下年度薪酬。非执行董事每年获得4.5万欧元的现金预聘金和3万欧元的非限制性股票。我们的董事会主席每年将获得65,000欧元的现金和40,000欧元的非限制性股票。股份酬金于股东周年大会前20天的VWAP计值,授予不受进一步限制。
此外,非执行董事还可获得以下委员会费用:
• 审计委员会:每年现金3,000欧元(主席9,000欧元);
• 薪酬委员会:每年现金3000欧元(主席6000欧元);以及
• 企业管治委员会:每年现金3,000欧元(主席6,000欧元)。
此外,根据董事会主席的决定,如果发生非常活动,可额外支付每天1,186美元的补偿。
下表概述了2021年12月31日终了年度支付给非执行董事的薪酬总额(单位:美元,注意美元薪酬是按当年适用的年度平均汇率换算的(2021:1:1,1860)):
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 固定报酬 | | 股份支付 |
| Paul Sekhri先生 | 77 | | 55 |
| 巴里·沃德先生 | 23 | | 20 |
| Jan Hendrik Egberts先生 | 0 | | 0 |
| 尤尔根·恩斯特先生 | 0 | | 6 |
| 阿德·德温特先生 | 26 | | 21 |
| Deb Jorn女士 | 64 | | 42 |
| Barbara Yanni女士 | 60 | | 36 |
| 马克·派克特先生 | 57 | | 36 |
贾宾·范德梅斯女士 (1) | 47 | | 24 |
里昂·克鲁默先生 (1) | 47 | | 24 |
史蒂文·巴特先生 (1) | 45 | | 24 |
(1): In office since May 2021
非执行董事与Pharming并无个人雇佣合约,并无权参与向管理层及员工提供的任何福利,包括但不限于退休金计划。本公司或其代表不会向任何非执行董事作出任何贷款或其他财务承诺。
股份所有权
执行董事必须收购并持有我们公司的股份。对于首席执行官来说,公司所持股份的价值至少应相当于其年基本工资的400%。对其他执行董事而言,持有本公司股份的价值应至少相当于其各自年度基本工资的200%。
所有执行董事均有权通过从LTI获得税后业绩股票,随着时间的推移积累其所需的最低股权,而无需自行购买,前提是在首次任命后五年内达到最低股权。
根据荷兰企业管治守则,非执行董事持有的所有本公司股份均为长期投资。
控制权的变更
随着股东大会批准的控制权变更成为无条件的,执行董事将有权在当时已到期的业绩期间按比例归属已发行但未分配的股份,但须取决于适用的业绩衡量标准和目标的实现情况。其余股份将按照预定时间表(即不加速归属)归属,但须视适用的业绩衡量标准和目标的实现情况而定。
如果控制权的主动变更成为无条件的,基于股份的激励计划不会因为控制权的变更成为无条件的结果而自动授予。
如果发生控制权变更或宣布拟正式公开要约收购本公司股份的情况,董事会可在没有执行董事参与的情况下决定以现金结算董事会成员分配的股份。
遣散费
根据《荷兰公司治理守则》和现行荷兰法律法规,执行董事有权获得遣散费,但须遵守下列条件:
•最高遣散费为固定年薪的100%;
•在破产的情况下,不支付遣散费;
•可以被归类为可变的遣散费不会被授予。
在下列情况下,不得支付固定或可变遣散费:
•如果关系在董事高管主动的情况下提前终止,除非这是由于公司的严重过失行为或疏忽;
•董事高管在履行职责过程中有严重过失或者重大过失的。
非执行董事应按照董事会通过的退休时间表辞职。不适用于通知期、遣散费或其他或解约费。
C.董事会惯例.
有关适用于本公司的境外私人发行人豁免的概述,请参阅本年报第16G项“公司管治”。
本公司董事会各委员会
董事会从其非执行成员中任命了一个审计委员会、一个薪酬委员会和一个公司治理委员会。
审计委员会
审计委员会由Krumer先生(主席)、Jorn女士、Yanni女士和van der Meijs女士组成。在2021年5月19日之前,审计委员会由德温特先生担任主席和乔恩女士组成。审计委员会执行的任务包括监督我们内部风险管理和控制系统的运作,包括监督相关法律和法规的执行情况,并监督行为守则的实施;Pharming提供财务信息(例如会计政策的选择、新规则的应用和评估、关于年度账目、预测和外聘审计员工作中估计项目处理的信息);遵守我们外聘审计员的建议和意见;我们的税务规划政策;与外聘审计员的关系,特别是他的独立性、薪酬和为Pharming提供的任何非审计服务;我们的融资;以及信息和通信技术(ICT)的应用。我们审计委员会的组成与DCGC的最佳实践条款和适用的纳斯达克规则一致。
审计委员会受一份符合适用的纳斯达克规则的章程管辖,该章程可在我们的网站www.pharming.com上找到。
薪酬委员会
薪酬委员会由乔恩女士(主席)、派克特先生和巴尔特先生组成。在2021年5月19日退休之前,沃德一直是薪酬委员会的成员。薪酬委员会的任务包括就我们的薪酬政策向我们的董事会提出建议;就我们董事会的个别成员的薪酬提出建议;以及准备我们的薪酬报告以纳入我们的年度报告。我们薪酬委员会的组成符合德州咨询的最佳实践规定和适用的纳斯达克规则。
薪酬委员会受一份符合适用的纳斯达克规则的章程管辖,该章程可在我们的网站www.pharming.com上找到。
企业管治委员会
公司治理委员会由Van der Meijs女士(主席)、Sekhri先生、Yanni女士和Baert先生组成。德温特先生和沃德先生分别担任公司治理委员会主席和成员,直至他们于2021年5月19日退休。企业管治委员会执行的任务
包括监察董事会及公司管治相关法律及法规的遵守情况、监察/评估董事会、其委员会及个别成员的运作,以及为提名新董事而招募及遴选(如适用)。我们的公司治理委员会的组成与DCGC的最佳实践条款和适用的纳斯达克规则一致。
公司治理委员会受一份符合适用的纳斯达克规则的章程管辖,该章程可在我们的网站www.pharming.com上查阅。
D.员工
2021年全年,该公司的加权平均全职员工人数为277人,而2020年和2019年的员工人数分别为229人和189人。该公司在2019-2021年期间表现出的员工增长与业务表现出的增长是一致的。该公司的业务涉及特定的高科技流程,需要雇用具有高技能和积极性的人员。因此,对于Pharming来说,在竞争激烈的全球市场中创造一个有吸引力的工作环境,留住和激励各种不同的人员并吸引人才,这一点很重要。本公司没有任何员工由任何集体谈判单位代表。
| | | | | | | | | | | | | | | | | |
| 加权平均全职当量 | 2021 | | 2020 | | 2019 |
| 荷兰 | 180 | | 145 | | 116 |
| 法国 | 16 | | 14 | | 13 |
| 德国 | 1 | | 2 | | 2 |
| 英国 | 5 | | 3 | | 1 |
| 美国 | 75 | | 66 | | 57 |
| 总计 | 277 | | 229 | | 189 |
| | | | | |
| 加权平均全职当量 | | | | | |
| 一般与行政 | 58 | | 43 | | 31 |
| 研究与发展 | 165 | | 136 | | 115 |
| 市场营销 | 54 | | 50 | | 43 |
| 总计 | 277 | | 229 | | 189 |
E.股份所有权
关于董事会和执行委员会的股份所有权信息见下文第7项。
项目7大股东和关联方交易
A.主要股东
下表列出了截至2022年4月1日我们普通股的实益所有权信息:
•实益拥有本公司已发行普通股5%或以上的每一人或一组关联人士;
•我们的每一位董事和行政人员;以及
•我们所有的董事和高管都是一个团队。
根据美国证券交易委员会规则确定实益权属。这些规则通常将证券的实益所有权归于对这些证券拥有单独或共享投票权或投资权的人,并包括可以在2022年4月1日起60天内获得的普通股。所有权百分比的计算基于截至2022年4月1日已发行和已发行的648,749,000股普通股,再加上每个证券持有人有能力在2022年4月1日起60天内获得的普通股,这符合美国证券交易委员会关于实益所有权披露的规则。
除另有说明外,表中反映的所有普通股均为普通股,且在适用社区财产法的规限下,下列所有人士对其实益拥有的普通股拥有唯一投票权和投资权。该信息不一定表明受益所有权用于任何其他目的。除下表另有说明外,董事、行政人员及指定实益拥有人的地址为Pharming Group N.V,Darwinweg 24,2333 CR Leiden,荷兰。
截至2022年4月1日,据我们所知,没有人是我们已发行和已发行的每一类普通股的实益拥有人超过5%(5%)。
我们大股东的投票权与非大股东的普通股持有者的投票权没有不同。
下表列出了截至2022年4月1日由记录持有人持有(实益拥有)的我们已发行和已发行普通股的数量:
| | | | | | | | |
| 实益拥有人姓名或名称 | 实益普通股股数 | 实益拥有的普通股百分比 |
| 执行干事和执行董事: | 13,503,109.00 | | 2.07% |
| 西门·德·弗里斯,医学硕士(1) | 10,234,383.00 | | 1.57% |
| Mireille Sanders,理学硕士(2) | 770,447.00 | | * |
| 斯蒂芬·图尔(3) | 1,275,542.00 | | * |
| Jeroen Wakkerman(4) | 526,697.00 | | * |
| 罗伯特·弗里森(5) | 38,348.00 | | * |
| 阿努拉格·雷兰(6) | 559,170.00 | | * |
| 路德·范·奥特斯特普(7) | 98,522.00 | | * |
| 非执行董事: | 714,892.00 | | * |
| 保罗·塞克里(8岁) | 447,613.00 | | * |
| 黛博拉·乔恩,MBA(第9名) | 69,958.00 | | * |
| 芭芭拉·扬尼(10岁) | 54,367.00 | | * |
| 马克·派克特(11岁) | 54,367.00 | | * |
| 贾宾·范德梅斯(11岁) | 29,529.00 | | * |
| 里昂·克鲁默(11岁) | 29,529.00 | | * |
| 史蒂文·巴特(11岁) | 29,529.00 | | * |
*代表实益所有权少于1%。
(1)包括截至2022年4月1日持有的7,434,383股普通股及2,800,000股可行使购股权。
(2)由截至2022年4月1日持有的76,697股普通股和693,750股可行使购股权组成
(3)包括截至2022年4月1日持有的138,042股普通股和1,137,500股可行使购股权
(4)由截至2022年4月1日持有的76,697股普通股和450,000股可行使购股权组成
(5)由截至2022年4月1日持有的38,348股普通股组成
(6)由截至2022年4月1日持有的109,170股普通股和450,000股可行使购股权组成
(7)由截至2022年4月1日持有的58,5227股普通股及40,000份可行使购股权组成
(8)由截至2022年4月1日持有的447,613股普通股组成
(9)由截至2022年4月1日持有的69,958股普通股组成
(10)由截至2022年4月1日持有的54,367股普通股组成
(11)由截至2022年4月1日持有的29,529股普通股组成
我们估计,截至2022年4月1日,我们约5.1%的已发行普通股由28家美国机构记录保持者持有。
B.关联方交易
自2018年1月1日以来,我们与我们的董事、高管或超过10%的已发行股本的持有人及其关联方(我们称为关联方)进行了以下交易。关于与我们的董事或高管的关联方交易的更多细节,请参阅管理部分。
与BioConnection B.V.的交易。
我们在正常过程中与BioConnection B.V.进行交易。自2019年4月收购BioConnection 43.85%的股权以来,我们向BioConnection支付了350万美元(2020年:300万美元),用于截至2021年12月31日的填充和完成服务。于2021年12月31日,本公司并无欠款(2020年:10万美元),以支付BioConnection提供的填充物及饰面服务。
与我们的执行人员和董事达成的协议
我们已经与某些高管(包括我们的执行董事)签订了管理合同,而其他高管则受雇于我们。我们与某些非执行董事签订了服务合同。这些协定载有惯例条款和陈述,包括执行干事的保密、竞业禁止、竞业禁止和发明转让承诺。但是,竞业限制条款的可执行性可能受到适用法律的限制。
赔偿协议
公司章程包括一项对所有董事会成员和执行官员的赔偿。我们与我们的每位董事和高管签订了与在纳斯达克上上市我们的美国存托凭证相关的赔偿协议,这与我们的组织章程中包含的赔偿一致。赔偿协议和我们的公司章程要求我们在法律允许的最大程度上赔偿我们的董事和高管。见“管理--保险和赔偿”。
与德弗里斯博士签订的服务合同包括第三方赔偿安排。与我们的三位非执行董事乔恩女士、雅尼女士和派克特先生签订的服务合同包括一项一般赔偿。
与Sanders夫人、Toor先生和Wakkerman先生的雇佣协议不包括合同赔偿(因此,第三方责任索赔受适用法律管辖)。
关联方交易政策
对于本公司在纳斯达克上市,吾等已采用关联方交易政策(关联人政策),要求根据《交易所法》规定须由境外私人发行人披露的所有关联方交易均须经吾等董事会或由独立董事组成的指定委员会(包括审计委员会)批准。我们的董事会还建立了一个内部程序,定期评估关联方交易(根据荷兰法律的定义)是否在正常的业务过程和正常的市场条件下达成。此外,根据荷兰法律,我们必须披露与关联方的重大交易(根据荷兰法律的定义,并受某些例外情况的限制),这些交易不是在正常业务过程中和/或交易达成时在正常市场条件下达成的,此类交易应得到我们董事会的批准。
审核委员会于2021年10月对本公司“关连人士政策”所指的现有关连人士交易进行年度审核。审计委员会根据收集到的资料得出结论,(1)该政策范围内的每一笔交易都是在正常业务过程中进行的,(2)没有相关相关人员的参与。因此,审计委员会根据现行政策批准了这些交易。
C.专家和律师的利益
不适用。
项目8.财务信息
A.合并报表和其他财务信息。
合并财务报表
我们的合并财务报表载于本年度报告20-F表的末尾,从F-1页开始(见项目17--财务报表)。
法律诉讼
有时,我们可能会卷入与正常业务过程中产生的索赔有关的诉讼或其他法律程序。
自2016年10月起,我们将RUCONEST®直接在法国商业化。我们已接到法国保健产品委员会(CEPS)的通知,根据与前被许可方预先达成的定价协议,我们有义务退还2018年与RUCONEST®销售相关的约750,000欧元。由于我们不是此类协议的一方,我们目前正在反对这一索赔的程序中。
股利分配政策
自从我们的普通股在阿姆斯特丹泛欧交易所上市以来,我们从未宣布或支付过我们的普通股的任何股息。我们打算保留任何收益用于我们的业务,目前不打算为我们的普通股支付股息。我们只有在我们的股东权益(Eigen Vermogen)超过我们的已缴足股本和催缴股本加上我们必须不时根据荷兰法律或我们的组织章程保持的准备金的总和,以及(如果涉及利润分配)在我们的股东大会通过似乎允许这种分配的年度账目后,才可以从我们的储备中支付股息或分配。受制于该等限制,未来是否派发股息或其他分派将由本公司董事会酌情决定,并将取决于多个因素,包括本公司的经营结果、现金需求、财务状况、未来前景、合约限制、任何未来债务协议、适用法律下的限制,以及本公司董事会可能认为相关的其他因素。
根据本公司的组织章程(详情请参阅“管理-董事会架构”),本公司的董事会可决定将本公司的全部或部分利润加入本公司的储备,而任何剩余利润将根据本公司董事会的建议在本公司的普通股上分配,但须受荷兰法律的限制。除某些要求外,我们的董事会可以宣布中期股息,而无需股东大会的批准。
B.重大变化。
不适用。
项目9.报价和清单
答:报价和挂牌细节。
自2020年12月22日以来,我们的美国存托股票,或ADS,每股代表制药集团的10股普通股,在纳斯达克全球市场上以“PHAR”的代码报价。自2009年12月21日以来,我们的Pharming Group N.V.普通股已在阿姆斯特丹泛欧交易所挂牌交易,交易代码为“PHAMM”。
B.分配计划。
不适用。
C.市场。
我们的美国存托股份,或ADS,每股代表制药集团的10股普通股,在纳斯达克全球市场上市,代码为“PHAR”。
我们的普通股目前在阿姆斯特丹泛欧交易所挂牌交易,交易代码为“PHAMM”。
D.出售股东。
不适用。
E.稀释。
不适用。
F.发行的费用。
不适用。
项目10.补充信息
A.股本
不适用。
B.组织备忘录和章程
我们通过引用将首次公开募股结束后生效的公司章程说明纳入本公司于2020年12月17日提交给美国证券交易委员会的注册说明书(F-1注册表第333-250984号文件)中,该说明书经修订后生效。该说明概述了我们公司章程中现行有效的某些条款。
C.材料合同
材料协议
诺华公司开发合作和许可协议
2019年8月12日,我们与诺华国际制药股份公司或诺华公司签订了许可协议或诺华许可协议,根据该协议,诺华公司授予我们独家许可,可以开发和商业化Leniolisib(CDZ173),这是一种由诺华公司开发的小分子磷脂酰肌醇3-激酶增量(PI3Kδ)抑制剂,用于治疗激活的磷脂酰肌醇3-激酶Delta综合征(APDS)患者。根据协议条款,许可证是独家的,即使诺华及其附属公司也是如此,根据协议条款,我们被允许再授权独家许可证。从2020年5月8日起,诺华国际制药股份公司合并为诺华制药股份公司。结果,诺华国际制药公司的所有资产和负债,包括诺华许可协议,都变成了诺华制药公司的资产和负债。
根据诺华许可协议的条款,我们于2019年8月向诺华支付了2000万美元的预付款。诺华公司已经完成了到目前为止的所有临床前和临床工作,并将继续进行正在进行的开放标签扩展研究。如果获得批准,我们将计划通过我们在美国和欧洲的现有商业基础设施将Leniolisib商业化,并预计将寻找方法使该药物在全球其他市场上市。根据协议,我们同意在(I)完成某些监管里程碑和(Ii)实现某些leniolisib销售里程碑时,向诺华支付总额高达2亿美元的某些里程碑式付款。我们还同意向诺华公司支付分级特许权使用费,按Leniolisib净销售额的低两位数到高十分之一计算。
该协议将在该国家/地区的许可产品的版税期限届满时,以许可产品和国家/地区的许可产品为基础终止,并将在领土所有国家正在开发、制造或商业化的最后一种许可产品的版税期限届满时全部终止。许可使用费期限在下列最后一次发生时结束:(I)许可专利的有效权利要求在该国家/地区终止;(Ii)该许可产品在该国家/地区的任何监管排他性到期;或(Iii)该许可产品在该国家/地区首次商业销售十(10)周年。任何一方在收到本协议后的一段时间内仍未得到补救的,另一方可以解除协议。
书面通知。我们有权在事先书面通知诺华公司后,以任何理由终止协议。
Valeant资产购买协议
于2016年8月9日,吾等与Salix PharmPharmticals,Inc.,Santarus,Inc.、Valeant PharmPharmticals卢森堡S.A.R.L.、Valeant PharmPharmticals North America LLC(统称“卖方”)及我们的子公司Pharming America B.V.订立资产购买协议。根据资产购买协议,吾等从卖方手中收购了本公司产品RUCONEST®在北美的所有商业化权利。卖方的母公司Valeant PharmPharmticals International,Inc.在收购博士伦后,于2018年更名为博世健康公司。根据资产购买协议的条款,吾等已预付60,000,000美元,并同意根据销售里程碑的实现再支付最多65,000,000美元的未来金额,其中40,000,000美元已支付。2020年,实现了最后一个销售里程碑。因此,Pharming在2021年支付了2500万美元的最后一个里程碑,以实现基于销售里程碑的6500万美元。
果园研究合作与许可协议
2021年7月1日,Pharming与Orchard Treeutics plc达成战略合作,研究、开发、制造OTL-105,并将其商业化。OTL-105是一种用于治疗遗传性血管水肿的研究性造血干细胞(HSC)基因疗法。根据合作条款,Pharming公司已被授予OTL-105的全球使用权,并将负责研究基因疗法的临床开发、监管申报和商业化,包括相关成本。Orchard将领导完成IND使能活动,并在临床前和临床开发期间监督OTL-105的制造,这将由Pharming提供资金。此外,两家公司还将探索与OTL-105给药一起使用的无毒调理疗法的应用。我们预付了1,750万美元,其中包括1,000万美元现金和Pharming的750万美元股权投资,溢价高于Orchard的股价。Orchard还有资格获得高达1.895亿美元的开发、监管和销售里程碑,以及未来全球销售的中位数至低两位数的特许权使用费。
D.外汇管制
根据荷兰现行法律,没有适用于向荷兰以外的人转移与荷兰公司股票有关的股息或其他分配或出售荷兰公司股票的收益的外汇管制,但须遵守根据欧洲联盟条例、1977年《制裁法》(1977年)或其他立法、适用的反抵制、反洗钱或反恐条例和类似规则实施的制裁和措施的适用限制,包括有关出口管制的限制。公司章程或荷兰法律没有特别限制非荷兰公民或居民的股东持有或投票股份的权利。
E.征税
物质所得税的考虑因素
以下摘要介绍了有关收购、拥有和处置我们的普通股或美国存托凭证的荷兰和美国联邦所得税方面的重要考虑因素。本摘要不应被视为与收购代表我们普通股的美国存托凭证的决定相关的所有税务考虑因素的全面描述。
美国联邦所得税对美国持有者的重要考虑
以下是对持有和处置我们的普通股或美国存托凭证的美国持有者的重要美国联邦所得税考虑事项的说明。它不是对可能与特定个人购买证券的决定相关的所有税务考虑因素的全面描述。本讨论仅适用于将我们的普通股或美国存托凭证作为资本资产持有的美国持有者,该资产符合1986年修订后的美国国税法第1221节的含义,或出于税收目的(通常是为投资而持有的财产)。此外,它没有描述可能存在的所有税务考虑因素
考虑到美国持有人的特定情况,包括州和地方税考虑因素,任何美国联邦非所得税考虑因素,如遗产税或赠与税考虑因素,替代最低税收考虑因素,对净投资收入征收的联邦医疗保险缴费税,守则第451(B)节下的特殊税务会计规则,以及符合特殊规则适用于美国持有人的税收考虑因素,例如:
•银行、保险公司和某些其他金融机构;
•美国侨民和某些在美国的前公民或长期居民;
•使用按市值计价的税务会计方法的证券交易商或交易者;
•持有普通股或美国存托凭证的人,作为套期保值交易、“跨境”出售、转换交易或综合交易的一部分,或就普通股或美国存托凭证进行推定出售的人;
•就美国联邦所得税而言,其“功能货币”不是美元的人;
•证券、商品或货币的经纪商、交易商或交易商;
•免税实体或政府组织;
•S公司、合伙企业或其他被归类为合伙或传递或美国联邦所得税目的的实体或安排(以及其中的投资者);
•受监管的投资公司、房地产投资信托基金、积累收入以逃避美国联邦所得税的公司;
•根据任何员工股票期权的行使或以其他方式作为补偿获得我们的普通股或美国存托凭证的人;
•拥有或被视为拥有(包括归属)我们10%或更多股份的人(通过投票或价值);以及
•持有我们的普通股或与美国境外的贸易或业务、常设机构或固定基地有关的美国存托凭证的人。
如果根据美国联邦所得税规定被归类为合伙企业的实体或安排持有普通股或美国存托凭证,则合伙企业的美国联邦所得税待遇通常取决于合伙人的地位和合伙企业的活动。鼓励持有普通股或美国存托凭证的合伙企业和此类合伙企业的合伙人就持有和处置普通股或美国存托凭证的特殊美国联邦所得税考虑事项咨询其税务顾问。
讨论的基础是《法典》、行政声明、司法裁决、最后的、临时的和拟议的财政条例,以及荷兰和美国之间的所得税条约,或条约,所有这些变化都可能影响本文所述的税收后果--可能具有追溯力。
“美国持有者”是指就美国联邦所得税而言,是普通股或美国存托凭证的实益所有人,并且有资格享受本条约利益的持有者:
•是美国公民或个人居民的个人;
•在美国、美国任何州或哥伦比亚特区的法律下设立或组织的公司或其他应作为公司征税的实体;
•其收入应缴纳美国联邦所得税的遗产,无论其来源如何;或
•如果(A)美国法院能够对信托的管理行使主要监督,并且一名或多名美国人有权控制信托的所有实质性决定,或者(B)根据适用的美国财政部法规,信托具有被视为美国人的有效选择。
我们鼓励美国股东就在其特定情况下持有和处置我们的普通股或美国存托凭证所产生的美国联邦、州、地方和非美国税收后果咨询他们的税务顾问。以下讨论假设存款协议所载的陈述属实,并假定存款协议及任何相关协议的义务将会按照其条款予以遵守。一般来说,出于美国联邦所得税的目的,美国存托股份的持有者应该被视为持有美国存托股份所代表的普通股。因此,在将美国存托凭证交换为普通股时,将不会确认任何损益。
被动型外国投资公司规则
非美国公司将在任何课税年度被归类为PFIC,在该年度内,在应用某些检查规则后,下列情况之一:
•至少75%的总收入是被动收入(如利息收入);或
•至少50%的总资产(根据季度平均值确定)可归因于产生被动收入或为产生被动收入(包括现金)而持有的资产。
•为此目的,现金是一种被动资产,被动收入通常包括股息、利息、特许权使用费和租金(特许权使用费和租金除外),这些特许权使用费和租金是在积极开展贸易或业务时获得的,而不是来自相关人士。就这项测试而言,我们将被视为拥有我们所占比例的资产,并在任何其他公司的收入中赚取我们所占的比例份额,我们直接或间接拥有该公司25%或更多的股权(按价值计算)。
根据我们2021年的收入、资产、运营和市值的估计构成,我们不认为我们在截至2021年12月31日的纳税年度被归类为美国联邦所得税目的PFIC。然而,我们不能保证我们在本课税年度或未来任何课税年度不会成为PFIC,也不能保证我们在之前的任何课税年度都不是PFIC。对我们是否为PIC的确定是每年一次的事实密集型确定,适用的法律可能会有不同的解释。特别是,将我们的资产描述为主动或被动可能在一定程度上取决于我们当前和计划中的未来业务计划,这些计划可能会发生变化。此外,就本课税年度及未来课税年度而言,我们用于PFIC测试的资产总值可能会部分参考我们的普通股或美国存托凭证的市价而厘定,而市价可能会有相当大的波动。根据收入测试,我们作为PFIC的地位取决于我们的收入构成,而我们的收入构成将取决于各种不确定因素,包括某些公司间付款和来自税务当局的付款的特征、我们未来进行的交易以及我们的公司结构。即使我们确定我们在某个课税年度不是PFIC,也不能保证美国国税局不会成功挑战我们的地位。因此,我们的美国法律顾问对我们在之前、当前或未来任何纳税年度的PFIC地位不发表任何意见。
如果我们在美国持有人拥有普通股或美国存托凭证的任何年度被归类为PFIC,我们将在美国持有人拥有普通股或美国存托凭证之后的所有年度中继续被视为PFIC,无论我们是否继续符合上述测试,除非(1)我们不再是PFIC,且美国持有人已根据PFIC规则作出“视为出售”的选择,或(2)美国持有人(A)作出“QEF选举”(定义见下文),或(B)有资格作出并按市值计价的选择(如下所述),有关该美国持有人持有期间内的所有应课税年度(我们是PFIC)。如作出该等当作出售选择,则美国持有人将被视为已按其于该等当作出售日期的公平市价出售其持有的普通股或美国存托凭证,而该等当作出售的任何收益将受下述规则所规限。在被视为出售选择后,只要我们没有在下一个课税年度成为PFIC,作出该选择的美国持有人的普通股或ADS将不会被视为PFIC的股份,并且美国持有人将不受以下关于美国持有人从我们那里获得的任何“超额分配”或从实际出售或以其他方式处置普通股或ADS的任何收益的规则的约束。如果我们不再是PFIC,并且可以进行这样的选择,美国持有人应该咨询他们的税务顾问,了解做出被视为出售选择的可能性和后果。
在每个课税年度,对于美国持有人而言,我们被视为PFIC,对于美国持有人收到的任何“超额分配”以及该美国持有人从普通股或美国存托凭证的出售或其他处置(包括质押)中确认的任何收益,美国持有人将遵守特别税收规则,除非(1)该美国持有人就我们是PFIC的所有纳税年度进行了“合格选举基金”选择或QEF选举,或(2)我们的普通股或美国存托凭证构成“可销售股票”,该美国持有者按市值进行选择(如下所述)。美国持股人在纳税年度收到的分派超过美国持有者在之前三个纳税年度或美国持有者持有普通股或美国存托凭证期间收到的年均分派的125%,将被视为超额分派。根据这些特殊的税收规则:
•超额分配或收益将在美国持有者持有普通股或美国存托凭证的期间按比例分配;
•分配给本课税年度以及我们成为私人投资公司的首个课税年度之前的任何课税年度的款额,将被视为普通收入;以及
•每隔一年分配的款额将适用该年度的最高税率,而一般适用于少缴税款的利息费用将对每一该等年度的应得税项征收。
在处置年度或“超额分配”年度之前的年度分配的税款,不能被该年度的任何净营业亏损抵消,出售普通股或美国存托凭证所实现的收益(但非亏损)不能被视为资本利得,即使美国持有者将普通股或美国存托凭证作为资本资产持有。
如果我们是PFIC,对于我们从我们的任何直接或间接子公司(也是PFIC)获得的分配和我们对其股票的处置,美国持有人通常将遵守类似的规则,就像此类分配是由该美国持有人间接接收和/或处置的一样。美国持有人应就PFIC规则适用于我们的子公司咨询他们的税务顾问。
如果美国持有者进行了有效的QEF选举,美国持有者将被要求在每年的总收入中计入资本利得,无论我们是否进行分配,作为资本利得,美国持有者在我们净资本利得中的比例份额,以及作为普通收入,美国持有者在我们超过净资本利得的收益中的比例份额。然而,美国持有人只有在公司同意每年向其提供某些税务信息的情况下,才能就PFIC中的普通股或美国存托凭证进行QEF选举。我们目前不希望在我们被归类为PFIC的情况下提供此类信息。
如果我们是美国股东在任何课税年度持有我们的普通股或美国存托凭证的个人私募股权投资公司,这些美国持有者可以通过对普通股或美国存托凭证进行按市值计价的选择,来避免与我们的普通股或美国存托凭证相关的超额分派或收益的利息费用,前提是普通股或美国存托凭证是“可出售股票”。普通股或美国存托凭证如果在某些美国证券交易所或在满足某些条件的非美国证券交易所“定期交易”,就是可交易的股票。就此等目的而言,普通股或美国存托凭证将于任何日历年内被视为定期交易,但在每个日历季内最少有15天以最低数量进行交易。任何以满足这一要求为主要目的的行业都将被忽略。我们的美国存托凭证(但不是普通股)在纳斯达克上市,这是一个符合这些目的的合格交易所。因此,如果我们的美国存托凭证继续在纳斯达克上市并定期交易,我们预计如果我们是PFIC,我们的美国存托凭证持有者将可以进行按市值计价的选举。对于我们的普通股或美国存托凭证,每个美国持有者都应咨询其税务顾问,以确定是否可以或是否适宜进行按市值计价的选举。
做出按市值计价选择的美国持有者必须在每一年的普通收入中包括相当于我们的普通股或美国存托凭证在纳税年度结束时的公平市场价值超过美国持有者的普通股或美国存托凭证的调整税基的金额。在纳税年度结束时,如果美国持有者的普通股或美国存托凭证的调整基准超过普通股或美国存托凭证的公平市值,选举持有人也可以申请普通损失扣除,但这一扣除仅限于前几年按市值计价的净收益范围内。实际出售或以其他方式出售普通股或美国存托凭证的收益将被视为普通收入,而因出售或以其他方式处置普通股而产生的任何亏损将被视为普通亏损,但以前几年按市值计价的净收益为限。一旦做出选择,未经美国国税局同意,不得撤销选择,除非普通股或美国存托凭证不再是流通股。
然而,通常不能对我们拥有的任何较低级别的PFIC的股权进行按市值计价的选举,除非这些较低级别的PFIC的股票本身就是“可销售的股票”。因此,即使美国持有人就我们的普通股或美国存托凭证作出按市值计价的选择,就其在我们的任何投资中的间接权益而言,美国持有人仍可能继续受PFIC规则(如上所述)的约束,而出于美国联邦所得税的目的,这些投资被视为PFIC的股权。美国持有人应咨询他们的税务顾问,了解按市值计价的选举的可行性和可取性,以及这种选举对任何较低级别PFIC的利益的影响。
除非美国财政部另有规定,否则PFIC的每一位美国股东都必须提交一份年度报告,其中包含美国财政部可能要求的信息。美国持有人未能提交年度报告将导致该美国持有人的美国联邦所得税申报单的诉讼时效保持开放状态
对于在美国持有人提交年度报告后三年内必须包括在此类报告中的项目,除非是由于合理原因而非故意疏忽,否则在此期间,美国持有人的整个美国联邦所得税申报单的诉讼时效将保持开放。美国持有者应就根据本规则提交此类信息申报单的要求咨询他们的税务顾问。
分派的课税
根据上述《被动型外国投资公司规则》的讨论,普通股或美国存托凭证支付的股息,普通股或美国存托凭证的某些按比例分配除外,一般将被视为从我们当前或累积的收益和利润(根据美国联邦所得税原则确定)中支付的股息。由于我们可能不会根据美国联邦所得税原则计算我们的收入和利润,我们预计分配通常将作为股息报告给美国持有者。如果我们是一家“合格外国公司”,非美国公司持有者可能有资格享受适用于长期资本收益(即出售所持资本资产超过一年的收益)的美国存托凭证股息的优惠税率。非美国公司(在支付股息的课税年度或上一课税年度被归类为PFIC的公司除外)一般将被视为合格外国公司(A)如果它有资格享受与美国的全面税收条约的好处,而美国财政部长认为该条约就本规则而言是令人满意的,并且包括信息交换规定(其中包括该条约),或(B)就其支付的美国存托凭证的任何股息而言,该等股息可以在美国既定的证券市场上随时交易。因此,根据上文《被动型外国投资公司规则》的讨论,如果《条约》适用,或者如果美国存托凭证很容易在美国成熟的证券市场上交易,只要满足某些条件,此类股息通常将是符合优惠税率的非公司美国持有者手中的“合格股息收入”, 包括与持有期和没有某些降低风险交易有关的条件。股息的数额将被视为美国持有者的外国股息收入,将没有资格享受根据该准则美国公司通常可以获得的股息扣除。股息通常在美国股东收到股息之日计入美国股东的收入中。以外币支付的任何股息收入的金额将是参考实际收到或推定收到之日的有效汇率计算的美元金额,无论支付实际上是否兑换成美元。如果股息在收到之日兑换成美元,美国持有者不应被要求确认股息收入的外币收益或损失。如果股息在收到之日后兑换成美元,美国持有者可能会有外币收益或损失。这样的收益或损失通常被视为来自美国的普通收入或损失。除现金外的任何财产分派(及若干按比例分派普通股或美国存托凭证或收购普通股或美国存托凭证的权利除外)的金额将为该等财产于分派当日的公平市价。出于外国税收抵免的目的,我们的股息通常将被视为被动类别收入。与确定美国外国税收抵免有关的规则很复杂,美国持有者应咨询他们的税务顾问,了解在他们的特定情况下是否有外国税收抵免,以及申请扣除(代替外国税收抵免)支付或扣缴的任何外国税款的可能性。
普通股和美国存托凭证的出售或其他应税处置
根据《被动型外国投资公司规则》的上述讨论,出售普通股或美国存托凭证或美国存托凭证的其他应税处置所实现的收益或亏损将是资本收益或亏损,如果美国持有者持有普通股或美国存托凭证超过一年,则为长期资本收益或亏损。收益或亏损的金额将等于美国持有者在出售的普通股或美国存托凭证中的纳税基础与出售的变现金额之间的差额,每种情况下都以美元确定。对于外国税收抵免而言,这种收益或损失通常是来自美国的收益或损失。资本损失的扣除是有限制的。如果美国持有者收到的对价不是以美元支付的,变现金额将是根据出售或其他处置日期的现货汇率确定的收到付款的美元价值。然而,如果普通股或美国存托凭证被视为在“既定证券市场”交易,并且您是现金收付制纳税人或权责发生制纳税人,并且您做出了特殊选择(必须每年一致适用,未经美国国税局同意不得更改),您将通过换算销售结算日按现货汇率收到的金额来确定以非美元货币变现的金额的美元价值。如你是按应计制缴税的纳税人,而你没有资格或不选择厘定已变现的款额
使用结算日的即期汇率,您将在出售或处置日实现的美元金额与结算日按即期汇率收到的货币的美元价值之间的任何差额范围内确认外币收益或损失。如果对普通股的应税处置征收外国税,以及他们是否有能力将这种外国税从他们的美国联邦所得税债务中抵扣,美国持有者应咨询他们的税务顾问。
我们强烈敦促您咨询您的税务顾问,了解我们的PFIC身份对您在普通股或美国存托凭证的投资的影响,以及PFIC规则对您在普通股或美国存托凭证的投资的适用情况。
信息报告和备份扣缴
在美国境内或通过某些与美国相关的金融中介机构支付的股息和销售收益通常需要进行信息报告,并可能受到备用扣缴的约束,除非(I)美国持有人是公司或其他豁免收款人,或(Ii)在备用扣缴的情况下,美国持有人提供正确的纳税人识别号码并证明其不受备用扣缴的约束。
备用预扣不是附加税。只要及时向美国国税局提供所需信息,向美国持有者支付的任何备用预扣金额将被允许作为持有者的美国联邦所得税义务的抵免,并可能有权获得退款。
关于外国金融资产的信息
某些作为个人(以及根据拟议的法规,某些实体)的美国持有者可能被要求报告与普通股或美国存托凭证相关的信息,但受某些例外情况的限制(包括某些美国金融机构开立的账户中持有的普通股或美国存托凭证的例外)。这些未能及时提供所需信息的美国持有者可能会受到惩罚。此外,如果美国持有者没有提交所需的信息,则与该信息相关的美国持有者的纳税申报单的诉讼时效可能要到该信息提交后三年才会结束。美国持有者应就其普通股或美国存托凭证的所有权和处置的报告义务咨询其税务顾问。
重要的荷兰税务考虑因素
一般信息
以下是收购、拥有和处置我们的普通股或美国存托凭证所产生的某些重大荷兰税收后果的一般摘要。本摘要并不旨在描述与本公司普通股或美国存托凭证持有人或潜在持有人有关的所有可能的税务考虑因素或后果,亦无意处理适用于所有类别投资者的税务后果,其中一些投资者(例如信托或类似安排)可能须遵守特别规则。鉴于其一般性,应相应谨慎地对待这一一般性总结。
本摘要以荷兰税法、根据税法发布的法规和权威判例法为基础,均在本摘要之日生效,所有内容均可能发生更改,可能具有追溯力。摘要中提到的“荷兰”或“荷兰”仅指荷兰王国位于欧洲的部分。
本讨论仅供一般参考之用,并非荷兰税务建议或与收购、拥有及处置我们普通股或美国存托凭证有关的所有荷兰税务后果的完整描述。本公司普通股或美国存托凭证的持有人或潜在持有人应根据其特定情况,就收购、拥有及处置本公司普通股或美国存托凭证的荷兰税务后果咨询其本身的税务顾问。
请注意,本摘要未说明荷兰的税收后果:
i.普通股或美国存托凭证的持有人,如果该等持有人,以及在个人的情况下,该持有人的合作伙伴或其某些直系亲属(包括寄养子女)根据2001年荷兰所得税法(Wet Inkomstasting 2001)在美国拥有重大权益(Aanmerkelijk Belang)或被视为拥有重大权益(Fitief Aanmerkelijk Belang)。一般而言,一家公司的证券持有人被视为持有该公司的大量权益,如果该持有人单独持有,或者就个人而言,与该持有人的合伙人(如2001年《荷兰所得税法》所界定)一起直接或间接持有:(1)该公司已发行和已发行资本总额的5%或以上的权益,或该公司某类股份已发行和已发行资本的5%或更多;或(2)直接或间接获得此类权益的权利;或(3)与公司年度利润的5%或以上或公司清算收益的5%或5%以上有关的该公司的某些利润分享权。如果一家公司的重大权益(或其部分)已在非确认基础上处置或被视为已处置,则可能产生被视为重大权益;
二、普通股或美国存托凭证持有人,只要该等持有人持有的普通股或美国存托凭证符合或符合1969年《荷兰公司所得税法》(Wet Op De Vennootschaps Last 1969)规定的参与(减值)资格。一般来说,持股人持有公司名义实收股本5%或更多的股份就符合参股资格。如果持股人没有5%或更多的股份,但相关实体(法律定义的术语)有参与,或者持有股份的公司是关联实体(法律定义的术语),则该持有人也可以参与;
三、养老基金、投资机构(财政性投资机构)、免税投资机构(均由1969年《荷兰公司所得税法》界定)和全部或部分不缴纳或部分免征荷兰公司所得税的其他实体,以及在其居住国免征公司所得税的实体,此类居住国是欧洲联盟的另一个国家、挪威、列支敦士登、冰岛或荷兰同意按照国际标准与其交换信息的任何其他国家;以及
四、普通股或美国存托凭证持有人为个人,而普通股或美国存托凭证或从普通股或美国存托凭证衍生之任何利益为该等持有人或若干个人与该等持有人有关之活动之酬金或被视为酬金(定义见2001年荷兰所得税法)。
预提税金
我们派发的股息一般按15%的税率缴纳荷兰股息预扣税。一般来说,我们负责从源头上扣缴此类股息预扣税;荷兰股息预扣税由普通股或美国存托凭证持有人承担。
“分红”一词除其他外包括:
•未确认为荷兰股息预扣税目的的现金或实物分配、视为和推定的实收资本分配和偿还;
•清算收益,普通股或美国存托凭证的赎回收益,或我们或我们的子公司或其他关联实体回购普通股或美国存托凭证的收益,只要该等收益超过该等普通股或美国存托凭证的平均实收资本,用于荷兰股息预扣税目的;
•相当于已发行的普通股或美国存托凭证的面值或普通股或美国存托凭证面值的增加的数额,只要似乎没有为荷兰股息预扣税目的而确认的贡献已经或将会作出的贡献;以及
•如本公司有纯利(Zuivere Winst),除非(I)股东大会已预先议决偿还该等缴入资本及(Ii)有关普通股或美国存托凭证的面值因修订公司组织章程细则而减少同等金额,否则将部分偿还实收资本、确认荷兰股息及预扣税项。
就荷兰税务而言,在荷兰居住或被视为荷兰居民的个人和法人实体(“荷兰居民个人”和“荷兰居民实体”,视情况而定)一般有权就其所得税或公司所得税债务获得任何荷兰股息预扣税的豁免或抵免,并有权退还任何剩余的荷兰股息预扣税。这通常也适用于普通股或美国存托凭证的持有者,他们既不是居民,也不被视为居民
如果普通股或美国存托凭证可归因于该非居民持有人的荷兰常设机构。
普通股持有人或居住在荷兰以外国家的美国存托凭证持有人,可根据该持有人的具体情况,根据荷兰国家税法或荷兰与该另一国家之间生效的双重课税公约,有权获得豁免、减免或全部或部分退还荷兰股息预扣税。
向荷兰税务机关汇款
一般来说,我们将被要求将作为荷兰股息预扣税预扣的所有金额汇给荷兰税务当局。然而,在某些情况下,我们被允许减少汇给荷兰税务当局的金额,金额以下列较小者为准:
•我们支付的应缴纳荷兰股息预扣税的分派部分的3%;以及
•本公司于本日历年(截至本公司分配之日)及之前两个日历年从符合资格的境外附属公司收取的未扣除外国预扣税前的股息和利润分配的3%,但该等股息和利润分配尚未计入上述扣减。
虽然这一减税减少了我们必须汇给荷兰税务当局的荷兰股息预提税额,但它并没有减少我们必须为我们分配的股息预扣的税额。
股利剥离
根据反“股息剥离”的立法,如果股息接受者不是1965年《荷兰股利预扣税法》(Wet OP De De Fredend Lasting 1965)所述的实益所有人,则拒绝减少、免除、抵免或退还荷兰股息预扣税。这项立法一般针对这样的情况,即股东保留其在股票中的经济利益,但通过与另一方的交易减少股息的预扣税成本。这些规则并不要求股利的接受者知道发生了股利剥离交易。荷兰财政国务秘书的立场是,这项立法提出的受益所有权的定义也将适用于双重征税公约。
所得税和资本利得税
荷兰居民实体
一般而言,如果普通股或美国存托凭证的持有人是荷兰居民实体,则普通股或美国存托凭证项下的任何付款或在出售或当作出售普通股或美国存托凭证时变现的任何损益,须按15%的税率缴纳荷兰企业所得税,税率为245,000欧元以下的应税利润税率为25%,超过该数额(2021年的税率和税级)的应税利润税率为25%。
荷兰居民个人
如果普通股或美国存托凭证的持有人是荷兰居民个人,普通股或美国存托凭证的任何付款或在出售或当作处置普通股或美国存托凭证时实现的任何收益或损失,应按荷兰累进所得税税率(2021年最高为49.50%)征税,条件是:
i.普通股或美国存托凭证归属于一家企业,普通股或美国存托凭证持有人从该企业获得利润份额,无论是作为企业家,还是作为不是股东的共同享有该企业净值的人(见2001年《荷兰所得税法》);或
二、普通股或美国存托凭证持有人被视为从事有关普通股或美国存托凭证超越普通资产管理的活动(Normaal,Actief Vermogensbeheer),或从普通股或美国存托凭证取得利益,而该等利益应作为其他活动的利益而课税(Resultaat Uit Overige We Kzaamheden)。
如上述第(I)及(Ii)项不适用于持有普通股或美国存托凭证的个人持有人,该持有人将每年就个人当年的投资资产净额(Rendementsgrondmark)按视为回报(2022年最高为5.53%)缴税,只要该个人当年的投资净资产超过法定门槛(Heffingvrij Vermogen)。个人当年净投资资产的视为回报按30%的税率征税。普通股或美国存托凭证的实际收入、收益或亏损无需缴纳荷兰所得税。
当年的投资资产净额为投资资产的公允市值减去有关历年1月1日的允许负债。普通股或美国存托凭证被列为投资资产。于2022年1月1日的净投资资产,当作回报介乎1.82%至5.53%。被视为回报将根据历史市场收益率每年进行调整。
非荷兰居民
普通股或美国存托凭证的持有人既不是荷兰居民实体,也不是荷兰居民个人,则不必就普通股或美国存托凭证下的任何付款或出售普通股或美国存托凭证而变现的任何收益或亏损缴纳荷兰税,条件是:
i.对于全部或部分在荷兰有效管理或通过荷兰常设机构、被视为常设机构或常驻荷兰代表经营的企业或被视为企业(如2001年《荷兰所得税法》和1969年《荷兰企业所得税法》所界定的),以及普通股或美国存托凭证归属于哪个企业或企业的部分,该持有人在该企业或被视为企业中没有权益;以及
二、如果持有人为个人,则该持有人不会在荷兰从事任何超越普通资产管理的普通股或美国存托凭证活动,亦不会从普通股或美国存托凭证中获得利益,而普通股或美国存托凭证在荷兰的其他活动的利益应课税。
赠与税和遗产税
荷兰居民
荷兰将对普通股或美国存托凭证的持有人以赠与方式转让普通股或美国存托凭证征收赠与税或遗产税,或该普通股或美国存托凭证持有人死亡时,该普通股或美国存托凭证持有人是荷兰居民或被视为荷兰居民。
非荷兰居民
非荷兰居民或被视为荷兰居民的普通股或美国存托凭证持有人以赠与方式转让普通股或美国存托凭证,或普通股或美国存托凭证持有人去世时,荷兰将不征收赠与税或遗产税,除非:
i.如果赠予普通股或美国存托凭证的个人在赠与之日既不是荷兰居民,也不是荷兰居民,则该个人在赠与之日后180天内死亡,而当时他是荷兰居民或被认为是荷兰居民;或
二、在其他情况下,转让被解释为赠与或继承,由赠与或死亡时是或被视为荷兰居民的人或代表赠与或继承。
就荷兰赠与税和遗产税等而言,如果拥有荷兰国籍的人在赠与之日或该人死亡之日之前十年内的任何时候一直居住在荷兰,则该人将被视为荷兰居民。此外,就荷兰赠与税等而言,如果非荷兰国籍的人在赠与之日之前12个月内的任何时间一直居住在荷兰,则该人将被视为荷兰居民。适用的税收条约可以凌驾于被视为居留的地位。
增值税(VAT)
普通股或美国存托凭证持有人将不会就普通股或美国存托凭证所有权或处置的任何代价支付荷兰增值税。
其他税项和关税
普通股或美国存托凭证持有人将不会就普通股或美国存托凭证的所有权或处置的任何代价支付任何荷兰登记税、印花税或任何其他类似文件税或税项。
F.股息和支付代理人
不适用。
G.专家的发言
不适用。
H.展出的文件
我们必须遵守《交易法》的信息要求。因此,我们必须向美国证券交易委员会提交报告和其他信息,包括Form 20-F年度报告和Form 6-K报告。美国证券交易委员会维护着一个互联网网站,其中包含有关发行人的报告和其他信息,这些发行人和我们一样,以电子方式在美国证券交易委员会备案。该网站网址为http://www.sec.gov
我们还在以电子方式提交给美国证券交易委员会或以电子方式提交给美国证券交易委员会的文件之后,在合理可行的范围内尽快在我们的网站上免费提供我们的年报和Form 6-K报告的文本,包括对这些报告的任何修订,以及某些其他美国证券交易委员会文件。我们的网站地址是www.pharming.com。本公司网站所载资料并未以参考方式纳入本年报,而本公司的网站地址仅作为非活跃的文本参考纳入本年报。
本年度报告中提及的20-F表格中有关本公司的文件可在正常营业时间内通过预约方式在我们的登记和记录办公室查阅,地址为新泽西州沃伦401室独立大道10号,邮编:07059。
I.子公司信息
不适用。
项目11.关于市场风险的定量和定性披露
关于市场风险的定量和定性披露
我们的业务使我们面临一些因使用金融工具而产生的金融风险,其中最重要的是流动性、市场风险和信用风险。董事会负责我们的风险管理政策,在保留对这些政策的责任的同时,它已将确保有效执行目标和政策的设计和操作程序的权力下放给我们的财务职能。请参阅年度财务报表附注27。
第12项.除股权证券外的证券说明
A.债务证券。
不适用。
B.权证和权利。
不适用。
C.其他证券
不适用。
D.美国存托股份
不适用。
项目13.拖欠股息和拖欠股息
不适用。
项目14.对担保持有人权利的实质性修改和收益的使用
不适用。
项目15.控制和程序
A.披露控制和程序
根据交易所法案第13a-15条的要求,管理层,包括我们的首席执行官(“CEO”)和我们的首席财务官(“CFO”),已经评估了截至本年度报告所涵盖期间结束时我们的披露控制和程序的有效性。披露控制和程序是指旨在确保我们根据交易法提交或提交的报告中要求披露的信息在美国证券交易委员会规则和表格中指定的时间段内被记录、处理、汇总和报告的控制和其他程序。
披露控制和程序包括但不限于控制和程序,旨在确保我们根据交易法提交或提交的报告中要求我们披露的信息被累积并传达给管理层,包括我们的主要高管和主要财务官,或酌情履行类似职能的人员,以便就我们需要的披露做出及时决定。
基于这样的评估,由于我们对财务报告的内部控制存在以下所述的重大弱点,我们的首席执行官和首席财务官得出结论,截至2021年12月31日,我们的披露控制程序和程序无效。
B.管理层财务报告内部控制年度报告
管理层,包括首席执行官和首席财务官,负责建立和维护对Pharming的财务报告和合并财务报表的编制进行充分的内部控制。他们评估了Pharming对财务报告的内部控制的有效性,以及根据特雷德韦委员会赞助组织委员会(“COSO”)发布的内部控制-综合框架(2013)编制综合财务报表的情况。
财务报告的内部控制
在编制截至2021年12月31日的年度综合财务报表时,我们发现了财务报告内部控制的重大弱点。重大缺陷是财务报告内部控制的缺陷或缺陷的组合,使得我们的年度或中期财务报表的重大错报有合理的可能性无法及时防止或发现。
正如之前发现并在前一年披露的那样,我们在实体层面上的COSO框架的五个组成部分中的每一个以及相应地在我们的业务和IT流程中仍然存在重大弱点。已确定的重大弱点如下:
•控制环境-我们没有保持有效的控制环境,没有有效的财务报告内部控制所需的结构。在此期间,我们没有进行足够的监督,没有吸引和保持适当的人才来设计和运作有效的内部控制。
•风险评估-我们的风险和内部控制框架正在制定中,因此,我们没有识别、实施和运行应对重大错报风险所需的控制措施。
•控制活动-对于已设计的控制活动,没有相关控制的详细控制说明,以便评估设计、确定实施和测试操作有效性。此外,在控制活动依赖于控制中使用的信息的情况下,公司没有执行控制以确定该信息的完整性和准确性。
•信息与沟通-我们对我们IT系统的控制不能有效地确保财务报告中使用的信息是及时、准确、完整、受保护和可核实的,我们也没有足够的流程和控制来在我们的财务报告过程中适当地披露这些信息。
•监测-由于风险评估和内部控制框架正在制定中,我们没有足够的控制措施来监测控制活动和发现控制缺陷。
补救计划
我们正在纠正已发现的重大弱点,包括进一步制定和实施与我们的财务报告有关的正式政策、流程、内部控制和文件。此外,在2021年期间,我们聘请了一名内部控制经理,并继续投资于财务等部门,以支持内部控制改进。
尽管作出了改进,并在这一年中实施了几项实体一级的控制措施,但这些控制措施还不足以充分处理COSO组成部分中的所有原则。
我们已经制定了内部控制计划,并一直在努力实现对财务报告进行有效控制的目标。该计划以分阶段办法为基础,2021年一直致力于启动内部控制框架、实施相关工具和编制内部控制手册。我们相信,这种结构化和分阶段的方法对于以可持续的方式建立对财务报告的有效内部控制至关重要,这也将使我们能够支持和适应公司的持续增长道路。
随着我们实施这些补救措施,并继续评估和努力改善我们对财务报告的内部控制,我们的管理层可能会确定可能需要采取额外的步骤或措施来解决和补救重大弱点。管理层还可以根据情况和公司需要,决定是否有必要修改上述补救措施。我们不能向您保证这些补救努力会成功,也不能保证其对财务报告的内部控制将始终有效地实现所有控制目标。管理层将结合对财务报告的内部控制的评价,继续评估这些补救努力的有效性。
C.注册会计师事务所的认证报告
本年度报告包括本公司注册会计师事务所关于本公司财务报告内部控制有效性的证明报告。
独立注册会计师事务所报告
致Pharming Group N.V.股东和董事会
财务报告内部控制之我见
我们根据特雷德韦委员会(COSO)赞助组织委员会发布的《内部控制-综合框架(2013)》中确立的标准,对截至2021年12月31日的Pharming Group N.V.及其子公司(“公司”)的财务报告进行了内部控制审计。我们认为,由于以下确定的实质性弱点对成就的影响
在控制标准的目标中,根据COSO发布的《内部控制-综合框架(2013)》中确立的标准,截至2021年12月31日,公司尚未对财务报告保持有效的内部控制。
我们还按照美国上市公司会计监督委员会(PCAOB)的标准审计了公司截至2021年12月31日及截至2021年12月31日年度的综合财务报表以及我们2022年4月6日的报告,对这些财务报表表达了无保留意见,并包括一段关于公司列报货币变化的说明性段落。
意见基础
本公司管理层负责维持有效的财务报告内部控制,并负责评估财务报告内部控制的有效性,包括在随附的管理层财务报告内部控制年度报告中。我们的责任是根据我们的审计,对公司财务报告的内部控制发表意见。我们是一家在PCAOB注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们是按照PCAOB的标准进行审计的。这些标准要求我们计划和执行审计,以获得合理的保证,以确定财务报告的有效内部控制是否在所有重要方面都得到了维护。我们的审计包括了解财务报告的内部控制,评估存在重大弱点的风险,根据评估的风险测试和评估内部控制的设计和运作有效性,以及执行我们认为在情况下必要的其他程序。我们相信,我们的审计为我们的观点提供了合理的基础。
财务报告内部控制的定义及局限性
公司对财务报告的内部控制是一个程序,旨在根据公认的会计原则,为财务报告的可靠性和为外部目的编制财务报表提供合理保证。公司对财务报告的内部控制包括下列政策和程序:(1)关于保存合理详细、准确和公平地反映公司资产的交易和处置的记录;(2)提供合理的保证,即交易被记录为必要的,以便按照公认的会计原则编制财务报表,公司的收入和支出仅根据公司管理层和董事的授权进行;(三)提供合理保证,防止或及时发现可能对财务报表产生重大影响的未经授权收购、使用或处置公司资产。
由于其固有的局限性,财务报告的内部控制可能无法防止或发现错误陈述。此外,对未来期间进行任何有效性评估的预测都有可能因条件的变化而出现控制不足的风险,或者政策或程序的遵守程度可能会恶化。
物质弱点
重大缺陷是指财务报告的内部控制存在缺陷或缺陷的组合,使得本公司年度或中期财务报表的重大错报有合理的可能性无法及时防止或发现。
根据管理层的评估,COSO框架的五个组成部分中的每一个都在实体层面以及我们的业务和IT流程中发现了以下重大弱点:
•控制环境-公司没有维护有效的控制环境,没有有效的财务报告内部控制所需的结构。本公司在此期间没有行使足够的监督,以及吸引和保持适当的人才来设计和运作有效的内部控制。
•风险评估-本公司正在制定其风险和内部控制框架,因此,本公司没有识别、实施和运行应对重大错报风险所需的控制措施。
•控制活动-对于已设计的控制活动,没有相关控制的详细控制说明,以便评估设计、确定实施和测试操作有效性。此外,在控制活动依赖于控制中使用的信息的情况下,公司没有执行控制以确定该信息的完整性和准确性。
•I信息与沟通-公司对IT系统的控制不能有效地确保财务报告中使用的信息是及时、准确、完整、受保护和可核实的,并且公司没有足够的流程和控制来在财务报告过程中适当地披露此类信息。
•监控-由于风险评估和内部控制框架正在制定中,公司没有足够的控制措施来监控控制活动和识别控制缺陷。
在决定对本公司截至2021年12月31日及截至2021年12月31日止年度的综合财务报表进行审计时所应用的审计测试的性质、时间及范围时,已考虑这些重大弱点,本报告不影响我们对该等财务报表的报告。
/s/德勤会计师事务所
荷兰阿姆斯特丹
April 6, 2022
D.改变对财务报告的控制
除上文第15.A项所述外,于本年报所涵盖期间,吾等对财务报告的内部控制(定义见外汇法案第13a-15(F)条)并无重大影响或合理地可能对财务报告的内部控制产生重大影响的改变。
第16项保留。
项目16 A.审计委员会财务专家
本公司董事会已认定审计委员会主席Leonard Krumer先生为美国证券交易委员会规则所界定的“审计委员会财务专家”,并具备纳斯达克证券市场适用规则及条例所规定的必要财务经验。克鲁默先生是独立的,因为该词是根据交易所法案下的规则10A-3及纳斯达克证券市场的上市标准界定的。
项目16.道德守则
我们通过了《商业行为和道德准则》,或称《行为准则》,其中概述了我们开展业务所遵循的合法和道德的商业行为原则。行为准则适用于我们的所有执行委员会成员、董事会成员以及我们的附属公司和员工。《行为准则》全文可在我们的网站上查阅,网址为https://www.pharming.com.《行为准则》在2021年没有改变。一项审查已定于2022年进行。
我们网站上的信息和其他内容不是本年度报告的一部分,我们的网站地址仅作为非活跃的文本参考包括在本年度报告中。对本公司执行委员会或董事会成员行为准则条款的任何修改或豁免,只有在本公司执行委员会批准后才能做出,并将在修改或豁免之日后立即在我们的网站上披露。
项目16 C.首席会计师的费用和服务
德勤会计师事务所在2021年和2020年担任我们的独立注册会计师事务所。在这两个会计年度,我们的会计师向我们收取了以下专业服务费用:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 审计费 | (1,201) | | | (1,226) | |
| 审计相关费用 | (16) | | | (678) | |
| 税费 | — | | | — |
| 其他费用 | — | | — |
| 总计 | (1,217) | | | (1,904) | |
“审计费”包括年度审计综合财务报表所收取的费用。审计费用还包括只有我们的独立外部审计师才能合理提供的服务,例如审查提交给美国证券交易委员会的文件。在截至2021年12月31日和2020年12月31日的财年,德勤会计师事务所为审计服务收取的总费用分别为120万美元和120万美元。
“审计相关费用”包括与审核或审核其财务报表的表现合理相关或传统上由外聘核数师执行的担保及相关服务所收取的费用,主要包括与证券发行、尽职调查及商定或扩展的审核程序有关的安慰函等服务。在截至2020年12月31日的财年,德勤会计师事务所为审计相关服务收取的总费用为70万美元,与2020年12月的首次公开募股相关。2021年,与我们的S8申请有关的总金额为16,000美元。
“税费”包括税务咨询,例如与以股份为基础的薪酬所产生的雇员税务有关的咨询。在截至2021年12月31日和2020年12月31日的财政年度,德勤会计师事务所为税务合规和税务规划收取的总费用分别为零美元和零美元。
“其他费用”包括采用或适用国际财务报告准则等咨询服务。截至2021年12月31日及2020年12月31日止财政年度,除上述服务外,德勤会计师事务所就其他非审计专业服务收取的总费用分别为零美元及零美元。
审批前的政策和程序
审计委员会评估独立核数师的资格、独立性和业绩,并预先批准和审查独立核数师将提供的审计和非审计服务。
审计委员会审查和讨论了外聘审计师的2021年审计计划,包括建议的费用和管理信函,特别是核实了内部风险控制和外部审计程序在管理整个公司风险方面的有效性。审计委员会在2021年8月4日举行的会议上批准了2021年审计计划。该计划和管理层信函也与董事会全体成员分享和讨论。
根据公司网站(www.pharming.com/aboutus/corporategovernance),上公布的审计委员会章程,审计委员会监督荷兰和美国关于独立注册会计师事务所提供非审计服务的规则的遵守情况。因此,审计委员会应在适用法律允许的范围内,在适用法律允许的范围内,预先批准外聘核数师向本公司提供的所有审计服务以及所有其他服务(审查、证明和非审计),但最低限度的非审计服务可能会根据适用的美国证券交易委员会规则获得批准。审计委员会在2021年不必批准德勤的非审计服务。
2021年10月,审计委员会对本公司“关联人政策”所指的关联人交易进行了年度审查。审计委员会根据收集到的资料得出结论:(1)该政策范围内的每一笔交易都是在#年的正常过程中进行的
业务;及(Ii)没有相关相关人士的参与。因此,审计委员会根据现行政策批准了这些交易。
根据审计委员会章程,审计委员会评估是否有必要设立内部审计员职能。这种功能在今天的Pharming中是不存在的。在2021年3月3日的评估中,审计委员会得出结论,并建议董事会也得出结论,由于公司的规模,目前不需要内部审计师。审计委员会除其他外,审议了财务主任、质量保证部和外聘审计员在评估和测试风险管理和控制系统方面的任务和责任。
审计委员会于2021年8月批准了外聘审计师的审计业绩,为制药公司向美国证券交易委员会提交S-8表格做准备,以根据公司的股票期权和股票计划向员工发行股票期权和限制性股票。
审计委员会评估了德勤会计师事务所(德勤)在2020财政年度作为外聘审计师的工作表现。审计委员会当时得出结论,建议董事会在股东大会上批准德勤作为2021和2022财政年度外聘审计师的提名。董事会根据审计委员会的建议,于2021年5月19日召开的股东周年大会上委任并指示德勤审议2021年及2022年财政年度报告,向审计委员会及董事会作出报告,并发表核数师报告。
项目16 D.审计委员会对上市标准的豁免
不适用。
项目16 E.发行人和关联购买人购买股权证券
不适用。
第16项F.变更注册人的认证会计师
不适用。
项目16 G.公司治理
外国私人发行人豁免
我们是美国证券交易委员会所定义的“外国私人发行人”。因此,根据纳斯达克规则,我们将遵守母国治理要求和相应的某些豁免,而不是遵守纳斯达克公司治理标准。虽然我们预计将自愿遵守大多数纳斯达克公司治理规则,但我们已经选择或可能决定选择利用以下有限的豁免:
•在发生特定重大事件时,豁免提交载有未经审计的财务和其他指定资料的表格10-Q的季度报告或表格8-K的当前报告;
•不受《交易法》第16条的约束,该条款要求内部人士提交其证券所有权和交易活动的公开报告,并规定短期内从交易中获利的内部人士的责任;
•豁免遵守适用于国内发行人的纳斯达克规则,该规则要求在4个工作日内披露对豁免董事和高管行为准则和道德规范的任何决定;
•免除某些证券发行必须获得股东批准的要求,包括股东批准股票期权计划;
•豁免我们的审计委员会对所有“关联方交易”负有审查和监督责任的要求,如表格20-F第7.B项所定义;
•豁免我们的董事会有一个薪酬委员会的要求,该委员会完全由独立董事组成,并有书面章程说明该委员会的目的和职责;以及
•不受以下要求的限制:(1)董事独立董事董事会中占多数的独立董事以只有独立董事参与的投票方式选出或推荐董事的被提名人,或(2)仅由独立董事组成的委员会,并通过正式的书面章程或董事会决议(视情况而定)解决提名过程。
此外,纳斯达克第5615(A)(3)条规定,像我们这样的外国私人发行人可以依赖本国的公司治理做法,来替代纳斯达克第5600系列规则和第5250(D)条中的某些规则,前提是我们仍然遵守纳斯达克的“不合规通知”要求(第5625条)、投票权要求(第5640条),以及我们拥有一个满足第5605(C)(3)条的审计委员会,该委员会由符合第5605(C)(2)(A)(Ii)条的独立性要求的委员会成员组成。
我们打算遵守适用于外国私人发行人的纳斯达克公司治理规则,这意味着我们被允许遵循某些符合荷兰要求的公司治理规则,而不是纳斯达克的许多公司治理规则。因此,我们的股东将不会得到与受纳斯达克所有公司治理要求约束的公司股东相同的保护。只要我们继续具备外国私人发行人的资格,我们就可以利用这些豁免。
有关荷兰上市公司(如Pharming)的公司治理原则与适用于特拉华州公司的公司治理原则之间的一些具体差异的概述,请参阅“股份资本”和“公司章程”一节。这些部分还概述了Pharming根据荷兰法律和《荷兰公司治理守则》实施公司治理原则的情况。最后,请参考“组织结构”和“董事和高级管理人员”部分,以了解有关Pharming的集团结构和公司治理结构的更多细节。所有参考章节均以引用方式并入本节。
项目16 H.披露矿山安全情况
不适用。
项目16.关于妨碍检查的外国司法管辖区的披露
不适用。
项目17财务报表
见第18项。
项目18财务报表
见本年度报告的F-1至F-59页。
项目19展示
展品索引
| | | | | |
展品编号 | 展品说明 |
1.1 | 修订及重订的自2020年12月11日起生效的Pharming Group N.V.公司章程(参考公司于2020年12月17日向美国证券交易委员会提交的F-1表格注册说明书附件3.1(文件编号333-250984)而并入)。# |
1.2 | Pharming Group N.V.的董事会规则(引用公司于2020年11月25日提交给美国证券交易委员会的F-1表格注册说明书(第333-250984号文件)附件3.2)。# |
2.1 | 证券说明 |
2.2 | 存款协议表格(引用本公司于2020年12月17日提交给美国证券交易委员会的F-1表格登记说明书(第333-250984号文件)附件4.1)。# |
2.3 | 美国存托凭证表格(通过引用公司于2020年12月17日提交给美国证券交易委员会的F-1表格注册说明书(第333-250984号文件)附件4.2并入)。 |
4.1 | 修订后的员工股票期权计划(参考公司于2020年12月17日提交给美国证券交易委员会的F-1表格注册说明书(第333-250984号文件)附件10.1)。 |
4.2 | 经修订和重述的修订员工股票期权计划(通过引用公司于2021年10月28日提交给美国证券交易委员会的S-8表格注册说明书(第333-260557号文件)附件99.1并入)。 |
4.3 | 经修订和重述的长期激励计划(通过引用公司于2021年10月28日提交给美国证券交易委员会的S-8表格注册说明书(第333-260557号文件)附件99.2并入)。 |
4.4 | 注册人和诺华国际制药公司之间的许可协议,日期为2019年8月12日(通过引用公司于2020年11月25日提交给美国证券交易委员会的F-1表格注册声明(文件编号333-250984)附件10.5合并)。#†+ |
4.5 | 注册人与其董事和高级管理人员之间的赔偿协议表(通过参考公司于2020年11月25日提交给美国证券交易委员会的F-1表注册说明书(第333-250984号文件)附件10.8而并入)。# |
4.6 | 资产购买协议,日期为2016年8月9日,由萨利克斯制药公司、桑塔鲁斯公司、Valeant制药卢森堡公司、Valeant制药北美有限责任公司、注册人和Pharming America B.V.(通过引用公司于2020年12月17日提交给美国证券交易委员会的F-1表格注册声明(文件编号333-250984)的附件10.5合并而成)。#† |
4.7 | 与Orchard的研究合作和许可协议 |
8.1 | 注册人子公司清单(参考公司于2020年11月25日提交给美国证券交易委员会的F-1表格注册说明书(第333-250984号文件)附件21.1并入)。# |
12.1 | 首席执行干事根据2002年《萨班斯-奥克斯利法案》第302节通过的《证券交易法》第13a-14(A)和15d-14(A)条规定的证明。 |
12.2 | 首席财务官根据2002年《萨班斯-奥克斯利法案》第302节通过的《证券交易法》第13a-14(A)和15d-14(A)条规定的证明。 |
| 13.1 | 首席执行官根据《美国法典》第18编第1350条的规定,即根据2002年《萨班斯-奥克斯利法案》第906条通过的证明。 |
13.2 | 根据2002年《萨班斯-奥克斯利法案》第906节通过的《美国法典》第18编第1350节的首席财务官的证明。 |
本展览的†部分(用星号表示)已被省略,因为注册人已确定它们不是实质性的,如果公开披露可能会对注册人造成竞争损害。
+根据S-K规则第601(A)(5)项,某些附表已被省略。登记人特此承诺,应美国证券交易委员会的要求,将补充提供任何遗漏的展览或时间表的副本。
#之前提交的。
签名
注册人特此证明,它符合提交20-F表格的所有要求,并已正式安排并授权以下签署人代表其签署本年度报告。
Pharing Group N.V.
/S/西门德弗里斯,医学硕士
——————————————
作者:西门·德·弗里斯,医学硕士
头衔:首席执行官
日期:2022年4月6日
| | | | | | | | | | | | | | |
| 财务报表索引 |
| 财务科 |
| 截至2021年、2020年和2019年12月31日及截至该年度的经审计综合财务报表 |
| | | | | |
| 目录 |
独立注册会计师事务所报告(PCAOB ID号1243) | F- 2 |
综合损益表 | F- 5 |
综合全面收益表 | F- 5 |
合并资产负债表 | F- 7 |
综合权益变动表 | F- 8 |
合并现金流量表 | F- 10 |
合并财务报表附注 | F- 11 |
致Pharming Group N.V.股东和董事会
对财务报表的几点看法
我们审计了Pharming Group N.V.及其子公司(“贵公司”)截至2021年12月31日和2020年12月31日的综合资产负债表、截至2021年12月31日的三个年度的相关综合收益表、综合全面收益表、权益和现金流量变动表以及相关附注(统称为“财务报表”)。我们认为,该等财务报表在各重大方面均公平地反映了本公司截至2021年12月31日及2020年12月31日的财务状况,以及截至2021年12月31日止三个年度内各年度的营运结果及现金流量,符合国际会计准则委员会颁布的国际财务报告准则(“IFRS”)。
我们还按照美国上市公司会计监督委员会(PCAOB)的标准,根据特雷德韦委员会赞助组织委员会发布的《内部控制-综合框架(2013)》中确立的标准,对公司截至2021年12月31日的财务报告内部控制进行了审计,我们于2022年4月6日发布的报告对公司的财务报告内部控制提出了不利意见。
列报货币的变动
如附注2.4所披露,本公司选择于2021年1月1日将其列报货币由欧元改为美元。
意见基础
这些财务报表由公司董事会负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们是按照PCAOB的标准进行审计的。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是舞弊。我们的审计包括执行评估财务报表重大错报风险的程序,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查与财务报表中的数额和披露有关的证据。我们的审计还包括评估董事会使用的会计原则和作出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
关键审计事项
下文所述的关键审计事项是指在对财务报表进行当期审计时产生的、已传达或要求传达给审计委员会的事项,这些事项(1)涉及对财务报表具有重大意义的账目或披露,(2)涉及我们特别具有挑战性的、主观的或复杂的判断。关键审计事项的传达不会以任何方式改变我们对财务报表的整体意见,我们也不会通过传达下面的关键审计事项,就关键审计事项或与之相关的账目或披露提供单独的意见。
收入、贸易和其他应付款。美国的回扣应计项目--见财务报表附注2.4、2.5、4和21
关键审计事项说明
在截至2021年12月31日的一年中,该公司确认在美国的产品销售收入总计1.932亿美元,截至2021年12月31日,与政府和其他返点计划有关的应付款项为1130万美元。在美国的销售受到与客户直接相关的回扣,或政府或保险付款人的最终报销要求,这被称为毛净调整,主要是美国医疗补助(美国收入回扣)。这些都是在估计的基础上核算的。
与美国收入退税相关的负债涉及在其计算中使用重大假设和判断。这些重要的假设和判断包括历史索赔经验、未开单索赔和索赔提交时间滞后。鉴于这项估计的复杂性,加上编制这项估计所需的有限历史数据和判断,以及对已发现的财务报告缺陷的内部控制,审计这项估计既需要广泛的审计工作,因为估计的复杂性,也需要审计师在执行审计程序和评估该等程序的结果时高度做出判断,因此我们将美国对回扣应计项目的会计处理确定为关键审计事项。
如何在审计中处理关键审计事项
我们的审计程序与管理层在估计美国收入回扣负债时做出的假设和判断有关,包括以下内容:
•我们评估了该公司用于计算美国收入回扣应计项目的方法、数据和假设的适当性和一致性。
•我们测试了美国税收退税应计计算的数学准确性。
•我们测试了用于计算美国收入退税应计项目的重要假设和关键输入,即根据来源文件测试本财政年度收到的退税申请,并通过与历史索赔进行比较来评估董事会对回收瓶子的预测的合理性。
•我们通过比较美国收入回扣应计项目的实际金额和历史估计数,评估了该公司准确估计美国收入回扣项目的能力。
•我们创建了数据可视化,将记录的美国收入回扣与历史数据进行比较,并跟踪任何不寻常的趋势。
研发成本和通过其他全面收益按公允价值进行的投资--战略合作--果园治疗(欧洲)有限公司--见财务报表附注2.5、6和13
关键审计事项说明
Pharming and Orchard Treeutics(Europe)Ltd(“Orchard”)与2021年7月1日生效,达成战略合作,研究、开发、制造一种新披露的造血干细胞(HSC)基因疗法(“OTL-015”),并将其商业化。该合作为Pharming提供了OTL-015的全球许可。
作为协议的一部分,Pharming预付了1750万美元,其中包括1000万美元的现金和750万美元的股权投资。根据Orchard的股价及任何影响公平价值的相关因素,收购股权投资时股份的公允价值为4,600,000美元。本公司确认预付现金1,000万美元及股价溢价290万美元为截至2021年12月31日止年度的研发成本。在厘定此项交易的会计处理时,管理层须作出高度判断,因为其中包括评估合作协议是否构成业务合并、联合安排或产生无形资产、选择适当的估值技术及作出适当的估值假设。
鉴于会计处理的确定需要高度的管理层判断,评估其合理性需要高度的审计师判断和更多的努力,包括需要我们的技术会计专家参与,因此我们将这次战略合作的会计处理确定为关键审计事项。
如何在审计中处理关键审计事项
我们与评估管理层采用会计准则的合理性有关的审计程序包括以下内容:
a.我们评估了股权转让是否发生,Pharming有权获得Orchard的投资。
b.我们对与Orchard的协议的会计处理进行了评估(其中包括):
i.阅读董事会会议记录和与Orchard签署的协议,以收集管理层在决定会计处理时考虑的相关事实和情况。
二、与我们的技术会计专家一起,参照国际会计准则第38号(“无形资产”)、国际财务报告准则第3号(“企业合并”)、国际财务报告准则第9号(“金融工具”)和国际财务报告准则第11号(“联合安排”)的相关准则,评估管理层判断的合理性。
c.我们评估了截至2021年12月31日对Orchard的投资估值,其中包括:
i.考虑到果园的公开股份信息,对管理层计算中包含的投资初值进行检验。
二、与我们的公允价值专家一起评估(I)管理层采用的估值技术和(Ii)以下机构使用的主要估值假设的合理性:
1.评估管理层作出的会计估计,包括相关的判断和决定,以确定可能的管理层偏见指标。
2.对管理层在制定公允价值计量时使用的数据进行测试,以确定信息的准确性和完整性。
/s/ 德勤会计师事务所。
荷兰阿姆斯特丹, April 6, 2022
自2019年以来,我们一直担任本公司的审计师。
综合损益表
截至12月31日止年度,
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | | 注 | | 2021 | | 重述2020年(*) | | 重述2019年(*) |
| 收入 | | 4 | | 198,871 | | | 212,174 | | | 189,389 | |
| 销售成本 | | 6 | | (21,142) | | | (23,539) | | | (23,928) | |
| 毛利 | | | | 177,729 | | | 188,635 | | | 165,461 | |
| 其他收入 | | 5 | | 2,620 | | | 1,829 | | | 487 | |
| 研发 | | | | (70,369) | | | (38,519) | | | (31,786) | |
| 一般和行政 | | | | (36,974) | | | (24,085) | | | (21,192) | |
| 市场营销和销售 | | | | (59,445) | | | (51,604) | | | (44,724) | |
| 其他运营成本 | | 6 | | (166,788) | | | (114,208) | | | (97,702) | |
| 营业利润 | | | | 13,561 | | | 76,256 | | | 68,246 | |
| 重估衍生工具的公允价值损益 | | | | 114 | | | 69 | | | (234) | |
| 其他财务收入 | | 7 | | 14,894 | | | 715 | | | 1,133 | |
| 其他财务费用 | | 7 | | (6,185) | | | (33,308) | | | (17,098) | |
| 财务成本,净额 | | | | 8,823 | | | (32,524) | | | (16,199) | |
| 使用权益法在联营公司中的净利润份额 | | 12 | | 694 | | | 362 | | | 257 | |
| 税前利润 | | | | 23,078 | | | 44,094 | | | 52,304 | |
| 所得税费用 | | 8 | | (7,082) | | | (6,348) | | | (11,747) | |
| 本年度利润 | | | | 15,996 | | | 37,746 | | | 40,557 | |
| 基本每股收益(美元) | | 28 | | 0.025 | | 0.058 | | 0.065 |
| 稀释后每股收益(美元) | | 28 | | 0.023 | | 0.055 | | 0.060 |
这些附注是这些财务报表不可分割的一部分。
(*) 本公司已于2021年1月1日将其列报货币由欧元改为美元,如附注2.4所述。因此,2020年12月31日及2019年12月31日的比较综合收益表及相关附注已根据附注2.4所概述的会计政策重新追溯呈列。
综合全面收益表
截至12月31日止年度,
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | | 注 | | 2021 | | 重述2020年(*) | | 重述2019年(*) |
| 本年度利润 | | | | 15,996 | | | 37,746 | | | 40,557 | |
| 货币折算差异 | | | | (14,802) | | | 14,956 | | | 5,141 | |
| 公允价值重计量投资 | | | | (2,283) | | | — | | | — | |
| 可随后重新分类为损益的项目 | | | | (17,085) | | | 14,956 | | | 5,141 | |
| 其他综合收益(亏损),税后净额 | | | | (17,085) | | | 14,956 | | | 5,141 | |
| 本年度综合收益(亏损)总额 | | | | (1,089) | | | 52,702 | | | 45,698 | |
这些附注是这些财务报表不可分割的一部分。
(*) 本公司已于2021年1月1日将其列报货币由欧元改为美元,如附注2.4所述。因此,2020年12月31日及2019年12月31日其他全面收益表及相关附注的比较综合报表已根据附注2.4所概述的会计政策重新追溯呈列。
合并资产负债表
截至12月31日止年度,
| | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | | 注 | | 2021 | | 重述2020年(*) | | 重述2020年1月1日(*) | | |
| 非流动资产 | | | | | | | | | | |
| 无形资产 | | 9 | | 83,834 | | | 94,083 | | | 79,403 | | | |
| 财产、厂房和设备 | | 10 | | 13,222 | | | 12,226 | | | 9,591 | | | |
| 使用权资产 | | 11 | | 19,943 | | | 9,427 | | | 6,704 | | | |
| 长期提前还款 | | | | 194 | | | — | | | — | | | |
| 递延税项资产 | | 9 | | 21,216 | | | 31,877 | | | 32,061 | | | |
| 使用权益法核算投资 | | 12 | | 7,201 | | | 7,118 | | | 6,177 | | | |
| 对FVTOCI指定的股权工具的投资 | | 13 | | 1,449 | | | — | | | — | | | |
| 受限现金 | | 14 | | 812 | | | 510 | | | 2,543 | | | |
| 非流动资产总额 | | | | 147,871 | | | 155,241 | | | 136,479 | | | |
| 流动资产 | | | | | | | | | | |
| 盘存 | | 15 | | 27,310 | | | 21,157 | | | 16,223 | | | |
| 贸易和其他应收款 | | 16 | | 29,983 | | | 35,901 | | | 28,864 | | | |
| 受限现金 | | 14 | | 227 | | | 995 | | | — | | | |
| 现金和现金等价物 | | 14 | | 191,924 | | | 205,159 | | | 74,348 | | | |
| 流动资产总额 | | | | 249,444 | | | 263,212 | | | 119,435 | | | |
| 总资产 | | | | 397,315 | | | 418,453 | | | 255,915 | | | |
| | | | | | | | | | |
| 权益 | | | | | | | | | | |
| 股本 | | | | 7,429 | | | 7,312 | | | 7,226 | | | |
| 股票溢价 | | | | 455,254 | | | 447,130 | | | 441,951 | | | |
| 法定准备金 | | | | 3,400 | | | 24,614 | | | 8,926 | | | |
| 累计赤字 | | | | (273,167) | | | (295,621) | | | (340,715) | | | |
| 股东权益 | | 29 | | 192,916 | | | 183,435 | | | 117,388 | | | |
| 非流动负债 | | | | | | | | | | |
| 可转换债券 | | 17 | | 139,007 | | | 149,727 | | | — | | | |
| 租赁负债 | | 19 | | 18,456 | | | 8,230 | | | 4,893 | | | |
| 其他财务负债 | | 25 | | 165 | | | 212 | | | 19,380 | | | |
| 非流动负债总额 | | | | 157,628 | | | 158,169 | | | 24,273 | | | |
| 流动负债 | | | | | | | | | | |
| 可转换债券 | | 17 | | 1,879 | | | 2,040 | | | — | | | |
| 贷款和借款 | | 18 | | — | | | — | | | 51,125 | | | |
| 衍生金融负债 | | | | — | | | 181 | | | 301 | | | |
| 贸易和其他应付款 | | 20 | | 42,473 | | | 47,666 | | | 40,646 | | | |
| 租赁负债 | | 19 | | 2,419 | | | 1,962 | | | 2,182 | | | |
| 其他财务负债 | | 25 | | — | | | 25,000 | | | 20,000 | | | |
| 流动负债总额 | | | | 46,771 | | | 76,849 | | | 114,254 | | | |
| 权益和负债总额 | | | | 397,315 | | | 418,453 | | | 255,915 | | | |
| | | | | | | | | | |
这些附注是这些财务报表不可分割的一部分。(*) 本公司已于2021年1月1日将其列报货币由欧元改为美元,如附注2.4所述。因此,2020年12月31日及2019年12月31日的比较综合资产负债表及相关附注已根据附注2.4概述的会计政策重新追溯呈列。
综合权益变动表
截至12月31日止年度,
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | | 股份数量
(in '000) | | 股本 | | 股票溢价 | | 法定准备金公允价值重估 |
| 2019年1月1日的余额--重述(*) | | 621,501 | | | 7,116 | | | 436,639 | | | — | |
| 本年度利润 | | — | | | — | | | — | | | — | |
| 本年度其他综合收益(亏损) | | — | | | — | | | — | | | — | |
| 本年度综合收益(亏损)总额 | | — | | | — | | | — | | | — | |
| 法定准备金 | | — | | | — | | | — | | | — | |
| 基于股份的薪酬 | | — | | | — | | | — | | | — | |
| 以股票形式结算的奖金 | | 6 | | | | | 7 | | | — | |
| 可转换债券的价值转换权 | | 1,662 | | | 19 | | | 255 | | | — | |
| 已行使/已发行的认股权证 | | 240 | | | 2 | | | 262 | | | — | |
| 已行使期权/已发行LTIP股份 | | 7,914 | | | 89 | | | 4,788 | | | — | |
| 直接在权益中确认的与所有者的交易总额 | | 9,822 | | | 110 | | | 5,312 | | | — | |
| 2020年1月1日的余额--重述(*) | | 631,323 | | | 7,226 | | | 441,951 | | | — | |
| 本年度利润 | | — | | | — | | | — | | | — | |
| 本年度其他综合收益(亏损) | | — | | | — | | | — | | | — | |
| 本年度综合收益(亏损)总额 | | — | | | — | | | — | | | — | |
| 法定准备金 | | — | | | — | | | — | | | — | |
| 与股票支付相关的超额减税带来的所得税好处 | | — | | | — | | | — | | | — | |
| 基于股份的薪酬 | | — | | | — | | | — | | | — | |
| 以股票形式结算的奖金 | | 34 | | | — | | | 51 | | | — | |
| 可转换债券的价值转换权 | | — | | | — | | | — | | | — | |
| 已行使/已发行的认股权证 | | 60 | | | 1 | | | 89 | | | — | |
| 已行使期权/已发行LTIP股份 | | 7,404 | | | 85 | | | 5,039 | | | — | |
| 直接在权益中确认的与所有者的交易总额 | | 7,498 | | | 86 | | | 5,179 | | | — | |
| 2020年12月31日的余额--重述(*) | | 638,821 | | | 7,312 | | | 447,130 | | | — | |
| 本年度利润 | | — | | | — | | | — | | | — | |
| 本年度其他综合收益(亏损) | | — | | | — | | | — | | | (2,283) | |
| 本年度综合收益(亏损)总额 | | — | | | — | | | — | | | (2,283) | |
| 法定准备金 | | — | | | — | | | — | | | — | |
| 与股票支付相关的超额减税带来的所得税好处 | | — | | | — | | | — | | | — | |
| 基于股份的薪酬 | | — | | | — | | | — | | | — | |
| 以股票形式结算的奖金 | | — | | | — | | | — | | | — | |
| 可转换债券的价值转换权 | | — | | | — | | | — | | | — | |
| 已行使认股权证 | | 61 | | | 1 | | | 80 | | | — | |
| 已行使期权/已发行LTIP股份 | | 9,867 | | | 116 | | | 8,044 | | | — | |
| 直接在权益中确认的与所有者的交易总额 | | 9,928 | | | 117 | | | 8,124 | | | — | |
| 2021年12月31日的余额 | | 648,749 | | | 7,429 | | | 455,254 | | | (2,283) | |
这些附注是这些财务报表不可分割的一部分。(*) 本公司已于2021年1月1日将其列报货币由欧元改为美元,如附注2.4所述。因此,2020年12月31日及2019年12月31日的比较综合权益变动表及相关附注已根据附注2.4概述的会计政策重新追溯呈列。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | | | | 法定准备金 | | | | | | | |
| 金额,以美元为单位‘000 | | | | 准备金参股利息 | | | 资本化开发成本 | | | 翻译储备 | | | 累计赤字 | | | 总股本 | |
| 2019年1月1日的余额--重述(*) | | | | — | | | | 2,481 | | | | (1,060) | | | | (381,075) | | | | 64,101 | | |
| 本年度业绩 | | | | | | | | | | | | | 40,557 | | | | 40,557 | | |
| 本年度其他综合收益(亏损) | | | | | | | | | | 5,141 | | | | — | | | | 5,141 | | |
| 本年度综合收益(亏损)总额 | | | | | | | | | | 5,141 | | | | 40,557 | | | | 45,698 | | |
| 法定准备金开发费用 | | | | | | | 2,364 | | | | | | | (2,364) | | | | — | | |
| 基于股份的薪酬 | | | | | | | | | | | | | 4,286 | | | | 4,286 | | |
| 以股票形式结算的奖金 | | | | | | | | | | | | | — | | | | 7 | | |
| 可转换债券的价值转换权 | | | | | | | | | | | | | (275) | | | | — | | |
| 已行使/已发行的认股权证 | | | | | | | | | | | | | — | | | | 264 | | |
| 行使的期权 | | | | | | | | | | | | | (1,845) | | | | 3,031 | | |
| 直接在权益中确认的与所有者的交易总额 | | | | | | | 2,364 | | | | — | | | | (198) | | | | 7,588 | | |
| 2020年1月1日的余额--重述(*) | | | | — | | | | 4,845 | | | | 4,081 | | | | (340,715) | | | | 117,388 | | |
| 本年度利润 | | | | — | | | | — | | | | | | | 37,746 | | | | 37,746 | | |
| 本年度其他综合收益(亏损) | | | | — | | | | | | | 14,956 | | | | — | | | | 14,956 | | |
| 本年度综合收益(亏损)总额 | | | | — | | | | — | | | | 14,956 | | | | 37,746 | | | | 52,702 | | |
| 法定准备金 | | | | 622 | | | | 110 | | | | — | | | | (732) | | | | — | | |
| 与股票支付相关的超额减税带来的所得税好处 | | | | — | | | | — | | | | — | | | | 2,361 | | | | 2,361 | | |
| 基于股份的薪酬 | | | | — | | | | — | | | | — | | | | 6,537 | | | | 6,537 | | |
| 以股票形式结算的奖金 | | | | — | | | | — | | | | — | | | | — | | | | 51 | | |
| 可转换债券的价值转换权 | | | | — | | | | — | | | | — | | | | 1,605 | | | | 1,605 | | |
| 已行使/已发行的认股权证 | | | | — | | | | — | | | | — | | | | — | | | | 90 | | |
| 已行使期权/已发行LTIP股份 | | | | — | | | | — | | | | — | | | | (2,423) | | | | 2,701 | | |
| 直接在权益中确认的与所有者的交易总额 | | | | 622 | | | | 110 | | | | — | | | | 7,348 | | | | 13,345 | | |
| 2020年12月31日的余额--重述(*) | | | | 622 | | | | 4,955 | | | | 19,037 | | | | (295,621) | | | | 183,435 | | |
| 本年度利润 | | | | — | | | | — | | | | — | | | | 15,996 | | | | 15,996 | | |
| 本年度其他综合收益(亏损) | | | | — | | | | 270 | | | | (15,072) | | | | — | | | | (17,085) | | |
| 本年度综合收益(亏损)总额 | | | | — | | | | 270 | | | | (15,072) | | | | 15,996 | | | | (1,089) | | |
| 法定准备金 | | | | 694 | | | | (4,823) | | | | — | | | | 4,129 | | | | — | | |
| 与股票支付相关的超额减税带来的所得税好处 | | | | — | | | | — | | | | — | | | | (1,853) | | | | (1,853) | | |
| 基于股份的薪酬 | | | | — | | | | — | | | | — | | | | 9,056 | | | | 9,056 | | |
| 以股票形式结算的奖金 | | | | — | | | | — | | | | — | | | | — | | | | — | | |
| 可转换债券的价值转换权 | | | | — | | | | — | | | | — | | | | — | | | | — | | |
| 已行使认股权证 | | | | — | | | | — | | | | — | | | | — | | | | 81 | | |
| 已行使期权/已发行LTIP股份 | | | | — | | | | — | | | | — | | | | (4,874) | | | | 3,286 | | |
| 直接在权益中确认的与所有者的交易总额 | | | | 694 | | | | (4,823) | | | | — | | | | 6,458 | | | | 10,570 | | |
| 2021年12月31日的余额 | | | | 1,316 | | | | 402 | | | | 3,965 | | | | (273,167) | | | | 192,916 | | |
这些附注是这些财务报表不可分割的一部分。
(*) 本公司已于2021年1月1日将其列报货币由欧元改为美元,如附注2.4所述。因此,2020年12月31日及2019年12月31日的比较综合权益变动表及相关附注已根据附注2.4概述的会计政策重新追溯呈列。
合并现金流量表
截至12月31日止年度,
| | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 注 | | 2021 | | 重述2020年(*) | | 重述2019年(*) |
| 税前利润 | | | 23,078 | | | 44,094 | | | 52,304 | |
| 非现金调整: | | | | | | | |
| 折旧、摊销、减值 | 6,9,10,11 | | 19,610 | | | 8,314 | | | 5,801 | |
| 基于股权结算的股份支付方式 | 21 | | 9,056 | | | 6,537 | | | 4,286 | |
| 衍生工具重估的公允价值损益 | | | (114) | | | (69) | | | 234 | |
| 其他财务收入 | 7 | | (14,906) | | | (713) | | | (1,133) | |
| 其他财务费用 | 7 | | 6,196 | | | 33,308 | | | 17,098 | |
| 使用权益法在联营公司中的净利润份额 | 12 | | (694) | | | (362) | | | (257) | |
| 其他 | | | 524 | | | (1,624) | | | (44) | |
| 营运资本变动前的营运现金流 | | | 42,750 | | | 89,485 | | | 78,289 | |
| | | | | | | |
| 营运资金变动: | | | | | | | |
| 盘存 | 15 | | (6,153) | | | (4,934) | | | 4,243 | |
| 贸易和其他应收款 | 16 | | 5,918 | | | (7,040) | | | (7,805) | |
| 应付款和其他流动负债 | 20 | | (5,193) | | | 7,019 | | | 6,855 | |
| 受限现金 | 14 | | 467 | | | 1,039 | | | (1,120) | |
| 解除合同责任 | | | — | | | — | | | (1,734) | |
| 营运资金变动总额 | | | (4,961) | | | (3,916) | | | 439 | |
| | | | | | | |
| 收到的利息 | 7 | | 53 | | | 715 | | | 1,133 | |
| 已缴纳的所得税 | 8 | | — | | | (2,658) | | | (5,712) | |
| | | | | | | |
| 经营活动产生的现金流量净额 | | | 37,842 | | | 83,626 | | | 74,149 | |
| 房地产、厂房和设备的资本支出 | 10 | | (10,739) | | | (4,657) | | | (2,647) | |
| 投资无形资产 | 9 | | (3,447) | | | (9,060) | | | (1,849) | |
| 投资助理 | 12 | | — | | | (329) | | | (2,805) | |
| 对FVTOCI指定的股权工具的投资 | 13 | | (4,589) | | | — | | | — | |
| 取得牌照 | 9 | | (2,530) | | | (1,583) | | | (20,956) | |
| 用于投资活动的现金流量净额 | | | (21,305) | | | (15,629) | | | (28,256) | |
| 偿还贷款和借款 | 18 | | — | | | (57,231) | | | (35,190) | |
| 按或有对价支付 | 25 | | (25,000) | | | (20,722) | | | (19,759) | |
| 支付租赁债务 | | | (3,217) | | | (2,186) | | | (2,204) | |
| 发行可转换债券所得款项 | 17 | | — | | | 142,825 | | | — | |
| 与发行的可转换债券相关的交易成本 | 17 | | — | | | (2,649) | | | — | |
| 贷款利息 | 17,18 | | (4,448) | | | (2,142) | | | (9,432) | |
| 股权及认股权证的收益 | | | 4,718 | | | 2,791 | | | 3,113 | |
| 融资活动产生(用于)的现金流量净额 | | | (27,947) | | | 60,686 | | | (63,473) | |
| | | | | | | |
| 现金的增加(减少) | | | (11,410) | | | 128,683 | | | (17,580) | |
| 汇率效应 | | | (1,825) | | | 2,128 | | | 60 | |
| | | | | | | |
| 1月1日的现金和现金等价物, | 14 | | 205,159 | | | 74,348 | | | 91,868 | |
| | | | | | | |
| 截至12月31日的现金和现金等价物合计 | | | 191,924 | | | 205,159 | | | 74,348 | |
| | | | | | | |
这些附注是这些财务报表不可分割的一部分。(*) 本公司已于2021年1月1日将其列报货币由欧元改为美元,如附注2.4所述。因此,2020年12月31日及2019年12月31日比较综合现金流量表及相关附注已根据附注2.4概述的会计政策重新追溯呈列。
合并财务报表附注
1.企业信息
Pharing Group N.V.(以下简称“本公司”、“本集团”或“Pharming”)是一家专业制药公司,开发安全、有效地治疗罕见疾病和未得到满足的医疗需求的创新产品。辉瑞的主导产品RUCONEST®(Conestat Alfa)是一种重组人类C1酯酶抑制剂,已被批准用于治疗欧洲、美国、以色列和韩国的急性遗传性血管性水肿发作。该产品在尚未获得营销授权的其他地区以患者命名的方式提供。
根据董事会于2022年4月6日的决议,已授权发布截至2021年12月31日止年度的Pharming综合财务报表。财务报表有待定于2022年5月18日召开的年度股东大会通过。
Pharming Group N.V.的总部和注册办事处位于:
达尔文威格24号
2333 CR莱顿
荷兰
2.会计原则和政策
2.1.筹备基础和持续经营假设
综合财务报表是根据国际会计准则委员会(IASB)发布的国际财务报告准则(IFRS)和IASB国际财务报告解释委员会发布的解释编制的。综合财务报表概述了我们的活动和取得的成果,是在持续经营的基础上编制的。
它还要求管理层在应用公司会计政策的过程中作出判断。涉及较高判断力或复杂性的领域,或假设和估计对合并财务报表具有重大意义的领域,在附注2.5中披露。
除非另有说明,这些财务报表均以美元(美元)列报,并舍入至最接近的千美元(美元‘000)。
持续经营的企业
展望未来,我们认为,由于全球新冠肺炎疫情及其相关市场波动,不确定性仍在继续。在编制财务报表时,作为采纳持续经营企业的一部分,考虑了全球新冠肺炎疫情的潜在影响。特别是,执行董事和高级管理人员评估了新冠肺炎疫情影响公司收入、成本或其他活动的可能性,其程度使公司在到期时无法履行所有债务的可能性降低,并得出结论,这种情况在未来12个月内发生的可能性不大。虽然如果商务旅行在很长一段时间内继续受到严格限制,销售增长可能会略低于预期,但我们患者的潜在需求预计不会改变。如果大流行继续下去,某些费用可能会推迟或根本不发生。
除上述情况外,风险因素、未来可能采取的行动和其他不确定因素依然存在,目前无法可靠地估计其对公司未来的影响。虽然尚不确定,但我们不相信新冠肺炎病毒的影响会对我们的财务状况或流动性产生实质性的不利影响,我们预计能够履行我们的财务义务。
2021年年末现金余额(含限制性现金)美元193预计从本报告发布之日起,100万美元将为该公司提供超过12个月的资金。来自客户的正常销售收入和正常成本加在一起使公司的现金余额增加到约美元189.7截至2022年3月31日。
到目前为止,我们的供应链没有遇到任何值得注意的中断,公司的(外部)生产设施/销售地点也没有关闭。向我们在拉丁美洲、韩国和以色列的合作伙伴商业供应产品的收入以及在美国和欧洲直接销售的收入目前产生的现金比公司日常开支和供应这些销售所需的现金更多,因此产生的盈余现金将进一步支持我们的资本支出计划和财务储备。
董事会预计将在准备推出Leniolisib方面进行大量投资,预计将于2023年第一季度推出,有待监管部门批准。这些投资将对2022年的利润产生负面影响。因此,随着公司对未来的投资,公司预计本年度的现金和现金等价物将减少。如果获得批准,leniolisib的预期收入将从2023年起大幅增加。
然而,目前还不能对未来盈利的时间或规模做出进一步的保证。此外,如果本公司需要通过增发股份筹集资金,股东的股权在投票权方面可能会被稀释,而他们的价值利益将取决于发行该等股票的价格。本公司目前认为不再需要筹集资本以支持其目前的业务,但可能会抓住机会通过发行股票或通过扩大现有可转换债券或筹集债务,或通过该等工具的组合来支持收购或许可额外资产,前提是能够获得符合股东最佳利益的适当条款。
总体而言,根据这项评估的结果,Pharming的2021年财务报表是在持续经营假设的基础上编制的。
2.2新的和修订的国际财务报告准则
本公司首次申请某些修订,自2021年1月1日或以后的年度期间起生效,如下所述。
•《国际财务报告准则第7号》、《国际财务报告准则第9号》和《国际会计准则第39号:利率基准改革》修正案
•国际财务报告准则解释委员会(IFRIC)关于云技术软件即服务(SaaS)特定部分安排的议程决定。
它们的采用对披露或这些财务报表中报告的金额没有任何实质性影响。本公司尚未及早采纳已发布但尚未生效的任何其他标准、解释或修订。
截至本集团财务报表发布之日已发出但尚未生效的新准则及经修订准则及诠释,本集团拟于生效时采纳(如适用)如下。
•国际财务报告准则第17号:保险合同。
•国际财务报告准则第10号和国际会计准则第28号修正案:投资者与其联营企业或合资企业之间的资产出售或出资。
•《国际会计准则》第1号修正案:将负债分类为流动负债或非流动负债。
•对“国际财务报告准则”第3号的修正:参考概念框架。
•《国际会计准则》第16号修正案:财产、厂房和设备:预期使用前的收益。
•《国际会计准则》第37号修正案:繁重的合同--履行合同的费用。
•对IFRS准则2018-2020周期的年度改进:对IFRS 1首次采用国际财务报告准则、IFRS 9金融工具、IFRS 16租赁和国际会计准则41农业的修订。
•对《国际会计准则1》和《国际财务报告准则》实务声明2的修正:会计政策的披露。
•《国际会计准则》第8号修正案:会计估计数的定义。
•国际会计准则第12号修正案:与单一交易产生的资产和负债有关的递延税金。
管理层预期采用上述准则不会对本公司未来期间的财务报表产生重大影响。
2.3巩固的基础
合并财务报表包括Pharming Group N.V.及其控制的子公司,在消除所有公司间交易和余额后。子公司从收购方获得有效控制权之日起合并,直至控制权终止。
如果公司有权直接或间接地管理实体的财务和经营政策,从而从其活动中获得利益,则该实体被视为有效控制。对子公司的收购采用会计收购法进行核算。子公司的财务报表与Pharming Group N.V.相同的报告年度编制,使用相同的会计政策。公司间交易、余额和集团公司间交易的未实现损益被冲销。
2.4会计原则和政策
企业合并
企业合并使用购置款会计方法进行会计处理。购入的可识别资产、负债和或有负债按购置日的公允价值计量。转让的对价按公允价值计量,包括任何或有对价的公允价值。如果转让的对价超过所取得的净资产、负债和或有负债的公允价值,超出的部分计入商誉。采购成本被确认为费用。
列报货币的变动
自2021年1月1日起,本公司的呈报货币由欧元改为美元。这一变化是为了更好地反映公司未来业务的经济足迹。公司相信,报告货币的变化将使投资者和其他利益相关者更清楚地了解公司随着时间的推移的表现。集团的本位币(欧元)没有变化。
因此,为满足《国际会计准则21》关于汇率变动的影响的要求,已使用以下程序将2021年12月31日终了年度和2020年12月31日终了年度的报告结果从欧元折算为美元:
•以非美元货币计价的资产和负债按相关收盘汇率折算成美元;
•功能货币为美元以外的子公司的交易结果按相关平均汇率折算为美元,如果平均汇率提供合理的近似值;
•其他储备的变动按有关平均汇率折算成美元;以及
•股本、股份溢价及其他储备按每次交易当日的历史汇率折算。
列报货币的变动是指国际会计准则第8号会计政策下会计政策的变动、会计估计的变动和追溯入账的错误。已提交一份期初资产负债表,显示2019年12月31日列报货币变化的影响。
外币折算
在编制本集团财务报表时,以实体功能货币(外币)以外的货币进行的交易按交易日期的汇率确认。在每个报告日期,以外币计价的货币资产和负债将按该日的现行汇率重新换算。按公允价值计价的以国外货币计价的非货币项目
货币按公允价值确定之日的现行汇率折算。以外币的历史成本计量的非货币项目不会重新换算。
汇兑差额在产生汇兑差额的当期在损益中确认,但下列情况除外:
•与在建用于未来生产用途的资产有关的外币借款的汇兑差额,在被视为对这些外币借款的利息成本进行调整时,计入这些资产的成本;
•为对冲某些外币风险而进行的交易的汇兑差额(见下文金融工具/对冲会计);
•从国外业务应收或应付的货币项目的汇兑差额,但在可预见的将来既没有计划也不可能对其进行结算(因此构成对国外业务的净投资的一部分),这些项目最初在其他全面收益中确认,并在处置或部分处置净投资时从权益重新归类为损益
为以美元列报综合财务报表,本集团以欧元为功能货币的业务的资产及负债按报告日的现行汇率换算。收入和支出项目按该期间的平均汇率换算,除非该期间的汇率大幅波动,在这种情况下,使用交易日期的汇率。如有汇兑差额,则在其他全面收益中确认,并累计在外汇折算准备金中。
2021年12月31日适用的欧元兑美元汇率为1.1334 (2020: 1.2280; 2019: 1.1214)。2021年适用的平均汇率为1.1860 (2020: 1.1426; 2019: 1.1205).
电流与非电流的区别
当一个项目预期在报告年度结束后12个月内实现(结算)时,该项目被归类为当期项目。负债分类为流动负债,除非本集团有无条件权利在报告年度结束后将负债延迟至少12个月清偿。
单独收购的无形资产
单独收购的无形资产(‘IFA’)按历史成本计量。在企业合并中收购的无形资产的成本按收购之日的公允价值确认和计量。于初步确认后,无形资产按成本减去任何累计摊销及任何累计减值亏损列账。
具有有限使用年限的无形资产将在使用年限内摊销,并在有迹象表明无形资产可能减值时和在每个报告期结束时进行减值评估。估计使用年限、剩余价值及摊销方法于每一报告期结束时予以审核,并于预期基础上计入估计值任何变动的影响。按照直线法计算的预期使用年限的变化,或资产体现的未来经济利益的预期消费模式的变化,通过适当改变摊销期间或方法进行核算,并作为会计估计的变化处理。使用年限有限的无形资产的摊销费用在损益表中与无形资产的功能相符的相关费用类别中确认。
无形资产也通过将某些类型的支出资本化来确认,特别是包括药品研发费用。本说明“内部产生的无形资产--研究和开发支出”一节更详细地讨论了这些问题。
截至2021年12月31日的无形资产剩余摊销期限为:
| | | | | | | | | | | |
| | 摊销期限 |
| 类别 | 描述 | 总计 | 剩余 |
| 转基因技术 | 专利和许可证 | 6至10年份 | 全额摊销 |
| 用于HAE的RUCONEST®(欧盟) | 开发成本 | 10年份 | 全额摊销 |
| 用于HAE的RUCONEST®(美国) | 重新获得的商业权 | 20年份 | 15年份 |
| 用于HAE的RUCONEST®(欧盟) | 重新获得的商业权 | 12年份 | 10年份 |
| 软件费用 | 开发成本 | 3至5年份 | 3至5年份 |
| 开发成本* | 开发成本 | 尚未使用 | 尚未使用 |
*关于庞贝和法布里病的收购资产和用于修改RUCONEST®的内部生成资产
该公司原有的转基因技术已全部摊销,目前账面价值为美元零。该公司正在基于已获专利的自有技术开发新的转基因技术,并利用外部开发的技术生产某些方正转基因动物。这项新技术如果在完成后获得资本,将在其当时的使用寿命内摊销。
内部产生的无形资产--研发支出
研究活动支出在发生期间确认为支出。因开发(或内部项目的开发阶段)产生的内部产生的无形资产,只有在下列所有条件均已证明的情况下才予以确认:
•完成无形资产以供使用或出售的技术可行性
•完成无形资产并使用或出售的意图
•使用或出售无形资产的能力
•无形资产如何产生未来可能的经济效益
•有足够的技术、财政和其他资源来完成开发和使用或出售无形资产
•能够可靠地计量无形资产在开发过程中的可归属支出
内部产生的无形资产最初确认的金额是自该无形资产首次符合上述确认标准之日起发生的支出的总和。在无法确认内部产生的无形资产的情况下,发展支出在发生期间在损益中确认。
在初步确认后,内部产生的无形资产按成本减去累计摊销和累计减值损失按与单独收购的无形资产相同的基准报告。
在企业合并中收购的无形资产
在企业合并中收购并与商誉分开确认的无形资产最初按收购日的公允价值确认(这被视为其成本)。在初始确认后,在企业合并中收购的无形资产按成本减去累计摊销和累计减值损失报告,其基准与单独收购的无形资产相同。
无形资产不再确认
无形资产在处置时,或者在使用或处置不会带来未来经济利益的情况下,被取消确认。因终止确认无形资产而产生的收益或损失,以出售所得款项净额与资产账面金额之间的差额计量,在资产终止确认时在损益中确认。
生物资产
根据国际会计准则第41号“农业”,管理层须评估对产生现金流有贡献的‘生物资产’是否应作为资产入账。管理层已评估Pharming的生物资产,并得出结论认为,由于其独特性和非常特殊的转基因性质,这些资产不符合相关标准IAS 41“农业”的确认资格,因此所有相关成本均在损益表中列支。
财产、厂房和设备
物业、厂房及设备按成本减去累计折旧费用及累计减值费用列账。一般来说,折旧是在资产的估计使用年限内采用直线基础计算的。估计可用年限、剩余价值及折旧方法于每个报告期结束时予以审核,并于预期基础上计入任何估计变动的影响。当事件或环境变化显示物业、厂房及设备之账面值可能无法收回时,便会检视其账面值是否有减值。
财产、厂房和设备在处置时或在其使用或处置不会带来未来经济利益的情况下被取消确认。
因终止确认该资产而产生的任何损益(按出售所得净额与该资产的账面金额之间的差额计算),计入该资产终止确认当年的损益表。剩余价值、使用年限和折旧方法在每个财政年度结束时进行审查,并在适当情况下进行调整。
所有直接可归因于将资产转移到使其能够以管理层预期的方式运营所需的地点和条件的成本,将被资本化。这些成本包括直接员工福利、租金和测试成本。资本化将一直进行,直到资产能够以管理层预期的方式运作。
不动产、厂房和设备的折旧期为:
| | | | | |
| 类别 | 折旧期 |
| 土地 | 未折旧 |
| 土地改良 | 20年份 |
| 运营设施 | 10-20年份 |
| 租赁权改进 | 5-10年份 |
| 制造设备* | 5-10年份 |
| 其他财产、厂房和设备 | 5-10年份 |
*制造设备的折旧费以所涉设备的实际使用为基础,预计将在技术到期前的一段时间内发生
对联营公司的投资
联营公司指本集团对其有重大影响力的实体,而该实体既非附属公司,亦非合资企业中的权益。重大影响力是参与被投资方的财务和经营政策决策的权力,但不是对这些政策的控制或共同控制。联营公司的业绩及资产和负债采用权益会计方法并入这些财务报表。根据权益法,对联营公司的投资最初于综合财务状况表中按成本确认,其后作出调整以确认本集团应占联营公司的损益及其他全面收益。
当本集团应占某联营公司的亏损超过本集团于该联营公司的权益(包括实质上构成本集团于该联营公司的净投资的任何长期权益)时,本集团将停止确认其应占的进一步亏损。额外损失仅在本集团已产生法律或推定义务或代表联营公司支付款项的范围内才予以确认。国际会计准则第36号的规定适用于厘定是否需要就本集团于联营公司的投资确认任何减值亏损。
必要时,投资(包括商誉)的全部账面金额将根据国际会计准则第36号作为单一资产进行减值测试,方法是将其可收回金额(使用价值和公允价值减去出售成本的较高者)与其账面金额进行比较。已确认的任何减值损失不会分配给任何资产,包括构成投资账面价值一部分的商誉。减值损失的任何冲销均按照国际会计准则第36条确认,但投资的可收回金额随后增加。
当集团实体与本集团的联营公司进行交易时,与该联营公司或合营公司的交易所产生的损益只在与本集团无关的联营公司或合营公司的权益范围内于综合财务报表中确认。
金融资产
当公司成为金融工具合同条款的当事人时,金融资产被确认。当从金融资产收取现金流的权利到期,或本公司将金融资产转让给另一方而不保留对该资产的控制权或实质上所有风险和回报时,金融资产将被取消确认。在正常业务过程中购买和出售的金融资产在结算日(即资产交付给本公司或由本公司交付的日期)入账。
于初步确认时,本公司按其公允价值计量其金融资产,如属非按公允价值计入损益的金融资产,则按直接应归属于收购或发行该金融资产的交易成本计量。
在初步确认后,本公司将其金融资产按以下两种方式分类计量:i)摊余成本、ii)通过其他全面收益的公允价值或iii)损益的公允价值:
•公司管理金融资产的业务模式;
•金融资产的合同现金流特征。
在初始确认之后,金融资产的计量如下所述。于每个资产负债表日,本公司评估是否有客观证据显示某项或一组金融资产已减值,并确认按摊销成本或按公允价值透过其他全面收益计量的金融资产预期信贷损失的损失准备。如于报告日期,金融工具的信贷风险自首次确认以来并未显著增加,本公司将按相当于12个月预期信贷损失的金额计量该金融工具的损失准备。如于报告日期,一项金融工具的信贷风险自首次确认以来已显著增加,本公司将按等同于终身预期信贷损失的金额计量该金融工具的损失准备。
按摊销成本计算的金融资产
在以下情况下,金融资产按摊余成本计量:i)金融资产是在其目标是持有金融资产以收取合同现金流量的商业模式下持有的;以及ii)金融资产的合同条款在指定日期产生现金流量,即仅支付本金和未偿还本金的利息。
按摊余成本计量的金融资产最初按公允价值加直接归属于该资产的交易成本确认。在初步确认后,按摊销成本计量的金融资产的账面金额采用实际利息法减去任何减值损失确定。
通过其他全面收益按公允价值计算的金融资产(FVTOCI)
经初步确认后,本集团可作出不可撤销的选择(以逐个工具为基准),指定投资于FVTOCI的权益工具。FVTOCI对股权工具的投资最初按公允价值加交易成本计量。
随后,它们按公允价值计量,公允价值变动产生的损益在其他全面收益中确认并累计在投资重估准备金中。累计损益重新分类为出售股权投资时的损益。
按公允价值计提损益的金融资产
当不符合上述任何金融资产分类条件时,金融资产被归类为“按公允价值计提损益”,并按公允价值计量,公允价值变动计入损益。
按公允价值通过损益计量的金融资产最初按公允价值确认,其交易成本在发生时在损益中确认。金融资产的损益按公允价值通过损益计量,在产生损益的报告期的综合收益表中确认。
本公司可在初始确认时不可撤销地将金融资产指定为按公允价值通过损益计量,前提是这样做消除或显著减少了因计量资产或负债或按不同基准确认其损益而产生的计量或确认不一致之处。
本公司按公允价值损益计量的金融工具包括衍生金融资产。本公司并无此类金融资产。
资产减值
具有无限使用寿命的资产和尚未使用的资产不受折旧或摊销的影响,并至少每年进行减值测试。应计提折旧或摊销之资产,每当发生事件或环境变化显示账面值可能无法收回时,便会就减值进行审核。
减值损失确认为资产的账面金额超过其可收回金额的金额。可收回的金额是资产的公允价值减去出售成本和使用价值两者中较高的一个。就评估减值而言,资产按有单独可识别现金流的最低水平分组。对已计入减值损失的非金融资产在每个报告日期进行审核,以确定是否有可能冲销减值。
盘存
存货按成本和可变现净值中较低者列报。本公司有三种存货类别:
•成品:由若干批次的RUCONEST®组成。这些批次包括可供销售的治疗产品(包括单瓶和自我给药试剂盒)、临床开发和临床前活动。初步确认按成本计算,包括与产品销售有关的所有生产成本,包括脱脂牛奶的生产成本、外部制造成本、产品测试成本以及将库存转移到目前的位置和状况所产生的其他成本;
•正在进行的工作:由药物物质组成的半成品;
•原料:由作为RUCONEST®批次原料的脱脂牛奶组成。每单位脱脂牛奶的估价是基于生产设施的总成本和正常的生产水平。
成本是使用先进先出(FIFO)方法确定的。可变现净值是在正常业务过程中的估计销售价格减去估计的完工成本和进行销售所需的估计成本。如果制药公司为外部临床试验研究提供了RUCONEST®药瓶,则计算药瓶的可变现净值。库存成本如果与产品销售有关,则计入销售成本。如果与临床试验中的使用有关,则费用包括在运营成本中。
如果预计或可能在到期日之前不会有未来的使用或销售,或者如果产品批次由于质量问题预计不会放行,则确认库存减值。
贸易和其他应收款
贸易及其他应收账款最初按交易价格确认。后续计量采用实际利息法按摊余成本减去预期信用损失。应收贸易账款是客户在正常业务过程中销售的货物的应收款项。它们一般应在30天内结清,因此都被归类为当前的。对于应收贸易账款和合同资产,本公司采用简化方法计算预期信贷损失。本公司根据过往的信贷损失经验评估预期信贷损失,并根据债务人及经济环境的特定前瞻性因素作出调整。“由于本期应收账款属短期性质,其账面值被视为与其公允价值相同。
现金和现金等价物
现金及现金等价物定义为手头现金、活期存款及短期高流动性投资(到期日少于3个月),可随时转换为已知数额的现金,并受价值变动的轻微风险影响。银行透支在财务状况表的流动负债中显示为借款。就现金流量表而言,现金和现金等价物是扣除银行透支后的净额,不包括受限现金。限制性现金是指存放在某些银行的短期存款中的现金,主要用于信用卡,不被视为现金和现金等价物。
权益
本公司只有普通股,这些股票在发行时归入股权。就可换股债务及衍生金融负债结算而转让的股份,按公允价值按股份于结算日前一个交易日的收市价计量。权益于发行具有固定行使价格的固定认股权证以及确认以股份为基础的支付费用时确认;因行使该等认股权证或期权而发行的股份按其行使价格计量。
与股权交易相关的交易成本被计入从股权中扣除的部分,只要它们是直接归因于股权交易的增量成本,否则就可以避免。与发行复合金融工具有关的交易成本按收益分配比例分配给工具的负债和权益部分。
金融负债和借款
金融负债分为按公允价值计入损益的金融负债(衍生金融负债)或按摊销成本计算的金融负债(借款、贸易及其他应付款项)。所有金融负债及借款初步按收到代价的公允价值减去直接应占交易成本确认;与发行复合金融工具有关的交易成本按收益分配比例分配至工具的负债及权益部分。在初步确认后,金融负债和借款随后按实际利息法按摊销成本计量。
在清偿或以其他方式消除负债时以及通过摊销过程,损益在损益表中确认。购买和出售金融负债在结算日确认。
金融负债在负债项下的债务解除、注销或到期时被取消确认。若一项现有财务负债以实质不同条款由同一贷款人的另一项财务负债取代,或一项现有负债的条款有重大修改,则该项交换或修改被视为终止确认原有负债及确认一项新负债,而有关账面值的差额则于损益表中确认。
可转换债券
该公司已发行可转换债券。在发行债券时,已将权益和负债部分分开计算在内。可转换债券的负债部分为
未来现金流,以市场利率折现债券的未来现金流(利息和本金),并假设没有转换选项可用。权益部分的价值将是从债券收到的总收益与现值(负债部分)之间的差额。
权益部分在初始确认后不会重新计量。
如果本公司通过提前赎回或回购在到期前通过原始转换特权不变的方式将可转换债券清偿,则实体将支付的对价和回购或赎回的任何交易成本分配给交易日期可转换债券的负债和权益部分。将已支付代价及交易成本分配至独立部分所采用的方法,与本公司发行可换股票据时所收到收益的单独部分原始分配所采用的方法一致。一旦分配了对价,由此产生的任何收益或损失将按下列方式处理:
•与负债部分有关的损益数额在损益中确认;以及
•与权益部分有关的对价金额在权益中确认。
如果可转换债券在到期前转换,则已发行股票的权益确认金额应为转换日期债务的列报金额。
于到期转换可换股债券时,本公司确认负债部分,并确认为权益。原来的权益部分仍然是权益(尽管它可以从权益内的一个项目转移到另一个项目)。于到期日兑换并无收益或亏损。
直接归属于可转换债券的交易成本从可转换债券的初始公允价值中扣除。交易费用按照收益的分配比例在负债和权益部分之间分配。负债部分的交易成本被确认为利息成本的一部分。
条文
当由于过去的事件而产生目前的债务(法律或推定)时,集团很可能被要求清偿该债务,并可对该债务的金额作出可靠的估计。确认为拨备的数额是对在报告日期结清本债务所需对价的最佳估计,同时考虑到债务的风险和不确定因素。如果一项拨备是使用估计用于清偿当前债务的现金流量计量的,其账面金额为该等现金流量的现值(如果货币时间价值的影响是重大的)。与任何准备金有关的费用在扣除任何偿还后的损益表中列报。
衍生金融负债
衍生金融负债最初按公允价值确认,其后按公允价值通过损益计量,公允价值变动在损益表中确认。
贸易和其他应付款
贸易及其他应付款项最初按公允价值确认。后续计量采用实际利息法按摊余成本计价。
收入确认
为了确定何时确认收入以及确认的金额,公司根据对商品或服务的控制权转移给客户,采用了以下五个步骤:
1.确定与客户的合同;
2.确定合同中的履约义务。履约义务是在合同中承诺将不同的货物或服务转让给客户;
3.确定交易价格。交易价格是一个实体预期有权获得的对价金额,以换取将承诺的货物或服务转让给客户。如果合同中承诺的对价包括可变金额,实体必须估计其预期有权获得的对价金额,以换取将承诺的货物或服务转让给客户;
4.根据合同中承诺的每种不同商品或服务的相对独立销售价格,将交易价格分配给每项履约义务;
5.当通过将承诺的货物或服务转让给客户来履行履行义务时(即客户获得该货物或服务的控制权时)确认收入。履行义务可以在某个时间点(通常是对向客户转让货物的承诺)或在一段时间内(通常是对向客户转让服务的承诺)履行。对于随时间履行的业绩义务,实体应选择适当的进度衡量标准,以确定在履行业绩义务时应确认多少收入。
本集团所有与客户签订合约的收入均来自运送货物,特别是药剂产品的瓶装。本集团不向客户提供任何额外服务(包括融资服务)或设备。
根据国际财务报告准则第15号,收入在客户获得货物控制权时确认。对于本集团的合同,客户通常在产品装运后立即获得控制权,产品在短时间内到达客户手中。
本集团与客户签订的绝大部分收入合约涉及直接与客户有关的扣减、折扣及/或回扣,或涉及政府或保险付款人的最终赔偿要求。这些费用是在估计净额的基础上核算的,任何实际折扣和回扣都用于在适当时候改进估计数。这些可变因素将在记录相关销售的同一期间从收入中扣除。
该集团过去曾从各方收到预付款,以换取欧洲、美国和其他销售和分销权利的许可证。这些预付款均被视为一项单独的履约义务,与随后交付的货物一起。它们最初被确认为递延合同负债,并根据与每个经销商的协议条款,在许可证有效期内计入损益表。在终止或变更相关协议或完成有关履约义务后,以这种方式保留的所有款项现已计入损益表。不存在与这些预付款有关的重大融资部分。
其他收入
PURING获得了某些赠款,用于支持公司在明确的研究和开发项目中的研究努力。这些补贴一般用于偿还各种赠款中规定的核定费用。如果公司能够证明它已经遵守了所有附加条件,并且很可能会收到赠款,补贴就会得到确认。赠款在本集团将赠款拟用于补偿的相关成本确认为费用的期间内系统地在损益中确认。
该公司在损益表中列入其他收入项下赠款的收入,以便能够将其损益表与生命科学部门的公司进行比较。
销售成本
销售成本是指与产品销售有关的所有生产成本,包括脱脂牛奶的生产成本、外部制造成本、用于产品测试的瓶子成本以及在生产过程中产生的其他成本。
将库存转移到目前的位置和状况。成本是根据先进先出的实际成本计量的,如果销售价格低于实际成本,则按可变现净值发生。
研发成本
研究费用在发生期间确认为费用。只有在满足下列标准的情况下,才能确认个别项目的开发支出产生的无形资产:
•完成无形资产以供使用或出售的技术可行性毋庸置疑;
•公司具有完成该资产、使用或出售该资产的明确意图和资源;
•其使用或出售资产的能力毋庸置疑;
•在作出决策时,未来经济效益的可能性是明确的;
•在发展过程中,完成所需发展所需资源的可获得性预计不会改变;
•在开发期间可靠地衡量支出是可能的。
当本公司估计有可能获得上市批准时,一般认为技术可行性及使用或出售该资产的能力是可能的。在实践中,只有当我们(I)之前在相同的治疗分子或组合上完成了类似的程序,或(Ii)之前在类似的分子或组合上完成了相同的程序时,才会出现这种情况。在其他情况下,评估每个剩余的临床开发和监管批准水平的成功可能性,除非集体概率被认为很高,否则在这些情况下很难满足标准。
在初步确认开发支出后,采用成本模式,要求资产按成本减去任何累计摊销和累计减值损失入账。
资本化的任何支出将在相关专利的预期使用年限内摊销。于报告年度内,当资产尚未使用或当出现减值迹象时,开发成本的账面价值会按年检讨减值。
利息收入
利息收入按实际利息法确认为应计利息。就综合现金流量表而言,来自现金和现金等价物的利息收入已作为经营现金流量列报。
运营成本
营业成本在发生时计入费用。研究和开发费用包括为获得新的科学或技术知识和理解以及将研究成果或其他知识应用于生产新的或大幅度改进的产品的计划或设计而开展的活动。一般和行政性质的费用适用于间接费用。营销和销售成本涉及产品商业化所产生的所有费用。
短期雇员福利
本公司不根据损益表的财务计量提供任何利益。
工资和薪金的负债,包括非货币福利和累积病假,预计将在雇员提供相关服务的期间结束后12个月内全部清偿,就截至报告期结束的雇员服务确认,并按清偿负债时预计支付的金额计量。负债在资产负债表中的贸易和其他应付款项下列示。
养老金计划
对于所有荷兰员工,本公司与一家独立的保险公司一起参加固定缴款养老金计划。界定供款在提供相关雇员服务的年度支出。
美国的员工可以参加401K计划,该计划也有资格成为固定缴费计划。要成为合格的参与者,员工必须完成6服务数月,并达到年满18好几年了。雇主匹配100第一个的百分比3%员工为其401K计划缴费,并且50超过以下任何款额的百分比3最高百分比5%。任何员工的贡献超过5%不匹配。401K计划的费用在提供相关雇员服务的当年支出。
股份支付
期权计划的成本是参照期权授予之日期权的公允价值计量的。公允价值是使用布莱克-斯科尔斯模型确定的。这些期权的成本在归属期间的损益表中确认(基于股份的补偿),以及相应的权益增加(其他准备金)。基于股份的支付费用不影响支出年度的负债或现金流,因为所有交易都是以股权结算的。
Phing的员工期权计划规定,员工有权在五年在授予之日之后。期权变得无条件的期间被定义为归属期间。
长期激励计划
对于有限数量的董事会成员和管理人员,业绩股票是免费授予的。可授予的预定股份的最大数量三年在授予日期之后,如果长期激励计划的参与者仍在服务中(继续雇用条件),实际股份将根据Pharming的股价相对于同行集团的相对业绩进行转让。控制权变更后,最大股份数量立即授予。
公允价值是通过蒙特卡罗模拟来确定的。长期信托投资协议的成本在归属期间的损益表中确认。于授出日的公允价值包括市场表现状况(相对股东总回报表现),但不包括三年制服务条件。
2020年12月11日,新的董事执行机构LTIP实施。于二零二零年十二月十一日起,LTIP项下的现有购股权计划及授予限制性股份将不再适用于新薪酬政策下的执行董事。新设计的LTIP与流行的“最佳实践”保持一致,仅与业绩有关。业绩包括股东总回报(40加权百分比)和长期战略导向目标的实现(60重量百分比)。股东总回报是与同行组进行比较的。
根据新的长期投资协议授予执行董事的股份,将归属于3在赠款之日之后数年,但须视一年业绩期间目标的实现情况、其相对权重和支付限额而定。所有股份的保留期为5自授予之日起数年。为了完全有权获得LTI条件下授予的股份,参与者必须是董事会成员,在归属日期担任执行董事会成员。
新LTIP的公允价值是通过蒙特卡罗模拟确定的。长期信托投资协议的成本在归属期间的损益表中确认。授予日的公允价值包括Pharming相对于基准的财务业绩状况、战略业绩状况以及服务状况。
租契
本集团评估合同在合同开始时是否为租约或包含租约。本集团就其为承租人的所有租赁安排确认使用权资产及相应租赁负债,但短期租赁(定义为租期12个月或以下的租赁)及低价值资产(如平板电脑及个人电脑、小型办公家具及电话)租赁除外。为
该等租赁本集团按直线法于租赁期内确认租赁付款为营运开支,除非另一系统基准更能代表租赁资产产生的经济利益的耗用时间模式。
租赁负债最初按开始日期未支付的租赁付款的现值计量,并使用租赁中隐含的利率进行贴现。如果不能很容易地确定这一利率,该公司将使用其递增借款利率。
在计量租赁负债时计入的租赁付款包括:
•固定租赁费
•取决于指数或费率的可变租赁付款,最初是使用开始日期的指数或费率来衡量的。
租赁负债在合并资产负债表中单独列示。
租赁负债随后通过增加账面金额以反映租赁负债的利息来计量(使用实际利息法),并通过减少账面金额以反映所支付的租赁付款来计量。
本集团在下列情况下重新计量租赁负债(并对相关使用权资产进行相应调整):
•租赁期限发生变化或发生重大事件或情况变化,导致对行使购买选择权的评估发生变化,在这种情况下,租赁负债通过使用修订贴现率对修订租赁付款进行贴现来重新计量。
•租赁付款因指数或利率的变动或担保剩余价值项下预期付款的变动而变动,在此情况下,租赁负债通过使用不变的贴现率对修订租赁付款进行贴现来重新计量(除非租赁付款变动是由于浮动利率的变化,在这种情况下使用修订贴现率)。
•租赁合同经修订,而租赁修订不作为独立租赁入账,在此情况下,租赁负债根据修订租赁的租期重新计量,方法是在修订生效日使用修订贴现率对修订租赁付款进行贴现。
在本报告所述期间,专家组没有作出任何此类调整。
使用权资产包括对相应租赁负债的初始计量、在开业之日或之前支付的租赁付款减去收到的任何租赁奖励和任何初始直接成本。它们随后按成本减去累计折旧和减值损失计量。
每当本集团产生拆除及移走租赁资产、恢复其所在地点或将相关资产恢复至租赁条款及条件所要求的条件的费用的责任时,将根据国际会计准则第37条确认及计量拨备。在成本与使用权资产有关的范围内,成本包括在相关的使用权内,除非这些成本是为了生产库存而产生的。
使用权资产按标的资产的租赁期和使用年限较短的时间折旧。如果租赁转让标的资产的所有权或使用权资产的成本反映本集团预期行使购买选择权,则相关的使用权资产将在标的资产的使用年限内折旧。折旧自租约开始之日起计。
使用权资产在合并资产负债表中单独列示。
本集团应用国际会计准则第36号厘定使用权资产是否已减值,并计入“物业、厂房及设备”政策所述的任何已确认减值损失。
不依赖于指数或费率的可变租金不计入租赁负债和使用权资产的计量。相关付款在事件或条件触发这些付款发生的期间确认为费用。
作为一种实际的权宜之计,国际财务报告准则第16号允许承租人不将非租赁组成部分分开,而是将任何租赁和相关的非租赁组成部分作为单一安排进行核算。工作组没有使用这一实际的权宜之计。对于包含租赁组成部分和一个或多个额外租赁或非租赁组成部分的合同,本集团根据租赁组成部分的相对独立价格、租赁组成部分的独立合计价格和非租赁组成部分的合计独立价格,将合同中的对价分配给每个租赁组成部分。在本报告所述期间,该集团没有此类租赁安排。
所得税
本期所得税支出或抵免是指根据每个司法管辖区适用的所得税税率,经可归因于暂时性差异和未用税项损失的递延税项资产和负债变动调整的当期应纳税所得额。
目前的所得税费用是根据本公司及其子公司经营和产生应纳税所得国在报告期末颁布或实质颁布的税法计算的。管理层会就适用税务法规须予解释的情况,定期评估报税表内的立场。它根据预计应向税务机关支付的金额,酌情规定了拨备。
递延所得税按综合财务报表中资产和负债的计税基准与其账面金额之间产生的暂时性差异采用负债法全额拨备。递延所得税采用于报告期末已颁布或实质颁布的税率厘定,并预期于相关递延所得税资产变现或清偿递延所得税负债时适用。
递延税项资产只有在未来的应税金额可能可用于使用这些暂时性差额和损失时才予以确认。本公司已根据IFRIC 23会计准则就不确定所得税评估其所有所得税金额及拨备,并已得出结论,其特定税务处理可能会被所有相关司法管辖区接受,因此本公司已厘定应课税溢利(税项亏损)、税基、未用税项亏损、未用税项抵免或税率与其所得税申报文件所包括的税务处理一致。
本期及递延税项于损益中确认,但与其他全面收益或直接于权益中确认的项目有关者除外。
现金流量表
现金流量表中的经营性现金流量采用间接法报告。在间接法中,这一数字是通过扣除非现金项目和营运资金变动的影响调整损益而得出的。公司选择税前利润作为对账的起点,因为净结果中的大多数其他要素都是非现金性质的。与营运资产及设备有关的融资租赁负债的付款计入营运现金流量,而所有其他融资租赁负债则计入融资现金流量。它们是制造成本的一部分,因此也是营运资金的一部分。这样,报表才能正确地反映现金流。
每股收益
每股基本收益按期内已发行普通股的加权平均数计算。摊薄每股收益乃根据已发行普通股之加权平均数计算,包括根据若干安排(如购股权计划、已发行认股权证及可换股贷款协议)将于未来发行之股份之摊薄效应。
细分市场报告
经营分部的报告方式与向首席运营决策者职能部门提供并由首席运营决策者在管理该分部时使用的分部信息的内部报告一致。
自2020年12月11日起,负责制定公司战略决策的董事会执行成员已被确定为负责分配资源和评估运营部门业绩的首席运营决策者。截至2020年12月11日,原管理委员会为首席运营决策者。请参阅附注22。
2.5 重大会计判断和估计
编制财务报表需要作出影响资产和负债、收入和费用的报告金额的判断和估计,以及在财务报表日期对或有资产和负债的相关披露。由此产生的会计估计,从定义上讲,很少与相关的实际结果相等。下一财政年度内有重大风险导致资产及负债账面值出现重大调整的估计及假设如下。
判决:
果园治疗学
2021年7月1日,Pharming Group N.V.和Orchard Treeutics宣布进行战略合作,研究、开发、制造OTL-105并将其商业化,该药物仍处于早期临床前阶段。Pharing将负责研究基因疗法的临床开发、监管申报和商业化,包括相关成本。
作为合作的一部分,Pharming支付了美元的对价17.5百万美元,包括美元10百万美元现金和一美元7.5百万股权投资(约相当于1Orchard流通股的1%),溢价于Orchard于2021年7月1日的股价。
为了评估合作协议是否构成业务合并、联合安排或无形资产,采用了判断。我们认为这笔交易不是国际财务报告准则第3号下的业务合并的主要考虑是基于没有劳动力或流程作为协议的一部分转移的事实。它也不是《国际财务报告准则》第11号下的联合安排,因为控制权不是按合同分享的。
为了评估合作协议获得的权利是否为Pharming财务报告目的的无形资产,根据国际会计准则第38号“无形资产”,对这些资产是否可识别、Pharming是否获得了对这些资产的控制权以及是否预期通过这些资产获得未来经济利益进行了评估。对未来收益是否可预期的评估需要管理层的判断。
通过Pharming和Orchard之间的合作协议,Pharming可能会从知识产权中获得未来的好处。管理层的结论是,在报告日期,治疗计划成功并按照国际会计准则38.22的要求为Pharming提供未来经济利益的可能性不大。
根据上述判断,无形资产的定义不符合无形资产的定义,所购股份的总代价减去所购股份的公允价值,即在“在FVTOCI指定的股权工具的投资”项下记录的一项单独资产,在发生时确认为支出。
开发成本
如果符合本说明“无形资产”第2.4段中进一步详细说明的下列标准,则可将发展支出确认为无形资产:
•完成资产,使其可用于销售的技术可行性明确;
•公司完成资产和使用或出售资产的意图是明确的;
•它使用或销售它的能力是显而易见的;
•未来经济效益的可能性很大(该产品有一个现有的市场,一旦该产品准备好投放市场,该市场可能就会出现);
•完成开发的资源是否可用是不成问题的;
•可靠地衡量项目支出的能力是不成问题的。
2018年,该公司开始修改目前的产品RUCONEST®,以使给药形式更加方便,供患者使用。预计这将导致现有产品的更好变种。这导致了开发费用的资本化。按照国际会计准则第36号“资产减值”的要求,管理层评估了是否有迹象表明一项资产可能减值。管理层不得不做出判断,以确定该项目的可行性。主要是考虑到对公司流水线资产投资的工作进行了重新排序,管理层决定停止该项目,从而减损了资本化的开发成本。另请参阅附注9。
生物资产
根据国际会计准则第41号“农业”,管理层须评估对产生现金流有贡献的‘生物资产’是否应作为资产入账。管理层已评估Pharming的生物资产,并得出结论认为,由于其独特性和非常特殊的转基因性质,这些资产不符合相关标准IAS 41“农业”的确认资格,因此所有相关成本均在损益表中列支。
估计:
收入
当控制权转移到客户手中时,收入被确认。收入因政府医疗保健计划的按存储容量使用计费和回扣、专业药店和批发商的折扣以及已提供或预计将提供的产品退货而减少,这些因素因患者群体而异。医疗保健计划的按存储容量使用计费和返点取决于最初确认销售后的某个时间提交的索赔。这一可变因素的负债是在销售时根据现有的市场信息和历史经验估计的退款和返点,主要是美国的医疗补助。由于金额是估计的,它们可能不能完全反映最终结果,而且金额可能会根据患者群体的类型等因素而发生变化。这些负债的水平正在根据合同和法律义务、历史收费和趋势、过去的经验和预计的患者群体组合而定期进行审查和调整。本集团从作为外部各方的两个内部资源处获得这一信息。
未来的事件可能会导致应计项目所依据的假设发生变化,从而影响本集团未来的业绩。
3.细分市场信息
董事会执行成员是首席运营决策者,从地域和产品的角度考虑业务。
从产品的角度来看,该公司的业务仅与重组人C1酯酶抑制剂业务相关。从地域上看,该公司在美国、欧洲和世界其他地区开展业务。
董事会执行成员主要衡量收入和毛利,以评估地理区域的业绩。运营成本以及非流动资产不再分配给地理区域。
2021、2020和2019年财政年度各地区的对外总收入和毛利如下:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 收入: | | | | | |
| 我们 | 193,419 | | | 202,684 | | | 182,294 | |
| 欧洲 | 4,933 | | | 8,232 | | | 5,648 | |
| 划 | 519 | | | 1,258 | | | 1,447 | |
| 总收入 | 198,871 | | | 212,174 | | | 189,389 | |
| 毛利: | | | | | |
| 我们 | 176,266 | | | 184,024 | | | 162,226 | |
| 欧洲 | 1,049 | | | 3,534 | | | 2,141 | |
| 划 | 414 | | | 1,077 | | | 1,094 | |
| 毛利总额 | 177,729 | | | 188,635 | | | 165,461 | |
4.收入
收入完全与货物的转让有关,并在货物交付给客户的时间点确认。2021年,RUCONEST®在美国市场的销售额为193.4百万美元(2020年:美元202.7百万美元)
在欧洲的收入为美元4.92021年为百万美元(2020年:美元8.2百万)。世界其他地区(不包括欧洲)的收入为美元0.5百万美元(起于美元1.32020年为100万人)。
两名美国客户约代表美元156.6百万(79占我们2021年净收入的1%)。在2020年和2019年,这两个美国客户约占美元161.7百万(76%)和美元146.6百万(77%)。这些客户是大型专业批发公司,专门在我们和我们竞争对手的疾病领域分销药品,并分销我们的产品。
5.其他收入
与赠款有关的其他收入,数额为#美元2.62021年为百万美元(2020年:美元1.8百万美元;2019年:美元0.5百万)。这笔赠款是荷兰和法国政府为该公司在这些国家实际开展的研究和开发活动提供的年度工资税补偿。
6.本质上的费用
销售成本
2021年、2020年和2019年的销售成本如下:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 销售成本 | (19,107) | | | (23,539) | | | (23,068) | |
| 陈旧库存减值 | (2,035) | | | — | | | (860) | |
| 总计 | (21,142) | | | (23,539) | | | (23,928) | |
2021年的销售成本为美元19.1百万美元(2020年:美元23.5百万美元),并与实际产品销售有关。
陈旧存货减值源于存货相对于较低的可变现净值的估值。与指定用于商业活动的库存有关的减值费用为#美元。2.0 million in 2021 (2020: $—).
研究和开发的成本
2021年、2020年和2019年的研发成本如下:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 员工成本 | (24,451) | | | (20,984) | | | (17,565) | |
| 摊销成本IFA | (132) | | | (774) | | | (62) | |
| 减值损失IFA | (4,992) | | | — | | | 820 | |
| 折旧PPE和使用权资产 | (3,152) | | | (2,062) | | | (1,986) | |
| 直接运营费用 | (33,190) | | | (12,804) | | | (10,832) | |
| 其他间接研究和开发成本 | (4,452) | | | (1,895) | | | (2,161) | |
| 研发总成本 | (70,369) | | | (38,519) | | | (31,786) | |
研发活动的运营费用为#美元。70.42021年为百万美元(2020年:美元38.5百万)。成本主要用于获得OTL-105的许可,准备和启动重组人C1INH治疗子痫前期和急性肾损伤的临床研究,Leniolisib的2/3期研究,用于治疗活化的肌醇磷脂3-激酶Delta综合征的投资,以及使用制药技术进行的新冠肺炎临床试验。2021年的费用包括OTL-105的费用(美元13.1百万美元)和减值损失为美元4.7与开发RUCONEST®相关的无形资产以更方便患者的形式提供了100万欧元(参见附注9)。
一般和行政活动的费用
2021年、2020年和2019年的一般和行政费用如下:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 员工成本 | (12,178) | | | (11,217) | | | (8,580) | |
| 摊销成本IFA | — | | | — | | | (6) | |
| 折旧PPE和使用权资产 | (857) | | | (1,144) | | | (1,095) | |
| 减值损失PPE | (5,447) | | | — | | | — | |
| 直接运营费用 | (8,419) | | | (9,546) | | | (8,934) | |
| 其他间接一般和行政费用 | (10,073) | | | (2,178) | | | (2,577) | |
| 一般费用和行政费用总额 | (36,974) | | | (24,085) | | | (21,192) | |
一般和行政活动的业务费用为#美元。37.02021年为百万美元(2020年:美元24.1百万)。其他间接的一般和行政成本包括与新浪纳斯达克最近在美上市相关的保险、合规和控制成本。物业、厂房和设备的减值损失为美元5.4百万美元涉及取消我们在俄亥俄州Pivot Park的下游产能(请参阅附注10)。
营销和销售活动的成本
2021年、2020年和2019年的营销和销售成本如下:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 员工成本 | (24,125) | | | (23,094) | | | (18,617) | |
| 摊销成本IFA | (4,098) | | | (3,238) | | | (3,164) | |
| 折旧PPE和使用权资产 | (930) | | | (865) | | | (310) | |
| 直接运营费用 | (28,543) | | | (23,362) | | | (19,587) | |
| 其他间接营销和销售成本 | (1,749) | | | (1,045) | | | (3,046) | |
| 营销和销售总成本 | (59,445) | | | (51,604) | | | (44,724) | |
营销和销售的运营费用为美元59.4 million in 2021 (2020: US$51.6百万)。
雇员福利
2021年、2020年和2019年的员工福利成本如下:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 薪金 | (44,202) | | | (36,811) | | | (29,540) | |
| 社会保障费用 | (5,318) | | | (4,302) | | | (3,769) | |
| 养老金成本 | (2,179) | | | (1,844) | | | (1,767) | |
| 基于股份的薪酬 | (9,055) | | | (8,405) | | | (4,985) | |
| 总计 | (60,754) | | | (51,362) | | | (40,061) | |
工资包括员工的假期津贴和现金奖金。
折旧及摊销费用
折旧和摊销费用包括在:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 财产、厂房和设备 | (2,158) | | | (2,044) | | | (1,763) | |
| 无形资产 | (4,232) | | | (4,008) | | | (3,232) | |
| | | | | |
| 总计 | (6,390) | | | (6,052) | | | (4,995) | |
| 使用权资产 | (2,781) | | | (2,027) | | | (1,628) | |
| 总计 | (2,781) | | | (2,027) | | | (1,628) | |
7.其他财务收支
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 利息收入 | 53 | | | 715 | | | 1,133 | |
| 外币业绩 | 14,841 | | | — | | | — | |
| 其他财务收入 | 14,894 | | | 715 | | | 1,133 | |
| | | | | |
| 贷款结算 | — | | | (4,313) | | | — | |
| 外币业绩 | — | | | (19,233) | | | (515) | |
| 利息贷款和借款 | (5,296) | | | (5,178) | | | (12,611) | |
| 利息租约 | (795) | | | (766) | | | (742) | |
| 或有对价 | — | | | (3,744) | | | (3,230) | |
| 其他财务费用 | (94) | | | (74) | | | — | |
| 其他财务费用 | (6,185) | | | (33,308) | | | (17,098) | |
| | | | | |
| 其他财务收入和支出合计 | 8,709 | | | (32,593) | | | (15,965) | |
贷款结算
2020年支付的和解费用和费用为#美元。4.3由于公司在2020年偿还了Orbimed Advisors的贷款,并完全取消了这笔贷款,因此产生了600万欧元的损失。在2021年,不是已经支付了和解费用。
外币业绩
这些结果主要是由于以外币(主要是美元)计价的银行余额重估,以及外币支付相对于实际汇率的时间。
与收取手续费或费用时适用的原始汇率相比。2021年的收益主要是由于我们荷兰实体的美元银行余额重估的结果,这些实体的职能货币是欧元。美元在2021年期间走强,而在2020年期间走弱。
利息贷款和借款
2021年、2020年和2019年的贷款和借款利息涉及根据《国际财务报告准则》按有效利率计算的可转换债券以及贷款和借款的摊销成本,其中考虑到认股权证或提前偿还选项等确认时的任何股权组成部分。2021年和2020年,与2020年1月发行的可转换债券相关的贷款和借款的摊余成本。2019年,贷款和借款的摊余成本主要与Orbimed Advisors的当前定期贷款有关。
或有对价
或有对价已在2021年第二季度全额偿还,因此没有2021年的费用.
8.所得税
普通活动所得税
下表详细说明了损益表中所得税的当期和递延纳税部分:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 所得税费用 | | | | | |
| 当期税额 | | | | | |
| 本年度利润的当期税额 | (97) | | | (2,705) | | | (4,835) | |
| 对前期本期税额的调整 | 96 | | | 1,497 | | | 271 | |
| 当期税费总额 | (1) | | | (1,208) | | | (4,564) | |
| | | | | |
| 递延所得税 | | | | | |
| 本年度利润递延税项 | (8,196) | | | (8,609) | | | (7,601) | |
| 对前期递延税金的调整 | 1,115 | | | 3,469 | | | 418 | |
| 递延税费总额 | (7,081) | | | (5,140) | | | (7,183) | |
| 所得税费用 | (7,082) | | | (6,348) | | | (11,747) | |
有效所得税率
辉瑞集团在其合并损益表中的有效税率与荷兰25%的法定税率不同。下表将法定所得税率与合并损益表中的实际所得税率进行核对:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 税费对账 | | | | | |
| 一般活动税前利润 | 23,078 | | | 44,094 | | | 52,304 | |
| | | | | |
| 一般活动的利润/(亏损)乘以 | | | | | |
| 荷兰的标准税率 | (5,770) | | | (11,023) | | | (13,076) | |
| | | | | |
| 以下因素的影响: | | | | | |
| 其他司法管辖区的税率 | 307 | | | 266 | | | 10 | |
| 免税收入(费用) | (2,853) | | | 293 | | | (704) | |
| 对前期的调整 | 655 | | | 2,122 | | | 418 | |
| 法定适用税率的变动 | 555 | | | 2,844 | | | 3,224 | |
| 其他 | 24 | | | (850) | | | (1,619) | |
| 本年度所得税支出 | (7,082) | | | (6,348) | | | (11,747) | |
影响当前和未来税费的因素
2021年名义税和实际税之间的主要差异可以由以下因素解释:非应税支出的影响、荷兰法定税率未来上调的影响、美国国家税收以及在税率与荷兰法定税率不同的司法管辖区产生和征税的应税收入的影响。
2018年底,该公司进入了一项税收损失恢复计划,将其自己的Pompe&Fabry计划的一小部分权利出售给财务集团以外的一家子公司,以换取该子公司的服务,该子公司将为这些计划中的蛋白质替代药物生产原始材料。这笔交易产生了一笔合理的应税利润,2018年所得税计算中使用了最古老的净营业亏损。这些权利产生了一种无形资产,将在这些计划的有效期内折旧,从而使未来的应税利润减少大致相同的数额。
尽管损失刷新交易的税务处理可能会被税务机关接受,但由于荷兰税务机关尚未做出最终决定,这仍被认为是IFRIC 23“所得税处理的不确定性”意义下的不确定税务处理。
递延税金
因此,递延税项净资产/(负债)余额如下:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 递延税项资产总额 | 27,025 | | | 33,735 | |
| 递延税项负债总额 | (5,809) | | | (1,858) | |
| 递延税项净资产总额 | 21,216 | | | 31,877 | |
由于有法律上可强制执行的权利将当期税项资产与当期税项负债相抵销,以及递延税项所得税涉及同一税务管辖区,因此递延税项资产及负债予以抵销。
截至2021年12月31日和2020年12月31日,递延所得税资产的重要组成部分和年度变动如下:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 无形固定资产 | 10,493 | | | 17,705 | |
| 应计项目 | 2,289 | | | 5,123 | |
| 其他 | 6,467 | | | 5,135 | |
| 税损 | 7,776 | | | 5,772 | |
| 递延税项资产总额 | 27,025 | | | 33,735 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 无形固定资产 | | 其他金融资产 | | 应计项目 | | 其他 | | 税损 | | 总计 |
| 2019年1月1日 | 14,033 | | | 9,180 | | | 3,608 | | | 1,236 | | | 6,632 | | | 34,689 | |
| (收费)/记入贷方 | | | | | | | | | | | |
| -至盈利或亏损 | 2,174 | | | (9,353) | | | 1,354 | | | 1,164 | | | (1,387) | | | (6,048) | |
| -累计赤字 | — | | | — | | | — | | | 2,361 | | | — | | | 2,361 | |
| -货币换算 | 1,498 | | | 173 | | | 161 | | | 374 | | | 527 | | | 2,733 | |
| 2020年12月31日 | 17,705 | | | — | | | 5,123 | | | 5,135 | | | 5,772 | | | 33,735 | |
| (收费)/记入贷方 | | | | | | | | | | | |
| -至盈利或亏损 | (6,121) | | | — | | | (2,834) | | | 3,519 | | | 2,515 | | | (2,921) | |
| -其他运动 | — | | | — | | | — | | | (598) | | | — | | | (598) | |
| -累计赤字 | — | | | — | | | — | | | (1,366) | | | — | | | (1,366) | |
| -货币换算 | (1,091) | | | — | | | — | | | (223) | | | (511) | | | (1,825) | |
| 2021年12月31日 | 10,493 | | | — | | | 2,289 | | | 6,467 | | | 7,776 | | | 27,025 | |
根据本公司最新的2022年预算及其对其后三年的长期预测,认为未来更有可能有足够的应税利润来实现递延税项资产,因此这些资产应继续在这些财务报表中确认。
与无形固定资产有关的递延税项指于2018年底在本集团内部转移的研究及开发无形资产的税基与账面金额之间的暂时性差额的税务影响。与无形固定资产有关的递延税金的减少是由于对Fabry计划权利的减值。与庞贝计划权利有关的递延税款将通过在财政统一范围内一旦使用的无形资产摊销来实现。
应计项目是指就应计负债的账面金额和税基之间的临时差异确认的递延税项资产。
未使用的税收损失是由荷兰财政团结和Pharming Healthcare产生的。
递延税项资产的计算如下:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 净营业亏损-荷兰 | | | |
| 年终净营业亏损 | 25,364 | | | 23,088 | |
| 为递延税项资产选择的部分 | 25,364 | | | 23,088 | |
| | | |
| 使用的税率: | | | |
| 2021 : 25% (25%) | — | | | 5,772 | |
| 2022 and later: 25% (21,7%) | 6,545 | | | — | |
| 总税收影响荷兰 | 6,545 | | | 5,772 | |
| | | |
| 净营业亏损-法国 | | | |
| 年终净营业亏损 | 4,356 | | | — | |
| 为递延税项资产选择的部分 | 4,356 | | | — | |
| | | |
| 使用的税率: | | | |
| 2020年及以后:31% | 1,231 | | | — | |
| 总税负影响法国 | 1,231 | | | — | |
| | | |
| 税收影响荷兰--递延亏损 | 6,545 | | | 5,772 | |
| 税收效应法国-递延亏损 | 1,231 | | | — | |
| 递延税项资产总额 | 7,776 | | | 5,772 | |
递延税项净资产的当期部分为美元2.4百万美元(2020年:美元10.9百万)。
截至2021年12月31日和2020年12月31日的递延所得税负债构成和年度变动如下:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 有形固定资产 | (4,149) | | | (1,648) | |
| 其他负债 | (1,660) | | | (210) | |
| 递延税项负债总额 | (5,809) | | | (1,858) | |
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 有形固定资产 | | 其他负债 | | 总计 |
| 2020年1月1日 | (1,273) | | | (1,355) | | | (2,628) | |
| (收费)/记入贷方 | | | | | |
| -至盈利或亏损 | (263) | | | 1,169 | | | 906 | |
| -至其他全面收入 | | | | | |
| -货币换算 | (112) | | | (24) | | | (136) | |
| 2020年12月31日 | (1,648) | | | (210) | | | (1,858) | |
| (收费)/记入贷方 | | | | | |
| -至盈利或亏损 | (2,710) | | | (1,450) | | | (4,160) | |
| -至其他全面收入 | | | — | | | — | |
| -货币换算 | 209 | | | — | | | 209 | |
| 2021年12月31日 | (4,149) | | | (1,660) | | | (5,809) | |
9.无形资产
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 转基因技术 | | 用于HAE的RUCONEST®(欧盟) | | 开发成本 | | 重新获得
权利和许可证 | | 诺华许可证 | | 软件 | | 总计 |
| 按成本计算 | 2,973 | | | 592 | | | 6,948 | | | 62,641 | | | 20,972 | | | 548 | | | 94,674 | |
| 累计: | | | | | | | | | | | | | |
| 摊销费用 | (2,934) | | | (543) | | | — | | | (9,590) | | | — | | | (43) | | | (13,110) | |
| 减值费用 | (39) | | | — | | | (2,122) | | | — | | | — | | | — | | | (2,161) | |
| 2020年1月1日的账面价值 | — | | | 49 | | | 4,826 | | | 53,051 | | | 20,972 | | | 505 | | | 79,403 | |
| | | | | | | | | | | | | |
| 摊销费用 | — | | | (50) | | | — | | | (3,905) | | | — | | | (53) | | | (4,008) | |
| 减值费用 | — | | | — | | | — | | | — | | | — | | | — | | | — | |
| 资本化开发成本 | — | | | — | | | 159 | | | — | | | — | | | — | | | 159 | |
| 收购的资产 | — | | | — | | | — | | | 8,570 | | | 1,583 | | | 333 | | | 10,486 | |
| 货币换算-成本 | 283 | | | 56 | | | 672 | | | 6,595 | | | 2,112 | | | 77 | | | 9,795 | |
| 货币换算-摊销 | (279) | | | (55) | | | — | | | (1,204) | | | — | | | (8) | | | (1,546) | |
| 货币换算--减值 | (4) | | | — | | | (202) | | | — | | | — | | | — | | | (206) | |
| 货币换算 | — | | | 1 | | | 470 | | | 5,391 | | | 2,112 | | | 69 | | | 8,043 | |
| 运动2020 | — | | | (49) | | | 629 | | | 10,056 | | | 3,695 | | | 349 | | | 14,680 | |
| | | | | | | | | | | | | |
| 按成本计算 | 3,256 | | | 648 | | | 7,779 | | | 77,806 | | | 24,667 | | | 958 | | | 115,114 | |
| 累计: | | | | | | | | | | | | | |
| 摊销费用 | (3,213) | | | (648) | | | — | | | (14,699) | | | — | | | (104) | | | (18,664) | |
| 减值费用 | (43) | | | — | | | (2,324) | | | — | | | — | | | — | | | (2,367) | |
| 2020年12月31日的账面价值 | — | | | — | | | 5,455 | | | 63,107 | | | 24,667 | | | 854 | | | 94,083 | |
| | | | | | | | | | | | | |
| 摊销费用 | — | | | — | | | — | | | (4,054) | | | — | | | (178) | | | (4,232) | |
| 减值费用 | — | | | — | | | (4,991) | | | — | | | — | | | — | | | (4,991) | |
| 资本化开发成本 | — | | | — | | | — | | | — | | | — | | | — | | | — | |
| 收购的资产 | — | | | — | | | — | | | — | | | 2,530 | | | 3,447 | | | 5,977 | |
| 从PPE转账-成本 | — | | | — | | | — | | | — | | | — | | | 175 | | | 175 | |
| 从PPE转移-累计摊销 | — | | | — | | | — | | | — | | | — | | | (78) | | | (78) | |
| 撤资--成本 | (3,145) | | | — | | | — | | | — | | | — | | | (99) | | | (3,244) | |
| 撤资-累计摊销 | 3,105 | | | — | | | — | | | — | | | — | | | 99 | | | 3,204 | |
| 撤资-减值费用 | 40 | | | — | | | — | | | — | | | — | | | — | | | 40 | |
| 货币换算-成本 | (111) | | | (50) | | | (599) | | | (5,995) | | | (2,012) | | | (226) | | | (8,993) | |
| 货币换算-摊销 | 108 | | | 50 | | | — | | | 1,312 | | | — | | | 19 | | | 1,489 | |
| 货币换算--减值 | 3 | | | — | | | 401 | | | — | | | — | | | — | | | 404 | |
| 运动2021 | — | | | — | | | (5,189) | | | (8,737) | | | 518 | | | 3,159 | | | (10,249) | |
| | | | | | | | | | | | | |
| 按成本计算 | — | | | 598 | | | 7,180 | | | 71,811 | | | 25,185 | | | 4,255 | | | 109,029 | |
| 累计: | | | | | | | | | | | | | |
| 摊销费用 | — | | | (598) | | | — | | | (17,441) | | | — | | | (242) | | | (18,281) | |
| 减值费用 | — | | | — | | | (6,914) | | | — | | | — | | | — | | | (6,914) | |
| 2021年12月31日的账面价值 | — | | | — | | | 266 | | | 54,370 | | | 25,185 | | | 4,013 | | | 83,834 | |
转基因技术
转基因技术涉及根据Pharming的生产平台在转基因哺乳动物的乳汁中表达人类蛋白质的历史上获得的专利和许可证。这项技术
能够以经济高效的方式开发复杂的治疗性蛋白质。截至2021年底和2020年底,这些专利和许可已全部摊销。在2021年期间,这些资产被处置。
用于HAE的RUCONEST®(欧盟)
2021年,该公司已将与欧盟HAE的RUCONEST®相关的开发成本资本化。该产品于二零一零年推出市场后,该资产开始摊销,此后再无任何有关该项目的进一步开发成本资本化。这些开发成本将在2021年底和2020年全额摊销。
开发成本
2014年,公司收购了转基因兔模型Sasu的资产,总金额为美元0.5百万美元,被确认为与开发成本有关的无形资产二新产品先导:Pompe病的α-葡萄糖苷酶和Fabry病的α-半乳糖苷酶。由于对公司流水线资产的投资进行了重新排序,董事会决定完全减值与治疗法布里病的α-半乳糖苷酶有关的资产,导致减值费用为#美元。0.3百万美元。
2018年,公司开始对目前的产品RUCONEST®进行修改,以使患者的给药形式更加方便。预计这将导致现有产品的更好变种。总金额为美元4.5截至2019年12月31日,新变体优先版本的100万美元已确认为内部产生的无形资产。2020年,该公司产生了美元0.2百万开发成本,而在2021年不是由于重新确定了投资于公司流水线资产的努力的优先顺序,因此产生了成本。该资产的成本在2021年已经完全减值,因为变种的开发计划已经休眠,导致减值费用为#美元4.7百万美元。
重新获得的权利和许可证
重新收购的权利涉及于2016年从博世健康(前Valeant PharmPharmticals)收购所有北美商业化权利,以及于2020年从瑞典孤儿国际AB(“Sobi”)收购所有欧洲商业化和经销权。
诺华许可证
2019年8月,Pharming与诺华公司签订了开发合作和许可协议,开发和商业化Leniolisib,这是一种由诺华公司正在开发的小分子磷脂酰肌醇3-激酶三角洲(P13Kδ)抑制剂,用于治疗激活的磷脂酰肌醇3-激酶三角洲综合征(APDS)患者。2021年,公司支付了美元2.5100万美元给诺华公司进行进一步开发。
软件
购置的与软件有关的资产主要用于实施我们新的企业资源规划系统SAP S/4HANA。董事会根据《国际会计准则第38号》和《国际财务报告准则》的解释对确认标准进行了评估,并得出结论,新的企业资源规划系统确实符合这些标准,将SAP S/4HANA确认为无形资产。
尚未使用的无形资产
尚未使用的无形资产每年进行测试,如果有迹象表明特定资产可能减值,则更频繁地进行测试。公允价值乃根据管理层批准的财务计划,按预期来自该等资产的收入的贴现现金流预测厘定。计算期间包括从年初到相关专利期满的期间。
10.财产、厂房和设备
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | | 土地和土地改良 | | 运营设施 | | 租赁权改进 | | 制造设备 | | 其他 | | 在建资产 | | 总计 |
| 按成本计算 | | 30 | | | 5,795 | | | 2,223 | | | 5,903 | | | 7,530 | | | 342 | | | 21,823 | |
| 累计折旧 | | — | | | (2,487) | | | (2,211) | | | (4,027) | | | (3,507) | | | — | | | (12,232) | |
| 2020年1月1日的账面价值 | | 30 | | | 3,308 | | | 12 | | | 1,876 | | | 4,023 | | | 342 | | | 9,591 | |
| 投资 | | — | | | 117 | | | 40 | | | 119 | | | 1,522 | | | 2,859 | | | 4,657 | |
| 内部转移-成本 | | — | | | (225) | | | 465 | | | — | | | 267 | | | (507) | | | — | |
| 内部转移-累计折旧 | | — | | | — | | | — | | | — | | | — | | | — | | | — | |
| 撤资 | | — | | | (56) | | | (465) | | | — | | | (439) | | | — | | | (960) | |
| 折旧费 | | — | | | (340) | | | (237) | | | (898) | | | (1,445) | | | — | | | (2,920) | |
| 撤资折旧 | | — | | | 55 | | | 465 | | | — | | | 425 | | | — | | | 945 | |
| 货币换算-成本 | | 3 | | | 539 | | | 213 | | | 569 | | | 722 | | | 178 | | | 2,224 | |
| 货币换算-累计折旧 | | — | | | (258) | | | (193) | | | (450) | | | (410) | | | — | | | (1,311) | |
| 运动2020 | | 3 | | | (168) | | | 288 | | | (660) | | | 642 | | | 2,530 | | | 2,635 | |
| 按成本计算 | | 33 | | | 6,170 | | | 2,476 | | | 6,591 | | | 9,602 | | | 2,872 | | | 27,744 | |
| 累计折旧 | | — | | | (3,030) | | | (2,176) | | | (5,375) | | | (4,937) | | | — | | | (15,518) | |
| 2020年12月31日的账面价值 | | 33 | | | 3,140 | | | 300 | | | 1,216 | | | 4,665 | | | 2,872 | | | 12,226 | |
| 投资 | | — | | | 27 | | | 457 | | | 1,206 | | | 952 | | | 8,097 | | | 10,739 | |
| 内部转移-成本 | | — | | | (544) | | | 3,097 | | | 7,977 | | | (5,743) | | | (4,787) | | | — | |
| 内部转移-累计折旧 | | — | | | 408 | | | 61 | | | (3,871) | | | 3,402 | | | — | | | — | |
| 转移到软件-成本 | | — | | | — | | | — | | | — | | | (175) | | | — | | | (175) | |
| 转移至软件-累计折旧 | | — | | | — | | | — | | | — | | | 78 | | | — | | | 78 | |
| 撤资 | | — | | | (2) | | | — | | | (20) | | | (131) | | | (5,447) | | | (5,600) | |
| 折旧费 | | — | | | (455) | | | (86) | | | (2,004) | | | (680) | | | — | | | (3,225) | |
| 撤资折旧 | | — | | | 2 | | | — | | | 4 | | | 54 | | | — | | | 60 | |
| 货币换算-成本 | | (2) | | | (451) | | | (324) | | | (914) | | | (347) | | | (112) | | | (2,150) | |
| 货币换算-累计折旧 | | — | | | 236 | | | 166 | | | 674 | | | 193 | | | — | | | 1,269 | |
| 运动2021 | | (2) | | | (779) | | | 3,371 | | | 3,052 | | | (2,397) | | | (2,249) | | | 996 | |
| 按成本计算 | | 31 | | | 5,200 | | | 5,706 | | | 14,840 | | | 4,158 | | | 623 | | | 30,558 | |
| 累计折旧 | | — | | | (2,839) | | | (2,035) | | | (10,572) | | | (1,890) | | | — | | | (17,336) | |
| 2021年12月31日的账面价值 | | 31 | | | 2,361 | | | 3,671 | | | 4,268 | | | 2,268 | | | 623 | | | 13,222 | |
2021年,该公司的资本支出为美元10.7百万美元(2020年:美元4.7百万美元),主要涉及新的生产设施和机械设备。由于我们与长期制造合作伙伴赛诺菲公司重新建立了战略制造合作伙伴关系,并经过仔细考虑,特别是最近大幅增加的装修成本,公司决定完成新大楼的建设,但不再在俄亥俄州的Pivot Park实现自己的下游产能。Pharing将继续将在建的建筑用于其他用途。这一决定导致在建资产资本化装修成本减值#美元。5.4百万美元。其中,总金额为美元4.4100万是2021年投资的一部分。
制造设备折旧费用为美元1.12021年为百万美元(2020年:美元0.9百万美元)已计入存货价值,金额为#美元2.12021年折旧费用总额中的100万已计入损益表(2020年:美元2.1百万)。
2021年期间,本公司评估了“其他个人防护装备”类别的资产,并得出结论,对于某些资产,账面价值为#美元。2.3万元,更符合制造设备、运营设施或租赁改进的特点。这些资产已被重新分类为相应的类别。
11.使用权资产
本附注提供本集团为承租人的租约的资料。
i.在资产负债表中确认的金额
资产负债表显示与租赁有关的下列数额:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 建筑物 | | 汽车 | | 总计 |
| 按成本价计账面值 | 7,363 | | | 971 | | | 8,334 | |
| 累计折旧时的账面价值 | (1,262) | | | (368) | | | (1,630) | |
| 2020年1月1日的账面价值 | 6,101 | | | 603 | | | 6,704 | |
| 投资 | 3,726 | | | 1,440 | | | 5,166 | |
| 撤资 | (639) | | | (270) | | | (909) | |
| 对转租的投资 | (415) | | | — | | | (415) | |
| 折旧费 | (1,681) | | | (346) | | | (2,027) | |
| 撤资折旧 | 80 | | | 131 | | | 211 | |
| 货币换算-成本 | 839 | | | 149 | | | 988 | |
| 货币换算-累计折旧 | (240) | | | (51) | | | (291) | |
| 运动2020 | 1,670 | | | 1,053 | | | 2,723 | |
| 按成本计算 | 10,874 | | | 2,290 | | | 13,164 | |
| 累计折旧 | (3,103) | | | (634) | | | (3,737) | |
| 2020年12月31日的账面价值 | 7,771 | | | 1,656 | | | 9,427 | |
| 投资 | 13,802 | | | 401 | | | 14,203 | |
| 撤资 | (51) | | | (165) | | | (216) | |
| 投资于转租 | — | | | — | | | — | |
| 折旧费 | (2,112) | | | (669) | | | (2,781) | |
| 撤资折旧 | 30 | | | 81 | | | 111 | |
| 其他搬家费用 | (478) | | | (79) | | | (557) | |
| 其他变动--累计折旧 | 644 | | | 57 | | | 701 | |
| 货币换算-成本 | (1,148) | | | (67) | | | (1,215) | |
| 货币换算-累计折旧 | 245 | | | 25 | | | 270 | |
| 运动2021 | 10,932 | | | (416) | | | 10,516 | |
| 按成本计算 | 22,999 | | | 2,380 | | | 25,379 | |
| 累计折旧 | (4,296) | | | (1,140) | | | (5,436) | |
| 2021年12月31日的账面价值 | 18,703 | | | 1,240 | | | 19,943 | |
2021年对建筑物的投资主要涉及我们在荷兰运营设施的新租赁合同。
本公司申请豁免披露短期租约和低价值租约。综合损益表中记录的金额对财务报表无关紧要。
二、在损益表中确认的数额
损益表显示与租赁有关的下列数额:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 使用权资产折旧权 | | | |
| 建筑物 | (2,112) | | | (1,681) | |
| 汽车 | (669) | | | (346) | |
| 使用权资产折旧合计 | (2,781) | | | (2,027) | |
| 利息支出 | (795) | | | (766) | |
| 总费用使用权资产 | (3,576) | | | (2,793) | |
三、租赁费
2021年,本公司收取美元3.6百万美元(2020年:美元2.8在办公室租金、设备、设施和租赁汽车的租赁承付款方面的收入报表。
截至2021年12月31日的不可撤销租约的剩余期限为一和十五年并一般包括一项条款,使租金可按当时的市场情况按年向上调整。
报告年度结束后的预期租赁费用已在下文附注27中披露。租赁费在费用或一般及行政费用中的分配是根据所用资产的性质而定的。
12.使用权益法核算投资
由于对BioConnection BV(BioConnection)的投资为本公司提供了对BioConnection的重大影响,于2021年12月31日,该公司一直被视为本集团的联营公司。BioConnection的股本完全由普通股组成,由一小部分股东直接持有。所有权权益比例与持有投票权比例相同。
2019年4月7日,Pharming Group通过其100%的子公司Pharming Technologies B.V.收购了43.85通过转换美元持有BioConnection B.V.的%股权2.9现有信贷(“预付款”)的百万美元和美元2.8百万美元现金支付,总额为美元5.7百万美元。
| | | | | | | | | | | | | | | | | | | | |
| 实体名称 | 营业地点 | 所有权权益的% | 关系的性质 | 测量方法 |
| 2021 | 2020 | 2019 |
| BioConnection B.V. | OSS,NL | 43.85% | 43.85% | 43.85% | 联想 | 权益 |
| | | | | | | | | | | | | | | | | | | | |
US$ '000
实体名称 | | 账面金额 |
| 2021 | | 2020 | | 2019 |
| BioConnection B.V. | | | | | | |
| | | | | | |
| 1月1日的余额 | | 7,118 | | | 6,177 | | | — | |
| | | | | | |
| 年内的变动情况 | | | | | | |
| 初始识别 | | — | | | — | | | 5,690 | |
| 净利润中的份额 | | 694 | | | 361 | | | 257 | |
| 财务担保的确认 | | — | | | — | | | 247 | |
| 财务担保摊销 | | (33) | | | (32) | | | (22) | |
| 货币换算 | | (578) | | | 612 | | | 5 | |
| | | | | | |
| 12月31日的结余 | | 7,201 | | | 7,118 | | | 6,177 | |
13.通过其他全面收益投资于按公允价值指定的权益工具
本集团持有1.0全球基因治疗领先者Orchard Treeutics普通股的百分比。这些股份是于2021年7月1日收购的,作为Pharming Group NV和Orchard Treeutics研究、开发、制造OTL-105并将其商业化的战略合作的一部分,OTL-105是一种新披露的用于治疗遗传性血管水肿(HAE)的体外自体造血干细胞(HSC)基因疗法,HAE是一种危及生命的罕见疾病,会导致面部、喉咙、四肢和腹部反复肿胀发作。
作为协议的一部分,Orchard收到了一笔预付款美元17.5百万美元,包括美元10.0百万美元现金和一美元7.5来自Pharming的百万股权投资,溢价高于Orchard的公允价值股价。
Orchard也有资格获得最高美元189.5在开发、法规和销售里程碑以及未来全球销售的中位数至低两位数的版税支付方面,该公司获得了100万美元的收入。
收购时股份的公平价值为美元。4.6百万美元。预付现金金额为美元10.0百万美元,股价溢价为美元2.92021年,作为研发费用支出了100万美元。请参阅附注7。该项投资于2021年12月31日的公允价值为美元。1.4百万美元。
管理层不认为本集团能够对Orchard Treeutics施加重大影响99.030%的普通股资本在纳斯达克证券交易所(纳斯达克股票代码:ORTX)公开交易。
| | | | | | | | | | | | | | | | | | | | |
| 实体名称 | 营业地点 | 所有权权益的% | 关系的性质 | 测量方法 |
| 2021 | 2020 | 2019 |
| 果园治疗公司。 | 英国伦敦 | 1.00% | —% | —% | 投资 | 公允价值 |
| | | | | | | | | | | | | | | | | | | | |
US$ '000
实体名称 | | 账面金额 |
| 2021 | | 2020 | | 2019 |
| 果园治疗公司。 | | | | | | |
| | | | | | |
| 1月1日的余额 | | — | | | — | | | — | |
| | | | | | |
| 年内的变动情况 | | | | | | |
| 初始识别 | | 4,589 | | | — | | | — | |
| 净利润中的份额 | | — | | | — | | | — | |
| 通过保监处进行公允价值调整 | | (3,077) | | | | | |
| 财务担保摊销 | | — | | | — | | | — | |
| 货币换算 | | (63) | | | — | | | — | |
| | | | | | |
| 12月31日的结余 | | 1,449 | | | — | | | — | |
14.受限现金、现金和现金等价物
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 受限现金(非流动现金) | 812 | | | 510 | |
| 受限现金(活期) | 227 | | | 995 | |
| 现金和现金等价物 | 191,924 | | | 205,159 | |
| 受限现金、现金和现金等价物合计 | 192,963 | | | 206,664 | |
现金和现金等价物包括现金和短期、高流动性的投资,这些投资可以很容易地转换为已知数量的现金,并受价值变化的微小风险的影响,但有限制的现金除外,金额为美元。1.02021年为百万美元(2020年:美元1.5百万)。限制性现金包括银行对第三方(潜在)承诺出具的担保的价值,这被认为是短期性质的。此外,受限现金包括被认为是长期租金的押金。
因此,尽管暂时受到限制,但公司可以在必要时获得这笔现金的当前部分。就现金流量表而言,所有限制性现金均不视为“现金及现金等价物”。
15.库存
库存包括批次RUCONEST®、正在进行的工作和可用于生产RUCONEST®的脱脂牛奶。
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 成品 | 13,560 | | | 12,742 | |
| 正在进行的工作 | 9,606 | | | 5,668 | |
| 原料 | 4,144 | | | 2,747 | |
| 12月31日的结余 | 27,310 | | | 21,157 | |
对可变现净值的调整变动:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 1月1日的余额 | (646) | | | (931) | |
| 除减值外 | (2,342) | | | (1,450) | |
| 减值的解除 | 20 | | | 1,192 | |
| 减值的使用 | 407 | | | 606 | |
| 货币换算 | 113 | | | (63) | |
| 12月31日的结余 | (2,448) | | | (646) | |
2021年12月31日的存货估值为美元27.3百万美元是减值后的净额2.4百万美元(2020年:美元0.6百万)。减值与将存货减记至其可变现净值有关。
库存可用于商业、临床前和临床活动。已经对产品的最终使用或销售做出了估计,考虑到了当前和预期的销售以及临床前和临床计划。这些估计反映在减值的增加中。减值的释放涉及对估计的修订,这是因为实际销售额可能与预测的销售额不同,以及分配给临床前和临床计划的瓶子可以退回库存。临床前和临床项目中使用的小瓶的成本列在研究和开发成本项下。
2021年包括在销售成本中的库存成本为#美元19.1百万美元(2020年:美元23.5百万美元;2019年:美元24.0百万美元。截至2021年12月31日的主要库存部分的到期日从2023年以后开始,预计都将在到期前出售和/或使用。
16.贸易和其他应收款
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 贸易应收账款 | 18,076 | | | 23,514 | |
| 预付费用 | 2,392 | | | 4,017 | |
| 增值税 | 2,486 | | | 1,625 | |
| 其他应收账款 | 2,363 | | | 2,305 | |
| 税收和社会保障 | 4,666 | | | 4,440 | |
| 12月31日的结余 | 29,983 | | | 35,901 | |
应收贸易账款是客户在正常业务过程中销售的货物的应收款项。它们一般应在30-60天内结清,因此都被归类为当前的。公司的未偿还应收账款主要与在美国的销售有关。应收贸易账款的减少与客户在年底前后付款的时间安排有关。
该公司没有确认任何预期的信贷损失。Pharing以等同于终身ECL的金额计量应收贸易账款的损失准备金。应收贸易账款的预期信贷损失是通过参考债务人过去的违约经验和对债务人当前财务状况的分析而使用拨备矩阵估计的,并根据债务人特有的因素、债务人的一般经济状况和
债务人所处的行业,以及在报告日期对当前情况和预测情况的评估。Pharing拥有长期合作关系的客户数量有限,没有短缺的历史。因此,没有确认预期信贷损失的损失准备金。
由于本期应收账款的短期性质,其账面值被视为与其公允价值相同。
17.可转换债券
可转换债券的确认和变动情况如下:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 1月1日的余额 | 151,767 | | | — | |
| 账面价值初始确认 | — | | | 138,571 | |
| 已支付利息(现金流) | (4,448) | | | (2,142) | |
| 摊销交易成本 | 849 | | | 743 | |
| 应计利息 | 4,447 | | | 4,040 | |
| 货币换算 | (11,729) | | | 10,555 | |
| 12月31日的结余 | 140,886 | | | 151,767 | |
| -当前部分 | 1,879 | | | 2,040 | |
| -非当前部分 | 139,007 | | | 149,727 | |
2020年1月21日,公司发行欧元125本金总额为百万美元3.002025年到期的可转换债券的百分比。债券按面值发行,计息利率为3.00年息%,每半年支付一次,等额分期付款。除非之前转换、赎回或购买并注销,否则债券将于2025年1月21日到期。
债券可转换为公司普通股,初始转换价格为欧元2.00。这一初始转换价格受惯例调整条款的约束。这些债券最初的普通股数量为62,412,622。任何导致换股股份数目增加的换股价格调整,可能需要本公司获得本公司股东的进一步授权,以发行股份、授予认购股份的权利及不包括优先购买权。本公司有权在任何时候以现金加应计利息赎回全部但不是部分未偿还债券,(A)如果在2023年2月13日或之后,至少20在一段时间内的交易日30连续交易日应超过130本金的%,或(B)在任何时候,85原发行的债券本金总额的%或以上应已被转换和/或回购和注销。
可转换债券由两部分组成。第一个组成部分是金融负债,它代表我们的合同义务,即交付现金或其他金融资产以支付利息和本金,如果不转换的话。第二部分是股本工具,因为它代表一项书面认购期权,授予持有人在指定期间将其转换为固定数量的本公司普通股的权利。
关于负债组成部分的代价的公允价值按没有任何相关股权转换选择权的类似负债的公允价值计量(IFRS 9第5.1.1段)。这是负债组成部分在初始确认时的账面金额。
权益部分将按没有任何相关权益转换选择权的类似负债的面值和公允价值之间的剩余差额计量(国际会计准则第32段)。初始确认时入账的原始权益部分为美元。1.6百万美元。
18.贷款和借款
Orbimed贷款的变动情况如下:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 1月1日的账面价值 | — | | | 51,125 | |
| 摊销成本(财务收入和支出) | — | | | 513 | |
| 已支付利息(现金流) | — | | | (395) | |
| 还款 | — | | | (52,720) | |
| 重估贷款 | — | | | 511 | |
| 货币换算 | — | | | 966 | |
| 12月31日的账面价值 | — | | | — | |
| -当前部分 | — | | | — | |
| -非当前部分 | — | | | — | |
于2017年,本公司与Orbimed Royalty Opportunities II,LP订立债务安排,以筹集美元100.0百万美元。
根据这项债务安排的条款和条件,贷款人提供了一笔美元。100.0百万美元获得优先债务融资48月有息本票,金额为(I)适用保证金11%加(Ii)(X)中较大者一个月期Libor和(Y)1.00%。这笔贷款已于2018年9月开始按季度偿还。本公司有权在贷款到期日之前预付贷款。作为对贷款的进一步考虑,贷款人收到了一份4认股权证覆盖率(9,174,372权证),执行价为美元0.46代表Pharming股票在紧接收盘日之前的收盘价,加上一个2.5本金的%承诺费和到期日的转让费美元3.7百万美元。
2020年1月,本公司偿还并完全取消了Orbimed的贷款。2021年期间没有达成任何新的贷款和借款协议。
19.租契
租赁负债可以规定如下:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 1月1日的余额 | 10,192 | | | 7,075 | |
| 新租约 | 14,118 | | | 3,780 | |
| 应计利息支出 | 680 | | | 766 | |
| 支付租赁负债 | (3,217) | | | (2,270) | |
| 其他动作 | 94 | | | — | |
| 货币换算 | (992) | | | 841 | |
| 12月31日的结余 | 20,875 | | | 10,192 | |
| -当前部分 | 2,419 | | | 1,962 | |
| -非当前部分 | 18,456 | | | 8,230 | |
2021年的新租赁主要涉及我们在荷兰运营设施的新租赁合同。
截至2021年12月31日和2020年12月31日的未来最低租赁付款如下:
| | | | | | | | | | | | | | | | | | | | | | | |
| 2021 | | 2020 |
| 金额,以美元为单位‘000 | 最低还款额 | | 付款现值 | | 最低还款额 | | 付款现值 |
| 一年内 | 3,118 | | 3,068 | | 2,590 | | 1,962 |
| 一年后但不超过五年 | 10,255 | | 9,392 | | 7,163 | | 5,763 |
| 五年多 | 10,123 | | 8,415 | | 3,211 | | 2,467 |
| 12月31日的结余 | 23,496 | | 20,875 | | 12,964 | | 10,192 |
20.贸易和其他应付款
截至2021年12月31日和2020年12月31日的贸易和其他应付款如下:
| | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 应付帐款 | 7,599 | | | 13,471 | |
| 税收和社会保障 | 1,505 | | | 616 | |
| 其他应付款 | 34 | | | 176 | |
| 雇员的应计项目 | 8,850 | | | 8,113 | |
| 回扣和折扣的应计项目 | 11,111 | | | 14,930 | |
| 生产应计项目 | 5,760 | | | 4,117 | |
| 其他应计项目 | 7,614 | | | 6,243 | |
| 12月31日的结余 | 42,473 | | | 47,666 | |
21.基于股份的薪酬
董事会的薪酬政策于2020年12月11日获本公司股东采纳,并规管执行董事及非执行董事的薪酬(下称“薪酬政策”)。根据荷兰法律,该政策必须每四年提交给我们的股东通过。
该政策指的是执行董事和非执行董事的数量不详。自2021年5月19日起,董事会由以下人员组成一执行董事(即首席执行官)和七非执行董事。如日后委任额外的执行董事,本政策亦适用于该等额外董事(如有)的薪酬福利,以符合其条款。因此,以下对董事高管的任何单数提及也包括复数,反之亦然,受政策中更具限制性的偏离以及对首席执行官的具体提及除外。
个别董事的薪酬福利由董事会厘定,不包括董事执行董事参与有关其本身薪酬的商议及决策,每次均在薪酬政策规定的限制范围内。
尽管已采纳政策,每次以股份或认购股份的权利作出的安排仍须经股东于股东大会上批准。2020年12月11日,股东批准了相应提交的关于董事高管新的长期激励计划的建议,以及实施该新计划的一次性过渡安排。我们的股东还授权董事会为期18个月,作为根据新的长期激励计划和一次性过渡安排分别授权向董事执行董事授予和发行普通股的公司机构,并排除现有股东与该等发行相关的任何优先购买权。
2021年确认的基于股份的支付计划的总费用为#美元9.1百万美元(2020年:美元8.4百万美元),2019年确认的基于股份的支付计划的总费用为美元5.0百万美元。
2021年、2020年和2019年股份支付计划的总费用具体如下:
| | | | | | | | | | | | | | | | | |
| 基于股份的薪酬 | 2021 | | 2020 | | 2019 |
| 管理委员会选项 | — | | | 86 | | | 625 | |
| 员工选项 | 4,262 | | | 2,964 | | | 2,419 | |
| 长期激励计划 | 4,793 | | | 5,304 | | | 1,946 | |
| 红股 | — | | | 51 | | | — | |
| 12月31日的结余 | 9,055 | | | 8,405 | | | 4,990 | |
由于2021年全年与2020年第四季度授予的期权相关的支出增加,员工期权支出增加。由于授予的股票的公允价值较低以及首席执行官的过渡协议,长期激励计划支出减少。
22.1模型和假设
模型和假设
IFRS 2描述了基于股份的支付交易的允许估值方法的层次结构。如果可能,实体应使用计量日期的市场价格来确定其权益工具的公允价值。如果无法获得市场价格,如Pharming的期权计划和长期激励计划,则实体应估计授予的股权工具的公允价值。估值技术应被用来估计这些股权工具的价值或价格,就像在知情、自愿的各方之间的公平交易的计量日期一样。
估值方法应与普遍接受的金融工具定价估值方法一致,并应纳入了解情况的市场参与者在制定价格时将考虑的所有因素和假设。
无论选择何种定价模式,至少都应考虑以下因素:
•期权的行权价格;
•期权的预期到期日;
•标的股票的当前价格;
•股价的预期波动;
•预期的股票股息;
•期权预期到期日的无风险利率。
模型和假设备选方案
期权计划的成本是参照期权授予日期权的公允价值来计量的。
这个六上述因素都纳入了布莱克-斯科尔斯模型,用于确定期权的公允价值。认购权的行权价和股价在授予日已知。波动率是基于期权授予日期之前一段时间内的月末历史收盘价,等于期权的预期寿命,最低为3好几年了。假设不会支付股息。
根据累积的期权计划可授予期权的股份总数应由Pharming确定,但不得超过10在稀释的基础上,占Pharming所有已发行和已发行股份的百分比。在行使期权时,转让或将转让的股份应适用于减少本计划预留的最高股份数量。未行使的期权可重复用于授予期权计划下的期权。
PURING可向执行委员会成员或员工授予选择权:
•在进行业绩审查时;
•仅限于个人:在其受雇的第一个月内的日期;
•取得非凡成就的;
•在Pharming内部被提升为新职能的情况下。
期权行权价为Pharming股票于授出日期前一交易日在证券交易所的价格。既得期权可在下列时间内随时行使五年在授予之日之后。未行使的期权应视为失效,并在下列时间后自动停止存在五年。期权的行使须遵守荷兰的法律和法规。期权的行使包括预扣税。除非另有说明,每份期权等同于一股。选项不适用于提前退休。
布莱克-斯科尔斯模型使用了以下假设来确定授予日期权的公允价值:
| | | | | | | | | | | | | | | | | |
| 2021 | | 2020 | | 2019 |
| 预期成熟时间(员工) | 1-4年份 | | 1-4年份 | | 1 - 4年份 |
| 预计到期时间(董事会) | 不适用 | | 不适用 | | 0.7年份 |
| 波动性(员工) | 47% - 57% | | 53% - 60% | | 54%- 58% |
| 波动性(董事会) | 不适用 | | 不适用 | | 56 | % |
| 无风险利率(员工) | (0.52)% - (0.03)% | | (0.52)% - (0.27)% | | (0.36)% -(0.30)% |
| 无风险利率(董事会) | 不适用 | | 不适用 | | (0.25) | % |
期权计划员工
“员工期权计划”第2.1条规定:“公司可以向任何员工授予期权。”截至2020年12月11日的期权授予标准由Pharming监事会全权决定。截至2020年12月11日,管理委员会提出:(1)潜在参与者是否符合授予期权的标准;(2)拟授予的期权数量。自2020年12月11日起,公司及其子公司所有员工(首席执行官和执行委员会其他成员除外)经董事会批准(在需要的范围内)执行公司的薪酬政策和其他福利政策和激励计划的工作将委托首席执行官执行。
员工期权计划第4.4条涉及员工期权的归属计划,内容如下:“如果参与者终止雇用,除退休和死亡外,Pharming有权自行决定参与者的期权失效。以下时间表适用于取消:
•如果在以下时间内终止雇佣关系一年自授予之日起,所有选择权均失效;
•如果在授予之日的第一年后终止雇用,所有选择权,减去选择权数量的四分之一,均应失效。每个月的就业持续时间超过一个月,取消选项的数量就会减少一年自授予之日起,减去授予日授予期权数量的1/48。
长期激励计划的模型与假设
对于长期激励计划,为了使用蒙特卡罗模拟来确定长期激励计划股票奖励的公允价值,包括Pharming和/或同级组的以下要素:
•绩效期间的开始和结束日期;
•授予日期;
•股票价格;
•汇率;
•预期波动;
•预期相关性;
•预期股息收益率;
•无风险利率。
波动性是基于历史月末收盘价3好几年了。
相关性的基础是3在考虑汇率的情况下,基于月末收盘报价的多年历史相关性。同行的预期股息收益率和无风险利率(取决于货币)从彭博社获得。
根据LTIP,每年有条件地授予限制性股票,股份归属基于市场条件,即将Pharming股票的总股东回报表现与其他欧洲生物科技公司的同行集团的总股东回报进行比较。
2020-2021年方案的参考组由以下内容组成22公司:
| | | | | | | | |
| 主要位置 | 数 | 公司 |
| 比利时 | 1 | 加拉帕戈斯群岛 |
| 丹麦 | 2 | 巴伐利亚北欧语,Genmab |
| 法国 | 4 | Cellectis,欧洲生物科学,营养学,先天制药 |
| 德国 | 5 | Evotec、Medigene、Medir、Heidelberg Pharma、Newron制药 |
| 意大利 | 1 | 光固化 |
| 挪威 | 1 | 转基因 |
| 11.瑞士 | 4 | Addex治疗公司,Basilea制药公司,Kuros生物科学公司,Morphosys |
| 英国 | 4 | 过敏治疗公司,ImmuPharma,牛津生物医学公司,Santhera制药公司 |
| 不包括Pharming集团的合计 | 22 | |
转归时间表如下。排名靠前:
| | | | | |
| 成就水平 | 已获拨款的百分比 |
5占指数的百分比: | 100 | % |
5%-10占指数的百分比: | 80最大百分比 |
10%-20占指数的百分比: | 60最大百分比 |
20%-30占指数的百分比: | 50最大百分比 |
30%-50占指数的百分比: | 20最大百分比 |
低于50百分比索引: | — | % |
一旦控制权发生变化,所有剩余的LTIP股份将自动归属。
蒙特卡洛模拟中用于确定长期激励计划股票奖励在授予日的公允价值的假设范围为:
| | | | | | | | | | | | | | | | | |
| 2021 | | 2020 | | 2019 |
| 波动性 | 47.00 | % | | 54.00 | % | | 56.00 | % |
| 无风险利率 | (0.31) | % | | (0.24) | % | | (0.21) | % |
| 股息收益率 | — | % | | — | % | | — | % |
执行董事的长期激励计划
根据现有长期激励计划授予的限售股将不再适用于新薪酬政策下的执行董事。新设计的长期激励计划与流行的“最佳做法”保持一致,而且只与业绩有关。对于执行董事而言,根据新设计的LTI计划授予的股份的目标价值,如薪酬政策所述,设定为300首席执行官年薪总额的百分比(代表50低于美国基准集团的最低四分位数,略低于欧盟基准集团执行董事的最高四分位数)和200其他执行董事及高级职员的百分比(代表20和30低于美国基准集团的最低四分位数,仅处于欧盟基准集团执行董事的最高四分位数)。
欧盟和美国基准组织:
| | | | | |
| 公司所在地 | 位置 |
| 欧洲 | |
| 阿尔克-阿尔贝罗 | 霍肖姆,丹麦 |
| 联合制药 | 英国切本纳姆 |
| Avadel制药公司 | 爱尔兰都柏林 |
| 罗勒药用 | 瑞士巴塞尔 |
| 巴伐利亚北欧 | 海勒鲁普,丹麦 |
| Bio Gaia | 瑞典斯德哥尔摩 |
| 生物测试 | 德雷伊奇,德国 |
| 卡穆鲁斯 | 瑞典隆德 |
| 科斯莫制药公司 | 爱尔兰都柏林 |
| 梅鲁斯 | 荷兰乌得勒支 |
| 密特拉制药公司 | 比利时列日 |
| 果园治疗学 | 联合王国,伦敦 |
| 奥利克索 | 瑞典乌普萨拉 |
| 牛津生物医学 | 牛津,英国 |
| UniQure | 荷兰阿姆斯特丹 |
| 瓦尔尼瓦 | 法国南特 |
| Vecture Group | 英国切本纳姆 |
| 新西兰制药公司 | 丹麦哥本哈根 |
| 美国 | |
| 艾瑞制药 | 北卡罗来纳州达勒姆 |
| 木通治疗学 | 马萨诸塞州剑桥 |
| 安妮卡治疗公司 | 马萨诸塞州贝德福德 |
| 克洛维斯肿瘤学 | 博尔德 |
| 科莱姆药业 | 马萨诸塞州斯托顿 |
| Corcept治疗公司 | 加利福尼亚州门洛帕克 |
| 埃南塔制药公司 | 马萨诸塞州沃特敦 |
| 苍鹭治疗学 | 加利福尼亚州圣地亚哥 |
| 铁木制药 | 马萨诸塞州波士顿 |
| 配基制药公司 | 加利福尼亚州圣地亚哥 |
| Omeros | 华盛顿州西雅图 |
| 帕西拉生物科学公司 | 新泽西州帕西帕尼 |
| RADIUS健康 | 马萨诸塞州沃尔瑟姆 |
| 回溯 | 加利福尼亚州圣地亚哥 |
| 瑞格尔制药公司 | 加利福尼亚州旧金山南部 |
| Supernus制药公司 | 马里兰州罗克维尔 |
| 万达制药 | 华盛顿特区 |
根据LTI计划可以授予的股份的最大价值设置为450首席执行官年薪总额的百分比以及300%适用于其他执行董事和高级管理人员。执行董事必须保留根据LTI计划授予的股份,最低金额为五年自授予之日起生效。
根据LTI计划授予执行董事的股份将归属于三年在授予日期后,视董事会根据薪酬委员会的建议为以下方面设定的目标的实现情况三年制履约期(即双触发归属)、其相对权重和
支付限额。所有授予的股票将受五年从授予之日起(即,两年归属后),根据DCGC的最佳实践规定。
业绩目标包括股东总回报(40加权百分比)和长期战略导向目标的实现(60重量百分比)。用于确定股东总回报的同行组由被纳入AMX指数和纳斯达克生物科技指数的公司组成,分别以IBB ETF为代表,在确定时权重相等。
下表给出了LTI计划的门槛和支出百分比,将分别为AMX和IBB指数确定(每个指数的权重为50支出的百分比):
| | | | | |
| TSR等于索引 | 80支付百分比 |
TSR10指数以上百分比 | 90支付百分比 |
TSR20指数以上百分比 | 100支付百分比 |
TSR40指数以上百分比 | 110支付百分比 |
TSR60指数以上百分比 | 120支付百分比 |
TSR80指数以上百分比 | 130支付百分比 |
TSR100指数以上百分比 | 150支付百分比 |
| TSR低于索引 | 0支付百分比 |
蒙特卡洛模拟中用于确定长期激励计划股票奖励在授予日的公允价值的假设范围为:
| | | | | | | | | | | |
| 2021 | | 2020 |
| 波动性 | 49.00 | % | | 53.46 | % |
| 无风险利率 | (0.554)%-(0.416)% | | (0.528)% - (0.551)% |
| 股息收益率 | — | % | | — | % |
行政总裁的一次过过渡安排
实施新的三年制LTIP下的归属计划对现任执行董事2020-2023年期间的现行薪酬福利有重大影响,因为执行董事目前的薪酬福利包括年度选择权和股份授予。现有薪酬方案和计划下的股份薪酬三年制这段时间会导致三期权授予,并保证总共授予8,400,000首席执行官在继续任职的基础上的选择三年制句号。此外,首席执行官将有资格获得三根据LTIP授予的年度限制性股票,最多30基本工资的%。
为减轻上述影响,本公司已同意于2020年12月11日股东大会上批准与行政总裁的一次过交接安排。这一一次性过渡安排规定:(1)将8,400,000首席执行官的期权(即在没有这种安排的情况下预计在2021年、2022年和2023年授予的股票期权总数)进入一授予总数为数的4,200,0002020年的股票,其中归属将受新LTI计划的基于业绩的标准管辖,以及(Ii)将业绩股票归属于三2021年、2022年和2023年第一季度的年度分期付款,遵循上文执行董事长期激励计划中描述的新的执行董事计划的基于业绩的标准。
此外,这笔赠款和每个三根据长期激励一次过安排,授予股份的潜在投资受以下条件限制:
•a 五年制已授予股份的保留期;
•董事会确定的设定的长期业绩目标归属后的年度按比例满意度;以及
•根据2020年12月11日的董事会薪酬政策适用于LTI计划的其他条款和条件。
根据一次过交接安排,行政总裁已放弃根据LTIP及现有2020财政年度购股权计划分别授予限制性股份及购股权的所有权利。2020年12月22日,总共有4,200,000根据一次性交接安排的条款,向首席执行官授予(限制性)股份。
期权计划
2021年备选方案的活动概览如下(另请参阅说明[27]关于报告日期以来的变动情况)(请注意,美元加权平均行使价格是使用各自年度的收盘汇率换算的(2021:1:1,1334)):
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2021 | | 2020 | | 2019 |
| 数 | | 加权平均行权价(美元) | | 数 | | 加权平均行使价(美元) | | 数 | | 加权平均行使价(美元) |
| 1月1日的余额 | 50,106,488 | | 0.909 | | | 40,327,537 | | 0.696 | | | 34,320,956 | | 0.609 | |
| 过期 | — | | | — | | | (3,281) | | 0.361 | | | (4,430,757) | | 1.146 | |
| 没收 | (946,738) | | 1.046 | | | (411,250) | | 0.640 | | | (133,750) | | 0.798 | |
| 授与 | 12,081,000 | | 0.931 | | | 15,536,750 | | 1.196 | | | 18,485,000 | | 0.842 | |
| 已锻炼 | (8,451,272) | | 0.520 | | | (5,343,268) | | 0.544 | | | (7,913,912) | | 0.386 | |
| 12月31日的结余 | 52,789,478 | | 0.911 | | | 50,106,488 | | 0.909 | | | 40,327,537 | | 0.696 | |
| -已授权 | 21,388,237 | | 0.833 | | | 19,675,875 | | 0.716 | | | 12,797,424 | | 0.450 | |
| -未归属 | 31,401,241 | | 0.966 | | | 30,430,613 | | 1.034 | | | 27,530,113 | | 0.806 | |
@行权期权20212021年,总共有8,451,272已行使期权,平均行权价为#美元。0.520。2020年,总共有5,343,268已行使期权,平均行权价为#美元。0.544.
所有于2021年12月31日尚未行使的购股权均可予行使,但授予仍在服务的雇员的未归属购股权除外。员工2021年股票期权授予后一年在这种情况下,员工在归属日仍在服务。
2021年12月31日未偿还期权的行权价格和行权价值在以下范围内(请注意,以美元计算的行权价值是使用各自年度的收盘汇率换算的(2021:1:1,1334)):
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2021 | | 2020 | | 2019 |
| 行权价格(美元) | 数 | | 锻炼价值
in US$’000 | | 数 | | 锻炼价值
in US$’000 | | 数 | | 锻炼价值
in US$’000 |
0.071 - 0.280 | 0 | | — | | | 3,225,000 | | 828 | | | 4,737,500 | | 1,110 | |
0.28 - 0.570 | 3,482,428 | | 1,322 | | | 6,742,863 | | 2,774 | | | 9,187,537 | | 3,477 | |
0.57 – 0.850 | 12,290,925 | | 10,155 | | | 12,974,375 | | 11,615 | | | 13,202,500 | | 10,793 | |
0.850 – 2.830 | 37,016,125 | | 36,646 | | | 27,164,250 | | 30,314 | | | 13,200,000 | | 12,698 | |
| 12月31日的结余 | 52,789,478 | | 48,123 | | | 50,106,488 | | 45,531 | | | 40,327,537 | | 28,078 | |
已授予的期权
2021年,公司授予12,081,000向员工提供加权平均行权价为美元的期权0.931;2021年授予的期权的公允价值在美元范围内0.891 - US$1.292. In 2020, the
公司获批15,536,750向员工提供加权平均行权价为美元的期权0.974;2020年授予的期权的公允价值在美元范围内0.247 - US$0.752.
长期激励计划
2019-2021年授予的LTIP股票数量和总数以及每股公允价值奖励概述如下(注意,每股公允价值奖励以美元为单位,使用各自年度的收盘汇率换算(2021:1:1,1334)):
| | | | | | | | | | | | | | | | | | | | | | | |
| 参与者类别 | 2021 | | 2020 | | 2019 | | 总计 |
| 董事会非执行董事 | — | | | — | | | 205,000 | | | 205,000 | |
| 董事会执行成员 | 1,337,888 | | | — | | | 201,050 | | | 1,538,938 | |
| 执行委员会 | 6,301,400 | | | 105,000 | | | 326,807 | | | 6,733,207 | |
| 高级管理人员 | 812,500 | | | 930,000 | | | 1,830,000 | | | 3,572,500 | |
| 总计 | 8,451,788 | | | 1,035,000 | | | 2,562,857 | | | 12,049,645 | |
| 每股公允价值奖励(美元) | 0.887 | | | 0.923 | | | 0.387 | | | |
下表概述了2019-2021年授予、没收或发行的LTIP股票,以及截至2021年12月31日保留的LTIP股票数量:
| | | | | | | | | | | | | | | | | | | | | | | |
| 参与者类别 | 授与 | | 没收 | | 未归属的 | | 预订时间为2021年12月31日 |
| 董事会非执行董事 | 205,000 | | (115,000) | | (72,000) | | 18,000 |
| 董事会执行成员 | 1,538,938 | | 0 | | (160,840) | | 1,378,098 | |
| 执行委员会 | 6,733,207 | | 0 | | (1,179,259) | | 5,553,948 | |
| 高级管理人员 | 3,572,500 | | (180,000) | | (1,380,000) | | | 2,012,500 | |
| 总计 | 12,049,645 | | | (295,000) | | | (2,792,099) | | | 8,962,546 | |
行政总裁的过渡安排
2020年12月22日,总共有4,200,000根据一次性交接安排的条款,向首席执行官授予(限制性)股份。这些股份将归属于三2021年第一季度、2022年第一季度和2023年第一季度的等额年度分期付款,取决于新LTI计划下长期目标的按比例实现。
农历新年第二年3年制根据LTI一次性过渡安排于2020年授予股份的实施期于2020年12月31日结束。因此,董事会根据薪酬委员会的建议,于2021年第一季度决定将4,200,000有条件地授予首席执行官的股份(即,1,400,000股份)。
这些股票将在2024年第一季度之前不会授予,适用于2021年三年业绩期开始时设定的目标。
在TSR和战略公司目标方面的表现,应用各自的权重,导致首席执行官在一次过过渡安排下的归属水平如下(即,1,400,000股份):
| | | | | | | | | | | |
| 指标定义 | 成就 | 加权 | 归属级别 |
| TSR | — | % | 40 | % | — | % |
| 战略目标 | 75 | % | 60 | % | 45 | % |
| 总计 | 75 | % | 100 | % | 45 | % |
根据所产生的45%归属级别,总数为630,0002022年授予首席执行官的股份,用于根据LTI一次性过渡安排授予的第二批年度股份。这些股票的保留期为五年.
22. 董事会
关于我们在纳斯达克上上市的美国存托凭证,我们将我们的二-将董事会结构分层为一层级董事会结构,由董事执行董事和非执行董事组成的单一董事会。新结构于2020年12月11日生效。自该日起,董事会共同负责公司的管理工作。公司的日常管理和战略的执行都委托给了首席执行官,作为董事的唯一执行机构。首席执行官在执行其任务和职责时得到非法定执行委员会的支持。非执行董事负有法定的管理责任,但应重点监督董事执行董事履行职责的方针和职能以及公司的总体情况。非执行董事将重点监督执行董事履行职责的政策和运作,以及公司的一般事务状况。
S.de Vries先生是公司董事会的唯一执行成员,并将继续担任首席执行官。
董事会成员如下:
| | | | | | | | |
| P.Sekhri先生 | 董事会主席及非执行董事会成员 | |
| D·乔恩女士 | 董事会副主席及非执行董事会成员 | |
| J.B.沃德先生 | 非执行董事会成员 | |
| B.Yanni女士 | 非执行董事会成员 | |
| M·派克特先生 | 非执行董事会成员 | |
| J.van der Meijs女士 | 非执行董事会成员 | 获委任为2021年5月19日 |
| L.克鲁默先生 | 非执行董事会成员 | 获委任为2021年5月19日 |
| S.Baert先生 | 非执行董事会成员 | 获委任为2021年5月19日 |
| S.De Vries先生 | 执行董事会成员兼首席执行官 | |
2021年5月19日,Aad de温特先生和Barrie Ward先生从监事会(BOSD)退休。
非执行董事董事会
报酬
2021年,监事会的年度薪酬如下:
| | | | | | | | | | | | | | | | | | | | | | | |
| 责任 | 欧元的现金
(每年) | | 欧元的普通股*
(每年) | | 美元现金
(每年) | | 美元普通股*
(每年) |
| 董事会主席 | 65,000 | | 40,000 | | 77,090 | | 47,440 |
| 非执行董事董事 | 45,000 | | 30,000 | | 53,370 | | 35,580 |
| 审计委员会主席 | 9,000 | | | | 10,674 | | |
| 审计委员会成员 | 3,000 | | | | 3,558 | | |
| 主席薪酬委员会 | 6,000 | | | | 7,116 | | |
| 成员薪酬委员会 | 3,000 | | | | 3,558 | | |
| 治理委员会主席 | 6,000 | | | | 7,116 | | |
| 成员管治委员会 | 3,000 | | | | 3,558 | | |
*)所有股票的估值为20年度股东大会前一天的VWAP,没有进一步的限制或授权.
一欧元的额外补偿1,000(美元1,186),如有特别活动,由董事会主席决定。董事会非执行成员和/或前董事会成员2021年和2020年的薪酬如下:
| | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 年 | | BOSD/BOD | | 股份支付 | | 总计 |
| | | | | | | |
| Paul Sekhri先生 | 2021 | | 77 | | | 55 | | | 132 | |
| 2020 | | 74 | | | 59 | | | 133 | |
| 2019 | | 56 | | | 37 | | | 93 | |
| 巴里·沃德先生 | 2021 | | 23 | | | 20 | | | 43 | |
| 2020 | | 62 | | | 46 | | | 108 | |
| 2019 | | 44 | | | 30 | | | 74 | |
| Jan Hendrik Egberts先生 | 2021 | | — | | | — | | | — | |
| 2020 | | — | | | 5 | | | 5 | |
| 2019 | | 18 | | | — | | | 18 | |
| 尤尔根·恩斯特先生 | 2021 | | — | | | 6 | | | 6 | |
| 2020 | | 57 | | | 42 | | | 99 | |
| 2019 | | 47 | | | 29 | | | 76 | |
| 阿德·德温特先生 | 2021 | | 26 | | | 21 | | | 47 | |
| 2020 | | 65 | | | 46 | | | 111 | |
| 2019 | | 50 | | | 31 | | | 81 | |
| Deb Jorn女士 | 2021 | | 64 | | | 42 | | | 106 | |
| 2020 | | 62 | | | 40 | | | 102 | |
| 2019 | | 29 | | | 6 | | | 35 | |
| Barbara Yanni女士 | 2021 | | 60 | | | 36 | | | 96 | |
| 2020 | | 35 | | | 24 | | | 59 | |
| 2019 | | — | | | — | | | — | |
| 马克·派克特先生 | 2021 | | 57 | | | 36 | | 93 | |
| 2020 | | 35 | | | 24 | | | 59 | |
| 2019 | | — | | | — | | | — | |
| 贾宾·范德梅斯女士 | 2021 | | 47 | | | 24 | | 71 | |
| 2020 | | — | | | — | | | — | |
| 2019 | | — | | | — | | | — | |
| 里昂·克鲁默先生 | 2021 | | 47 | | | 24 | | 71 | |
| 2020 | | — | | | — | | | — | |
| 2019 | | — | | | — | | | — | |
| 史蒂文·巴特先生 | 2021 | | 45 | | | 24 | | 69 | |
| 2020 | | — | | | — | | | — | |
| 2019 | | — | | | — | | | — | |
| 总计 | 2021 | | 446 | | | 288 | | | 734 | |
| 2020 | | 390 | | | 286 | | | 676 | |
| 2019 | | 226 | | | 133 | | | 359 | |
股份、认股权及认股权证
前监事会成员没有参与期权计划。下表概述了截至2021年12月31日的一年中,董事会非执行成员和/或前监事会成员在任期间LTIP股票数量的变动情况:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 年 | | 授与 | | 已解决 | | 没收 | | 未归属 | | 预留至2021年12月31日 |
| P.Sekhri | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 50,000 | | | (10,000) | | | — | | | (40,000) | | | — | |
| | 2018 | | 30,000 | | | (15,000) | | | — | | | (15,000) | | | — | |
| D.乔恩 | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 40,000 | | | (8,000) | | | — | | | (32,000) | | | — | |
| A·德温特 | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 40,000 | | | — | | | (40,000) | | | — | | | — | |
| | 2018 | | 25,000 | | | (12,500) | | | — | | | (12,500) | | | — | |
| J.B.沃德 | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 35,000 | | | — | | | (35,000) | | | — | | | — | |
| | 2018 | | 25,000 | | | (12,500) | | | — | | | (12,500) | | | — | |
| 总计 | | 2021 | | — | | | — | | | — | | | — | | | — | |
| | 2020 | | — | | | — | | | — | | | — | | | — | |
| | 2019 | | 165,000 | | | (18,000) | | | (75,000) | | | (72,000) | | | — | |
| | 2018 | | 80,000 | | | (40,000) | | | — | | | (40,000) | | | — | |
股票
截至2021年12月31日,董事会非执行成员持有以下数量的股份:
| | | | | | | | | | | | | | |
| 截至2021年12月31日 | | 普通股 | | 股份证书 |
| Paul Sekhri先生 | | 423,985 | | | — | |
| Deb Jorn女士 | | 51,738 | | | — | |
| Barbara Yanni女士 | | 44,147 | | | — | |
| 马克·派克特先生 | | 44,147 | | | — | |
| 贾宾·范德梅斯女士 | | 19,309 | | | — | |
| 里昂·克鲁默先生 | | 19,309 | | | |
| 史蒂文·巴特先生 | | 19,309 | | | — | |
| 总计 | | 621,944 | | | — | |
董事会非执行成员持有的所有股份均不受限制。
贷款或担保
2021年期间,本公司未向任何非执行董事会成员或前监事会成员提供贷款或担保。截至2021年12月31日,向董事会非执行成员或前监事会成员提供的贷款或担保均未偿还。
董事会执行成员
报酬
执行局成员有权享受下列薪酬待遇:
•固定报酬:年基本工资;
•可变薪酬:可变薪酬部分是:(A)年度现金奖金占固定部分的百分比(短期奖励)和(B)长期奖励(以股份为基础);
•其他:缴款养老金保费、旅费津贴和假期津贴。
上文确定的一次性过渡安排规定:(1)向首席执行官发放总额为4,200,000(Ii)分别于2021年、2022年及2023年首季分三个年度分批归属该等股份。
薪酬如下,包括2021年至2021年12月31日的全年:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额(单位:$‘000) | 固定报酬 | | 短期变量:年度奖金 | | 基于股份的支付 | | 离职后福利 | | 其他 | | 总计 |
| 董事首席执行官兼执行总裁西门·德弗里斯先生 | 2021: | 681 | | | 2021: | 357 | | | 2021: | 1,264 | | | 2021: | 120 | | | 2021: | 38 | | | 2021: | 2,460 | |
| 2020: | 614 | | | 2020: | 431 | | | 2020: | 1,739 | | | 2020: | 107 | | | 2020: | 37 | | | 2020: | 2,927 | |
| 2019: | 568 | | | 2019: | 347 | | | 2019: | 546 | | | 2019: | 81 | | | 2019: | 36 | | | 2019: | 1,578 | |
| 布鲁诺·贾内蒂先生 | 2021: | — | | | 2021: | — | | | 2021: | — | | | 2021: | — | | | 2021: | — | | | 2021: | — | |
| 2020: | 402 | | | 2020: | 201 | | | 2020: | 708 | | | 2020: | 85 | | | 2020: | 27 | | | 2020: | 1,424 | |
| 2019: | 371 | | | 2019: | 190 | | | 2019: | 324 | | | 2019: | 78 | | | 2019: | 9 | | | 2019: | 973 | |
| 罗宾·赖特先生 | 2021: | — | | | 2021: | — | | | 2021: | — | | | 2021: | — | | | 2021: | — | | | 2021: | — | |
| 2020: | 155 | | | 2020: | 14 | | | 2020: | 107 | | | 2020: | 15 | | | 2020: | 350 | | | 2020: | 641 | |
| 2019: | 355 | | | 2019: | 167 | | | 2019: | 128 | | | 2019: | 26 | | | 2019: | — | | | 2019: | 676 | |
选项
下表概述了执行董事会个别成员在2021年持有的期权数量、行权价格和截至2021年12月31日的到期日的变动情况:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2021年1月1日 | | 授予2021年 | | 在2021年实施 | | 2021年被没收/过期 | | 2021年12月31日 | | 行权价格(美元) | | 到期日 |
| 西门·德弗里斯先生 | | 2,800,000 | | | — | | | — | | | — | | | 2,800,000 | | | 0.912 | | | 22/05/2024 |
股票
截至2021年12月31日,董事会执行成员持有以下数量的股份:
| | | | | | | | |
| 持有的股份 | | 截至2021年12月31日 |
| 西门·德弗里斯先生 | | 7,095,927 | |
长期激励计划
| | | | | | | | | | | | | | | | | | | | | | | |
| | 年 | 授与 | 已解决 | 没收 | 未归属 | 预留至2021年12月31日 |
| 西门·德弗里斯先生 | | 2021 | 1,337,888 | | — | | — | | — | | 1,337,888 |
| | 2020 | — | | — | | — | | — | | — | |
| | 2019 | 201,050 | | — | | — | | — | | 201.050 | |
| | 2018 | 130,131 | | (130,131) | | — | | — | | — | |
贷款或担保
在2021年期间,没有向董事会执行成员提供任何贷款或担保。截至2021年12月31日,董事会执行成员没有未偿还的贷款或担保。
董事董事会执行成员是董事的唯一法定成员。
23. 关联方交易
关联方的披露主要涉及关键管理层薪酬以及与关联公司BioConnection B.V.的交易。
密钥管理包括董事会成员:
| | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 | | 2019 |
| 薪金和其他短期雇员福利 | 1,522 | | | 2,695 | | | 2,389 | |
| 离职后福利 | 120 | | | 207 | | | 185 | |
| 基于股份的薪酬 | 1,552 | | | 2,841 | | | 1,131 | |
| 总计 | 3,194 | | | 5,743 | | | 3,705 | |
与董事会成员的所有直接交易已在本财务报表附注22和23中披露。于2021年12月31日,本公司的应付结余总额为美元0.1百万美元(2020年:美元零)致董事会成员。
与BioConnection B.V.的关联方交易是该公司填充物和饰面业务的正常过程,金额为美元3.5百万美元(2020年:美元3.0百万)。截至2021年12月31日,公司欠下不是余额(2020年:美元0.1百万美元)到BioConnection,提供填充物和涂饰服务。
24. 其他金融负债,包括企业合并和或有对价
其他财务负债:
| | | | | | | | | | | |
| 金额(单位:$‘000) | 2021 | | 2020 |
| 当前 | | | |
| 或有对价 | — | | | 25,000 | |
| 总电流 | — | | | 25,000 | |
| | | |
| 非当前 | | | |
| 财务担保合同 | 165 | | | 212 | |
| 总非流动 | 165 | | | 212 | |
| 总计 | 165 | | | 25,212 | |
2016年,Pharming完成了从博世手中收购其自身产品RUCONEST®在北美的所有商业化权利。Pharing预付了一笔美元60100万美元,并承诺未来最高可再支付美元65百万美元,基于某些销售里程碑的成就。此次收购后,法明开始负责在美国直接销售RUCONEST®。
或有对价已于2021年第二季度全额偿还。
25. 承付款和或有事项
材料协议
2021年底,该公司与第三方就RUCONEST的制造和新产品的开发达成了几项协议。在这些协议中,承诺了一定的最低数量。这些协议下的潜在负债总额约为#美元。97.3百万美元(2020年:美元21.9百万美元),其中美元22.2与2022年相关的百万美元和美元75.0100万与2023年及更远的时间有关。所有支出都与货物成本有关。
租赁协议
公司已经签署了一份新的15荷兰奥斯市枢轴公园一栋办公楼的一年租赁合同。Pharing承诺在租赁期内支付未来的租赁费。租赁价格尚未确定。租赁开始时,办公大楼将按照国际财务报告准则第16号作为使用权资产和负债入账。
Leniolisib里程碑承诺
作为Leniolisib许可协议的一部分,Pharming承诺根据全球实际年销售额进行某些里程碑式的付款。考虑到Leniolisib目前的测试和批准阶段,管理层得出结论,这些里程碑式的付款很可能会实现。这些里程碑式的付款可能导致最高债务为#美元。200百万美元。除了这些里程碑式的付款外,该公司还同意向诺华公司支付特许权使用费。这些特许权使用费是以净销售额的固定百分比计算的,最高增长到18净销售额超过美元时的%300百万美元。这些特许权使用费的期限为10好几年了。
26. 金融风险管理
私募股权融资面临几种金融风险:市场风险(货币风险和利率风险)、信用风险和流动性风险。董事会和执行委员会负责货币、利息、信贷和流动性风险的管理,并因此最终对在这一领域作出的决定负责。
资本风险管理
该公司管理其资本,以确保其能够继续作为一家持续经营的企业。这包括定期审查现金流预测,并在认为适当的情况下,随后通过执行股权和/或债务交易筹集资金。在这样做的过程中,董事会和执行委员会的战略是实现一种考虑到所有利益相关者最佳利益的资本结构。辉瑞的资本结构包括现金和现金等价物、债务和股权。与去年相比,风险管理政策没有重大变化。
货币风险
这就是资产、负债、特别是金融工具未来现金流的公允价值因汇率变化而波动的风险。PURING管理外币风险的政策旨在保护以外币,特别是美元持有或记录的营业利润和头寸。RUCONEST®在美国的某些付款和销售正在并将以美元收到。2021年,这些贷款的偿还和利息都是以美元支付的。美国活动的一些直接付款是通过荷兰实体以美元支付的。于2021年12月31日,本集团的现金及现金等价物,包括限制性现金,为美元193.0百万美元。这一余额包括以欧元计价的现金资产,总额为#美元。130.7百万或欧元115.3百万(适用于2021年12月31日的欧元/美元汇率1.1334)和美元现金资产,总额为#美元62.0百万美元。美元现金余额将用于美国组织的商业化活动,并用于支付欧盟和ROW活动的运营成本。
于2020年底,集团的或有对价为#美元25.0百万美元作为资产负债表上的负债。这笔余额已在2021年全额偿还。
以欧元计价的现金和现金等价物(包括限制性现金)、应收账款和存货共计#美元。87.3百万欧元(欧元77.0百万美元),分别为美元20.2百万欧元(欧元17.8百万),用于以欧元计价的贸易和其他应付款。PURING在年底对现货汇率进行了调整,进行了敏感性分析。由于年终现金和现金等价物(包括限制性现金)应收账款、存货、贸易和其他以欧元计价的应付款余额为#美元。67.1100万欧元,欧元兑美元汇率每升值或贬值10%,将产生1美元的影响6.7本集团的收益(欧元走弱)或亏损(欧元走强)为100万欧元。
利率风险
利率风险是指金融工具未来现金流的公允价值因市场利率变化而波动的风险。PERING的利率风险政策旨在将与公司融资相关的利率风险降至最低,从而优化净利息成本。这一政策转化为某种理想的固定利息和浮动利息头寸,包括现金和现金等价物产生的头寸以及融资租赁负债支付的头寸。由于Orbimed的贷款已经全额偿还,而可转换债券的利率是固定的百分比,Pharming得出结论认为,总的利息风险并不重要。
发行2025年到期的可转换债券,固定利率为3.00年利率%取代公司以前的债务安排使这一担忧变得过时。该公司绝大多数金融工具的利息现在不随市场利率变化。有关2025年到期的可转换债券的更多信息可在附注17中找到。
信用风险
信用风险被定义为金融工具的一方因不履行义务而给另一方造成经济损失的风险。辉瑞通过使用标准普尔和穆迪等机构发布的信用评级报告,选择信用评级较高的金融机构来管理信用风险敞口。2021年12月31日的信用风险敞口由现金和现金等价物以及贸易和其他应收账款的账面价值表示。
截至2021年12月31日,现金和现金等价物(包括限制性现金)的账面价值为美元193.0它是通过金融机构持有的,评级从标准普尔的BB+到A级或更高,从穆迪的Baa3到A1级,惠誉的BBB+到A级。
截至2021年12月31日的贸易和其他应收账款为美元30.0百万美元。截至编制这些财务报表之日,这些款项已基本结清,包括现金收据以及作为预付费用项目交换的货物和服务收据。根据现金及现金等价物(包括受限制现金)的信用评级,以及就贸易及其他应收账款所采取的立场,本公司认为该风险已得到充分管理。
流动性风险
流动性风险是指一个实体在履行与金融负债相关的义务时遇到困难的风险。PURING的目标是保持现金和现金等价物(包括短期存款)的最低水平和一定的比率。该公司的战略是通过从产品销售和许可协议等经营活动中产生现金收入来偿还债务。如果此类现金流不足,公司将依靠发行股票或产生财务负债的方式为现金流融资。这些财务报表中的附注2更全面地描述了公司的持续经营评估。
下表列出了2021年年底的财务负债,显示了包括名义利息在内的剩余未贴现合同金额。以外币计价的负债已按2021年12月31日的汇率折算。其他财务负债包括博世健康预期未来里程碑的或有对价拨备(如附注25进一步解释),以及向BioConnection提供的财务担保的公允价值(如附注12所述)。
金融负债到期日概况:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2022 | | 2023 | | 2024 | | 2025 | | 2026年及以后 | | 总计 | | 上一年总额 |
| 贸易和其他应付款 | 42,473 | | | — | | | — | | | — | | | — | | | 42,473 | | | 47,666 | |
| 衍生金融负债 | — | | | — | | | — | | | — | | | — | | | — | | | 180 | |
| 贷款和借款 | — | | | — | | | — | | | — | | | — | | | — | | | — | |
| 其他财务负债 | — | | | — | | | — | | | — | | | 165 | | | 165 | | | 25,212 | |
| 租赁负债 | 3,118 | | | 2,901 | | | 2,616 | | | 2,489 | | | 12,372 | | | 23,496 | | | 13,013 | |
| 可转换债券 | 4,250 | | | 4,250 | | | 4,250 | | | 143,800 | | | — | | | 156,550 | | | 174,223 | |
| 总计 | 49,841 | | | 7,151 | | | 6,866 | | | 146,289 | | | 12,537 | | | 222,684 | | | 260,294 | |
公允价值估计
该公司使用以下层次结构来确定按公允价值计量的金融工具的公允价值:
•第1级:相同资产或负债的活跃市场报价(未经调整);
•第2级:除第1级所列报价外,对资产或负债可直接(即作为价格)或间接(即从价格中得出)可观察到的投入;
•第3级:资产或负债的投入不是基于可观察到的市场数据或基于未来事件发生的可能性(即不可观察到的投入)。
下表列出了2021年年终和2020年年终按公允价值计量的资产:
| | | | | | | | | | | | | | | | | | | | | | | |
| 2021 | | 2020 |
| 金额,以美元为单位‘000 | 1级 | | 总计 | | 1级 | | 总计 |
| 对FVTOCI指定的股权工具的投资 | 1,449 | | | 1,449 | | | — | | | — | |
| 12月31日的结余 | 1,449 | | | 1,449 | | | — | | | — | |
下表列出了2021年年终和2020年年终按公允价值计量的负债:
| | | | | | | | | | | | | | | | | | | | | | | |
| 2021 | | 2020 |
| 金额,以美元为单位‘000 | 3级 | | 总计 | | 3级 | | 总计 |
| 衍生金融负债 | — | | | — | | | 180 | | | 180 | |
| 其他财务负债 | 165 | | | 165 | | | 212 | | | 212 | |
| 12月31日的结余 | 165 | | | 165 | | | 392 | | | 392 | |
按公允价值通过损益计量的衍生金融负债包括没有公开交易且没有其他可观察到的投入的认股权证。因此,认股权证的公允价值是通过布莱克-斯科尔斯模型确定的,采用了截至每年12月31日的下列参数:
| | | | | | | | | | | |
| 2021 | | 2020 |
| 已发行认股权证的预期到期日 | 0年份 | 0.9 | | 0.9年份 |
| 波动率 | — | % | 53 | % | 53 | % |
| 无风险利率 | — | % | -0.53 | % | -0.53 | % |
下表包括金融工具的账面价值和估计公允价值:
| | | | | | | | | | | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | 2021 | | 2020 |
| 账面价值 | | 公允价值 | | 账面价值 | | 公允价值 |
| 资产: | | | | | | | |
| 现金和现金等价物,包括受限现金 | 192,963 | | | 192,963 | | | 206,664 | | | 206,664 | |
| 贸易和其他应收款 | 29,983 | | | 29,983 | | | 35,901 | | | 35,901 | |
| 负债: | | | | | | | |
| 可转换债券 | 140,886 | | | 140,886 | | | 151,767 | | | 151,767 | |
| 租赁负债 | 20,875 | | | 20,875 | | | 10,192 | | | 10,192 | |
| 其他财务负债 | 165 | | | 165 | | | 25,212 | | | 25,212 | |
| 贸易和其他应付款 | 42,473 | | | 42,473 | | | 47,666 | | | 47,666 | |
| 衍生金融负债 | — | | | — | | | 181 | | | 181 | |
上述金融工具的公允价值均按内部计算,但由独立估值师计算的衍生金融负债中的权证及转换选择权除外。现金及现金等价物、贸易及其他应收账款以及贸易及其他应付款项按账面值列账,鉴于该等票据到期日较短,账面价值与公允价值大致相同。融资租赁负债及贷款及借款(包括非流动部分及流动部分)的公允价值均以公平交易为基础。
该表列出了所列每个期间可转换债券的净头寸以及现金和现金等价物的分析,显示了包括名义利息在内的剩余未贴现合同金额。
| | | | | | | | | | | | | | |
| 金额,以美元为单位‘000 | | 2021 | | 2020 |
| 现金和现金等价物(包括受限现金) | | 192,963 | | | 206,664 | |
| 可转换债券--一年内偿还 | | (1,879) | | | (2,040) | |
| 可转换债券-一年后偿还 | | (139,007) | | | (149,727) | |
| 净债务 | | 52,077 | | | 54,897 | |
| | | | |
| 现金和现金等价物(包括受限现金) | | 192,963 | | | 206,664 | |
| 总债务--固定利率 | | (140,886) | | | (151,767) | |
| 净债务 | | 52,077 | | | 54,897 | |
对融资活动产生的负债进行对账:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2020 | | 现金流 | | 非现金变动 | | 2021 |
| 金额,以美元为单位‘000 | | | | | 采办 | | 应计利息支出 | | 摊销成本 | | 公允价值变动 | | 其他 | | |
| 可转换债券 | 151,767 | | | (4,448) | | | — | | | 4,447 | | | 849 | | | — | | | (11,729) | | * | 140,886 | |
| 其他财务负债 | 25,212 | | | (25,000) | | | — | | | — | | | — | | | (27) | | | (20) | | | 165 | |
| 租赁负债 | 10,192 | | | (3,217) | | | 14,118 | | | 680 | | | — | | | — | | | (898) | | | 20,875 | |
| 衍生金融负债 | 181 | | | | | | | | | | | (181) | | | — | | | — | |
| 融资活动的总负债 | 187,352 | | | (32,665) | | | 14,118 | | | 5,127 | | | 849 | | | (208) | | | (12,647) | | | 161,926 | |
*代表可转债在综合全面收益表中反映的换算影响
27. 每股收益和完全稀释后的股票
每股基本收益按本年度已发行普通股的加权平均数计算。稀释每股收益是根据已发行普通股的加权平均数计算的,包括根据某些安排将于未来发行的股份的摊薄效果,例如认股权计划及认股权证的发行。2021年、2020年和2019年,每股基本和稀释后利润(亏损)为:
| | | | | | | | | | | | | | | | | |
| 2021 | | 2020 | | 2019 |
| 母公司股权所有者应占净利润(单位:美元‘000) | 15,996 | | | 37,746 | | | 40,557 | |
| 加权平均流通股 | 642,007,692 | | | 636,268,929 | | | 626,315,013 | |
| 基本每股收益(美元) | 0.025 | | | 0.058 | | | 0.065 | |
| 加权平均稀释后已发行股份 | 701,151,525 | | | 682,737,280 | | | 673,519,995 | |
| 稀释后每股收益(单位:美元) | 0.023 | | | 0.055 | | | 0.060 | |
2021年用于计算每股摊薄利润的摊薄净利润为美元16.0百万美元。用于计算每股基本利润的加权平均已发行股份和加权平均已发行稀释股份之间的差额与期权、认股权证和长期转让权证有关。这个62,412,622与可转换债券相关的平均股份是反摊薄的,因此不包括在普通股加权平均数之外,以稀释每股收益为目的。
稀释后股份
下表列出了截至2021年12月31日的已发行股数和已发行股权以及法定股本的构成以及这些财务报表的日期。
股票和其他票据在2021年12月31日至2022年4月4日期间的变动情况如下表所示:
| | | | | | | | | | | | | | | | | | | | | | | |
| 2021年12月31日 | | 已发行股份 | | 保留股份 | | April 4, 2022 |
| 股票 | 648,749,282 | | 2,683,764 | | — | | 651,433,046 |
| 认股权证 | — | | — | | — | | — |
| 选项 | 52,789,478 | | (1,640,072) | | (599,313) | | 50,550,093 |
| 可转换债券 | 62,412,622 | | — | | — | | 62,412,622 |
| LTIP | 10,992,546 | | (1,849,504) | | 8,179,538 | | 17,322,580 |
| 已发布 | 774,943,928 | | (805,812) | | 7,580,225 | | 781,718,341 |
| 可供发行 | 105,056,072 | | 805,812 | | (7,580,225) | | 98,281,659 |
| 法定股本 | 880,000,000 | | — | | — | | 880,000,000 |
28. 股东权益
公司的法定股本为美元。10.0百万欧元(欧元8.8百万,汇率(欧元:美元)等于1:1.1334),分为880,000,000面值为欧元的普通股0.01每个人。2021年12月31日648,749,282 (2020: 638,821,000)流通股已全部缴足股款。其他准备金包括与货币兑换、基于股票的薪酬支出和其他股权结算交易有关的准备金。请参阅综合权益变动表及附注28。
29. 报告年度之后的事件
管理层进行了与全球地缘政治局势和乌克兰战争有关的风险评估,并确定,截至这些财务报表发布之日,战争本身、制裁的影响或战争的影响对Pharming业务没有任何实质性影响。
管理层在报告所述期间之后没有发现任何影响2021年财务报表的事件。

 上图显示了补体级联中C1INH的重要性及其对HAE的意义
上图显示了补体级联中C1INH的重要性及其对HAE的意义