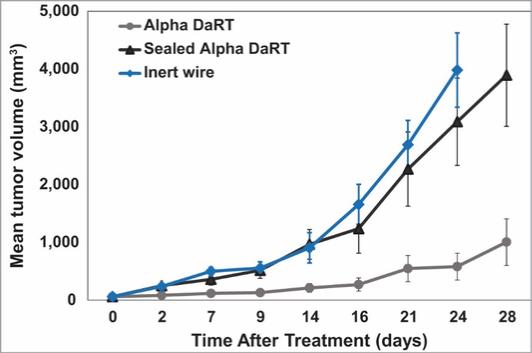
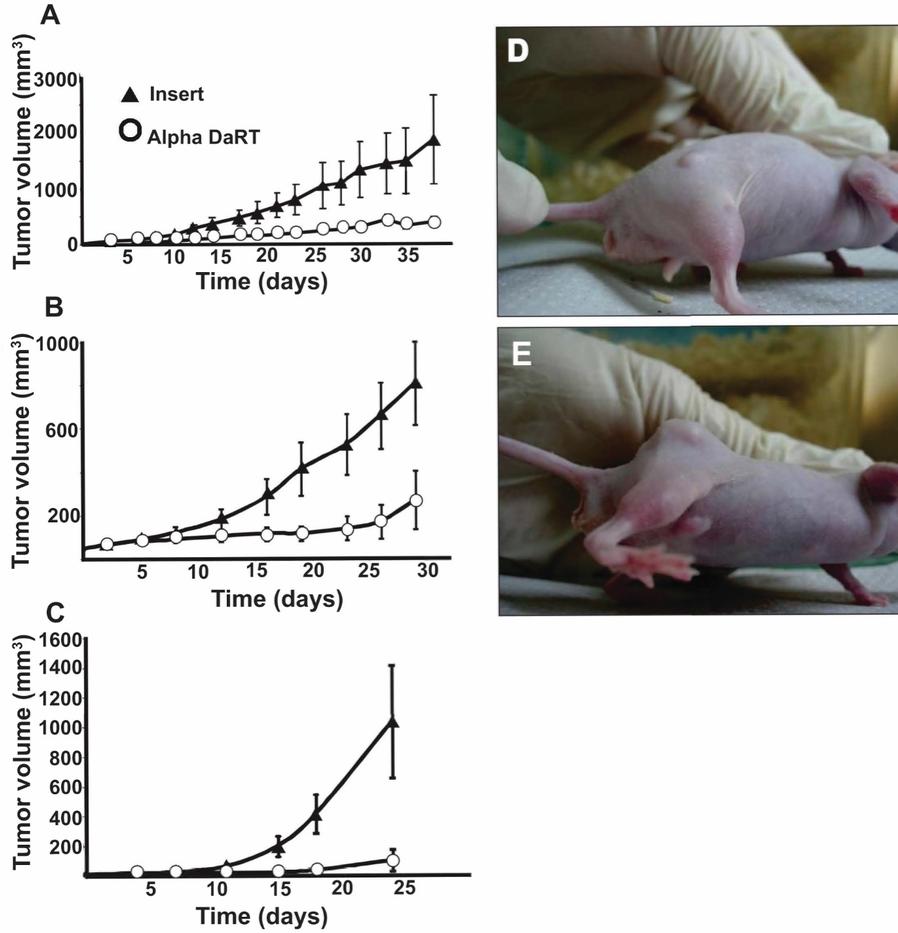
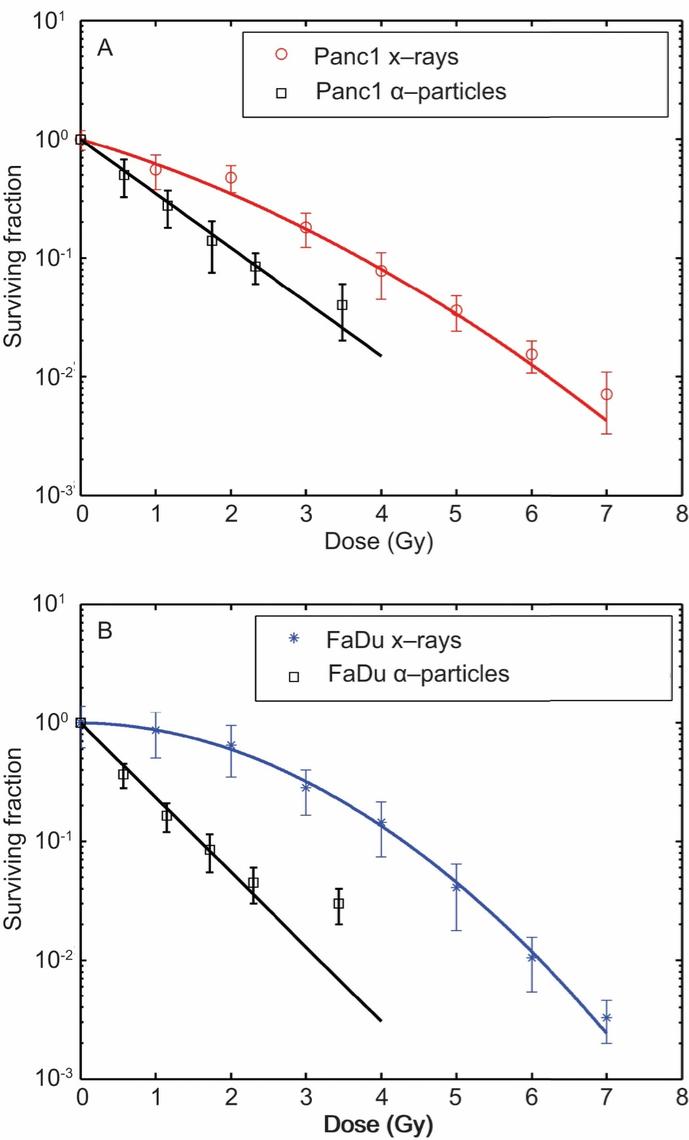
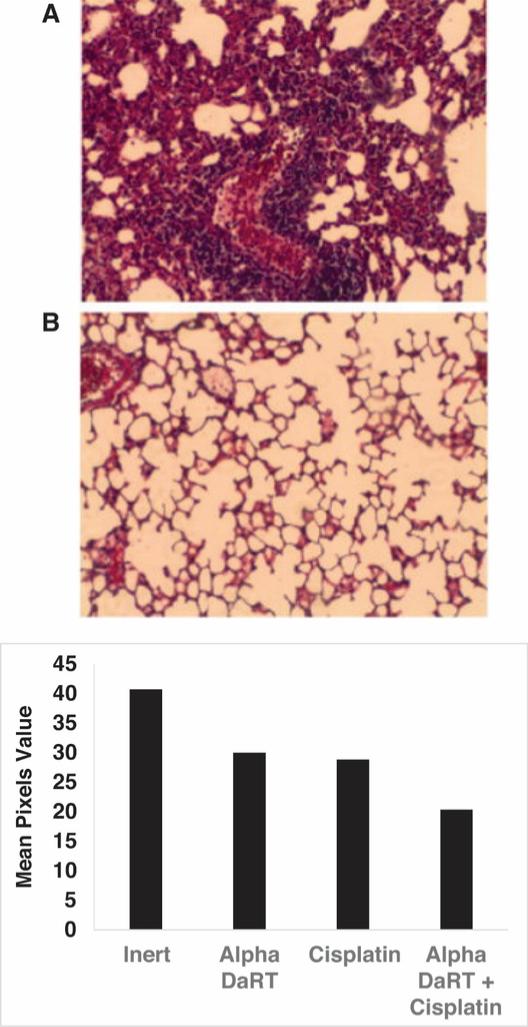
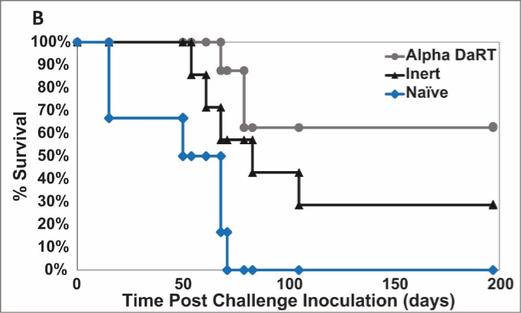
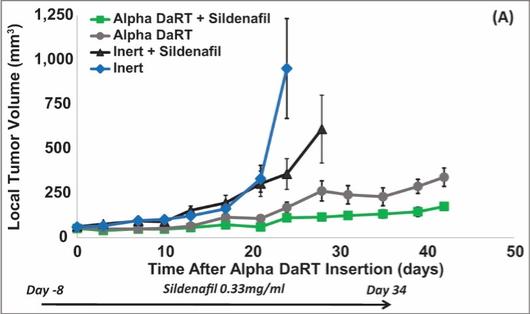
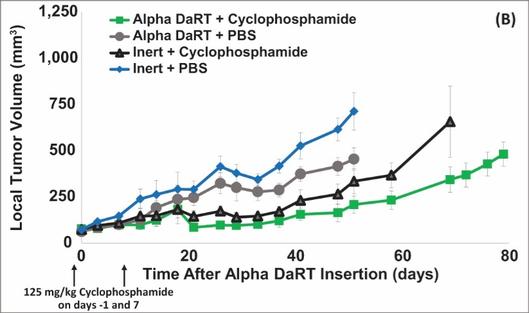
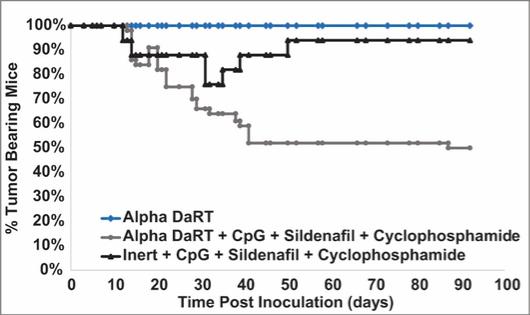
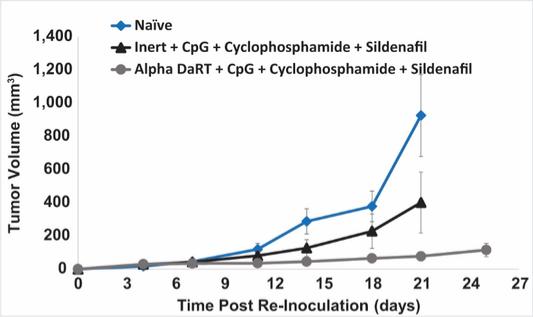
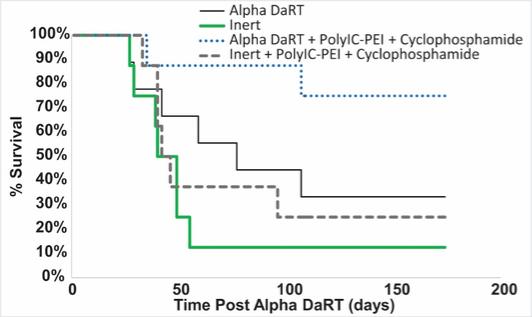
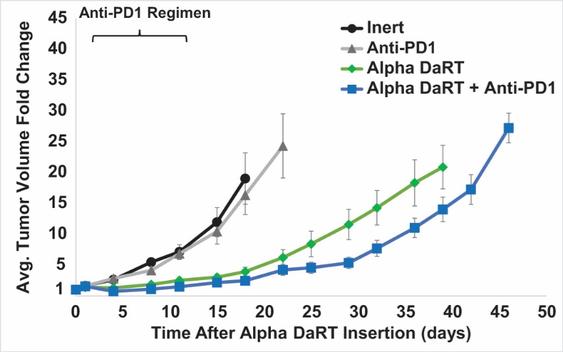
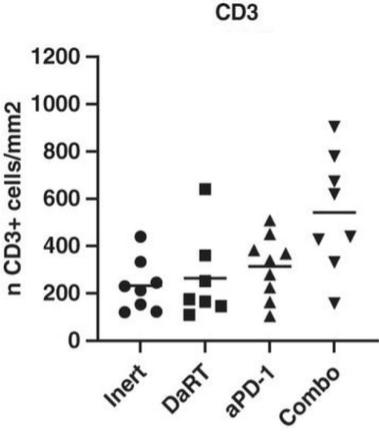
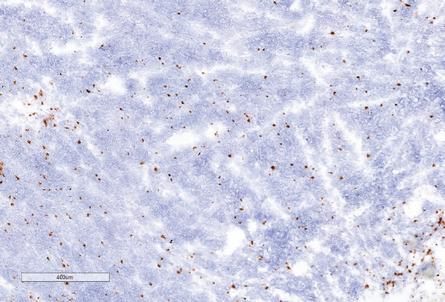
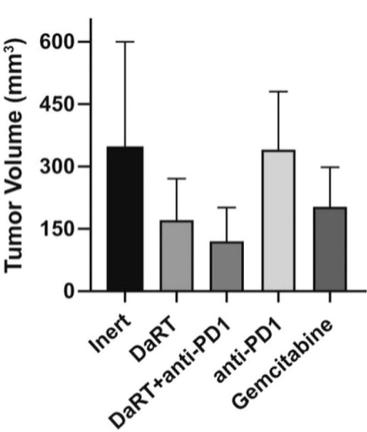
用于经营活动的现金净额
经营活动中使用的现金主要来自经非现金费用和营运资本组成部分变化调整后的净亏损。截至2020年12月31日的一年,经营活动中使用的净现金为7,251美元,而截至2021年12月31日的一年为11,812美元。增加4,561美元的主要原因是净亏损增加18,389美元,被可转换优先股认股权证公允价值变动增加13,054美元所抵销。
截至2019年12月31日的年度,经营活动中使用的净现金为6910美元,而截至2020年12月31日的年度为7,251美元。经营活动中使用的现金增加341美元,主要是由于净亏损增加418美元,但被与重新计量认股权证有关的财务费用减少791美元所抵销,以及营运资本组成部分变化增加963美元,包括预付费用和其他应收账款与截至2019年12月31日的年度相比增加,以及其他应付款和应计费用增加。
投资活动提供的/用于投资活动的现金净额
截至2020年12月31日的年度,投资活动使用的现金净额为7817美元,而截至2021年12月31日的年度,投资活动提供的现金净额为19,273美元。投资活动提供的现金增加27090美元,主要原因是银行存款减少26250美元。
截至2019年12月31日的年度,用于投资活动的净现金为10,163美元,而截至2020年12月31日的年度为7,817美元。用于投资活动的现金减少2346美元,主要原因是购置财产和设备增加2474美元,存款减少4820美元。
融资活动提供的现金净额
在截至2020年12月31日的一年中,融资活动提供的净现金为29,317美元,而截至2021年12月31日的一年为111美元。减少29,206美元的主要原因是在截至2020年12月31日的一年中,发行B系列优先股的收益为28,726美元。
截至2019年12月31日的年度,融资活动提供的净现金为5,323美元,而截至2020年12月31日的年度为29,317美元。增加23,994美元主要是由于截至2020年12月31日止年度发行B系列优先股所得款项为28,726美元,而截至2019年12月31日止年度发行普通股所得款项为5,250美元。
汇率变动的影响现金、现金等价物和限制性现金
汇率变化对现金、现金等价物和限制性现金的影响在截至2020年12月31日的一年中增加了84美元,而在截至2021年12月31日的一年中增加了108美元。增加24美元的主要原因是美元对以色列新谢克尔汇率的变化。
汇率变动对现金、现金等价物和限制性现金的影响在截至2019年12月31日的年度减少18美元,而截至2020年12月31日的年度增加84美元。增加102美元的主要原因是美元对以色列新谢克尔和欧元之间的汇率变化。
资金需求
我们预计,与我们正在进行的活动相关的费用将会增加,特别是当我们继续为我们的Alpha DART技术和其他潜在的未来候选产品进行研究和开发、启动后期临床试验并寻求进一步的营销批准时。此外,如果我们的Alpha DART技术和其他潜在的未来候选产品获得进一步的营销批准,我们预计将产生与产品销售、营销、制造和分销相关的巨额商业化费用。此外,在业务合并完成后,我们预计将产生与上市公司运营相关的额外成本。因此,我们将需要获得与我们的持续业务有关的大量额外资金。如果我们无法在需要时或在有吸引力的条件下筹集资金,我们将被迫推迟、减少或取消我们的研发计划或未来的商业化努力。