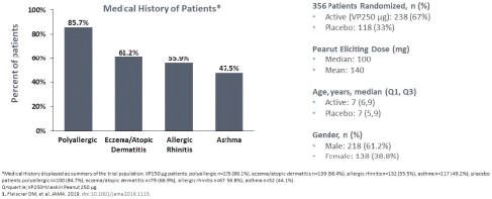
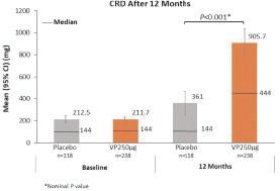
统计学上证明了这两种剂量相对于安慰剂的优越性。这些结果证实了正在进行的对250名
m
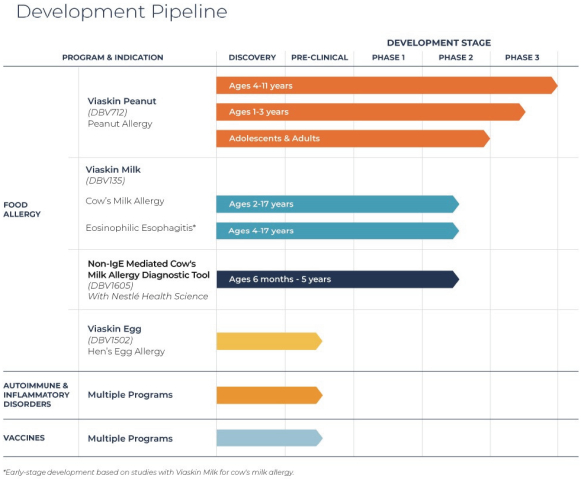
这个年龄组的G剂量,这是研究的B部分正在研究的剂量。表位B部分的注册于2021年第一季度完成,预计2022年年中将公布主要结果。
2020年2月,本公司宣布结束一项全球承销发行,发行总额为7,500,000(I)公开发售的普通股4,535,581以下列形式持有的普通股9,071,162美国存托股票(ADS)在美国、加拿大和欧洲以外的某些国家上市,公开发行价为#美元。10.25每美国存托股份(按#美元的汇率计算)1.0999=1.00欧元),以及(Ii)专门面向欧洲(包括法国)合格投资者的发售2,964,419普通股,发行价为欧元18.63每股普通股(统称为“全球发售”)。
2020年3月,本公司宣布,承销商部分行使了购买选择权338,687以以下形式增发普通股677,374美国存托凭证,发行价为$10.25根据美国存托股份,在扣除佣金和预计发售费用之前(“选项”)。该期权于2020年3月4日结束。
因此,在部分行使选择权后,全球发售的普通股总数为7,838,687普通股,包括4,874,268以下列形式持有的普通股9,748,536美国存托凭证,使全球发行的总收益达到美元160.7百万美元,净收益为$150.0百万美元。
该公司于2020年6月启动了一项全球重组计划,为研究用Viaskin的临床开发和监管审查提供运营空间
™
美国和欧盟的花生。2021年下半年完成了全组织降成本措施的全面实施。重组计划的全面实施导致减产幅度超过
200乔布斯和剩下的全球团队中约有
90人们致力于追求创新和科学发展的新疗法。
重组成本主要包括工资支出、与重组相关的咨询和法律费用,以及设施调整后的设施减值和使用权资产。
下表汇总了经营和全面亏损报表中包括的截至2021年12月31日和2020年12月31日的重组效果:
|
|
|
|
|
|
|
|
|
| |
|
|
|
| |
|
|
|
|
|
|
| |
|
|
(920 |
) |
|
|
19,194 |
|
| |
|
|
— |
|
|
|
2,028 |
|
| |
|
|
— |
|
|
|
2,330 |
|
| |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|