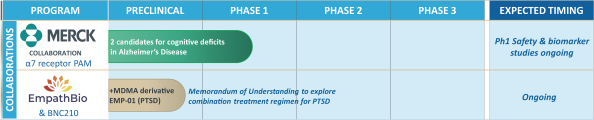
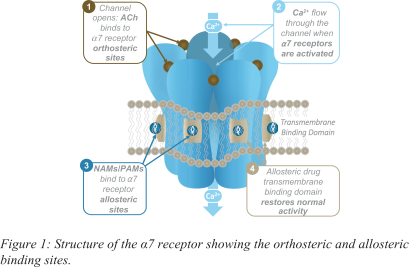
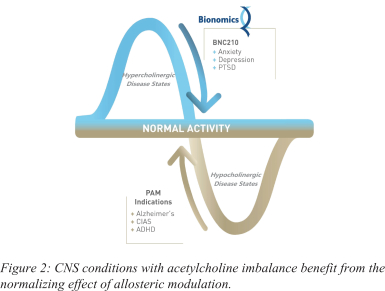
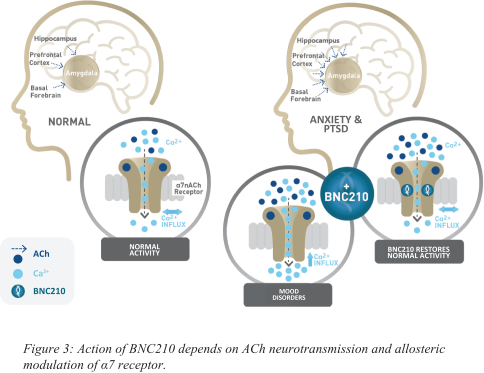
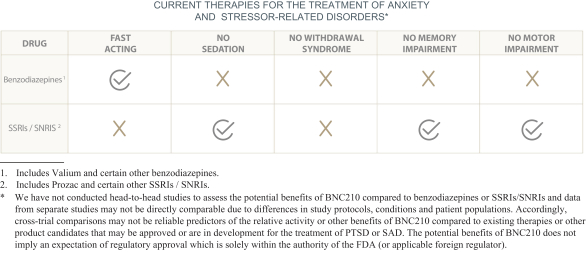
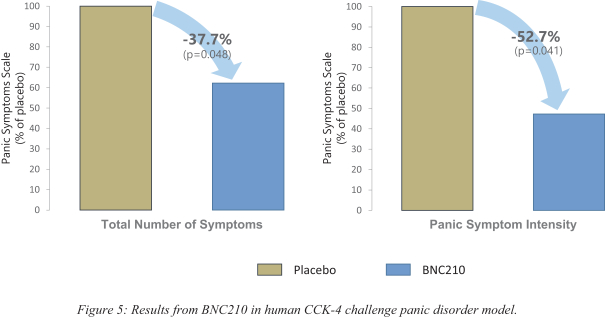
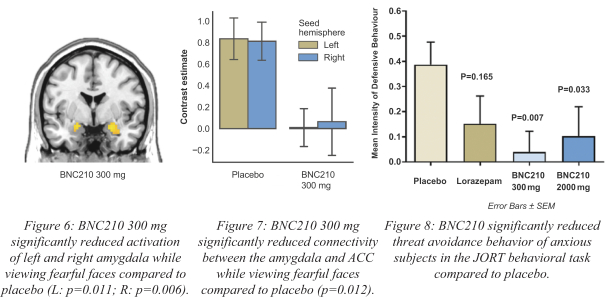
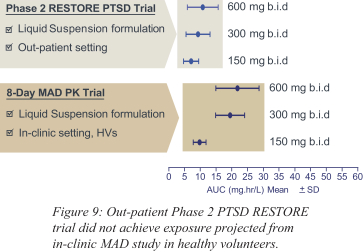
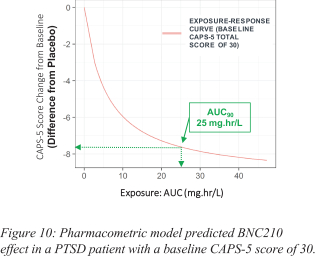
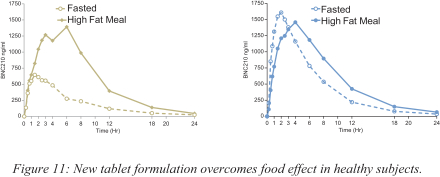
依据第424(B)(4)条提交
注册号码333-261280
招股说明书
1,622,000股美国存托股份
相当于291,960,000股普通股

每个美国存托股份12.35美元
这是Bionomics Limited在美国的首次公开募股。Bionomics Limited将发行美国存托股份 (美国存托凭证),每股相当于180股普通股。
我们的普通股 在澳大利亚证券交易所(ASX?)上市,代码为?BNO。
我们的美国存托凭证已获批 在纳斯达克全球市场上市,代码为BNOX。美国存托凭证的首次公开募股价格为每股美国存托股份12.35美元。
我们是一家新兴的成长型公司,因为2012年的Jumpstart Our Business Startups Act中使用了这个词,因此,我们受到上市公司披露标准的降低。参见招股说明书摘要以及作为一家新兴成长型公司的影响 。
投资我们的美国存托凭证涉及高度风险。在购买任何美国存托凭证之前,您应仔细阅读本招股说明书第13页开始的 风险因素中有关重大风险的讨论。
| 人均广告 | 总计 | |||||||
| 首次公开发行(IPO)价格 |
美元 | 12.35 | 美元 | 20,031,700 | ||||
| 承保折扣和佣金 (1) |
美元 | 0.8645 | 美元 | 1,402,219 | ||||
| 扣除费用前的收益,给我们 |
美元 | 11.4855 | 美元 | 18,629,481 | ||||
| (1) | 我们已同意向承销商报销与此次发行相关的某些费用。请参阅 ?承保。 |
我们已授予承销商在本招股说明书发布之日起30天内向我们额外购买最多243,300张美国存托凭证的选择权 。
我们的某些现有股东,包括那些与我们的董事会成员有关联的股东,已同意在此次发行中按美国存托股份的首次公开募股(IPO)价格以及与此次发行的其他买家相同的条款购买总计约900万美元的我们的美国存托凭证。 承销商将从这些美国存托凭证中获得与他们在此次发售中向公众出售的任何其他美国存托凭证相同的承销折扣和佣金。
美国证券交易委员会或任何其他监管机构都没有批准或不批准这些证券,也没有对本招股说明书的准确性或充分性作出任何判断。任何相反的陈述都是刑事犯罪。
承销商预计在2021年12月20日左右向投资者交付 美国存托凭证。
| Evercore ISI | 威廉·布莱尔威廉·布莱尔。 | 康托尔 | ||||||||
| 贝伦伯格 | H.C.温赖特公司(H.C.Wainwright&Co.) | |||||||||
本招股说明书的日期为2021年12月15日。