目录
美国
美国证券交易委员会
华盛顿特区,20549
表格
| (标记一) |
| | 根据1934年“证券交易法”第13或15(D)节提交的季度报告 |
截至2010年12月31日的季度业绩。
或
| | 根据1934年《证券交易法》第13或15(D)条提交的过渡报告 |
的过渡期 至
委托文件编号:
|
| Vaxart,Inc. |
|
|
| (注册人的确切姓名载于其约章) |
|
|
| |
| |
|
|
| (注册成立或组织的州或其他司法管辖区) |
| (美国国税局雇主身分证号码) |
|
|
| |
| ( |
|
|
| (主要执行机构地址,包括邮政编码) |
| (注册人电话号码,包括区号) |
|
根据该法第12(B)款登记的证券:
|
| 每节课的标题 |
| 商品代号 |
| 注册的每个交易所的名称 | |
|
|
|
|
用复选标记表示注册人(1)是否在过去12个月内(或注册人被要求提交此类报告的较短期限内)提交了1934年《证券交易法》(Securities Exchange Act)第F13或15(D)节要求提交的所有报告,以及(2)在过去90天内是否符合此类提交要求。
用复选标记表示注册人是否在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-T规则405规定必须提交的每个互动数据文件。
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司,还是较小的报告公司,还是新兴的成长型公司。见《交易法》规则第312B-2条中对“大型加速申报公司”、“加速申报公司”、“较小报告公司”和“新兴成长型公司”的定义。
| | 加速文件管理器☐ |
| ☐中的非加速文件管理器 | 规模较小的报告公司。 |
| 新兴成长型公司: |
如果是新兴成长型公司,用勾号表示注册人是否选择不使用延长的过渡期来遵守根据交易所法案第13(A)节提供的任何新的或修订的财务会计准则。☐
用复选标记表示注册人是否是空壳公司(如交易法规则第312b-2条所定义)。**是。
注册人有
表格10-Q
截至2021年9月30日的季度
目录
| 页面 |
||||
| 第I部分 |
财务信息 |
1 | ||
| 第一项。 |
财务报表(未经审计) |
1 | ||
| 截至2021年9月30日和2020年12月31日的简明合并资产负债表 |
1 | |||
| 截至2021年9月30日和2020年9月30日的三个月和九个月的简明综合经营报表和全面亏损率 |
2 | |||
| 截至2021年9月30日和2020年9月30日的三个月和九个月股东权益简明合并报表 |
3 | |||
| 截至2021年9月30日和2020年9月30日的9个月简明现金流量表 |
5 | |||
| 简明合并财务报表附注 |
6 | |||
| 第二项。 |
管理层对财务状况和经营成果的探讨与分析 |
19 | ||
| 第三项。 |
关于市场风险的定量和定性披露 |
29 | ||
| 第四项。 |
管制和程序 |
30 | ||
| 第II部 |
其他信息 |
31 | ||
| 第一项。 |
法律程序 |
31 | ||
| 项目1A。 |
风险因素 |
31 | ||
| 第二项。 |
未登记的股权证券销售和收益的使用 |
31 | ||
| 第三项。 |
高级证券违约 |
31 | ||
| 第四项。 |
煤矿安全信息披露 |
31 | ||
| 第五项。 |
其他信息 |
31 | ||
| 第6项。 |
陈列品 |
32 | ||
| 签名 |
33 | |||
第一部分财务信息
第(1)项:财务报表
Vaxart,Inc.
简明综合资产负债表
(以千为单位,不包括每股和每股金额)
(未经审计)
| 2021年9月30日 | 2020年12月31日 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | $ | $ | ||||||
| 短期投资 | ||||||||
| 应收账款 | ||||||||
| 预付费用和其他流动资产 | ||||||||
| 流动资产总额 | ||||||||
| 长期投资 | ||||||||
| 财产和设备,净值 | ||||||||
| 使用权资产,净额 | ||||||||
| 无形资产,净额 | ||||||||
| 其他长期资产 | ||||||||
| 总资产 | $ | $ | ||||||
| 负债与股东权益 | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | $ | $ | ||||||
| 经营租赁负债的当期部分 | ||||||||
| 与销售未来特许权使用费有关的当前责任部分 | ||||||||
| 其他应计负债 | ||||||||
| 流动负债总额 | ||||||||
| 经营租赁负债,扣除当期部分后的净额 | ||||||||
| 与出售未来特许权使用费有关的负债,扣除当前部分后的净额 | ||||||||
| 其他长期负债 | ||||||||
| 总负债 | ||||||||
| 承担和或有事项(附注8) | ||||||||
| 股东权益: | ||||||||
| 优先股:票面价值;授权股份;截至2021年9月30日和2020年12月31日发行和未偿还 | ||||||||
| 普通股:票面价值;授权股份;和截至2021年9月30日和2020年12月31日分别发行和发行的股票 | ||||||||
| 额外实收资本 | ||||||||
| 累计赤字 | ( | ) | ( | ) | ||||
| 累计其他综合损失 | ( | ) | ||||||
| 股东权益总额 | ||||||||
| 总负债和股东权益 | $ | $ | ||||||
附注是这些未经审计的简明综合财务报表的组成部分。
Vaxart,Inc.
简明合并经营报表与全面亏损
(以千为单位,不包括每股和每股金额)
(未经审计)
| 截至9月30日的三个月, |
截至9月30日的9个月, |
|||||||||||||||
| 2021 |
2020 |
2021 |
2020 |
|||||||||||||
| 收入: |
||||||||||||||||
| 客户服务合同收入 |
$ | $ | $ | $ | ||||||||||||
| 特许权使用费收入 |
||||||||||||||||
| 与销售未来特许权使用费相关的非现金特许权使用费收入 |
||||||||||||||||
| 总收入 |
||||||||||||||||
| 运营费用: |
||||||||||||||||
| 研发 |
||||||||||||||||
| 一般事务和行政事务 |
||||||||||||||||
| 重组成本 |
( |
) | ( |
) | ||||||||||||
| 总运营费用 |
||||||||||||||||
| 营业亏损 |
( |
) | ( |
) | ( |
) | ( |
) | ||||||||
| 其他收入和(支出): |
||||||||||||||||
| 利息收入 |
||||||||||||||||
| 与销售未来特许权使用费相关的非现金利息支出 |
( |
) | ( |
) | ( |
) | ( |
) | ||||||||
| 净汇兑损失 |
( |
) | ( |
) | ( |
) | ||||||||||
| 所得税前亏损 |
( |
) | ( |
) | ( |
) | ( |
) | ||||||||
| 所得税拨备 |
||||||||||||||||
| 净损失 |
$ | ( |
) | $ | ( |
) | $ | ( |
) | $ | ( |
) | ||||
| 每股净亏损-基本和摊薄 |
$ | ( |
) | $ | ( |
) | $ | ( |
) | $ | ( |
) | ||||
| 用于计算每股净亏损的股票-基本和稀释 |
||||||||||||||||
| 综合亏损: |
||||||||||||||||
| 净损失 |
$ | ( |
) | $ | ( |
) | $ | ( |
) | $ | ( |
) | ||||
| 可供出售投资的未实现收益(亏损) |
( |
) | ||||||||||||||
| 综合损失 |
$ | ( |
) | $ | ( |
) | $ | ( |
) | $ | ( |
) | ||||
附注是这些未经审计的简明综合财务报表的组成部分。
Vaxart,Inc.
股东权益简明合并报表
截至2021年9月30日的前三个月和前九个月
(单位为千,份额除外)
(未经审计)
| 累计 | ||||||||||||||||||||||||
| 其他内容 | 其他 | 总计 | ||||||||||||||||||||||
| 普通股 | 实缴 | 累计 | 全面 | 股东的 | ||||||||||||||||||||
| 股票 | 金额 | 资本 | 赤字 | 损失 | 权益 | |||||||||||||||||||
| 截至2021年9月30日的三个月 | ||||||||||||||||||||||||
| 截至2021年6月30日的余额 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||
| 根据2020年10月自动柜员机发行普通股,扣除发行成本为 | ||||||||||||||||||||||||
| 行使股票期权时发行普通股 | ||||||||||||||||||||||||
| 基于股票的薪酬 | — | |||||||||||||||||||||||
| 可供出售投资的未实现收益 | — | |||||||||||||||||||||||
| 净损失 | — | ( | ) | ( | ) | |||||||||||||||||||
| 截至2021年9月30日的余额 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||
| 截至2021年9月30日的9个月 | ||||||||||||||||||||||||
| 截至2020年12月31日的余额 | $ | $ | $ | ( | ) | $ | $ | |||||||||||||||||
| 根据2020年10月自动柜员机发行普通股,扣除发行成本为 | ||||||||||||||||||||||||
| 普通股认股权证行使时发行普通股 | ||||||||||||||||||||||||
| 行使股票期权时发行普通股 | ||||||||||||||||||||||||
| 基于股票的薪酬 | — | |||||||||||||||||||||||
| 可供出售投资的未实现亏损 | — | ( | ) | ( | ) | |||||||||||||||||||
| 净损失 | — | ( | ) | ( | ) | |||||||||||||||||||
| 截至2021年9月30日的余额 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||
附注是这些未经审计的简明综合财务报表的组成部分。
Vaxart,Inc.
股东权益简明合并报表
截至2020年9月30日的前三个月和前九个月
(单位为千,份额除外)
(未经审计)
| 其他内容 | 总计 | |||||||||||||||||||
| 普通股 | 实缴 | 累计 | 股东的 | |||||||||||||||||
| 股票 | 金额 | 资本 | 赤字 | 权益 | ||||||||||||||||
| 截至2020年9月30日的三个月 | ||||||||||||||||||||
| 截至2020年6月30日的余额 | $ | $ | $ | ( | ) | $ | ||||||||||||||
| 2020年7月发行普通股,扣除发行成本 | ||||||||||||||||||||
| 普通股认股权证行使时发行普通股 | ||||||||||||||||||||
| 行使股票期权时发行普通股 | ||||||||||||||||||||
| 基于股票的薪酬 | — | |||||||||||||||||||
| 净损失 | — | ( | ) | ( | ) | |||||||||||||||
| 截至2020年9月30日的余额 | $ | $ | $ | ( | ) | $ | ||||||||||||||
| 截至2020年9月30日的9个月 | ||||||||||||||||||||
| 截至2019年12月31日的余额 | $ | $ | $ | ( | ) | $ | ||||||||||||||
| 2020年3月发行普通股和普通股认股权证,扣除发行成本 | ||||||||||||||||||||
| 于2020年3月向配售代理指定人士发行普通股认股权证 | — | |||||||||||||||||||
| 2020年7月发行普通股,扣除发行成本 | ||||||||||||||||||||
| 普通股认股权证行使时发行普通股 | ||||||||||||||||||||
| 行使股票期权时发行普通股 | ||||||||||||||||||||
| 扣除成本后短期利润的返还 | — | |||||||||||||||||||
| 基于股票的薪酬 | — | |||||||||||||||||||
| 净损失 | — | ( | ) | ( | ) | |||||||||||||||
| 截至2020年9月30日的余额 | $ | $ | $ | ( | ) | $ | ||||||||||||||
附注是这些未经审计的简明综合财务报表的组成部分。
Vaxart,Inc.
现金流量表简明合并报表
(单位:千)
(未经审计)
| 截至9月30日的9个月, |
||||||||
| 2021 |
2020 |
|||||||
| 经营活动的现金流: |
||||||||
| 净损失 |
$ | ( |
) | $ | ( |
) | ||
| 对净亏损与经营活动中使用的现金净额进行调整: |
||||||||
| 折旧及摊销 |
||||||||
| 增加投资保费 |
||||||||
| 基于股票的薪酬 |
||||||||
| 与销售未来特许权使用费相关的非现金利息支出 |
||||||||
| 与销售未来特许权使用费相关的非现金收入 |
( |
) | ( |
) | ||||
| 营业资产和负债变动情况: |
||||||||
| 应收账款 |
||||||||
| 预付费用和其他资产 |
( |
) | ( |
) | ||||
| 应付帐款 |
||||||||
| 其他应计负债 |
( |
) | ( |
) | ||||
| 用于经营活动的现金净额 |
( |
) | ( |
) | ||||
| 投资活动的现金流: |
||||||||
| 购置房产和设备 |
( |
) | ( |
) | ||||
| 出售设备所得收益 |
||||||||
| 购买投资 |
( |
) | ||||||
| 投资到期收益 |
||||||||
| 用于投资活动的净现金 |
( |
) | ( |
) | ||||
| 融资活动的现金流: |
||||||||
| 以登记直接发行方式发行证券的净收益 |
||||||||
| 通过自动柜员机发行普通股的净收益 |
||||||||
| 行使普通股权证时发行普通股所得款项 |
||||||||
| 行使股票期权时发行普通股所得款项 |
||||||||
| 扣除成本后短期利润的返还 |
||||||||
| 融资活动提供的现金净额 |
||||||||
| 现金及现金等价物净增加情况 |
||||||||
| 期初现金及现金等价物 |
||||||||
| 期末现金和现金等价物 |
$ | $ | ||||||
| 补充披露非现金融资活动: |
||||||||
| 向配售代理的代表发出认股权证 |
$ | $ | ||||||
| 取得使用权资产所产生的经营租赁负债 |
$ | $ | ||||||
| 与租赁相关的资产和负债在提前终止和修改租赁时取消确认 |
$ | $ | ||||||
| 购置列入应付帐款和应计费用的财产和设备 |
$ | $ |
附注是这些未经审计的简明综合财务报表的组成部分。
Vaxart,Inc.
简明合并财务报表附注(未经审计)
注1.报告的组织结构和依据
总司令:
Vaxart Biosciences,Inc.最初于#年在加利福尼亚州注册成立。三月2004,年,该公司更名为Vaxart,Inc.(“私人Vaxart”),名称为西海岸生物公司(West Coast Biologals,Inc.)。七月2007,在特拉华州重新注册。
在……上面二月十三日(星期四)2018,Private Vaxart完成了与Aviragen治疗公司(“Aviragen”)的业务合并,根据该合并,Aviragen与Private Vaxart合并,Private Vaxart作为Aviragen的全资子公司继续存在(“合并”)。根据合并条款,Aviragen公司更名为Vaxart公司(连同其子公司“公司”或“Vaxart”),私人Vaxart公司更名为Vaxart生物科学公司。
在……上面2020年6月8日,公司股东批准了对公司公司注册证书的修订,将其普通股和优先股的面值从1美元改为1美元。
在……上面2020年10月13日,本公司已订立公开市场销售协议,“2020年10月自动柜员机“),据此,它可以不时通过销售代理提供和出售其普通股股票,总发行价最高可达$
在九截至的月份9月30日, 2021此外,该公司还额外销售了一批产品。
在……上面2021年9月13日这个2020年10月自动柜员机已终止并开启2021年9月15日本公司已签订受控股权发行及销售协议(The Ctrl Equity Offering And Sales Agreement)。“2021年9月自动柜员机“),据此可能不时通过销售代理提供和出售其普通股股票,总发行价最高可达$
该公司的主要业务设在加利福尼亚州旧金山南部,并在
注2.《重要会计政策摘要》
列报基础--本公司根据美国证券交易委员会的规章制度编制了随附的简明合并财务报表。根据这些规则和规定,按照美国公认会计原则(“美国公认会计原则”)编制的综合财务报表中通常包含的某些信息和脚注披露已被浓缩或省略。这些简明综合财务报表应与本公司截至该年度的经审计财务报表及相关附注一并阅读十二月31, 2020,包括在公司年度报告的表格中。10-K于向美国证券交易委员会备案2021年2月25日(“年度报告”)。除非下面注明,否则已经有不是附注中所述的公司重大会计政策的重大变化2在年度报告中包括的综合财务报表。管理层认为,未经审核的简明综合财务报表包括所有必要的调整(仅包括正常经常性调整),以公平地反映公司的财务状况及其运营和现金流的结果。该等过渡期的经营结果如下不必须表明全年或未来任何时期的预期结果。
Vaxart,Inc.
简明合并财务报表附注(未经审计)
合并基础--简明合并财务报表包括Vaxart,Inc.及其子公司的财务报表。Vaxart,Inc.与其子公司之间的所有重大交易和余额都已在合并中消除。
使用估计--在按照美国公认会计原则编制财务报表时,管理层需要做出影响资产、负债、收入和费用报告金额的估计和假设,并在财务报表和附注中披露或有资产和负债。实际结果和结果可能与这些估计和假设不同。
投资-减少超额现金余额可能投资于有价证券。所有可随时转换为已知金额、规定到期日大于或超过规定到期日的投资。三购买的月份被归类为投资。
该公司在购买时确定其有价证券投资的适当分类,并在每个资产负债表日期重新评估这种指定。可出售的债务证券被归类并计入可供出售的资产。经考虑本公司的保本目标及流动资金要求后,可能在规定的到期日之前出售这些债务证券。这些证券按公允价值列账,未实现损益(税后净额)作为股东权益的一个组成部分报告,但被确定为非临时性的未实现损失除外,这些未实现损失被记录在其他收入和(费用)中。出售有价证券的已实现损益按照特定的识别方法确定,该损益计入其他收入和(费用)的组成部分。可供出售的投资根据每种工具的基本有效到期日以及本公司是否有意图和能力持有该投资超过一段时间而被分类为流动资产或非流动资产。12月份。剩余期限为1210个月或以下被归类为流动资产,并报告为浓缩综合资产负债表中的短期投资。剩余期限超过的有价证券12本公司持有该投资的意向和能力超过5个月的几个月。12这些月份被归类为非流动月份,并计入浓缩综合资产负债表中的长期投资。
证券在每个报告期结束时进行减值评估。评估减值时会考虑众多因素,包括公允价值下降至摊余成本基础以下是由于信贷相关因素还是非信贷相关因素、发行人的财务状况和近期前景,以及持有投资的意图和能力,以实现预期的公允价值回升。与信贷相关的减值被确认为资产负债表上的一项准备,并对收益进行了相应的调整。任何符合以下条件的损害不与信贷有关的项目在扣除适用税项后的其他综合亏损中确认。
信用风险不集中的金融工具可能使公司面临严重的信用风险,主要包括现金、现金等价物和可供出售的投资。该公司将其现金、现金等价物和可供出售的投资放在管理层认为具有高信用质量的金融机构。如果持有现金和现金等价物的金融机构违约,超过联邦保险限额,公司将面临信用风险。本公司拥有不自成立以来,其存款出现过任何亏损。
该公司投资战略的主要重点是保存资本和满足流动性要求。该公司的投资政策通过限制集中在任何一对企业发行人或行业进行评级,并建立最低允许信用评级。
最近的国际会计公告
在……里面八月2020,FASB发布的会计准则更新(ASU)2020-06, 债务-带转换和其他选项的债务(小主题470-20)和衍生工具和套期保值--实体自有权益的合同(小主题815-40).*除了简化某些债务和股权工具的会计处理外,无尽管本公司目前尚有未偿还的债务工具,但本次标准更新提供了在计算每股收益时应如何处理某些工具的指导意见。公司采用新的指导方针生效2021年1月1日采用改良的回顾性调查方法。它的采用对计算今年迄今基本每股收益和稀释后每股收益所使用的股份数量产生了无形的影响。
公司审查了所有其他重要的新发布的会计声明,这些声明包括不但仍然有效,并得出结论认为,它们要么是不适用于其运营或采用的是不预计将对其财务状况或经营业绩产生实质性影响。
Vaxart,Inc.
简明合并财务报表附注(未经审计)
注3……金融工具的公允价值。
公允价值会计适用于所有以公允价值在财务报表中经常性(至少每年)确认或披露的金融资产和负债以及非金融资产和负债。金融工具包括现金及现金等价物、有价证券、应收账款、应付账款及因到期日相对较短而接近公允价值的应计负债。
在资产负债表中按公允价值经常性记录的资产和负债根据与用于计量其公允价值的投入相关的判断水平进行分类。公允价值会计准则提供了计量公允价值的框架,并要求披露公允价值是如何确定的。公允价值被定义为在报告日在市场参与者之间有序交易中为出售资产而收取的价格或为转移负债而支付的价格(退出价格)。会计准则还规定了三-一级估值层次结构,根据用于计量公允价值的估值技术的输入是可观察的还是不可观察的,确定这些输入的优先顺序。可观察到的投入反映了从独立来源获得的市场数据,而不可观察到的投入反映了报告实体所做的市场假设。
这个三-评估技术输入的层次结构简要总结如下:
级别:1未调整的投入是在计量日期相同资产或负债的活跃市场上未经调整的报价;
级别:2短期投入是指活跃市场中类似资产或负债的可观察的、未调整的报价,相同或类似资产或负债的市场中的未调整报价。不活跃的或其他可观察到的或可被相关资产或负债的整个期限的可观察市场数据所证实的其他投入;以及
级别:33-对计量资产或负债的公允价值有重要意义的不可观察的投入,这些资产或负债由较少或较少的资产或负债支持不是市场数据。
下表列出了公司金融资产的公允价值,这些资产是按经常性基础计量的,截至2021年9月30日和2020年12月31日(以千为单位):
| 1级 | 2级 | 3级 | 总计 | |||||||||||||
| 2021年9月30日 | ||||||||||||||||
| 经常性金融资产: | ||||||||||||||||
| 货币市场基金 | $ | $ | $ | $ | ||||||||||||
| 美国国债 | ||||||||||||||||
| 商业票据 | ||||||||||||||||
| 公司债务证券 | ||||||||||||||||
| 总计 | $ | $ | $ | $ | ||||||||||||
| 1级 | 2级 | 3级 | 总计 | |||||||||||||
| 2020年12月31日 | ||||||||||||||||
| 经常性金融资产: | ||||||||||||||||
| 货币市场基金 | $ | $ | $ | $ | ||||||||||||
| 总计 | $ | $ | $ | $ | ||||||||||||
本公司持有
Vaxart,Inc.
简明合并财务报表附注(未经审计)
注:4.包括资产负债表组成部分。
| (a) | 现金,现金等价物企业和投资 |
现金、现金等价物和投资由以下部分组成(以千计):
| 摊销 | 未实现总额 | 估计数 | 现金和现金 | 短期内 | 长期 | |||||||||||||||||||||||
| 成本 | 收益 | 损失 | 公允价值 | 等价物 | 投资 | 投资 | ||||||||||||||||||||||
| 2021年9月30日 | ||||||||||||||||||||||||||||
| 银行里的现金 | $ | $ | — | $ | — | $ | $ | $ | — | $ | — | |||||||||||||||||
| 货币市场基金 | — | — | — | — | ||||||||||||||||||||||||
| 美国国债 | — | ( | ) | — | ||||||||||||||||||||||||
| 商业票据 | — | — | — | — | ||||||||||||||||||||||||
| 公司债务证券 | — | — | ||||||||||||||||||||||||||
| 总计 | $ | $ | — | $ | ( | ) | $ | $ | $ | $ | ||||||||||||||||||
| 摊销 | 未实现总额 | 估计数 | 现金和现金 | 短期内 | 长期 | |||||||||||||||||||||||
| 成本 | 收益 | 损失 | 公允价值 | 等价物 | 投资 | 投资 | ||||||||||||||||||||||
| 2020年12月31日 | ||||||||||||||||||||||||||||
| 银行里的现金 | $ | $ | — | $ | — | $ | $ | $ | — | $ | — | |||||||||||||||||
| 货币市场基金 | — | — | — | — | ||||||||||||||||||||||||
| 总计 | $ | $ | — | $ | $ | $ | $ | $ | ||||||||||||||||||||
| (b) | 应收帐款 |
应收账款包括应收特许权使用费#美元。
| (c) | 财产和设备,净值 |
财产和设备,净值由以下部分组成(以千为单位):
| 2021年9月30日 | 2020年12月31日 | |||||||
| 实验室设备 | $ | $ | ||||||
| 办公室和计算机设备 | ||||||||
| 租赁权的改进 | ||||||||
| 在建工程正在进行中 | ||||||||
| 总资产和设备 | ||||||||
| 减去:累计折旧 | ( | ) | ( | ) | ||||
| 财产和设备,净值 | $ | $ | ||||||
折旧费用为$
| (d) | 使用权资产,NET |
使用权资产,净额由以下资产组成(以千为单位):
| 2021年9月30日 | 2020年12月31日 | |||||||
| 设施 | $ | $ | ||||||
| 办公设备 | ||||||||
| 使用权资产,净额 | $ | $ | ||||||
Vaxart,Inc.
简明合并财务报表附注(未经审计)
| (e) | 无形资产净额 |
无形资产包括发达的技术和知识产权。无形资产按成本减去累计摊销列账。摊销是使用直线法计算的,使用寿命范围为
| 2021年9月30日 | 2020年12月31日 | |||||||
| 发达的技术 | $ | $ | ||||||
| 知识产权 | ||||||||
| 总成本 | ||||||||
| 减去:累计摊销 | ( | ) | ( | ) | ||||
| 无形资产,净额 | $ | $ | ||||||
的摊销费用总额三截至的月份9月30日, 2021和2020,是$
| 截至十二月三十一日止的年度: | 金额 | |||
| 2021年(还剩三个月) | $ | |||
| 2022 | ||||
| 2023 | ||||
| 2024 | ||||
| 2025 | ||||
| 此后 | ||||
| 总计 | $ | |||
| (f) | 其他应计负债 |
其他应计负债包括以下负债(以千计):
| 2021年9月30日 | 2020年12月31日 | |||||||
| 应计补偿 | $ | $ | ||||||
| 应计临床和制造费用 | ||||||||
| 应计专业和咨询服务 | ||||||||
| 其他负债,流动部分 | ||||||||
| 总计 | $ | $ | ||||||
注:5.--收入。
与客户签订服务合同
合同余额。截至2010年12月1日2021年9月30日和2020年12月31日,这里有
剩余的履约义务。剩余履约义务(“RPO”)包括递延收入加上未开单的合同收入。截止日期:2021年9月30日和2020年12月31日,有递延收入和RPO总额为及$
Vaxart,Inc.
简明合并财务报表附注(未经审计)
版税协议
年,Aviragen与葛兰素史克(GlaxoSmithKline,plc)签订了一项产生特许权使用费的研究和许可协议。1990用于开发和商业化扎那米韦(Zanamivir),这是一种神经氨酸酶抑制剂,由葛兰素史克(GSK)以瑞乐沙(Relenza)的名称销售,用于治疗流感。该公司的所有Relenza专利都已到期,最后一项剩余专利将于#年到期2019年7月在日本,特许权使用费收入在那时停止,尽管直到2020年4月30日,它仍然受到销售退货和汇率差异调整的影响。曾经有过
根据Aviragen于#年与第一三共株式会社(“Daiichi Sankyo”)签订的合作和许可协议,该公司还通过在日本出售Inavir获得特许权使用费收入。2009.在……里面2010年9月,辛酸拉奈米韦已获日本厚生福利省批准销售,用于治疗成人和儿童流感,第一三共以依那韦的名称推销该药。在日本,辛酸拉奈米韦被日本厚生福利省批准销售,用于治疗成人和儿童流感,第一三共将其命名为依那韦。根据协议,该公司目前收到一份
该公司的特许权使用费收入是季节性的,与流感季节一致,因此该公司的特许权使用费收入大部分来自第一和第四财政季度。
注:6。与销售未来特许权使用费有关的责任
在……里面2016年4月,Aviragen与Healthcare Royalty Partners III,L.P.(“HCRP”)签订了特许权使用费权益收购协议(“RIAA”)。在RIAA下,HCRP赚取了$
根据相关会计指引,由于HCRP根据RIAA可赚取的特许权使用费金额受到限制,本次交易将作为一项负债入账,该负债将在安排的有效期内使用利息方法摊销。本公司拥有不是向HCRP支付任何金额的义务,但将其从第一三共收到的版税份额转嫁给HCRP的义务除外。为了记录债务的摊销,公司需要估计根据许可协议未来将收到的特许权使用费支付总额,以及在本协议有效期内将转嫁给HCRP的支付总额。因此,该公司对负债的未摊销部分计入利息,并使用估计的实际利率记录非现金利息支出。将传递给hcrp的每一期间所赚取的特许权使用费被记录为与销售未来特许权使用费有关的非现金特许权使用费收入,任何超出的部分都将被记录为非现金特许权使用费收入。不必须将传递记录为特许权使用费收入。在下一季度向HCRP支付转账特许权使用费时,与销售未来特许权使用费相关的责任相应减少。本公司定期评估预期的特许权使用费支付,如果该等支付高于或低于最初估计,本公司将调整债务和利率的摊销。作为这一会计核算的结果,即使该公司不在保留HCRP在特许权使用费中的份额的情况下,它将继续记录与这些特许权使用费相关的非现金收入,直到相关负债(包括相关利息)的金额完全摊销为止。
下表显示了本年度负债账户内的活动情况。九截至的月份9月30日, 2021*(以千为单位):
| 与销售未来特许权使用费有关的总负债,期间开始 | $ | |||
| 支付给HCRP的非现金特许权使用费收入 | ( | ) | ||
| 已确认非现金利息支出 | ||||
| 与销售未来特许权使用费有关的总负债,期末 | ||||
| 当前部分 | ( | ) | ||
| 长期部分 | $ |
Vaxart,Inc.
简明合并财务报表附注(未经审计)
注:7……签订租约。
北京公司拥有下列办公和制造设施的使用权初始条款超过以下条件的经营租赁协议
该公司于#年取得位于加利福尼亚州南三藩市的房地产使用权。2020年11月:根据一份原定于8月1日终止的租约2025年9月30日它已经被延长到2029年3月31日使用不是扩展选项。年,该公司还获得了位于加利福尼亚州旧金山南部的房地产使用权。2015年6月这件事原定于周二终止。2020年4月30日,使用一个-公司于以下时间行使的延长年期选择权2019年7月将租约延长至2025年4月30日它已经被延长到2029年3月31日可选择扩展以获得额外的此外,本公司通过于2018年2月,位于佐治亚州Alpharetta的设施的使用权,于2010年终止。2021年2月28日使用不是扩展选项。这些设施在租赁期的剩余时间内转租生效。2018年11月30日。此外,根据一项租赁协议,本公司拥有位于加利福尼亚州旧金山南部的设施的使用权,在一-延期一年,现在终止于2022年7月31日使用不是扩展选项。此外,根据一项租约,该公司有权使用位于加利福尼亚州旧金山南部的一家设施,该租约于2029年3月30日使用一个-年续订选项。该公司还在一份生产大宗疫苗产品的工作说明书中确定了租赁加利福尼亚州伯灵格姆设施的嵌入租约,预计将于#年完成。2022,以及短期嵌入式租赁,用于租赁加利福尼亚州旧金山南部和威斯康星州洛迪的设施。
自.起2021年9月30日,初始租期超过10年的经营租赁的加权平均贴现率一那一年是
下表汇总了公司对其经营租赁负债的未贴现现金支付义务,初始期限超过十二截至9月1日的月份2021年9月30日(以千为单位):
| 截至十二月三十一日止的年度: | ||||
| 2021年(还剩三个月) | $ | |||
| 2022 | ||||
| 2023 | ||||
| 2024 | ||||
| 2025 | ||||
| 此后 | ||||
| 未贴现合计 | ||||
| 减去:推定利息 | ( | ) | ||
| 未来最低还款额的现值 | ||||
| 经营租赁负债的当期部分 | ( | ) | ||
| 经营租赁负债,扣除当期部分后的净额 | $ |
该公司目前拥有
某些设施的运营租赁协议包括非租赁成本,如公共区域维护,这些成本被记录为可变租赁成本。三和九截至的月份9月30日, 2021和2020,摘要如下(以千为单位):
| 截至9月30日的三个月, | 截至9月30日的9个月, | |||||||||||||||
| 2021 | 2020 | 2021 | 2020 | |||||||||||||
| 租赁费 | ||||||||||||||||
| 经营租赁成本 | $ | $ | $ | $ | ||||||||||||
| 短期租赁成本 | ||||||||||||||||
| 可变租赁成本 | ||||||||||||||||
| 转租收入 | ( | ) | ( | ) | ( | ) | ||||||||||
| 总租赁成本 | $ | $ | $ | $ | ||||||||||||
与经营租赁相关的现金净流出总额为#美元。
Vaxart,Inc.
简明合并财务报表附注(未经审计)
注8。承诺和或有事项
| (a) | 购买承诺 |
自.起2021年9月30日,公司大约有$
| (b) | 弥偿 |
在正常业务过程中,本公司签订以下协议可能包括赔偿条款。根据该等协议,本公司可能对被补偿方遭受的损失进行赔偿,使之无害,并为其辩护。其中一些条款将把损失限制在因下列原因造成的损失第三--党的行动。在某些情况下,协议终止后赔偿仍将继续。根据这些规定,公司未来可能需要支付的最高潜在金额为不可以确定的。公司还与其董事和高级管理人员签订了赔偿协议,要求公司赔偿其董事和高级管理人员在以下情况下的责任:可能在特拉华州公司法允许的最大范围内,由于他们作为董事或高级管理人员的身份或服务而产生的。该公司目前有董事和高级职员保险。
| (c) | 诉讼 |
公司时不时地可能参与与其业务相关的法律诉讼。根据目前掌握的信息,本公司认为,与针对其的任何悬而未决的行动有关的合理可能损失的金额或范围合计超过已建立的准备金不对其综合财务状况或现金流产生重大影响。然而,目前或未来的任何争议解决或法律程序,无论任何此类程序的是非曲直,都可能导致巨额成本,并转移管理层成功运营本公司所需的注意力和资源,并可能对其业务、财务状况和运营结果产生重大不利影响。
在……上面2020年8月4日,一份据称的股东派生诉讼被提交给圣马特奥县加利福尼亚州高等法院,题为Godfrey诉Latour等人案。*修改后的申诉于2020年9月4日,此案被重新命名为恩尼斯诉拉图尔等人案. A 第二经修订的申诉提交日期为2020年11月25日。在……上面2021年3月15日法院维持了对第二修改后的申诉,但不影响提交进一步修订后的申诉。一个第三经修订的申诉提交日期为2021年6月11日这个第三修改后的起诉书将某些现任和前任Vaxart董事列为被告,主张对他们提出违反受托责任、不当得利和浪费的索赔,并要求裁决未指明的损害赔偿、某些公平救济以及律师费和费用等。起诉书还主张对违反受托责任以及协助和教唆违反对停战资本有限责任公司(“停战”)的受托责任的索赔。起诉书对授予公司某些高级管理人员和董事的某些股票期权提出了质疑2020年3月24日和2020年6月15日;本公司在以下文件中所作的若干指称陈述及遗漏2020年4月24日委托书;以及对二由停战组织持有的授权证,披露于2020年6月8日。这个第三修改后的起诉书声称代表公司并为公司的利益派生地提起诉讼,并将公司列为“名义上的被告”,不是寻求损害赔偿。在……上面2021年8月31日所有被告都将各自的抗辩书提交给第三修改后的申诉仍悬而未决。
在……上面2020年9月8日,一份据称的股东派生诉讼被提交给特拉华州衡平法院,题为Galjour诉Floroiu等人案。在……上面2020年10月20日,所谓的股东派生和集体诉讼申诉,标题为Jaquith诉Vaxart,Inc.,提交给特拉华州衡平法院。2020年11月12日,这个二操作已合并到标题下在Re Vaxart,Inc.股东诉讼在贾基斯的诉讼中提出的申诉被认为是有效的抗辩。执行起诉书将Vaxart的某些现任和前任董事列为被告,声称对他们提出了违反受托责任和不当得利的索赔,并要求获得未指明的损害赔偿、某些公平救济以及律师费和费用等。起诉书还主张对不当得利和违反受托责任的索赔,或者协助和教唆违反停战受托责任的索赔。起诉书对授予公司某些高级管理人员和董事的某些股票期权提出了质疑2020年3月24日和2020年6月15日;本公司在以下文件中所作的若干指称陈述及遗漏2020年4月24日委托书;以及对二由停战组织持有的授权证,披露于2020年6月8日。起诉书声称带来了除了一代表公司并为公司利益派生的索赔。它还声称带来了一基于公司被指控的陈述和遗漏而提出的违反受托责任的索赔2020年4月24日委托书,直接代表Vaxart的一类股东。起诉书将该公司列为针对其不是目前正在寻求损害赔偿。2021年1月4日所有被告都提出了驳回诉讼的动议。这些动议正在审理中。
Vaxart,Inc.
简明合并财务报表附注(未经审计)
在……里面八月和2020年9月,二美国加州北区地区法院也提起了基本上类似的证券集体诉讼。第一个,标题为希梅尔伯格诉Vaxart,Inc.等人案。已于2020年8月24日。这个第二诉讼,标题为Hovhannisyan诉Vaxart,Inc.等人案。已于2020年9月1日(合在一起,“推定的集体诉讼”)。按日期为的订单2020年9月17日,这个二诉讼被认为是相关的;主要原告和主要原告律师随后于2020年12月9日。在……上面2021年1月29日主要原告提交了他们合并的修改后的起诉书。在……上面2021年7月8日所有被告都采取行动,驳回了合并后的修改后的起诉书。在……上面2021年5月14日法院批准了主要原告修改合并后的修订起诉书的请求,并驳回了被告的驳回动议,认为这是没有意义的。在……上面2021年6月10日主要原告提交了一份第一修正合并申诉。这个第一修改后的合并起诉书将Vaxart的某些现任和前任高管和董事以及停战协议列为被告。它声称三违反联邦民事证券法;违反条款10(B)《交换法》和《美国证券交易委员会规则》10b-5,针对本公司和所有个别被告;违反第20(A)违反《交换法》,针对停战协定和所有个别被告;以及违反第20A反对停战的交换法案。这个第一经修订的合并起诉书称,被告错误陈述和/或遗漏有关公司开发诺沃克病毒疫苗、业务对手方的疫苗制造能力以及公司参与Warp Speed(“OWS”)的信息,以及参与抬高Vaxart股价的计划,违反了证券法。这个第一经修订的合并申诉寻求证明为处境相似的股东的集体诉讼,并要求(其中包括)数额不详的损害赔偿以及律师费和费用。在……上面2021年7月8日所有被告都采取行动驳回了第一修正合并申诉。这项动议正在待决。
在……上面2020年10月23日,美国纽约南区地区法院提起了一项申诉,题为Roth诉停战资本有限责任公司案,等人。*起诉书将停战和某些与停战相关的各方列为被告,声称违反了交易法部分16(B)并寻求归还短期利润。起诉书声称是代表公司并为公司的利益提起诉讼,并将公司列为“名义上的被告”,为其寻求利益损害赔偿。
在……上面2021年1月8日所谓的股东菲利普·陈(Phillip Chan)开始了一项专业人士在美国加利福尼亚州北区地区法院提起的诉讼,题为Chan诉Vaxart,Inc.等人案。(“选择退出操作这起起诉书与推定的集体诉讼中提起的起诉书的早期版本几乎完全相同,起诉书中提到了相同的被告,Vaxart的某些现任和前任高管和董事以及停战协议,并声称与相同的事实指控有关的法律主张相同。起诉书称。二违反联邦民事证券法,违反条款10(B)《交换法》和《美国证券交易委员会规则》10b-5对所有被告的指控,以及违反第20(A)《交易法》对个别被告的不利影响。选择退出诉讼指控被告错误陈述和遗漏有关公司开发Covid的信息,违反了证券法-19疫苗及其OWS参与欺骗投资公众并抬高Vaxart的股价。选择退出行动一直被搁置,等待推定的集体诉讼的解决。
在……上面2021年2月4日所谓的股东斯蒂芬·巴克(Stephen Barker)在特拉华州衡平法院提起诉讼,名为Barker诉Vaxart,Inc.等人案。起诉书将公司及其当时的董事会列为被告。起诉书提出了一项索赔,要求声明一公司章程中要求获得绝对多数票才能罢免公司董事的规定,违反了特拉华州一般公司法部分141(K)其他。2021年5月14日法院下达了一项命令,自愿驳回这一诉讼,认为这是毫无意义的。
在……上面2021年3月5日所谓的股东凯瑟琳·萨内特尔(Kathleen Sanetel)向公司董事会发出了一封要求信,要求公司调查并开始对某些董事会成员和/或高管采取适当的法律行动,停战协议从#年开始纠正所谓的不当行为2020年4月。在上或在附近2021年6月2日另一位所谓的股东杰里·贝萨(Jerry Besa)发出了一封基本相同的请求信。索偿函所载的具体指控及被指的不当行为,在各重大方面与本公司于推定的集体诉讼中的综合经修订申诉中的指控及索偿大体相似。董事会在收到Sanetel索偿函后,委任董事会一个委员会(“索偿委员会”),并授权索偿委员会调查索偿函所述事项及决定本公司因应该要求而须采取的行动(如有)。
不是应计金额是因为公司管理层不目前认为任何损失都是可能的不有可能合理估计损失或损失范围(如果有的话)可能任何正在进行的诉讼的结果。本公司为抗辩这些索赔而产生的法律费用在发生时计入费用。
注9**股东权益
| (a) | P推荐股票 |
本公司获授权发行
Vaxart,Inc.
简明合并财务报表附注(未经审计)
| (b) | 普通股 |
除法律另有规定或任何系列优先股的指定证书另有规定外,普通股持有人拥有选举本公司董事及所有其他需要股东采取行动的事项的投票权。普通股持有者有权一对股东投票表决的事项进行每股投票。普通股持有人有权获得下列股息(如果有的话)可能由本公司董事会不时酌情宣布,从合法可供其使用的资金中提取。在……里面不是除非当时已发行的普通股得到同等对待,否则普通股是否会有任何股息或股票拆分或股票组合被宣布或进行股票组合。自.起2021年9月30日,
在公司自动或非自愿清算、解散、资产分配或清盘的情况下,在优先股持有人的权利得到满足后,普通股持有人将有权获得公司所有可供分配给股东的任何类型资产的等额每股收益。确实有不是适用于普通股的偿债基金拨备。
该公司为发行预留的普通股如下:
| 2021年9月30日 | 2020年12月31日 | |||||||
| 已发行和未偿还期权 | ||||||||
| 可供将来授予股权奖励 | ||||||||
| 普通股认股权证 | ||||||||
| 总计 | ||||||||
| (c) | 认股权证 |
截至,以下认股权证尚未结清2021年9月30日在随后的配股、股票拆分、股票分红或其他非常股息或公司普通股或资本结构的其他类似变化的情况下,所有这些都包含标准的反稀释保护,以及无它们对任何损失都有任何参与权:
| 认股权证可转换为的证券 | 未清偿认股权证 | 行权价格 | 到期日 | ||||||
| 普通股 | $ | 2024年9月 | |||||||
| 普通股 | $ | 2024年4月 | |||||||
| 普通股 | $ | 2024年4月 | |||||||
| 普通股 | $ | 2025年3月 | |||||||
| 普通股 | $ | 2025年2月 | |||||||
| 普通股 | $ | 2024年3月 | |||||||
| 普通股 | $ | 2026年12月 | |||||||
| 总计 | |||||||||
如果发生在公司控制范围内的基本交易(权证定义的公司所有权转移),未行使的普通股认股权证持有人可行使的价格为$
Vaxart,Inc.
简明合并财务报表附注(未经审计)
注:10.制定股权激励计划
在……上面2019年4月23日公司股东批准采用2019股权激励计划(“2019计划“),根据该计划,公司有权发行激励性股票期权、非限制性股票期权、股票增值权、限制性股票奖励和限制性股票单位、其他股票奖励和业绩奖励可能以现金、股票或其他财产结算。这个2019计划旨在确保和留住员工、董事和顾问的服务,激励公司的员工、董事和顾问为公司及其附属公司的成功尽最大努力,并为员工、董事和顾问提供一种可能有机会从公司普通股价值的增加中受益。*在通过2019计划,所有以前的计划都被冻结,在没收、取消和到期时,这些计划下的奖励是不由2019计划一下。
根据本协议授权发行的普通股总股数2019最初的计划是
本年度股票期权交易摘要九截至的月份9月30日, 2021,详情如下:
| 加权 | ||||||||||||
| 股票 | 数量 | 平均值 | ||||||||||
| 可用 | 选项 | 锻炼 | ||||||||||
| 对于格兰特 | 杰出的 | 价格 | ||||||||||
| 2021年1月1日的余额 | $ | |||||||||||
| 2019年规划修正案 | — | $ | — | |||||||||
| 授与 | ( | ) | $ | |||||||||
| 练习 | — | ( | ) | $ | ||||||||
| 没收 | ( | ) | $ | |||||||||
| 取消 | ( | ) | $ | |||||||||
| 2021年9月30日的余额 | $ | |||||||||||
自.起2021年9月30日,这里有
Vaxart,Inc.
简明合并财务报表附注(未经审计)
中授予的期权的加权平均授予日期公允价值九截至的月份9月30日, 2021和2020,是$
| 截至9月30日的9个月, | ||||||||
| 2021 | 2020 | |||||||
| 无风险利率 | ||||||||
| 预期期限(以年为单位) | ||||||||
| 预期波动率 | ||||||||
| 股息率 | % | % | ||||||
该公司在授予日衡量所有股票奖励的公允价值,并记录这些奖励的公允价值,扣除估计的没收,计入服务期内的补偿费用。期权确认的股票薪酬总额如下:
| 截至9月30日的三个月, | 截至9月30日的9个月, | |||||||||||||||
| 2021 | 2020 | 2021 | 2020 | |||||||||||||
| 研发 | $ | $ | $ | $ | ||||||||||||
| 一般事务和行政事务 | ||||||||||||||||
| 股票薪酬总额 | $ | $ | $ | $ | ||||||||||||
有效2021年6月16日本公司修改了授予其前董事会主席Wouter W.Latour的未偿还期权的条款,以便归属
自.起2021年9月30日,与已发行的未归属股票期权相关的未确认的基于股票的薪酬成本为#美元。
注11.**关联方交易
在……里面2020年4月该公司记录的净金额为#美元。
Vaxart,Inc.
简明合并财务报表附注(未经审计)
注12*每股净亏损美元
下表列出了每股基本和摊薄净亏损的计算方法(单位为千,不包括每股和每股金额):
| 截至9月30日的三个月, | 截至9月30日的9个月, | |||||||||||||||
| 2021 | 2020 | 2021 | 2020 | |||||||||||||
| 净损失 | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
| 用于计算每股净亏损的股票-基本和稀释 | ||||||||||||||||
| 每股净亏损-基本和摊薄 | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
下列可能稀释的证券不包括在已发行的稀释加权平均股票的计算中,因为它们将具有反稀释作用:
| 截至9月30日的三个月, | 截至9月30日的9个月, | |||||||||||||||
| 2021 | 2020 | 2021 | 2020 | |||||||||||||
| 购买普通股的期权 | ||||||||||||||||
| 基于业绩的限制性股票单位 | ||||||||||||||||
| 购买普通股的认股权证 | ||||||||||||||||
| 从稀释每股收益计算的分母中剔除的潜在摊薄证券总额 | ||||||||||||||||
第二项:财务管理部门对财务状况和经营成果的讨论和分析
以下对我们的财务状况和经营结果进行了讨论和分析D应与本季度报告Form 10-Q中其他部分包含的简明综合财务报表和相关附注一起阅读,并与Form年度报告中包含的经审计综合财务报表一起阅读10-K于2021年2月25日向美国证券交易委员会提交了申请。这份关于Form 10-Q的季度报告包含符合1933年“证券法”(经修订)第27A节和“1934年证券交易法”(经修订)第21E节的含义的前瞻性陈述,受这些条款所创造的“安全港”的约束。前瞻性陈述是基于我们管理层的信念和假设以及我们管理层目前掌握的信息。在某些情况下,您可以通过诸如“可能”、“将会”、“应该”、“可能”、“目标”、“将会”、“预期”、“计划”、“预期”、“相信”、“估计”、“项目”、“预测”、“潜在”以及旨在识别前瞻性陈述并反映我们对相关主题的信念和意见的类似表达来识别前瞻性陈述。我们的实际结果可能与前瞻性陈述中讨论的结果大不相同。可能导致或促成这些差异的因素包括以下讨论的因素和本季度报告中关于表格10-Q的那些因素,特别是在第二部分第1A项中题为“风险因素”的一节中。本Form 10-Q季度报告中包含的前瞻性陈述仅针对本报告日期作出。这些陈述基于截至本Form 10-Q季度报告提交之日我们掌握的信息,虽然我们认为此类信息构成此类陈述的合理基础,但此类信息可能是有限或不完整的,我们的陈述不应被解读为表明我们已对所有潜在可用的相关信息进行了详尽的调查或审核。这些陈述本质上是不确定的,我们告诫投资者不要过度依赖这些陈述。在任何情况下, 我们没有义务修改或更新任何前瞻性声明,无论是由于新信息、情况变化、未来事件或其他原因,我们建议您参考我们可能直接向您作出的任何额外披露,或通过我们未来可能向美国证券交易委员会提交的报告,包括Form 10-K年度报告、Form 10-Q季度报告和Form 8-K当前报告。
公司概况和背景
我们是一家临床阶段的生物技术公司,主要致力于基于我们的载体-佐剂-抗原标准化技术(“VAAST”)专有口服疫苗平台开发口服重组疫苗。我们的口服疫苗旨在产生广泛和持久的免疫反应,可以预防各种传染病,并可能对慢性病毒感染和癌症的治疗有用。我们正在研究的疫苗使用室温稳定的片剂,而不是注射。
我们正在开发针对一系列传染病的预防性候选疫苗,包括SARS-CoV-2(导致2019年冠状病毒病的病毒(“新冠肺炎”))、诺沃克病毒(一种广泛导致急性胃肠炎的病毒)、季节性流感和呼吸道合胞病毒(一种常见的呼吸道感染原因)。我们已经完成了人类剂量和我们的SARS CoV-2候选疫苗第一阶段临床试验的活跃阶段,该试验于2020年10月开始;这项研究已经达到了主要和次要终点。我们的诺沃克病毒候选疫苗的三项第一阶段人体研究已经完成,包括一项关于二价诺沃克病毒疫苗的研究,正如我们在2019年9月披露的那样,该疫苗达到了主要和次要终点。我们的单价H1流感疫苗在第二阶段挑战研究中产生了保护性免疫,类似于获得许可的肌肉内疫苗,可抵御H1流感感染。此外,我们正在开发第一种针对子宫颈癌和人乳头瘤病毒(HPV)引起的异型增生的治疗性疫苗。
对于目前我们候选疫苗的良好制造规范(“cGMP”)生产,我们同时使用内部产能和第三方制造商。此外,我们正在开发目前正在研发的疫苗计划,包括SARS-CoV-2疫苗计划、诺沃克病毒疫苗计划、我们的季节性流感疫苗,以及与Janssen Vaccines&Prevention B.V.公司(“Janssen”)的通用流感疫苗合作,同时也在探索合作机会。在等待许可、合作或协作协议期间,我们的RSV和HPV计划目前处于搁置状态。
Vaxart Biosciences,Inc.最初于2004年3月在加利福尼亚州注册成立,名称为西海岸生物公司(West Coast Biologals,Inc.),2007年7月更名为Vaxart,Inc.(“私人Vaxart”),并在特拉华州重新注册。2018年2月13日,私人Vaxart完成了与Aviragen Treateutics,Inc.(“Aviragen”)的反向合并,据此私人Vaxart幸存了下来。根据合并条款,Aviragen更名为Vaxart,Inc.,Private Vaxart更名为Vaxart Biosciences,Inc.
新冠肺炎相关商业动态
新冠肺炎大流行继续给世界各地的公共卫生和经济带来巨大挑战,并正在影响雇主、员工、患者、社区和商业运营,以及美国经济和金融市场。新冠肺炎大流行的持续严重性和规模将在多大程度上直接或间接影响我们的业务、运营和财务状况,将取决于仍然高度不确定和无法准确预测的未来发展,包括可能出现的关于新冠肺炎的新信息,包括其变体、为遏制它或治疗其影响而采取的行动、全球疫苗接种努力的成功以及对当地、地区、国家和国际市场的经济影响。
到目前为止,我们能够继续运营,预计在可预见的未来不会有任何实质性的中断。然而,我们继续评估新冠肺炎大流行以及其他竞争对手新冠肺炎疫苗的开发对我们的业务和运营的潜在影响,包括我们的费用、供应链和临床试验。我们的合作伙伴大多继续在正常水平或接近正常水平运营他们的设施。虽然我们目前预计我们的运营不会受到任何中断,但新冠肺炎疫情和应对努力未来可能会对我们的运营和/或我们的第三方供应商和合作伙伴的运营产生影响。新冠肺炎疫情对我们业务和相关经济影响的任何负面影响的复苏,也可能会因为一些因素而放缓或逆转,包括传染性更强的新变种的出现。
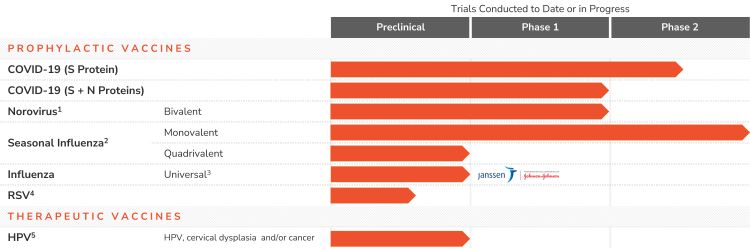
我们的产品线
下表概述了我们口服疫苗开发计划的状况:

|
|
1. |
双价GI.1-GII-4诺如病毒疫苗对GI.1和GII的IgA-ASC应答率分别为78-86%和90-93%。 |
|
|
2. |
单价H1流感疫苗完成第二阶段概念验证疗效研究。四价流感第一阶段暂停,等待合作进程。 |
|
|
3. |
詹森合作。在向Janssen提交初步报告之前,讨论正在进行中。 |
|
|
4. |
RSV计划将与新的抗原合作伙伴合作。该计划目前被搁置。 |
|
|
5. |
HPV治疗前IND反馈已收到。该计划目前被搁置。 |
我们正在开发以下候选片剂疫苗,它们基于我们的专有平台:
|
|
● |
冠状病毒疫苗。我们正在开发一种口服片剂疫苗,以防止SARS-CoV-2感染,这种病毒导致新冠肺炎。我们基于公布的SARS-CoV-2基因组产生了多种候选疫苗,并在临床前模型中评估了它们产生粘膜和系统免疫反应的能力。特别令人感兴趣的是粘膜免疫反应,因为冠状病毒主要是呼吸道感染。我们认为,使用方便的室温稳定片剂接种口服疫苗的后勤优势,在开展重大的公共卫生疫苗接种活动时可能是至关重要的。鉴于最近出现了S蛋白突变的冠状病毒株,这些变异蛋白被认为比原始株更具传染性,随着时间的推移,注射疫苗的血清抗体可能不足以抵御这些SARS-CoV-2变异株,而能够产生针对保守表位的交叉反应T细胞的新疫苗可能具有重大优势。 |
据美国疾病控制和预防中心表示,由SARS-CoV-2病毒引起的新冠肺炎疫情于2019年末在中国武汉爆发,并在全球迅速传播。截至2021年11月3日,全球已发现超过2.48亿例新冠肺炎病例,其中包括美国,美国疾控中心报告的感染人数超过4610万,死亡人数为74.6万人。虽然新冠肺炎的大多数限制,如在家下单,已经取消,但新冠肺炎仍在继续传播,特别是在未接种疫苗的人群中,并仍然威胁着公共健康,尤其是由于新变种的出现。
2020年9月14日,我们宣布,美国食品和药物管理局(FDA)已经批准了我们的临床研究新药(IND)申请,允许启动人体临床试验。2020年10月13日,我们宣布一期临床试验已经开始,2021年2月3日,我们公布了试验的初步结果。这项研究分别达到了安全性和免疫原性的主要和次要终点。我们在2021年2月宣布,我们将评估只包含Spike蛋白的候选疫苗,以及正在研究的不同变种特异性疫苗。在临床前评估(包括在非人类灵长类动物研究中)显示,只表达Spike蛋白的新候选疫苗可以改善抗体反应后,我们决定将这一候选疫苗向前推进进行临床评估。这种新的候选疫苗VXA-CoV2-1.1-S也能够诱导针对人类冠状病毒变异株的抗体反应,如Beta(首次鉴定这种新的候选疫苗在杜克大学领导的疫苗突破/传播模型中进行了测试,发现比起注射基于S蛋白的候选疫苗,它能更好地抑制气溶胶向疫苗幼稚动物的传播。这些结果发表在2021年10月的《bialRxiv》杂志上。
一种新的IND于2021年6月为这种仅S候选疫苗提交,并于2021年7月被FDA批准。我们在2021年10月开始的2a阶段研究中启动了对该候选疫苗的人体试验,大约896名参与者参加了一项分为两部分的研究。第一部分将招募48名年龄在18岁至55岁之间的参与者和48名年龄在56岁至75岁之间的参与者,以进一步评估安全性和免疫原性,并评估最佳剂量。这项研究的第二部分将招募大约800名年龄在18岁到75岁之间的受试者。此外,试验中一半的受试者已经接种了信使核糖核酸疫苗,以测试瓦克沙特新冠肺炎候选疫苗增强免疫反应和增强变种特异性交叉反应性的能力。
|
|
● |
诺沃克病毒疫苗。我们正在开发一种诺沃克病毒口服片剂疫苗,诺沃克病毒是美国和欧洲急性胃肠炎的主要原因。由于诺沃克病毒会感染小肠,我们认为,我们的疫苗除了血液中的系统性抗体外,还能在肠道局部产生粘膜抗体,比注射疫苗可能更好地预防诺沃克病毒感染。基于我们平台技术的疫苗可以预防感染的临床证据在下面的“季节性流感疫苗”一节中描述。2021年初,我们恢复了这一计划,在参加双价1b期诺沃克病毒试验的参与者中,在初始剂量超过12个月后增加了增强剂量。我们于2021年5月在55岁至80岁的健康老年人中开始了一项1b期安慰剂对照剂量范围研究。研究登记接近完成;支持数据库锁定的样本分析预计将在2021年底完成。这项试验的背线数据预计在2022年初。最后,评估不同时间点Boost有效性的1b阶段开放Boost优化研究已经完成登记,所有受试者都完成了对研究主要目标的访问和评估。数据分析正在进行中,预计2021年底之前会有背线结果。 |
诺沃克病毒是美国所有年龄段的人中急性胃肠炎症状的主要原因,如呕吐和腹泻。平均每年,诺沃克病毒导致1900万至2100万例急性胃肠炎,导致5.6万至7.1万人住院,570至800人死亡,主要发生在幼儿和老年人中。典型症状包括脱水、呕吐、腹痛腹泻和恶心。在疾病预防控制中心(CDC)和约翰·霍普金斯大学(Johns Hopkins University)2016年发表的一项研究中,诺沃克病毒疾病对全球经济的影响估计为600亿美元,其中340亿美元发生在包括美国、欧洲和日本在内的高收入国家。主要作者的最新报告估计,2018年仅美国的负担就达105亿美元。几乎所有的诺沃克病毒疾病都是由诺沃克病毒Gi和GII基因型引起的,我们正在开发一种双价疫苗,旨在预防这两种基因型。我们预计,如果获得批准,该疫苗将在冬季诺沃克病毒感染高峰期之前每年一次性接种,类似于流感季节。
临床试验最新进展。2019年,我们用我们针对GI.1和GII.4型诺沃克病毒株的双价口服片剂疫苗完成了1b期临床试验的活跃阶段。口服诺沃克病毒GI.1和GII-4疫苗耐受性良好,没有严重不良事件报道。大多数主动和主动的不良事件严重程度较轻,疫苗组和安慰剂治疗组之间没有观察到显著差异。
Vaxart的二价疫苗表现出强大的免疫原性,在研究的二价队列中,GI.1株和GII.4株的IgA ASC应答率分别为78%和93%,两个单价队列的IgA ASC应答率分别为86%和90%。在研究的二价臂中没有观察到干扰。
在2019年末暂停了我们的诺沃克病毒计划后,我们于2020年10月恢复了我们的诺沃克病毒候选疫苗的临床开发。我们已经完成了1b期二价研究的Boost阶段(一年多后的第二剂),最近启动了在老年受试者中进行安慰剂对照的剂量范围研究,以及在年轻人中进行Boost(第二剂)时间表优化研究。在2021年7月29日公布的结果中,我们显示,我们能够成功地用G1.1诺沃克病毒片增强免疫反应,这些反应包括IgA抗体分泌细胞,以及IgG和IgA血清抗体反应。目前,我们正计划在18岁及以上的受试者中进行Vaxart的二价诺沃克病毒疫苗的第二阶段安全性和剂量确认研究,并考虑在进行第二阶段剂量确认研究的同时进行第二阶段诺沃克病毒挑战研究的可行性。这些研究将构成结束第二阶段会议的基础(安全性、免疫原性和初步疗效数据),以便在18岁以上的成年人中就第三阶段关键疗效研究的范围达成一致。
|
|
● |
季节性流感疫苗。流感是美国和世界范围内发病率和死亡率的主要原因,根据疾控中心的数据,2018/2019年只有49%的合格美国公民接种了疫苗,18岁至49岁的成年人的疫苗接种率特别低。我们相信,我们的口服片剂疫苗有可能提高目前可用的流感疫苗的保护效力,并提高流感疫苗接种率。 |
流感是全球最常见的传染病之一,可引起轻微到危及生命的疾病,甚至死亡。全世界每年大约发生3.5亿季节性流感病例,其中300万到500万例被认为是严重的,每年造成29万到65万人死亡。根据美国疾病控制与预防中心(CDC)的数据,在2018/2019年流感季节,仅在美国就有3.42万人死于流感。年幼的儿童和老年人面临的风险最大。在美国,5%到20%的人口患有流感,22.6万人因流感并发症住院,每年有3000到4.9万人死于流感及其并发症,高达90%的流感相关死亡发生在65岁以上的成年人中。季节性流感造成的总经济负担估计为871亿美元,其中包括平均每年104亿美元的医疗费用,而每年因疾病和生命损失造成的收入损失高达163亿美元。
我们相信,我们的候选片剂疫苗可能会解决基于鸡蛋的注射流感疫苗带来的许多限制,原因如下:(I)我们的候选片剂疫苗旨在产生广泛和持久的免疫反应,这可能提供更有效的免疫力,并防止其他毒株变异;(Ii)我们的疫苗是室温稳定的片剂,我们相信这将提供更方便的给药方法,提高患者的接受度,并简化分发和管理过程;(Iii)我们认为我们的片剂疫苗的生产速度可能比使用鸡蛋生产的疫苗更快以及(Iv)使用我们的平板疫苗代替鸡蛋疫苗将消除对鸡蛋蛋白发生过敏反应的风险。
2018年9月,我们通过卫生与公众服务部生物医学高级研究与发展管理局(HHS BARDA)办公室与美国政府完成了一份价值1570万美元的合同,根据该合同,我们对我们的H1N1流感候选疫苗进行了第二阶段挑战研究。此前,我们曾宣布,在接种了H1流感疫苗并进行实验感染的健康志愿者中,我们的H1流感口服片剂疫苗比安慰剂减少了39%的临床疾病。市场领先的可注射四价流感疫苗Fluzone仅减少了27%的临床疾病。我们的片剂疫苗也显示出良好的安全性,与安慰剂没有什么区别。
2018年10月4日,我们公布了研究数据,表明我们的疫苗诱导了粘膜归巢受体浆母细胞的显著扩张,达到约60%的激活B细胞。我们相信,这些粘膜浆母细胞是保护性粘膜免疫反应的关键指标,也是我们疫苗的一个独特功能。这一数据还表明,我们的疫苗通过诱导粘膜免疫(抵御流感、诺沃克病毒和RSV等粘膜感染的第一道防线)提供保护,这可能是比注射疫苗更关键的优势。
目前,我们的目标是通过第三方合作和许可安排和/或非稀释资金,为我们的季节性四价流感口服片剂疫苗的开发和商业化提供资金。未来,我们还可能考虑发行股票和/或债务融资,为该计划提供资金。在达成许可、合作或合作协议之前,季节性流感计划目前被搁置。
除了我们的常规季节性流感疫苗外,我们还于2019年7月与Janssen签订了一项研究合作协议,以评估我们针对Janssen通用流感疫苗计划的专有口服疫苗平台。根据协议,我们生产了一种含有杨森某些专有抗原的非GMP口服候选疫苗,并在临床前挑战模型中对该产品进行了测试,临床前研究已经完成,我们已经向杨森提交了一份报告。
|
|
● |
RSV疫苗。呼吸道合胞病毒(RSV)是一种主要的呼吸道病原体,对幼儿和老年人都有很大的疾病负担。 |
基于我们临床前棉鼠研究的积极结果,我们相信我们的专有口服疫苗平台有潜力成为RSV的最佳疫苗递送系统,与注射疫苗相比具有显著的优势。我们将寻求开发片状RSV疫苗,方法是授权一种或多种RSV蛋白抗原,这些抗原在临床研究中已证明对RSV感染具有保护作用,或者与第三方合作,提供可通过我们的平台提供的RSV抗原。在达成许可、合作或协作协议之前,RSV计划目前处于搁置状态。
|
|
● |
人乳头瘤病毒治疗性疫苗。我们的首个治疗性口服疫苗候选目标是HPV-16和HPV-18,这两种病毒株导致70%的宫颈癌和癌前宫颈不典型增生。 |
宫颈癌是全球和美国女性第四常见的癌症,根据全国宫颈癌联盟的数据,美国每年约有1.3万例新诊断病例。
我们已经在两种不同的小鼠HPV-16实体瘤模型上测试了我们的HPV-16候选疫苗。候选疫苗成功地激发了T细胞反应,促进了活化的T细胞迁移到肿瘤中,导致了肿瘤细胞的杀伤。接受我们的HPV-16疫苗的小鼠通常表现出其已建立的肿瘤体积的显著减少。
2018年10月,我们向FDA提交了IND前会议请求,要求我们的第一个针对HPV16和HPV18的治疗性疫苗,随后我们提交了IND前简报包。我们在2019年1月收到FDA的反馈,支持提交IND申请以支持临床试验的启动。然而,该计划目前被搁置,因为该公司正将重点放在新冠肺炎疫苗上。
抗病毒药物
|
|
● |
通过合并,我们获得了两种赚取特许权使用费的产品,Relenza和Inavir。我们还获得了三种2期临床阶段抗病毒化合物,我们已经停止生产,但对于其中一种,Vapendavir,我们已于2021年7月6日与Altesa Biosciences,Inc.(简称Altesa)签订了独家全球许可协议,允许Altesa开发这种衣壳结合的广谱抗病毒药物并将其商业化。 |
|
|
● |
瑞乐沙和依那韦是治疗流感的抗病毒药物,分别由葛兰素史克(GlaxoSmithKline,plc)和第一三共株式会社(Daiichi Sankyo Company,Limited)销售。我们已经从瑞乐沙和依那韦在日本的净销售额中赚取了版税。瑞乐沙的最后一项专利于2019年7月到期,依那韦的最后一项专利于2029年12月到期。这些抗病毒药物的销量因季度而异,因为流感病毒的活动表现出强烈的季节性周期,并因年而异,这取决于流感季节的强度和持续时间,以及与达菲等其他抗病毒药物的竞争。重要的是,2018年2月23日,由Shionogi研发的治疗流感的新药Xofluza在日本获批。该药物已经获得了相当大的市场份额,大大减少了依那韦的销售。 |
财务运营概述
收入
客户服务合同收入
我们从修改后的固定价格服务合同中获得了61.7万美元的收入,我们在2021年前三个月完成了这项工作。
版税R平均
在专利到期之前,我们从销售依纳维亚和瑞乐沙中赚取版税收入,根据特许权使用费协议,我们的被许可人第一三共(Daiichi Sankyo)和葛兰素史克(GSK)分别提供了两种治疗流感的药物,基于这些药物净销售额的固定百分比,有效期分别为2029年12月和2019年7月。
与S相关的非现金特许权使用费收入艾尔未来R的E牡蛎
2016年4月,Aviragen在日本市场以2000万美元的价格将与Inavir相关的某些特许权使用费出售给Healthcare Royalty Partners III,L.P.(简称HCRP)。在合并时,HCRP的估计未来收益的公允价值为1,590万美元,我们将这笔收益记录为负债,我们将使用实际利息方法在安排的剩余估计寿命内摊销这笔负债。尽管我们没有保留交易中的相关版税,但由于金额汇至HCRP,我们将继续记录与这些版税相关的收入,直到相关负债和相关利息的金额完全摊销为止。
研究与开发费用
研发费用是指进行研究的成本,例如开发我们的平板疫苗平台,以及支持我们的平板疫苗候选的临床前和临床开发活动。我们确认所有的研究和开发费用都是按实际发生的金额计入的。研发费用主要包括以下几项:
| ● |
与员工有关的费用,包括工资、福利和股票薪酬; |
| ● |
根据与代表我们进行临床试验的合同研究机构(“CRO”)的协议而发生的费用; |
| ● |
与生产临床试验所用产品的合同制造组织(“CMO”)签订的协议项下发生的费用; |
| ● |
为生产用于临床试验的候选疫苗所需的材料采购费用以及分析和释放测试服务费用; |
| ● |
为提高批量疫苗和片剂生产活动的效率和产量而在内部和外部发生的工艺开发费用; |
| ● |
与临床前研究活动相关的实验室用品和供应商费用; |
| ● |
支持我们的临床、监管和制造活动的服务的顾问费;以及 |
| ● |
设施、折旧和分配的间接费用。 |
我们不会将内部费用分配给特定的项目。我们的员工和其他内部资源不直接绑定到任何一个研究计划,通常部署在多个项目中。内部研发费用作为一个总额列示。
我们为生产我们的候选片剂疫苗以及代表我们进行临床试验的CRO产生了巨大的外部成本。我们统计了每个疫苗项目的这些费用。我们不会将临床前研究或过程开发的外部成本分配给特定的项目。
下表显示了我们在一段时期内的研究和开发费用,确定了我们每个疫苗计划以及临床前研究和过程开发的外部成本(以千为单位):
| 截至9月30日的三个月, |
截至9月30日的9个月, |
|||||||||||||||
| 2021 |
2020 |
2021 |
2020 |
|||||||||||||
| 外部计划成本: |
||||||||||||||||
| 新冠肺炎计划 |
$ | 1,860 | $ | 1,436 | $ | 8,020 | $ | 3,301 | ||||||||
| 诺沃克病毒计划 |
1,202 | 215 | 2,746 | 475 | ||||||||||||
| 所有其他计划 |
— | — | — | 7 | ||||||||||||
| 临床前研究 |
870 | 323 | 1,811 | 695 | ||||||||||||
| 流程开发 |
386 | 90 | 1,680 | 136 | ||||||||||||
| 总外部成本 |
4,318 | 2,064 | 14,257 | 4,614 | ||||||||||||
| 内部成本 |
8,091 | 2,552 | 18,962 | 6,658 | ||||||||||||
| 总研发 |
$ | 12,409 | $ | 4,616 | $ | 33,219 | $ | 11,272 | ||||||||
我们预计,随着我们进一步推进我们的平板疫苗候选者进入并通过更多的临床试验,寻求监管部门对我们的平板疫苗候选者的批准,并为可能的商业推出做准备,研发费用将继续增加,所有这些都将需要在制造和库存相关成本方面进行大量投资。在我们签订许可、合作或协作协议的范围内,此类成本的很大一部分可能由第三方承担。
进行必要的临床试验以获得监管批准的过程既昂贵又耗时。我们可能永远不会成功获得新冠肺炎口服片剂疫苗候选疫苗的上市批准,或者我们的任何片剂疫苗候选疫苗。我们候选片剂疫苗成功商业化的可能性可能受到许多因素的影响,包括在未来试验中获得的临床数据、竞争、制造能力和商业可行性。因此,我们无法确定我们研发项目的持续时间和完成成本,也无法确定我们将在何时以及在多大程度上从我们的任何平板疫苗候选产品的商业化和销售中获得收入。
一般和行政费用
一般和行政费用包括人事成本、分配费用和外部专业服务费用,包括法律、审计、会计、公共关系、市场研究和其他咨询服务。人事成本包括工资、福利和基于股票的薪酬。分摊费用包括租金、折旧和其他设施相关费用。
经营成果
下表列出了截至2021年9月30日和2020年9月30日的三个月和九个月的简明综合营业报表和综合亏损表中的精选项目(单位为千,百分比除外):
| 截至9月30日的三个月, |
截至9月30日的9个月, |
|||||||||||||||||||||||
| 2021 |
2020 |
%变化 |
2021 |
2020 |
%变化 |
|||||||||||||||||||
| 收入 |
$ | 200 | $ | 265 | (25 | )% |
$ | 818 | $ | 3,690 | (78 | )% |
||||||||||||
| 运营费用 |
17,451 | 7,854 | 122 | % |
49,355 | 20,499 | 141 | % |
||||||||||||||||
| 营业亏损 |
(17,251 | ) | (7,589 | ) | 127 | % |
(48,537 | ) | (16,809 | ) | 189 | % |
||||||||||||
| 其他收入和(费用) |
(311 | ) | (470 | ) | (34 | )% |
(1,080 | ) | (1,345 | ) | (20 | )% |
||||||||||||
| 所得税前亏损 |
(17,562 | ) | (8,059 | ) | 118 | % |
(49,617 | ) | (18,154 | ) | 173 | % |
||||||||||||
| 所得税拨备 |
21 | 26 | (19 | )% |
89 | 205 | (57 | )% | ||||||||||||||||
| 净损失 |
$ | (17,583 | ) | $ | (8,085 | ) | 117 | % |
$ | (49,706 | ) | $ | (18,359 | ) | 171 | % |
||||||||
总收入
下表汇总了截至2021年9月30日和2020年9月30日的三个月和九个月的收入(单位为千,百分比除外):
| 截至9月30日的三个月, |
截至9月30日的9个月, |
|||||||||||||||||||||||
| 2021 |
2020 |
%变化 |
2021 |
2020 |
%变化 |
|||||||||||||||||||
| 客户服务合同收入 |
$ | — | $ | 2 | (100 | )% | $ | 13 | $ | 193 | (93 | )% | ||||||||||||
| 特许权使用费收入 |
— | — | 不适用 |
|
— | 2,962 | (100 | )% | ||||||||||||||||
| 与销售未来特许权使用费相关的非现金特许权使用费收入 |
200 | 263 | (24 | )% |
805 | 535 | 50 | % |
||||||||||||||||
| 总收入 |
$ | 200 | $ | 265 | (25 | )% |
$ | 818 | $ | 3,690 | (78 | )% | ||||||||||||
客户服务合同收入
在截至2021年9月30日的前9个月,我们从客户服务合同中获得了1.3万美元的收入,全部是在第一季度,在截至2020年9月30日的3个月和9个月里,我们分别获得了2,000美元和19.3万美元的收入。这笔收入是从2019年7月签署的经修订的固定价格合同中确认的,总金额为61.7万美元,我们现在已经完成。
R牡蛎R平均
截至9月30日的前三个月, 20212020年和2020年但我们没有赚取特许权使用费收入。对于美国人来说截至9月30日的9个月, 2021,我们没有赚取特许权使用费收入,相比之下,我们的版税收入为$3.0在这一年里赚了300万美元截至9月30日的9个月, 2020,其中280万美元与Inavir有关,在截至2020年3月31日的三个月内赚取,其余与Relenza有关,我们不再有权获得版税。我们不确认任何来自Inavir销售的特许权使用费收入,直到截至3月31日的几年中的前300万美元(扣除5%的预扣税)被确认为与销售未来特许权使用费相关的非现金特许权使用费收入。我们在截至2021年3月31日的财年没有确认特许权使用费收入,因为净特许权使用费仅为130万美元,而截至2020年3月31日的财年,净特许权使用费为640万美元。我们认为,这80%的减少主要是因为社会距离、戴口罩以及新冠肺炎大流行导致的流感疫苗接种率上升导致流感感染人数下降。由于新冠肺炎对未来流感季节的影响不可预测,我们无法预测未来我们将获得多少特许权使用费收入(如果有的话)。
非现金R牡蛎R平均与未来特许权使用费的销售相关
在截至2021年9月30日的三个月里,与销售未来特许权使用费相关的非现金特许权使用费收入为20万美元,而截至2020年9月30日的三个月为26.3万美元,这是由于Inavir在日本的销售额减少所致。在截至2021年9月30日的9个月里,与销售未来特许权使用费相关的非现金特许权使用费收入为80.5万美元,而截至2020年9月30日的9个月为53.5万美元。这一增长是由于截至3月31日的年度可能赚取的330万美元的上限,在截至2020年3月31日的一年中,我们在截至2019年12月31日的9个月中确认了除3.4万美元以外的所有收入,而在截至2021年3月31日的一年中,Inavir销售的总特许权使用费收入仅为130万美元,包括截至2021年3月31日的三个月的493,000美元,所有这些收入都被确认为非现金特许权使用费收入。
总运营费用
下表列出了截至2021年9月30日和2020年9月30日的三个月和九个月的运营费用(单位为千,百分比除外):
| 截至9月30日的三个月, |
截至9月30日的9个月, |
|||||||||||||||||||||||
| 2021 |
2020 |
%变化 |
2021 |
2020 |
%变化 |
|||||||||||||||||||
| 研发 |
$ | 12,409 | $ | 4,616 | 169 | % |
$ | 33,219 | $ | 11,272 | 195 | % |
||||||||||||
| 一般事务和行政事务 |
5,042 | 4,190 | 20 | % |
16,136 | 10,076 | 60 | % |
||||||||||||||||
| 重组成本 |
— | (952 | ) | (100 | )% |
— | (849 | ) | (100 | )% |
||||||||||||||
| 总运营费用 |
$ | 17,451 | $ | 7,854 | 122 | % |
$ | 49,355 | $ | 20,499 | 141 | % |
||||||||||||
回复研究与开发
对于截至9月30日的三个月,2021、研发费用。增额减少了$7.81000万美元,或169%,与截至9月30日的三个月,2020,以及截至9月30日的9个月, 2021,他们说:增额减少了$21.91000万美元,或195%,相比之下,截至9月30日的9个月, 2020。这个增加这两个时期的亏损主要是由于与我们的新冠肺炎和诺沃克病毒候选疫苗相关的临床前、制造和临床费用,以及与员工增加相关的人员成本增加,包括基于股票的薪酬和设施分配。
我们希望研究和开发开发费用为2021年及以后,随着我们继续增加员工人数,并在我们的新冠肺炎和诺沃克病毒候选疫苗的制造和临床药物试验方面产生重大支出,2021年及以后的数字将显著高于2020年。
一般事务和行政事务
截至2021年9月30日的三个月,外设和管理与2020年同期相比,地方行政费用增加了85.2万美元,增幅为20%。主要原因是律师费用以外的专业费用增加,人员成本和设施分配与我们的公司增长一致,以及董事和高级管理人员责任保险成本增加,但被法律费用净额的减少(主要是由于报销)部分抵消。
在截至2021年9月30日的9个月中,一般和行政费用与2020年同期相比增加了610万美元,增幅为60%。主要原因是较高的法律费用和其他专业成本、额外的董事和高级管理人员责任保险成本、修改授予我们的前董事会主席的未偿还期权条款的非现金费用,以及随着我们的公司增长而增加的人事成本、设施分配和招聘成本,但由于我们的前首席执行官没有遣散费,这部分抵消了这一费用。
重组成本
在截至2020年9月30日的三个月中,重组成本的净逆转与和解金额低于我们在2019年底重组时暂停的制造工单可能支付的最高金额有关。在截至2020年9月30日的9个月中,这部分被法律费用和增值成本所抵消。自2020年9月30日以来,我们没有发生任何与重组相关的费用,预计不会有任何进一步的调整。
其他收入和(费用)
下表分别列出了截至2021年9月30日和2020年9月30日的三个月和九个月的营业外收入和费用(单位为千,不包括百分比):
| 截至9月30日的三个月, |
截至9月30日的9个月, |
|||||||||||||||||||||||
| 2021 |
2020 |
%变化 |
2021 |
2020 |
%变化 |
|||||||||||||||||||
| 利息收入 |
$ | 26 | $ | 5 | 420 | % |
$ | 58 | $ | 69 | (16 | )% | ||||||||||||
| 与销售未来特许权使用费相关的非现金利息支出 |
(337 | ) | (464 | ) | (27 | )% |
(1,137 | ) | (1,401 | ) | (19 | )% | ||||||||||||
| 净汇兑损失 |
— | (11 | ) | (100 | )% | (1 | ) | (13 | ) | (92 | )% | |||||||||||||
| 净营业外收入和(费用) |
$ | (311 | ) | $ | (470 | ) | (34 | )% |
$ | (1,080 | ) | $ | (1,345 | ) | (20 | )% |
||||||||
截至2021年9月30日的三个月,我们录得净非运营费用为31.1万美元,比截至2020年9月30日的三个月的47万美元下降了34%。截至2021年9月30日的9个月,我们记录的净非运营支出为110万美元,比截至2020年9月30日的9个月的130万美元下降了近20%。
在截至2021年9月30日的前九个月,利息收入与截至2020年9月30日的前九个月相比有所下降,尽管现金和投资余额较高,原因是利率较低,尽管在截至2021年9月30日的三个月里,利率确实有所上升。与销售未来特许权使用费相关的非现金利息支出,与计入从Inavir获得的特许权使用费收入作为债务支付给HCRP的金额有关,在截至2021年9月30日的前三个月和九个月都有所下降。2021年,归属利率下降。
所得税拨备
下表分别列出了截至2021年9月30日和2020年9月30日的三个月和九个月的所得税拨备(单位为千,百分比除外):
| 截至9月30日的三个月, |
截至9月30日的9个月, |
|||||||||||||||||||||||
| 2021 |
2020 |
%变化 |
2021 |
2020 |
%变化 |
|||||||||||||||||||
| 特许权使用费收入的外国预扣税 |
$ | 10 | $ | 13 | (23 | )% |
$ | 40 | $ | 165 | (76 | )% |
||||||||||||
| 公司间利息应付的外国税金 |
15 | 13 | 15 | % |
48 | 39 | 23 | % |
||||||||||||||||
| 州所得税 |
(4 | ) | — | 不适用 |
|
1 | 1 | — | % |
|||||||||||||||
| 所得税拨备 |
$ | 21 | $ | 26 | (19 | )% |
$ | 89 | $ | 205 | (57 | )% |
||||||||||||
在截至2021年和2020年9月30日的三个月里,所得税拨备分别为2.1万美元和2.6万美元。大部分费用与一家外国子公司的公司间贷款利息有关,该贷款的到期余额有所增加。
在截至2021年和2020年9月30日的9个月里,所得税拨备分别为8.9万美元和20.5万美元。这笔费用的很大一部分是对在日本销售Inavir所赚取的特许权使用费收入的预扣税,这笔收入可能可以作为外国税收抵免收回,但由于我们对递延税项资产记录了100%的估值津贴,因此要支出。出现下降的原因是,扣除预扣税后的Inavir特许权使用费(包括我们转移到HCRP的部分)从截至2020年9月30日的9个月的310万美元下降到截至2021年9月30日的9个月的76.5万美元。此外,我们还产生了与外国子公司的公司间贷款利息和美国州所得税相关的费用。
流动性与资本资源
我们的主要融资来源是在公开发售中出售和发行普通股和普通股认股权证,以及行使认股权证所得款项。*过去,我们还从发行担保债务和优先股以及合作协议中获得资金。2020年10月,我们达成了一项公开市场销售协议(“2020年10月自动取款机”),根据该协议,我们可以出售我们普通股的股票,总发行价最高可达2.5亿美元。在以总收益1.334亿美元出售了2020年10月自动取款机下的普通股后,我们于2021年9月终止了2020年10月的自动取款机,并签订了受控股权发行和销售协议(“2021年9月自动取款机”),根据该协议,我们可以不时通过销售代理提供和出售总发行价高达1亿美元的普通股股票。我们将产生直接费用,并支付高达2021年9月自动取款机出售股票所得毛收入3.0%的销售佣金。
截至2021年9月30日,我们拥有约2.04亿美元的现金,包括现金等价物和流动投资。根据2021年9月的自动取款机,我们可以获得大约9600万美元的净收益。
我们相信,我们现有的资金足以为我们提供到2023年的资金。为了在此之后继续运营,我们预计我们将需要通过出售更多证券或其他方式筹集更多资金。我们的运营需求包括运营业务的计划成本,包括为营运资本和资本支出提供资金所需的金额。我们未来的资本需求和可用资金的充足性将取决于许多因素,最重要的是我们能否成功地将我们的产品和服务商业化。
我们可能会通过合作和合作协议为我们正在进行的业务提供很大一部分资金,这在降低我们的风险并扩大我们的现金跑道的同时,也将减少我们在候选疫苗产品最终收入(如果有的话)中的份额。在政府项目(包括HHS BARDA)的帮助下,我们或许能够为某些活动提供资金。出售额外的股权将导致我们股东的股权被进一步稀释。我们还可以通过举债融资为我们的运营提供资金。招致债务将导致偿债义务,而管理这类债务的工具可以规定运营和融资契约,这些契约将限制我们的运营。如果我们无法以足够的金额或可接受的条件筹集额外资金,我们可能会被要求推迟、限制、减少或终止我们的产品开发或未来的商业化努力,或者授予开发和营销我们原本更愿意开发和营销的候选疫苗的权利。这些行动中的任何一项都可能损害我们的业务、运营结果和前景。
我们未来的拨款需求,将视乎多项因素而定,包括:
| ● |
我们为候选产品计划的临床前研究的时间和成本; |
| ● |
我们计划的候选产品临床试验的时间和成本; |
| ● |
我们的制造能力,包括合同制造组织是否能够以合理的成本供应我们的候选产品; |
| ● |
因销售依纳维亚而收到的特许权使用费的数额和时间; |
| ● |
我们追求的候选产品的数量和特点; |
| ● |
寻求监管批准的结果、时间和成本; |
| ● |
我们未来产品的商业销售收入,这需要得到监管部门的批准; |
| ● |
我们未来可能达成的任何合作、许可、咨询或其他安排的条款和时间; |
| ● |
与任何专利或专利申请或其他知识产权的许可、提交、起诉、维护、抗辩和执行有关的任何付款的金额和时间;以及 |
| ● |
我们授权或获取其他产品和技术的程度。 |
现金流
下表汇总了我们在指定时期的现金流:
| 截至9月30日的9个月, |
||||||||
| 2021 |
2020 |
|||||||
| 用于经营活动的现金净额 |
$ | (44,018 | ) | $ | (12,984 | ) | ||
| 用于投资活动的净现金 |
(40,920 | ) | (318 | ) | ||||
| 融资活动提供的现金净额 |
125,299 | 133,214 | ||||||
| 现金及现金等价物净增加情况 |
$ | 40,361 | $ | 119,912 | ||||
经营活动中使用的净现金
截至2021年9月30日和2020年9月30日的前9个月,Vaxart的经营活动现金流为负,分别为4400万美元和1300万美元。在截至2021年9月30日的9个月中,经营活动中使用的现金是由于用于资助4970万美元的净亏损和360万美元的营运资本增加,但被与折旧和摊销相关的净非现金收入、投资溢价的增加、股票薪酬、与销售未来特许权使用费相关的非现金利息支出以及与销售未来特许权使用费相关的非现金收入的调整部分抵消。在截至2020年9月30日的前9个月,经营活动中使用的现金是用于为1840万美元的净亏损提供资金的现金,但被与折旧和摊销相关的净非现金收入、基于股票的薪酬、与销售未来特许权使用费相关的非现金利息支出以及与销售未来特许权使用费相关的非现金收入总计410万美元以及营运资金减少130万美元的调整部分抵消。
净现金使用量*投资活动
在截至2021年9月30日的前9个月里,我们使用了3680万美元购买了有价证券(扣除到期日)。在截至2021年和2020年9月30日的前9个月,我们分别使用了410万美元和32.1万美元购买房产和设备。在截至2020年9月30日的前9个月里,我们收到了3,000美元的现金用于设备销售。
净现金由以下人员提供融资活动
在截至2021年9月30日的前9个月,我们从根据2021年10月自动取款机出售普通股获得122.2美元,从行使普通权证和股票期权收到310万美元。在截至2020年9月30日的前9个月,我们从3月份登记直接发行的普通股和认股权证获得920万美元,从7月份在市场机制下出售普通股获得9,700万美元,从行使普通股认股权证获得2,640万美元。在截至2021年9月30日的前9个月,我们从2021年10月自动取款机下的普通股销售中获得了122.2美元,从行使普通股和认股权证中获得了2,640万美元。
合同义务和商业承诺
截至2021年9月30日,我们有以下合同义务和商业承诺(单位:千):
| 合同义务 |
总计 |
|
1-3年 |
3-5年 |
>5年 |
|||||||||||||||
| 长期债务,HCRP |
$ | 20,675 | $ | 3,118 | $ | 6,102 | $ | 5,261 | $ | 6,194 | ||||||||||
| 经营租约 |
33,078 | 3,335 | 7,540 | 8,987 | 13,216 | |||||||||||||||
| 购买义务 |
18,208 | 18,208 | — | — | — | |||||||||||||||
| 总计 |
$ | 71,961 | $ | 24,661 | $ | 13,642 | $ | 14,248 | $ | 19,410 | ||||||||||
长期债务,HCRP。根据2016年签署的一项协议,我们有义务向HCRP支付前300万美元,外加我们在截至3月31日的每年销售Inavir所赚取的100万美元特许权使用费收入的15%。详情见第一部分第1项简明合并财务报表附注6。
经营租约。经营租赁金额包括我们所有初始期限超过一年的不可撤销经营租赁项下的未来最低租赁支付,包括已签署但尚未开始的一份租赁的总金额1,490万美元。有关已开始的租约的进一步详情,请参阅第一部分第1项简明综合财务报表附注7。
购买义务。*这些金额包括对正常业务过程中所有未结采购订单和合同义务的估计,包括与我们尚未收到货物或服务的合同制造商和供应商的承诺。我们将所有一般可强制执行并具有法律约束力的未结采购订单视为承诺,尽管条款可能允许我们在交付货物或履行服务之前根据我们的业务需求选择取消。
表外安排
在本报告所述期间,我们没有表外安排。
关键会计政策和估算
我们管理层对财务状况和经营结果的讨论和分析是以我们的简明合并财务报表为基础的,这些报表是按照美国公认的会计原则编制的。编制这些财务报表需要我们做出影响资产、负债和费用报告金额的估计和判断。在持续的基础上,我们评估这些估计和判断。我们的估计是基于历史经验和我们认为在这种情况下合理的各种假设。这些估计和假设构成了对资产和负债的账面价值作出判断的基础,并记录了从其他来源看不到的费用。实际结果可能与这些估计大不相同。我们认为,下面讨论的会计政策对于理解我们的历史和未来业绩至关重要,因为这些政策涉及更重要的领域,涉及管理层的判断和估计。
应计研究与开发费用
我们记录由第三方服务提供商进行的研发活动的估计成本的应计费用,包括进行临床前研究、临床试验和制造活动。我们根据所提供服务的估计金额记录研发活动的估计成本,并在简明综合资产负债表中计入已发生但尚未计入应计负债的成本,在简明综合经营报表和全面亏损中计入研发费用。这些成本可能是我们研发费用的重要组成部分。
我们估计,透过与内部人员和外间服务供应商商讨有关服务的进度或完成阶段,以及就该等服务须支付的协定费用,已完成的工作量。我们在确定每个报告期的应计余额时作出重大判断和估计。随着实际成本的了解,我们调整了应计预算。
无形资产
在合并中获得的无形资产的估计公允价值为2030万美元,其中与Inavir相关的开发技术将在11.75年的未来特许权使用费的估计期内直线摊销,与Relenza相关的开发技术的无形资产将在剩余的1.3年特许权使用费期间全额摊销。在合并中获得的无形资产的估计公允价值为2030万美元,这些技术将在未来11.75年的特许权使用费的估计期内直线摊销,并在剩余的1.3年特许权使用费期间全额摊销。这些估值是由独立第三方根据基于概率加权未来开发支出和收入流的估计贴现现金流编制的,这些估计具有高度主观性。
近期会计公告
关于2021年前9个月新会计准则发布的相关信息,见第I部分简明合并财务报表附注2第1项中的《近期会计公告》,均未对我们的简明合并财务报表产生实质性影响。
项目3.关于市场风险的定量和定性披露
利率敏感度
我们因利率变化而面临的市场风险主要与我们对有价证券的投资有关。我们投资活动的主要目标是保持本金,保持足够的流动性来满足现金需求,并在不大幅增加风险的情况下实现总回报的最大化。为了实现这一目标,我们维持货币市场基金和债务证券的过剩现金和现金等价物。我们不以交易或投机为目的进行投资,也不持有任何股权证券。我们目前没有借款,也没有信用额度。
具体地说,截至2021年9月30日,我们拥有约2.04亿美元的现金、现金等价物和投资,包括银行存款、货币市场基金、美国政府或其机构的直接债务、商业票据和公司债券,我们所有的投资在购买时都必须满足高信用评级要求。这类生息工具带有一定的利率风险,但由于我们的投资评级很高,而且大多是短期的,我们认为我们因利率变化而面临的损失风险敞口并不大。
汇率敏感度
我们的特许权使用费收入是以美元计算的,是根据日元的销售额计算的,所以美元对日元的强势每增加1%,特许权使用费收入就会减少1%。目前,我们没有保留任何与我们的特许权使用费收入相关的现金,我们所有的其他收入,以及我们几乎所有的费用、资产和负债都是以美元计价的。因此,我们最近没有经历过重大的外汇损益,认为我们对汇率波动的敞口微不足道。
第四项:安全控制和程序
信息披露控制和程序的评估
我们的管理层在总裁兼首席执行官(担任首席执行官和首席财务官)的参与下,评估了截至本季度报告10-Q表格所涵盖的期间结束时,我们的披露控制和程序(如1934年证券交易法下的规则13a-15(E)和15d-15(E)所定义)的有效性。基于这样的评估,我们的管理层得出结论,截至2021年9月30日,我们的披露控制和程序在合理的保证水平下是有效的。
财务报告内部控制的变化
控制措施有效性的固有限制
我们的管理层,包括我们的总裁和首席执行官,并不期望我们的披露控制和程序或我们的内部控制能够防止所有错误和所有欺诈。一个控制系统,无论构思和操作如何完善,都只能提供合理的保证,而不是绝对的保证,以确保控制系统的目标得以实现。此外,控制系统的设计必须反映这样一个事实,即存在资源限制,并且控制的好处必须相对于其成本来考虑。由于所有控制系统的固有限制,任何控制评估都不能绝对保证Vaxart内部的所有控制问题和欺诈实例(如果有)都已被检测到。
第二部分其他信息
第一项:第三项法律诉讼
简明合并财务报表第I部分第1项“附注8.承付款和或有事项--(C)诉讼”中包含的信息通过引用并入本项目。
我们还可能不时卷入与我们的业务相关的法律诉讼。根据目前掌握的信息,我们认为,与针对我们的任何悬而未决的行动相关的合理可能损失的金额或范围总计超过既定准备金,对我们的综合财务状况或现金流并不重要。然而,目前或未来的任何争议解决或法律程序,无论任何此类程序的是非曲直,都可能导致巨额成本,并转移管理层成功运营业务所需的注意力和资源,并可能对我们的业务、财务状况和运营结果产生重大不利影响。
项目11A.不同的风险因素
在评估我们的业务和我们的前景时,您应该考虑我们于2021年2月25日提交给美国证券交易委员会(SEC)的截至2020年12月31日的财政年度Form 10-K年度报告第I部分第1a项下描述的风险和不确定因素,以及本Form 10-Q季度报告中通过引用包含或并入的所有其他信息,包括下面描述的风险因素。除以下所述外,本公司截至2020年12月31日止年度的Form 10-K年度报告第I部分第1A项所载风险因素并无重大变动。
我们是目前正在欧洲专利局对Vaxart的一项欧洲专利进行反对诉讼。如果我们在这些诉讼中没有胜诉,我们可能就不能如果欧洲专利得到支持,防止欧洲其他公司复制我们的一些候选产品.
我们目前正在欧洲专利局对我们的一项欧洲专利进行反对诉讼。欧洲专利局反对3307239号欧洲专利,该专利声称针对诺沃克病毒和呼吸道合胞病毒(“RSV”)的疫苗组合物。反对派的最终结果仍不确定。如果Vaxart在诉讼中最终没有胜诉,它可能无法阻止其他公司在一些或所有欧洲国家复制其诺沃克病毒和RSV产品,只要在反对意见中维持专利的有效性,它就可以阻止其他公司复制它的诺沃克病毒和RSV产品。如果反对的欧洲专利被欧洲专利局部分或全部撤销,竞争对手可能能够更早地销售诺沃克病毒或RSV的竞争疫苗,而Vaxart无法对它们主张专利。Vaxart在欧洲还有另一项专利,涵盖其诺沃克病毒和RSV产品,但如果在反对中不能取得成功,我们将无法将专利保护延长到2036年。
第二项:禁止未登记的股权证券销售和收益使用
不适用。
第三项高级证券的债务违约
不适用。
项目4.发布煤矿安全信息披露情况
不适用。
项目5.报告和其他信息
不适用。
项目6.所有展品
|
|
通过引用并入本文 |
||||||
| 展品 |
文件说明 |
附表/表格 |
档案 |
展品 |
提交日期 |
||
| 3.1 | Vaxart,Inc.重新注册证书的修订证书 | 表格8-K | 001-35285 | 3.1 | 2019年4月24日 | ||
| 3.2 | Vaxart,Inc.重新注册证书的修订证书 | 表格8-K | 001-35285 | 3.1 | 2020年6月9日 | ||
| 3.3 | Vaxart,Inc.修订和重新制定的章程,自2021年4月7日起生效 | 表格8-K | 001-35285 | 3.1 | 2021年4月13日 | ||
| 10.1 | 受控股票发行和销售协议日期为2021年9月15日,由公司、Cantor Fitzgerald&Co.和B.Riley Securities,Inc.签署。 | 表格8-K | 001-35285 | 1.1 | 2021年9月16日 | ||
| 10.2 | Vaxart,Inc.和Britannia Pointe Grand Limited Partnership之间签订的租赁协议,日期为2021年9月17日 | 表格8-K | 001-35285 | 10.1 | 2021年9月21日 | ||
| 10.3 | Vaxart,Inc.和HealthPeak Properties,Inc.之间于2021年9月17日签署的租赁协议第二修正案。 | 表格8-K | 001-35285 | 10.2 | 2021年9月21日 | ||
| 10.4 * | 邀请函,日期为2021年8月16日,由公司和詹姆斯·卡明斯医学博士签署 | ||||||
| 31.1 * |
根据2002年萨班斯-奥克斯利法案第302节通过的交易法规则13a-14(A)和15d-14(A)对首席执行官和财务官的认证 |
||||||
| 32.1 § | 根据经修订的1934年“证券交易法”第13a-14(B)条和根据2002年“萨班斯-奥克斯利法案”第906条通过的“美国法典”第18编第1350条对首席执行官和财务官的认证 | ||||||
| 101.INS* |
内联XBRL实例文档-实例文档不会显示在交互数据文件中,因为其XBRL标记嵌入在内联XBRL文档中 | ||||||
| 101.SCH* | 内联XBRL分类扩展架构文档 | ||||||
| 101.CAL* | 内联XBRL分类扩展计算链接库文档 | ||||||
| 101.DEF* | 内联XBRL分类扩展定义Linkbase文档 | ||||||
| 101.LAB* | 内联XBRL分类扩展标签Linkbase文档 | ||||||
| 101.PRE* | 内联XBRL分类扩展演示文稿Linkbase文档 | ||||||
| 104 | 封面交互数据文件(格式为内联XBRL,包含在附件101中) | ||||||
| * | 在此提交 | ||||||
| § |
根据S-K法规第601(B)(32)(Ii)项和美国证券交易委员会第33-8238号和第34-47986号新闻稿“最终规则:管理层关于财务报告内部控制的报告和交易所法定期报告中披露披露的证明”,本协议附件32.1中提供的证明被视为随本季度报告一起提交的10-Q表格,并且就交易法第18节而言将不被视为“已存档”。此类认证不会被视为通过引用被纳入根据证券法或交易法提交的任何文件,除非注册人通过引用明确将其纳入其中。 |
||||||
签名
根据1934年证券交易法的要求,注册人已正式促使本报告由正式授权的以下签名者代表其签署。
| Vaxart,Inc. |
|||
| 日期:2021年11月4日 |
作者:安德烈·弗洛罗(Andrei FLOROIU) |
||
| 安德烈·弗洛卢(Andrei Floroiu) |
|||
| 总裁兼首席执行官 |
|||
| (首席执行官和首席财务官) |
|||
|
|