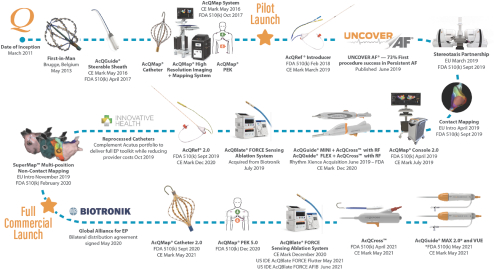
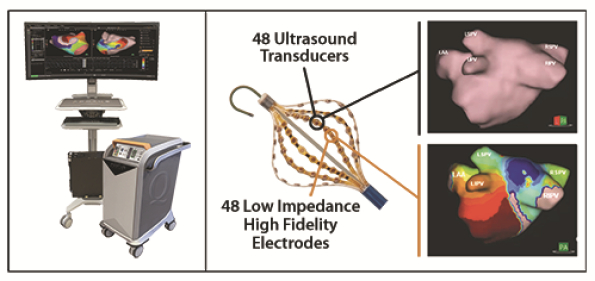
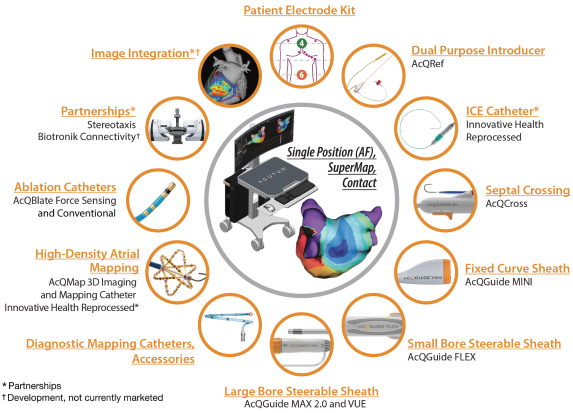
依据第424(B)(4)条提交
注册号码333-257844
550万股

普通股
我们将提供550万股我们的普通股。我们的普通股在纳斯达克全球精选市场上市,代码为 AFib。2021年7月14日,我们的普通股在纳斯达克全球精选市场的最后一次报告售价为每股15.05美元。
根据联邦证券法,我们是一家新兴的成长型公司,因此,我们选择遵守某些降低的上市公司 报告要求。
投资我们的普通股有很高的风险。?请参见第15页开始的风险 因素。
| 人均 分享 |
总计 | |||||||
| 公开发行价 |
$ | 14.00 | $ | 77,000,000 | ||||
| 承保折扣和佣金 (1) |
$ | 0.84 | $ | 4,620,000 | ||||
| 扣除费用前的收益,给我们 |
$ | 13.16 | $ | 72,380,000 | ||||
| (1) | 有关承销折扣和佣金以及预计发售费用的其他披露,请参阅承销? 。 |
我们已授予承销商为期30天的选择权,最多可额外购买825,000股我们的普通股。
与Deerfield Management Company,L.P.和OrbiMed Advisors LLC有关联的实体 是我们的现有股东,与我们的某些董事有关联,他们表示有兴趣分别以公开募股 的价格在此次发行中购买总计约2,142,856股我们的普通股。但是,由于这些意向指示不是具有约束力的协议或购买承诺,承销商可以决定向任何或所有这些实体出售更多、更少或不购买此次发行的股票,或者任何或所有这些 实体可以决定购买更多、更少或不购买此次发行的股票。承销商从这些股东购买的任何股票中获得的承销折扣与他们在此次 发行中向公众出售的任何其他股票的承销折扣相同。只要这些股东或与他们有关联的人购买了本次发行的任何股票,可供公众出售的股票数量将相应减少。请参阅特定关系和关联方交易 参与此产品。?
承销商预计将于2021年7月19日在纽约交割股票。
美国证券交易委员会(Securities And Exchange Commission)和任何州证券委员会都没有批准或不批准 这些证券,也没有确定本招股说明书是否真实或完整。任何相反的陈述都是刑事犯罪。
高盛有限责任公司
2021年7月14日