目录
SMA的治疗分别于2020年8月和2018年3月进行。2021年3月,欧洲药品管理局(“EMA”)授予apitegromab治疗SMA的优先药物(PRIME)称号。
2021年4月6日,我们宣布了我们的黄玉第二阶段概念验证试验12个月治疗期的正面顶线数据,该试验在美国和欧洲的16个研究地点招募了58名2型和3型SMA患者。这项试验评估了在为期12个月的治疗期间每4周静脉注射一次的阿替格罗布(Q4W)的安全性和有效性。4名患者(1名在队列2中,3名在队列3中)在12个月的治疗过程中,由于新冠肺炎相关的网站准入限制,每个患者都错过了连续三剂apitegromab,并被排除在预先指定的意向治疗初步分析之外。
队列1:这个开放标签的单臂队列纳入了23名3型非卧床SMA患者。患者接受20毫克/公斤的apitegromab治疗,要么作为单一疗法,要么与批准的SMN上调疗法(Nusinesen)结合使用。队列1的主要目标是评估安全性和治疗12个月后修订的Hammersmith量表与基线的平均变化。

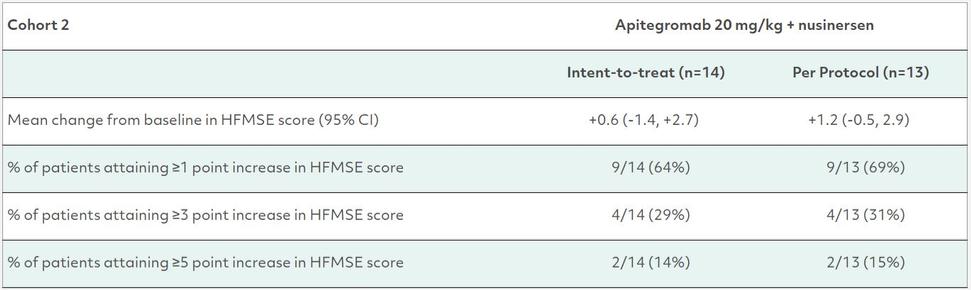
队列2:这个开放标签的单臂队列纳入了15名患有2型或非卧床3型SMA的患者,他们已经在接受5岁或以上开始的经批准的SMN上调药(Nusinesen)的治疗。一名患者由于新冠肺炎相关的网站准入限制错过了连续三剂的爱必佳,并被排除在预先指定的意向治疗初步分析之外。该队列的主要目标是评估安全性和治疗12个月后HFMSE较基线的平均变化。
队列2中的一名患者被确认在研究前和研究期间同时接受了乙酰胆碱酯酶抑制剂的治疗,这是试验方案不允许的。这位患者在12个月的时间点上HFMSE评分下降了7分。在根据预先指定的方法进行的按方案分析中,排除了这名患者以及由于新冠肺炎相关网站准入限制而错过连续三次注射的患者,队列2的HFMSE评分比基线平均提高了1.2点。
18
