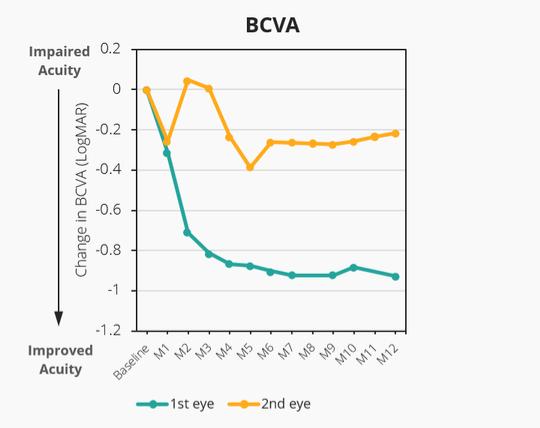
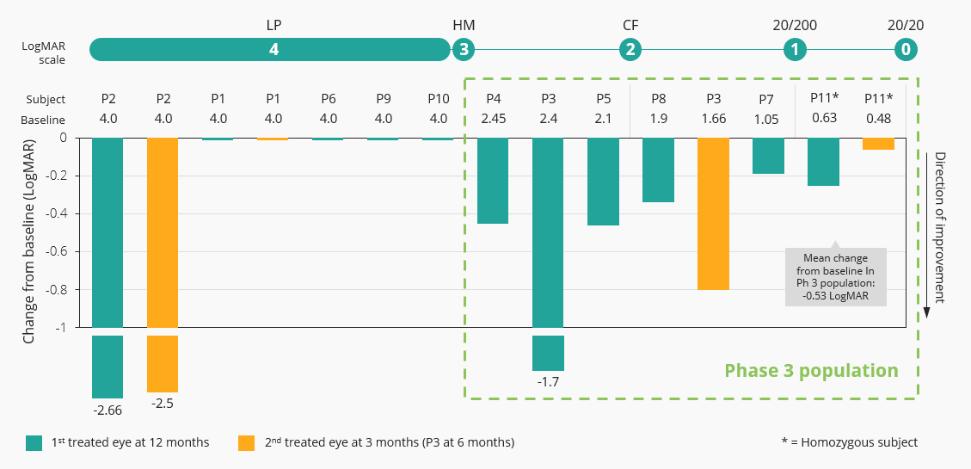
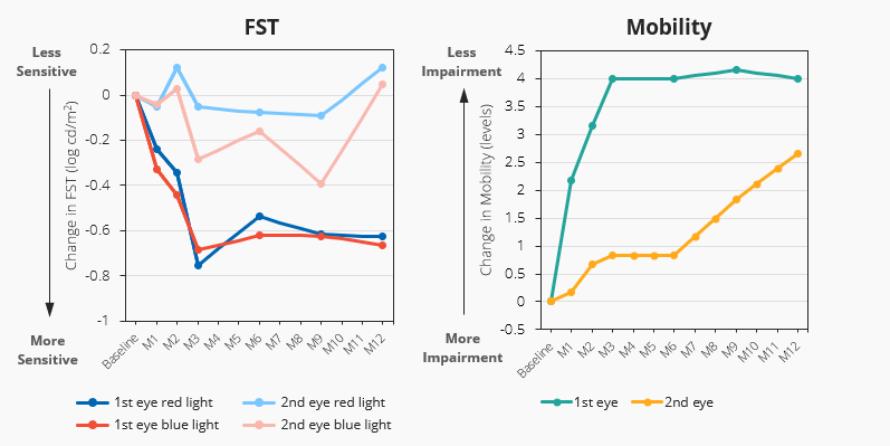
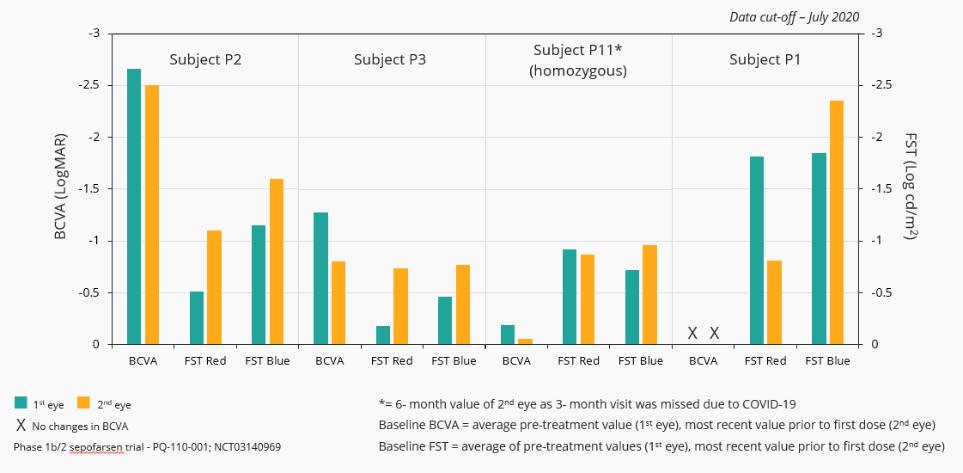
12.股东权益
(A)增加股本
| | | | | | |
| | 2020年中国股票数量增加 | | 2019年中国股票数量增加 | | 2018年中国股票数量增加 |
| | 平凡的生活方式 | | 平凡的生活方式 | | 平凡的生活方式 |
1月1日的余额 | | 53,975,838 | | 43,149,987 | | 36,425,014 |
以现金出具 | | 53,708 | | 10,454,545 | | 6,612,500 |
为服务颁发的证书 | | 102,007 | | 371,306 | | 112,473 |
行使购股权 | | 303,408 | | 46,900 | | 226,098 |
已发行(转让)库存股 | | (303,408) | | (46,900) | | (226,098) |
12月31日的余额 | | 54,131,553 | | 53,975,838 | | 43,149,987 |
公司法定股本为7,200,000欧元,包括90,000,000股普通股和90,000,000股优先股,每股面值为0.04欧元。于2020年12月31日,已发行及缴足54,131,553股普通股,其中3,926,743股由本公司作为库藏股持有(2019年:4,230,151股)。
2018年9月,公司完成了6,612,500股普通股的包销公开发行和同时登记直接发行,发行价为每股515.75美元。此次发行的总收益为89,983,000欧元,交易成本为5,792,000欧元,净收益为84,191,000欧元。
2018年11月,该公司向Ionis PharmPharmticals,Inc.发行了112,473股股票,总金额为250万美元,每股22.23美元(19.46欧元)。根据协议条款,在签署全球许可协议时,向Ionis支付了普通股的预付款。该公司获得了QR-1123及相关专利的全球独家许可。该公司还将支付未来的里程碑付款,其中一些将以股权支付,其他一些将由公司自行决定以现金或股权支付,以及通过特许权使用费条款按净销售额20%支付的特许权使用费。
2018年11月7日,本公司提交了一份搁置登记声明,该声明允许:(A)本公司发售、发行和出售其普通股、认股权证和/或单位的最高总发行价为5300,000,000美元;以及(B)作为23亿美元的一部分,我们发售、发行和出售根据与H.C.Wainwright&Co签订的销售协议可能发行和出售的最高总发行价为375,000,000美元的普通股。
2019年10月,公司完成了10,445,545股普通股的包销公开发行,发行价为每股55.50欧元。此次发行的总收益为51,597,000欧元,交易成本为3,047,000欧元,净收益为48,550,000欧元。
2019年12月,该公司向Ionis PharmPharmticals,Inc.发行了371,306股股票,总金额为233,501,000美元,每股59.43美元(8.51欧元)。根据协议条款,在QR-1123的1/2期Aurora临床试验中的第一名患者服用QR-1123的1/2期Aurora临床试验中的第一名患者后,向Ionis支付了普通股预付款的第二期。
2020年3月,公司终止了与H.C.Wainwright&Co的销售协议,并签订了一项销售协议,允许公司发行、发行和出售最高总计7500万美元的普通股,这些普通股可以在花旗全球市场公司(Citigroup Global Markets,Inc.)和坎托·菲茨杰拉德公司(Cantor Fitzgerald&Co)的一次或多次市场发行中发行和出售。2020年,没有任何股票根据这一自动取款机设施发行。
(B)股权结算员工福利储备
员工、监事会成员和管理委员会成员的股票期权成本在损益表中确认,并在归属期间相应增加股本。