我们致力于为食品过敏患者寻找安全、有效和对病人友好的治疗方法。 与其他过敏治疗方法相比,我们相信我们EPIT的安全性。TM方法通过Viaskin实现TM贴片可以提供显著的治疗性、耐受性和耐受性。易用性对这些病人有利。EPITTM可用作过敏特异性免疫治疗,通常称为脱敏。脱敏包括重复使用少量的过敏原,以降低患者的过敏原 反应性。目前研究的脱敏方法包括皮下、舌下和口服免疫治疗,这往往需要经常或长期在专门中心使用。在学术环境中,存在一些成功的案例,但由于这些治疗食物过敏的脱敏方法的安全性和商业可行性,这一领域的大规模药物开发受到了限制。这些方法也可能是很差的 为儿科病人设计,因为他们的安全概况或不方便的给药方法。最重要的是,其中一些方法也因引发与治疗有关的严重不良事件而闻名,包括严重的过敏反应,在给药期间危及病人的生命。此外,其中一些方法还与长期不良治疗效应的风险增加有关,如EoE。作为一种自我给药的治疗方法,我们相信Viaskin具有良好的 安全特性。TM使我们成为迄今为止食品过敏方面最先进的临床项目之一的公司。
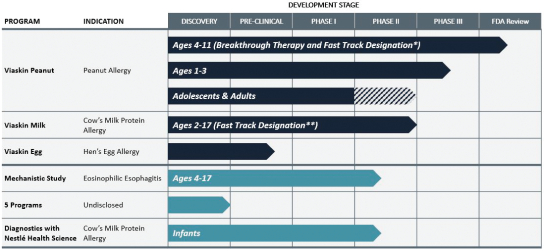
下表汇总了我们最先进的产品候选产品:
| * | 美国FDA突破治疗与儿童快车道命名 |
| ** | 美国FDA在儿童两岁及以上患者中的快速命名 |
我们致力于成为发现、开发和商业化食品过敏产品的领先者。我们的管道开发战略是基于 利用Viaskin的。TM同时考虑到目标市场特征的组合,包括过敏原流行率、持久性和严重程度。我们选择我们的目标产品候选人,目的是解决过敏,高未满足的医疗需求。
我们的主要产品候选人,ViaskinTM花生,已经完成了一项全球第三阶段方案,用于治疗4至11岁的花生过敏患者。维斯金TM花生在美国食品和药物管理局(FDA)的儿童中获得了快速通道指定和突破性治疗指定,这是旨在加速或便利审查旨在治疗严重或危及生命的疾病或疾病的新药和生物产品的监管指定,并表明有可能解决这种疾病或状况未得到满足的医疗需求。欧洲药品管理局(简称EMA)儿科委员会也对我们针对Viaskin的儿科调查计划(PIP)采取了积极的意见。TM花生,是欧洲任何一种新的医药产品申请销售授权的先决条件。
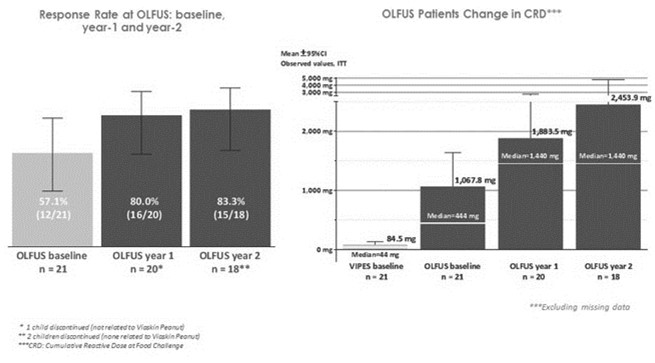
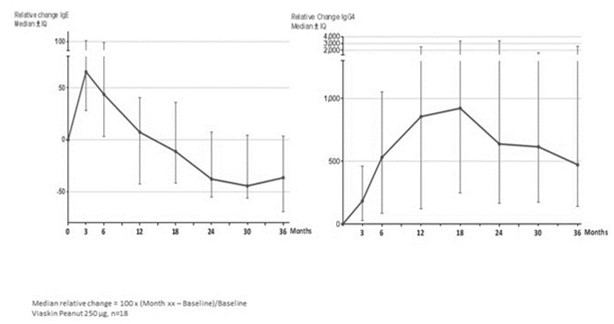
2014年9月,我们宣布了我们的 Viaskin的对线结果。TM花生的药效与安全性,VIPES,ViaskinⅡb期临床试验TM花生用于治疗花生过敏患者,随后在得克萨斯州休斯敦举行的2015年AAAAI年会上提交了一份完整的研究报告。2016年10月,我们公布了为期两年的OLFUS-VIPES评估Viaskin长期疗效和安全性的研究结果。TM花生用于治疗花生过敏儿童。OLFUS-VIPES,或OLFUS,是一个开放标签的, 跟踪研究VIPES.根据我们的第IIb阶段计划的结果,我们启动了第三阶段计划,旨在评估 viaskin的有效性和安全性。TM儿童花生。作为我们第三阶段项目开发的一部分,我们启动了花生EPIT。TM功效与安全性研究,或称
47