美国
证券交易委员会
华盛顿特区20549
表格10-q
根据1934年证券交易所第13或15(D)节提交的季度报告
截至2019年11月30日止的季度
O根据1934年证券交易所ACT第13或15(D)节提交的过渡报告
佣金档案号码:000-50298
奥拉梅德制药公司
( 其约章所指明的注册人的确切名称)
| 特拉华州 | 98-0376008 | |
| ( 注册或组织的州或其他管辖范围) | (I.R.S.雇主) 识别号) | |
| 美洲大道1185号,纽约228号套房,纽约 | 10036 | |
| (首席行政办公室地址) | (邮政编码) |
844-967-2633
(登记人的电话号码,包括 区号)
根据该法第12(B)条登记的证券:
| 每一班的职称 | 交易符号 | 注册的每个交易所的名称 | ||
| 普通股票面价值0.012美元 | ORMP | 纳斯达克资本市场,特拉维夫证券交易所 |
(1)已提交1934年“证券交易法”第13条或第15(D)节要求在过去12个月内提交的所有报告(或要求登记人提交此类报告的时间较短的 );(2)在过去90天中一直受到这种申报要求的限制。
是 x No o
通过检查标记,说明注册人是否以电子方式提交了每一份交互数据文件,这些文件必须按照本章第405条(本章第232.405节)的规定在过去12个月内提交(或在较短的时间内要求注册人提交此类文件)。
是x否o
通过检查标记指示注册人是大型加速 备案者、加速备案者、非加速备案者、较小的报告公司还是新兴的增长公司。参见“Exchange Act”规则12b-2中“大型加速筛选器”、“加速筛选器”、“小型报告公司”和“新兴 增长公司”的定义 。
| 大型加速滤波器 | 加速滤波器 |
| 非加速滤波器x |
小型报告公司x 新兴成长公司o |
如果是新兴成长型公司,请用支票标记表明注册人是否选择不使用延长的过渡期来遵守“外汇法”第13(A)条规定的任何新的或经修订的财务会计准则。☐
通过复选标记指示注册人是否为shell公司 (如“交易法”第12b-2条所定义)。
是的 o No x
截至2020年1月9日,发行人普通股共有17735775股,每股票面价值0.012美元,已发行。
奥雷德制药公司
表格10-q
目录
| 第一部分-财务资料 | 1 |
| 项目1-财务报表 | 1 |
| 项目2-管理层对财务状况和业务结果的讨论和分析 | 17 |
| 项目3-市场风险的定量和定性披露 | 24 |
| 项目4-管制和程序 | 24 |
| 第二部分-其他资料 | 25 |
| 第2项-股本证券的未登记出售及收益的使用 | 25 |
| 项目6-展品 | 25 |
如本季度报告中所用的表格 10-Q,术语“we”、“us”、“our”和“Company”指的是Oramed制药公司。以及我们的全资子公司,除非另有说明。除 另有说明外,所有美元金额均指美元。
2019年11月30日,以色列银行引用的新以色列谢克尔(或称新谢克尔)与美元之间的汇率为3.476至1.00美元。除非上下文另有说明,本季度报告表10-Q中提供新谢克尔金额美元等值或 提供新谢克尔等值美元数额的报表均以这种汇率为基础。
i
第一部分-财务 资料
项目1-财务报表
奥雷德制药公司
精简合并财务报表
截至2019年11月30日
目录
| 页 | |
| 精简的合并财务报表: | |
| 资产负债表 | 2 |
| 综合损失表 | 3 |
| 股东权益变动表 | 4 |
| 现金流量表 | 5 |
| 财务 报表附注 | 6-16 |
1
Oramed制药公司
压缩合并资产负债表
美元(千美元)(除股票 和每股数据外)
(未经审计)
| 十一月三十日, | 八月三十一日, | |||||||
| 2019 | 2019 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | 3,171 | 3,329 | ||||||
| 短期存款 | 23,755 | 25,252 | ||||||
| 有价证券 | 3,207 | 3,701 | ||||||
| 预付费用和其他流动资产 | 609 | 1,042 | ||||||
| 流动资产总额 | 30,742 | 33,324 | ||||||
| 长期资产: | ||||||||
| 长期存款 | 1 | 1 | ||||||
| 有价证券 | 250 | 1,295 | ||||||
| 退休时为雇员权利提供资金的数额 | 16 | 19 | ||||||
| 财产和设备,净额 | 27 | 24 | ||||||
| 经营租赁使用权资产 | 106 | - | ||||||
| 长期资产总额 | 400 | 1,339 | ||||||
| 总资产 | 31,142 | 34,663 | ||||||
| 负债和股东权益 | ||||||||
| 流动负债: | ||||||||
| 应付帐款和应计费用 | 1,796 | 2,541 | ||||||
| 递延收入 | 2,703 | 2,703 | ||||||
| 应付关联方的款项 | 96 | 64 | ||||||
| 经营租赁负债 | 46 | - | ||||||
| 流动负债总额 | 4,641 | 5,308 | ||||||
| 长期负债: | ||||||||
| 递延收入 | 8,983 | 9,658 | ||||||
| 雇员退休后的权利 | 17 | 22 | ||||||
| 对不确定税收状况的备抵 | 11 | 11 | ||||||
| 经营租赁负债 | 60 | - | ||||||
| 其他负债 | 270 | 271 | ||||||
| 长期负债总额 | 9,341 | 9,962 | ||||||
| 承诺(附注2) | ||||||||
| 股东权益: | ||||||||
| 普通股,票面价值0.012美元(截至2019年11月30日和2019年8月31日,分别为30,000,000股;17,400,612股和17,383,359股) | 209 | 208 | ||||||
| 额外已付资本 | 100,597 | 100,288 | ||||||
| 累积赤字 | (83,646 | ) | (81,103 | ) | ||||
| 股东权益总额 | 17,160 | 19,393 | ||||||
| 负债和股东权益共计 | 31,142 | 34,663 | ||||||
所附附注是精简合并财务报表的组成部分。
2
奥雷德制药公司
综合损失合并报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
| 三个月结束 | ||||||||
| 十一月三十日, | 十一月三十日, | |||||||
| 2019 | 2018 | |||||||
| 收入 | $ | 674 | $ | 674 | ||||
| 收入成本 | 35 | |||||||
| 研发费用 | 2,022 | 4,347 | ||||||
| 一般和行政费用 | 1,081 | 932 | ||||||
| 营运损失 | 2,429 | 4,640 | ||||||
| 财政收入 | 209 | 286 | ||||||
| 财务费用 | 20 | 8 | ||||||
| 投资公允价值变动的收入(损失) | (303 | ) | 60 | |||||
| 这一期间的净亏损 | $ | 2,543 | $ | 4,302 | ||||
| 普通股每股亏损: | ||||||||
| 普通股每股基本损失和稀释损失 | $ | 0.15 | $ | 0.25 | ||||
| 用于计算普通股每股基本损失和稀释损失的普通股加权平均数量 | 17,472,315 | 17,448,744 | ||||||
所附附注是精简合并财务报表的组成部分。
3
奥雷德制药公司
股东权益变动的合并合并报表
美元(千美元)
(未经审计)
| 累积 | ||||||||||||||||||||||||
| 额外 | 其他 | 共计 | ||||||||||||||||||||||
| 普通股 | 已付 | 综合 | 累积 | 股东‘ | ||||||||||||||||||||
| 股份 | $ | 资本 | 收入 | 赤字 | 衡平法 | |||||||||||||||||||
| 以千计 | ||||||||||||||||||||||||
| 截至2019年8月31日的余额 | 17,383 | $ | 208 | $ | 100,288 | - | $ | (81,103 | ) | $ | 19,393 | |||||||||||||
| 截至2019年11月30日的三个月期间的变化情况: | ||||||||||||||||||||||||
| 为服务发行的股份 | 5 | * | 17 | - | - | 17 | ||||||||||||||||||
| 认股权证及期权的行使 | 12 | 1 | 12 | - | - | 13 | ||||||||||||||||||
| 股票补偿 | - | * | 280 | - | - | 280 | ||||||||||||||||||
| 净损失 | - | - | - | - | (2,543 | ) | (2,543 | ) | ||||||||||||||||
| 截至2019年11月30日的结余 | 17,400 | $ | 209 | $ | 100,597 | - | $ | (83,646 | ) | $ | 17,160 | |||||||||||||
| 累积 | ||||||||||||||||||||||||
| 额外 | 其他 | 共计 | ||||||||||||||||||||||
| 普通股 | 已付 | 综合 | 累积 | 股东‘ | ||||||||||||||||||||
| 股份 | $ | 资本 | 收入 | 赤字 | 衡平法 | |||||||||||||||||||
| 以千计 | ||||||||||||||||||||||||
| 截至2018年8月31日的余额 | 17,369 | $ | 207 | $ | 99,426 | $ | 702 | $ | (69,223 | ) | $ | 31,112 | ||||||||||||
| ASC 606的初步通过 | 1,773 | 1,773 | ||||||||||||||||||||||
| ASU 2016-01初步通过 | (702 | ) | 702 | - | ||||||||||||||||||||
| 2018年11月30日终了的三个月期间的变化: | ||||||||||||||||||||||||
| 为服务发行的股份 | 8 | * | 36 | - | - | 36 | ||||||||||||||||||
| 股票补偿 | - | * | 239 | - | - | 239 | ||||||||||||||||||
| 净损失 | - | - | - | - | (4,302 | ) | (4,302 | ) | ||||||||||||||||
| 截至2018年11月30日余额 | 17,377 | $ | 207 | $ | 99,701 | - | $ | (71,050 | ) | $ | 28,858 | |||||||||||||
| * | 表示小于$1的金额。 |
所附附注是精简合并财务报表的组成部分。
4
奥雷德制药公司
合并现金流量表
千美元
(未经审计)
| 三个月结束 | ||||||||
| 十一月三十日, | ||||||||
| 2019 | 2018 | |||||||
| 业务活动现金流量: | ||||||||
| 净损失 | $ | (2,543 | ) | $ | (4,302 | ) | ||
| 将净亏损与用于业务活动的现金净额对账所需的调整数: | ||||||||
| 折旧 | - | 2 | ||||||
| 存款和到期日债券的汇兑差额和利息 | (92 | ) | (116 | ) | ||||
| 投资公允价值的变化 | 303 | (60 | ) | |||||
| 股票补偿 | 280 | 239 | ||||||
| 为服务发行的股份 | 17 | 36 | ||||||
| 经营资产和负债的变化: | ||||||||
| 预付费用和其他流动资产 | 433 | (153 | ) | |||||
| 应付帐款、应计费用和关联方 | (714 | ) | 929 | |||||
| 合同负债 | (675 | ) | (674 | ) | ||||
| 退休时雇员权利的法律责任 | (5 | ) | - | |||||
| 其他负债 | - | (32 | ) | |||||
| 用于业务活动的现金净额共计 | (2,996 | ) | (4,131 | ) | ||||
| 投资活动的现金流量: | ||||||||
| 购买短期存款 | (3,000 | ) | - | |||||
| 购买持有至到期证券 | - | (397 | ) | |||||
| 出售短期存款所得收益 | 4,600 | 3,000 | ||||||
| 持有至到期证券的到期日收益 | 1,225 | 400 | ||||||
| 退休时雇员权利基金 | 3 | - | ||||||
| 购置财产和设备 | (3 | ) | (8 | ) | ||||
| 投资活动提供的现金净额共计 | 2,825 | 2,995 | ||||||
| 来自筹资活动的现金流量: | ||||||||
| 发行普通股的收益,扣除发行成本 | 1 | - | ||||||
| 行使选择权所得收益 | 12 | - | ||||||
| 筹资活动提供的现金净额共计 | 13 | - | ||||||
| 汇率变动对现金的影响 | 0 | 1 | ||||||
| 现金和现金等价物减少 | (158 | ) | (1,135 | ) | ||||
| 期初现金及现金等价物 | 3,329 | 4,996 | ||||||
| 期末现金及现金等价物 | $ | 3,171 | $ | 3,861 | ||||
| 现金流量补充披露- | ||||||||
| 收到的利息 | $ | 112 | $ | 159 | ||||
所附附注是精简的合并财务报表的组成部分。
5
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
注 1-重要会计政策:
| a. | 一般情况: |
| 1) | 成立及运作 |
奥拉梅德制药公司(与其子公司“公司”合并,除非上下文另有说明)是根据内华达州的法律于2002年4月12日成立的。从公司成立到2006年3月3日,该公司是一家从事矿产资产收购和勘探的勘探阶段公司。2006年2月17日,该公司与Hadasit医疗服务和发展有限公司签订了一项协议,获得用于治疗糖尿病患者的口服胰岛素胶囊的临时专利。
2007年5月14日,该公司在以色列成立了一家全资子公司Oramed Ltd.(“子公司”),从事研究和开发。
2011年3月11日,该公司从内华达州恢复到特拉华州。
2019年7月30日,该附属公司在香港成立了全资子公司Oramed HK Limited.截至2019年11月30日,OramedHK有限公司没有业务。
2015年11月30日,公司与合肥天辉科技有限公司签订技术许可证协议。(“HTIT”) 和2015年12月21日,双方签署了一项经修正和恢复的技术许可协议,并于2016年6月3日和2016年7月24日(“许可协议”)进一步修正了 。根据许可证协议, 公司授予HTIT在中华人民共和国、澳门和香港(“领土”)境内的独家商业化许可证,涉及该公司的口服胰岛素胶囊ORMD-0801(“产品”)。根据许可证协议 ,HTIT将自费就子公司的技术和ORMD-0801胶囊开展某些商业化前和管制活动,并将向附属公司支付10%的特许使用费,用于HTIT在该领土销售的相关商业化产品(“特许权使用费”), 和(Ii)总计37,500美元,其中3,000美元应立即支付,其中8,000美元将由公司与某些第三方签订某些协议,在实现某些里程碑和条件后,将支付26 500美元。如果公司不符合某些条件,可以将特许权使用费降低到至少8%。在2033年该公司关于该技术的专利最终到期后,在某些情况下可将 特许权使用费降低到5%。
特许权使用费支付义务应在下列期间适用:自该产品在领土内第一次商业销售起至(1)在该领土上最后到期的许可专利的最后一次过期;和(2)该产品在领土内首次商业销售后15年(“皇家条款”)之后的一段时间内。
“许可协议”将一直有效,直到王室任期届满时为止。“许可证协定”载有习惯上的终止条款。
6
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
注 1-重大会计政策(续):
除其他外,该公司通过 参与产品提交日期将包括为该领土的商业化前活动提供咨询,以及不断向技术创新技术提供咨询服务。
截至2019年11月30日,该公司共收到20 500美元的里程碑付款,总额如下:首次付款3 000美元已于2016年1月收到。在实现某些里程碑之后,2016年7月分别收到第二次和第三次付款6 500美元和第三次付款4 000美元,2016年10月收到第四次里程碑付款4 000美元,2019年1月收到第五次里程碑付款3 000美元。
此外,2015年11月30日,该公司与HTIT签订了股票购买协议(“SPA”)。根据SPA,该公司以12,000美元向HTIT发行了1,155,367股 普通股。交易于2015年12月28日结束。
2015年7月,根据双方或其附属公司签署的意向书 ,HTIT的附属公司向子公司支付了不可退还的500美元的非商店 费用。没有商店的费用被推迟,相关的收入在许可证协议的估计期限内被确认。
收入确认政策见附注1c。
| 2) | 发展和流动性风险 |
该公司在生物技术领域从事创新药物解决方案的研究和开发,包括用于治疗糖尿病患者的口服胰岛素胶囊,以及使用口服可吸收胶囊运送其他多肽,而且没有从其业务中获得可观的收入。根据公司目前的现金资源和承付款项,公司认为至少在今后12个月及以后能够维持目前计划的开发活动 和相应的支出水平,但不能保证公司在此之前不需要额外资金。如果业务费用意外增加, 公司可能需要在今后12个月内寻求额外资金。该公司成功完成开发 项目和向正常运作过渡取决于在美国境内销售其产品、获得外国监管机构批准在国际上销售其产品或与第三方签订许可协议之前,必须获得美国食品和药品管理局的必要监管批准。不能保证 公司将获得其任何产品候选方的监管批准,而且在 公司达到足以支持其业务的收入水平之前,可能需要相当长的时间。, 如果有的话。该公司还期望在其每个产品候选人各自开发期间的管理审批过程中产生大量的 支出。获得营销批准将直接取决于公司是否有能力执行在美国和其他国家获得营销批准所需的必要的管理步骤。公司无法预测这些活动的结果。
7
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
附注1-重大会计政策(续):
| b. | 普通股亏损 |
每普通股的基本净亏损和稀释净亏损是通过将该期间的净亏损除以每一期间已发行普通股的加权平均股份数来计算的。未偿还的股票期权、认股权证和限制性股票单位(“RSU”)已被排除在摊薄的每股 损失的计算之外,因为所有这类证券在提出的所有期间都是反稀释的。在截至11月30日、2019年和2018年的三个月期间,不计算稀释净损失的普通股(认股权证)、认股权证和RSU的加权平均数分别为4,366,806和4,352,798。
| c. | 收入确认 |
许可协议和SPA被认为是具有多个交付品的 单一安排。该公司根据许可证协议 和SPA之间的公允价值分配了49,500美元的总审议额,具体如下:10,617美元用于发行普通股(减去发行费用 $23),根据该公司在2015年12月28日SPA截止日期的股票报价,分配给许可证协议的是38,883美元。
根据会计准则编纂(“ASC”) 605(这是2018年9月1日前所有期间适用的权威性收入确认指南),鉴于该公司通过在2023年6月提交预期产品而继续参与,在该公司有权获得相应付款的期间内确认了与许可证协议 有关的金额,并在赚取费用期间采用基于时间的模式方法确认了预期提交的产品 日期。
2018年9月1日,该公司采用修正的回顾性采用方法,通过了会计准则更新(“ASU”)“2014-09年与客户的合同收入(主题606)”(“ASC 606”)。根据这一方法,该公司在通过日期 将ASC 606应用于许可证协议,并被要求对2018年9月1日开始累积赤字余额进行调整,所有以前的 期继续列在ASC 605项下。采用ASC 606最重要的影响是确认与里程碑付款相关的收入的时间(br})的影响。根据ASC 605(这是2018年9月1日之前所有时期适用的权威收入确认 指南),鉴于该公司通过2023年6月提交的预期产品 继续参与,在公司有权获得相应付款的期间内确认了与许可证协议有关的金额,并在赚取费用的期间内使用基于时间的模式方法确定了预期的产品提交日期。然而,根据ASC 606,公司必须确认交易总价格(包括在满足识别标准后与里程碑相关的 考虑),在此期间,公司必须使用输入法确认交易价格(包括与里程碑相关的 考虑)-履行了履约义务。因此,一旦在交易 价格中包含了与里程碑相关的考虑因素,就会立即根据完全满足执行义务 的时间来确认增量收入。这种方法比ASC 605早确认收入,由此产生的影响 记录为2018年9月1日累积赤字期初余额的减少,详见下文。
8
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
附注1-重大会计政策(续):
根据ASC 606,该公司在协议中确定了一个单一的执行 义务,并确定许可证和服务并不不同,因为许可证和服务彼此高度依赖。换句话说,如果没有相关服务,HTIT就不能从许可证中获益,反之亦然。
由于客户随着 实体的执行而从服务中受益,收入将通过2023年6月的预期产品提交日期(使用输入法)来确认。 公司使用输入方法来衡量此过程,以识别收入,这与直接的 线属性接近。公司在确定产品提交日期时使用了重要的判断。
根据ASC 606,公司在实现合同里程碑(视未来事件的发生而定)时有权获得的考虑是一种可变的考虑形式。在评估将包含在交易价格 中的此类里程碑相关考虑的部分(如果有的话)时,公司首先评估每个里程碑的最可能结果,并排除与发生的事件不被视为最可能的结果的与里程碑相关的考虑因素( )。
然后,公司评价在第一步中确定的任何可变代价 是否受到限制,在交易价格变量中列入考虑因素,使其 有可能在随后解决与可变代价相关联的不确定性时,不发生所确认的累积收入数额的重大逆转。公司在确定可变考虑的第一步时使用了重要的判断。
潜在的未来版权费考虑也被认为是ASC 606下可变考虑的一种形式,因为它基于公司产品未来潜在销售的百分比。 但是,公司适用基于销售的版权费例外情况,因此在相关销售发生时将确认基于销售的版权费金额。到目前为止,本公司尚未确认任何与特许权使用费有关的收入.
截至收养日,由于可变考虑的影响,公司将其累计 赤字从合同负债中调整了1,773美元。
截至2019年11月30日,分配给许可证协议 的金额共计22 382美元,所有这些都是通过资产负债表日期收到的。截至2019年11月30日,公司确认了与该协议有关的收入总额为10 696美元(其中674美元在2019年11月30日终了的季度中被确认为 ),并推迟了其余的11 686美元,后者作为合并资产负债表上的递延收入列报。
9
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
附注1-重大会计政策(续):
| d. | 金融工具 |
2016年1月,财务会计准则委员会(“FASB”)发布了指南,更新了确认、计量、列报 和披露金融资产和金融负债的某些方面(“ASU 2016-01”)。该指南要求各实体确认公允价值在净收入中的变化,而不是在累积的其他综合收入中的变化。该公司在2019年财政年度第一季度采用了 这一更新的规定。自2018年9月1日起,该公司将可出售证券的 归类为按公允价值通过损益计量的金融资产。这一收养对公司截至收养日累计亏损的影响为702美元。
| e. | 合并财务报表的编制 |
此处包括 在内的精简合并财务报表是按照美国普遍接受的会计原则(“美国公认会计原则”)和附注1f所述的情况编制的,其基础与公司2019年8月31日终了会计年度10-K表的审定合并财务报表(“2019表10-K”)相同。这些精简的合并的 财务报表反映了所有的调整,这些调整具有正常的经常性性质,并被认为是公平的所列期间结果的 报表所必需的。通常列入年度合并财务报表的某些信息和披露已根据证券和交易委员会的规则和条例在本中期报告中省略。由于精简的合并中期财务报表没有包括美国公认会计准则对年度财务报表所要求的所有信息和 披露,因此应结合2019年表格10-K所载经审计的合并的 财务报表和附注一并阅读。中期的结果不一定表示整个财政年度的结果。
| f. | 最近采用的标准 |
2016年2月,FASB发布了题为“租赁 (主题842)”的ASU第2016-02号,取代了现有的租赁会计准则-租约(主题840)。新标准要求 a承租人在其资产负债表上记录所有12个月以上租约的资产和负债。租赁将被归类为融资或经营,分类影响到承租人的 收益表中的费用确认模式。该公司从2019年9月1日起在修订的追溯基础上采用了这一标准,并且不会重新声明比较期。该公司选出了在 过渡指导下允许的一揽子实际权宜之计,该新标准除其他外,允许公司进行历史租赁分类。公司进行了会计政策选择,将最初期限为12个月或更短的租约保留在资产负债表之外。公司 在租赁期内直线业务报表中确认了这些租赁付款。
截至通过之日,截至2019年9月1日,公司在其资产负债表上确认经营 租赁资产和负债分别为113美元和113美元。
10
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
说明2-承诺:
| a. | 2011年3月,该子公司将其被投资公司Entera的股份出售给D.N.A,保留了117 000股普通股(在2018年7月实施了Entera公司的股票分割之后)。在考虑出售给D.N.A的股份时,除其他付款外,公司还收到了D.N.A的普通股(另见注 4)。 |
作为该协议的一部分,该附属公司签订了一项专利转让协议(“专利转让协定”),根据该协议,指定给Entera 的附属公司在与口头管理自2010年8月以来已向Entera发放的蛋白质有关的某项专利申请中拥有所有权利、所有权和权益。根据这一协议,附属公司有权从Entera特许使用费 收取Entera 3%的净收入(如协议所定义),并获得该专利申请的许可证,用于糖尿病和流感的 。截至2019年11月30日,Entera尚未实现任何收入,也未向该子公司支付任何特许权使用费。2018年12月11日,Entera宣布与Amgen签订了研究合作和许可协议 (“Amgen许可证”),涉及炎症性疾病和其他严重疾病的研究。据报告,根据Amgen许可证的条款,Entera将从Amgen收取少量的初步技术访问费,并将负责安进的临床前发展。如果 Amgen决定将所有这些项目向前推进,Entera将有资格获得高达27万美元的总计 付款,以及高达中个位数的分级版税。安进是负责临床发展,制造和商业化 的任何结果项目。如果安进许可证产生专利转让协议所界定的净收入,则该子公司将有权获得上述特许权使用费。
此外,作为2011年2月15日与第三方 的咨询协议的一部分,附属公司有义务支付2011年3月出售给Entera的专利净使用费 的8%。
| b. | 2017年1月3日,该子公司就其在以色列的办公设施签订了租赁协议。租约有效期为60个月,自2016年10月1日起生效。 |
从2016年10月至2018年9月,年度租赁付款为新以色列谢克尔119 000(32美元),2018年10月至2021年9月为132 000新谢克尔(38美元),并与以色列消费价格指数(“CPI”)的上涨挂钩(截至2019年11月30日,根据2019年11月30日的汇率计算,未来租赁付款总额为70美元)。
作为对这一租赁协议义务的担保,该公司提供了相当于三个月租赁付款的银行担保。
11
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
说明2-承诺(续):
| c. | 2017年12月18日,该子公司与一家供应商达成协议,开发和生产其一种口服胶囊成分,金额为2 905美元,将在订婚期间支付,并以实现某些发展里程碑为基础,其中1 542美元已在截至2019年11月30日的研发费用中得到确认。 |
| d. | 2018年2月14日,该附属公司与第三方签订了“临床研究组织服务协议”,自2017年11月1日起生效,以保留其作为临床研究组织(“CRO”)的地位,用于该公司为2型糖尿病患者口服胰岛素胶囊的三个月剂量范围的临床试验,并于2019年5月20日对该协议进行了修正。作为对其服务的考虑,该子公司将在聘用期间并根据某些里程碑的实现情况,向CRO支付总额为10,206美元的款项,其中8,003美元在截至2019年11月30日的研发费用中得到确认。 |
| e. | 2018年5月21日,该子公司与第三方签订了CRO服务协议,将其保留为CRO,用于其口服胰岛素胶囊的食品效应临床试验。作为对其服务的考虑,该附属公司将在聘用期间并根据某些里程碑的实现情况,向CRO支付总额为1 166美元的款项,其中1 141美元在截至2019年11月30日的研发费用中得到确认。 |
| f. | 2019年7月29日,该子公司与第三方签订了CRO服务协议,将其保留为CRO,用于其口服胰岛素的剂量范围广泛的临床试验。作为对其服务的考虑,该子公司将在聘用期间并根据某些里程碑的实现情况,向CRO支付总额658美元的款项,其中313美元在截至2019年11月30日的研发费用中得到确认。 |
| g. | 以色列创新管理局(IIA)的赠款 |
根据该公司从 IIA提供的资金条件,从如此供资的项目开发的产品的销售应支付3%的特许权使用费,最高数额相当于所收到赠款的100%-150%(与美元挂钩),并按伦敦银行同业拆借利率增加利息。
在收到赠款时,有关项目的成功开发没有得到保证。截至2019年11月30日收到的总额为2,207美元。
与已供资的 项目有关的特许权使用费费用在2019年11月30日终了的季度和以前各期的收入成本中得到确认。
| h. | 欧洲联盟委员会(“欧共体”)的赠款 |
2019年11月26日,该公司收到欧共体根据“2020年欧洲创新方案地平线”的中小企业工具支付的初步付款17.50欧元。
作为赠款条款的一部分,公司必须在欧洲使用赠款的收益。该公司打算利用这笔赠款,探讨在欧洲进行临床 试验的可能性。
12
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
附注3-公允价值:
公司计量公允价值,公开金融资产公允 价值计量。公允价值是基于在计量日市场参与者之间有秩序的 交易中出售资产所收到的价格。为了提高公允价值 计量的一致性和可比性,指南建立了一个公允价值等级,将用于衡量 公允价值的可观测和不可观测的投入分为三大层次,其描述如下:
| 第1级: | 在资产或负债的计量日,活跃市场的报价(未经调整)。公允价值层次结构给予1级输入最高优先级。 |
| 2级: | 根据不包括在一级内的报价以外的投入而直接或间接观察到的资产或负债的可观测价格的可观察价格。 |
| 第3级: | 当很少或根本没有市场数据时,使用不可观测的输入。公允价值层次结构给予3级输入最低优先级。 |
截至2019年11月30日,按 公允价值计量的资产由股票证券(一级)构成。附注4所列持有至到期债券的公允价值是基于第2级计量的 。
截至2019年11月30日,由于这些票据的短期期限, 现金等价物、短期存款和应付账款的账面价值接近其公允价值。
截至2019年11月30日,由于市场利率的规定,长期存款的账面金额接近其公允价值。
为雇员权利提供资金的数额 按现金退还价值列报,接近其公允价值。
在截至2019年11月30日和2018年11月30日的三个月 期内,没有第三级项目。
13
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
附注4:有价证券:
公司的有价证券包括对D.N.A和Entera的股票证券和持有至到期债券的投资。
| a. | 组成: |
十一月三十日, 2019 | 八月三十一日 | |||||||
| 短期: | ||||||||
| D.N.A(见下文b) | $ | 296 | $ | 557 | ||||
| Entera(见下文c) | 263 | 304 | ||||||
| 持有到期日债券(见下文d) | 2,648 | 2,840 | ||||||
| $ | 3,207 | $ | 3,701 | |||||
| 长期: | ||||||||
| 持有到期日债券(见下文d) | $ | 250 | $ | 1,295 | ||||
| b. | D.N.A |
D.N.A普通股在特拉维夫证券交易所交易。这些证券的公允价值按计量日的证券报价计算。
截至2019年11月30日,该公司拥有D.N.A公司流通股的6.9%左右。
截至2019年11月30日和2019年8月31日的证券成本为595美元。
| c. | 肠 |
Entera普通股自2018年6月28日以来一直在纳斯达克资本市场交易。公司从该日起按公允价值计量投资,因为它有一个易于确定的 公允价值(在此日期之前,该投资被记为成本法投资(共计1美元))。
14
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
附注4-有价证券(续):
| d. | 持有至到期证券 |
截至2019年11月30日,持有至到期日证券的摊销成本和估计公允价值如下:
| (2019年11月30日) | ||||||||||||
| 摊销成本 | 未实现损失毛额 | 估计公允价值 | ||||||||||
| 短期: | ||||||||||||
| 商业债券 | $ | 2,624 | $ | (16 | ) | $ | 2,608 | |||||
| 应计利息 | 24 | - | 24 | |||||||||
| 长期 | 250 | - | 250 | |||||||||
| $ | 2,898 | $ | (16 | ) | $ | 2,882 | ||||||
截至2019年11月30日,被归类为持有到期日的债务证券的合同期限 如下:一年至两年后,250美元,到期收益率为2.77%。
截至2019年8月31日,持有至到期日证券的摊销成本和估计公允价值如下:
| 八月三十一日 | ||||||||||||
| 摊销成本 | 未实现损失毛额 | 估计公允价值 | ||||||||||
| 短期: | ||||||||||||
| 商业债券 | $ | 2,808 | $ | 6 | $ | 2,814 | ||||||
| 应计利息 | 32 | - | 32 | |||||||||
| 长期 | 1,295 | 4 | 1,299 | |||||||||
| $ | 4,135 | $ | 10 | $ | 4,145 | |||||||
截至2019年8月31日,被归类为持有至到期的债务证券的合同期限 如下:一年至两年后,1,295美元和到期收益率(br}利率介于2.55%至3.20%之间。
持有至到期的证券,在 期间到期,自资产负债表日期起计的12个月,包括在短期可买卖证券中。持有到期日超过一年的到期日被认为是长期有价证券。
15
奥拉梅德制药公司
附注 精简合并财务报表
美元(千美元)(除股票 和每股数据外)
(未经审计)
附注5-股东权益:
2019年9月5日,公司根据 订立了一项股权分配协议(“销售协议”),公司可根据公司的选择不时发行和出售公司普通股的股份,其总发行价最高可达15,000美元,但须符合某些条款和条件。任何出售的股份都将按照公司S-3表格上的有效货架登记声明出售,包括一份日期为2017年2月2日的招股说明书,并辅以2019年9月5日的招股说明书补充说明。本公司将向销售代理支付现金佣金(Br}为销售协议下通过销售代理出售的股票收益总额的3.0%。截至2019年11月30日,没有根据销售协议出售股票。截至2020年1月9日,根据销售协议{Br}发行了335,163股,净收益总额为1,785美元。
附注6-相关各方-交易:
2008年7月1日,该子公司与KNRY有限公司签订了两项咨询协议。(“KNRY”),一家以色列公司,由首席科学干事(“CSO”)拥有, 据此首席执行官(“首席执行官”)和民间社会组织通过KNRY向该公司提供服务(“咨询协议”)。咨询协议在书面通知前140天由任何一方终止。经修订的咨询协议规定,KNRY将得到补偿,以支付与执行咨询协议有关的合理费用,每月付给首席执行干事和CSO的咨询费分别为127,570新谢克尔(37美元)和80,454新谢克尔(23美元), 。
除了咨询协议之外,该公司还根据ORI-组织资源国际有限公司编写的搬迁成本分析报告,支付因首席执行官迁至纽约而产生的某些直接费用、相关税收和费用。在截至2019年11月30日的三个月期间,此类搬迁费用共计86美元,而截至2018年11月30日的3个月为131美元。
16
项目2-管理层对财务状况和经营结果的讨论和分析
以下对我们财务状况和业务结果的讨论和分析,应与本报告其他地方所载的合并财务报表(br}和相关附注以及我们的合并财务报表、所附附注和“管理部门对财务状况和业务结果的讨论和分析”一并阅读,这些说明和分析载于我们的年度报告(见下文)。
前瞻性陈述
本季度报告中关于表10-Q的陈述不是历史事实,是1995年“私人证券诉讼改革法”和其他联邦证券法意义上的“前瞻性陈述”。“预期”、“预期”、“打算”、“计划”、“计划支出”、“认为”、“寻求”、“估计” 等词以及类似的词语或变体,都是为了识别前瞻性语句,但不认为 代表一种包括识别前瞻性报表的所有手段,如本季度表10-Q报告中所指的前瞻性报表。此外,关于未来事项的 声明是前瞻性声明.我们提醒读者,前瞻性声明仅仅是 预测,因此必然受不确定因素和其他因素的影响,涉及已知和未知的风险,这些风险可能导致实际结果、绩效、活动水平、或我们的成就或行业成果与任何未来的结果、业绩、活动水平、或我们的成就或行业成果(这些前瞻性陈述所表达或暗示的)大不相同。这些前瞻性发言除其他外,包括关于下列方面的发言:
| ● | 我们的 产品在治疗糖尿病方面的预期发展和潜在利益; |
| ● | 与其他公司或医疗机构签订更多许可证协议或其他伙伴关系或合作形式的前景; |
| ● | 与合肥天辉科技有限公司签订的许可协议下的未来里程碑、条件和特许权使用费, 或HTIT; |
| ● | 我们的研究和发展计划,包括临床前和临床试验计划和注册时间,取得 结果和试验结论,包括但不限于,我们对我们将开始第三阶段临床 试验的期望,以及我们以后提出一项新的药物应用的期望; |
| ● | 我们相信,我们的技术有潜力口头提供药物和疫苗,而今天只能通过注射才能提供药物和疫苗; |
| ● | 以技术为基础的产品效能、安全性、病人方便性、可靠性、价值和专利地位的竞争能力; |
| ● | 潜在的市场需求,我们的产品; |
| ● | 我们期望在未来的一年里,我们的研发开支净额将继续成为我们的主要支出; |
| ● | 我们对短期和长期资本需求的期望; |
| ● | 我们对未来几个月和未来时期的展望,包括但不限于我们对未来收入和支出的预期;以及 |
| ● | 有关我们业务的任何其他计划和策略的信息。 |
17
尽管这个 季度的前瞻性语句 表格10-Q的报告反映了我们管理层的诚信判断,这样的陈述只能基于我们目前所知道的事实和因素。因此,前瞻性陈述本身就受制于风险和不确定性 ,实际结果和结果可能与前瞻性 语句中讨论或预期的结果和结果大不相同。可能导致或促成这种成果和结果差异的因素包括(但不限于)在标题1A下具体述及的 因素。风险因素“在截至2019年8月31日的 财政年度的表10-K的年度报告中,或我们于2019年11月27日向证券交易委员会或证券交易委员会提交的年度报告中,以及在我们的年度报告其他地方讨论并不时在我们向 SEC提交的其他文件中表达的风险因素。此外,科学研究、临床和临床前试验的历史性成果并不能保证未来研究或试验的 结论不会提出不同的结论。此外,根据额外的研究、临床及临床前试验结果,本季刊(br}表格10-q报告所提及的历史性结果,可根据额外的研究、临床及临床前试验结果而作出不同的解释。 表格10-Q报告 。除法律规定外,我们没有义务修改或更新任何前瞻性陈述,以便 反映本季度报告表10-Q之后可能出现的任何事件或情况。我们促请读者仔细检讨及考虑整季所作的各种披露。 报告表格 10-Q试图就可能影响我们的业务、财务状况、经营结果和前景的风险和因素向有关各方提出建议。
业务概览
我们是一家制药公司,目前正在研究和开发创新的药物解决方案,包括用于治疗糖尿病患者的口服胰岛素胶囊,以及使用口服可摄取的胶囊运送其他多肽。我们利用临床研究组织(CROS)来进行我们的临床研究。
最近的业务发展
产品候选
口服胰岛素我们正在寻求通过我们的专利旗舰产品ORMD-0801改变对糖尿病的治疗,我们的技术允许胰岛素从胃肠道经由门静脉进入血液,彻底改变胰岛素的传递方式。它能以比目前给药方法更生理的方式通过 胰岛素。我们的技术是一个平台,有可能口头提供药物和疫苗,而今天只能通过注射来提供药物和疫苗。
FDA指南:2017年8月,在与美国食品和药物管理局(FDA)的电话中,我们被告知,提交ORMD-0801 的监管途径将是生物制剂许可证申请(BLA)。如果获得批准,BLA途径将允许我们从批准之日起为ORMD-0801提供12年的营销专卖权,如果该产品也获得用于儿科病人的 批准,我们还可以获得6个月的独家销售许可。FDA证实,非临床毒理学、化学制造 控制和辅料鉴定的方法将由其公布的指导文件驱动。
阶段 IIb研究:2018年5月,我们启动了ORMD-0801的三个月剂量范围II期临床试验.这一安慰剂对照, 随机,90天的治疗临床试验是在美国全国多个中心的269名2型糖尿病患者进行的,依据的是FDA的调查新药物应用程序(Ind)。试验的主要终点是评估ORMD-0801在90天治疗期间对HbA1c水平的影响。试验的次要终点 包括在混合餐耐受性试验中测定空腹血糖或FPG、餐后血糖或ppg水平、 或mmmtd和体重。在2019年5月,我们开始对大约75名2型糖尿病患者延长这一方案,他们使用较低剂量的 剂量。我们期望在2020年历年第一季度收到这项研究的最后报告。
18
在2019年11月,我们宣布了第IIb阶段试验的初步结果。随机进入每日ORMD-0801的患者平均HbA1c比基线降低0.60%,或经安慰剂调整后减少0.54%(p值=0.036)。这0.54%的减少HbA1c 被认为是有临床意义的。与安慰剂相比,ORMD-0801的治疗显示出很好的安全性,没有严重的与药物相关的 不良事件,也没有增加低血糖发作的频率。此外,在这90天的试验中,没有观察到体重增加.在最初的队列中,269名以美国为基础的患者接受了剂量递增的 方法治疗:16毫克初始剂量,滴定至24毫克/剂量,然后滴定至32毫克/剂量。将患者随机分为三组,分别为每日一次(32 mg/d)、每日两次(64 mg/d)、每日三次(96 mg/d)。每个治疗臂都有相应的安慰剂。209例患者完成治疗至12周终点 ,并纳入数据分析(24名受试者未完成整个12周的治疗)。此外,由于证据 的治疗中心相互作用,两个位点(36名患者(占在册受试者的13.4%)被排除在统计分析 ,因为他们显示的结果与其他有统计学意义的结果相反。我们仍在调查造成这一差异的原因。
每日一次和两天两次的武器分别比A1C的基线 减少0.60%(安慰剂调整为0.54%)和0.59%(安慰剂调整为0.53%)(p值分别为0.036和0.042)。每日三次臂 不符合统计学意义(p-值0.093).
FDA同意于2020年2月4日举行第二阶段会议的初步结束,以审查化学制造和控制(CMC)的各个方面。第二阶段会议的第二次会议将侧重于临床方面,预计在2b阶段试验的低剂量组 公布数据之后。
我们预计将开始对1型和2型糖尿病患者进行第三阶段临床试验,预计将在2020年历年的下半年开始。在这些试验之后,我们希望在2024年的日历结束前提交一份可能获得FDA批准的BLA。
夹钳研究:2018年6月,我们发起了一项葡萄糖钳夹研究,该研究应该量化使用ORMD-0801治疗的糖尿病患者的胰岛素吸收。葡萄糖钳是一种定量胰岛素吸收的方法,用于测量病人的胰岛素敏感性和病人代谢葡萄糖的情况。这项探索性的、随机的、双盲的葡萄糖钳夹研究正在评估使用ORMD-0801治疗的1型糖尿病患者的暴露-反应谱。6名A1C水平在10%或10%以下的患者,年龄在18-50岁之间,参加了这项研究。我们期望在2020年第一季度收到这项研究的最后报告。
食物效应研究:2018年6月,我们启动了ORMD-0801食品效应试验。这一单盲、五周期、随机、安慰剂对照的交叉试验正在评估在不同时间服用的ORMD-0801与健康志愿者和1型糖尿病患者膳食关系中的药代动力学(PK)和药效学。48(48)名患者,包括24名健康志愿者和24名1型糖尿病患者.我们期望在2020年的第一季度收到这项研究的最后报告。
纳什研究:2018年10月,我们开始了一项关于非酒精性脂肪性肝炎(NASH)2型患者ORMD-0801的探索性临床研究。由以色列卫生部批准的为期三个月的治疗研究将评估ORMD-0801对30例NASH患者降低肝脏脂肪含量、炎症和纤维化的效果。应以色列卫生部的要求,这项研究的第一部分将对10名参加者进行,预计将在2020年历年第一季度完成。
毒理学研究(6个月):在2019年3月,我们完成了为期6个月的ORMD-0801剂量毒理学研究,该研究是在FDA的请求下于2018年9月启动的。我们期望在2020年历年第一季度收到这项研究的最后报告。
第一类研究:在2019年11月,我们发起了一项1型糖尿病患者的交叉研究,以比较每日一次的ORMD-0801与每日三次的ORMD-0801的效果。这项研究预计将包括26个主题,预计将于2020年第一季度完成。
19
口服胰高血糖素样肽-1胰高血糖素样肽-1(GLP-1)是一种促分泌胰岛素的内分泌激素.此外,还发现 GLP-1可抑制胰高血糖素的释放(一种参与调节葡萄糖的激素),减缓胃 排空,以减少营养物质在血液中的吸收速度,增加饱腹感。GLP-1的其他重要有益属性 是其增加胰腺β细胞(制造和释放胰岛素的细胞)数量的作用,也可能是保护心脏的作用。除了我们的旗舰产品ORMD-0801胰岛素胶囊,我们正在使用我们的技术 口服可食用的GLP-1胶囊,或ORMD-0901。
在2019年2月,我们完成了一项 第一阶段PK试验,以评价ORMD-0901与安慰剂相比的安全性和药动学。我们期望在2020年的第一季度收到这项研究的最后报告。这项研究是根据IND进行的,我们预计随后将进行进一步的生物利用度研究(预期结果在历年 2020),并对2型糖尿病患者进行第二阶段试验,该试验很可能将在美国根据IND进行。
其他产品
我们最近开始开发一种新的药物 候选,以口服瘦素胶囊的形式进行减肥治疗。我们预计在2020年的第一季度,我们的口服瘦素药物候选药物的概念、单剂量 研究将对10例1型糖尿病成人患者的药效学和药效学(胰高血糖素减少)进行评估。我们期望在2020年历年的上半年收到这项研究的最后报告。
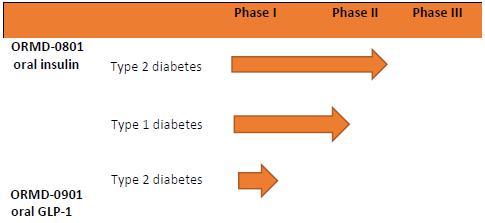
下表概述了我们的 初级产品管道:

无牌技术
2015年11月30日,我们与我们的以色列子公司 和HTIT签订了一项技术许可协议,2015年12月21日,这些缔约方签订了一项经修正和恢复的技术许可协议,该协议于2016年6月3日和2016年7月24日或许可协议中被双方进一步修正。 根据许可协议,我们在中华人民共和国、澳门和香港或该领土的领土内授予了HTIT独家商业化许可证,涉及我们的口服胰岛素胶囊ORMD-0801,或者产品。根据 许可证协议,HTIT将自费对我们子公司的技术和ORMD-0801胶囊进行某些商业化前和监管活动,并将支付(I)将由HTIT在该领土销售的相关商业化 产品净销售额10%的版税,或版税;(Ii)总计3750万美元,其中300万美元应立即支付 ,800万美元将由我们与某些第三方签订某些协议,在实现某些里程碑和条件后,将支付2 650万美元。如果我们不能满足某些条件,可以将 版税率降低到至少8%。在2033年,我们的专利涉及 地区的专利最终到期后,在某些情况下,特许权使用费可能会降低到5%。特许权使用费支付义务应在下列期间内适用:自该产品在领土内首次商业销售之日起,至其后(I)在该领土上最后到期的特许专利届满之时止;及(Ii)该产品在领土内首次商业销售后15年内。, 或者皇室术语。许可证协议将继续有效,直到 皇家任期届满。“许可证协定”载有习惯上的终止条款。截至2019年11月30日,在3750万美元的总额中,我们总共收到了2050万美元的里程碑付款。
20
2015年11月30日,我们还与HTIT(SPA)签订了一份单独的证券采购协议,根据该协议,我们于2015年12月向HTIT发行了1,155,367股我们的普通股 股票,总价为1,200万美元。关于许可证协议和SPA,我们收到了一笔500,000美元的非商店费用。
业务结果
2019和2018年11月30日终了三个月期间的比较
下表汇总了公司截至2019年11月30日和2018年11月30日三个月期间业务数据的某些报表(除 股和每股数据外,以千美元计):
| 三个月结束 | ||||||||
| 十一月三十日, | ||||||||
| 2019 | 2018 | |||||||
| 收入 | $ | 674 | $ | 674 | ||||
| 收入成本 | - | 35 | ||||||
| 研发费用 | 2,022 | 4,347 | ||||||
| 一般和行政费用 | 1,081 | 932 | ||||||
| 财务收入净额 | 114 | 338 | ||||||
| 这一期间的净亏损 | $ | 2,543 | $ | 4,302 | ||||
| 普通股亏损-基本损失和稀释损失 | $ | 0.15 | $ | 0.25 | ||||
| 加权平均普通股 | 17,472,315 | 17,448,744 | ||||||
收入
收入包括与许可证协议 有关的收益,这些收益是在可能不会通过使用输入法的预期产品提交日期2023年6月实现确认的 累积收入的情况下累计确认的。
在截至2019年11月30日和2018年11月30日的三个月期间,每个月的收入都是67.4万美元。
收入成本
收入成本包括与许可证协议有关的特许权使用费,这些使用费将根据收入确认会计和1984年“鼓励工业研究、发展和技术创新法”(经修订)在许可证协定的期限内支付,包括根据该协定颁布的任何条例或轨道。
截至2019年11月30日的三个月期间没有收入成本,而2018年11月30日终了的三个月期间的收入为3.5万美元。减少的原因是,在截至2018年11月30日的三个月内,将许可证协议下的额外里程碑付款列入交易价格,作为ASC 606实施 的一部分。
21
研发费用
研究和开发费用包括直接归因于进行研究和开发方案的费用,包括工资、雇员福利、材料、用品的费用、外部承包商提供的服务的费用,包括与我们的临床 试验有关的服务、临床试验费用、制造用于研究和临床前开发的药品的全部费用。与研究和开发有关的所有 费用均按已发生的费用计算。
临床试验费用是研究和开发费用的重要组成部分,包括与第三方承包商有关的费用。我们将我们的临床试验活动的很大一部分外包出去,利用外部实体,如合同研究机构或CRO、独立的临床 调查人员和其他第三方服务提供商来协助我们进行临床研究。
临床活动主要涉及临床地点和其他管理职能,以管理我们的临床试验主要是由CRO执行。CRO通常为我们的试验执行大部分的启动活动,包括文件准备、站点识别、筛选和准备、 学习前访问、培训和项目管理。
临床试验和临床前试验费用包括管理和科学顾问的薪酬和费用、研究费用、材料采购、胶囊制造费用、病人招募和治疗费用以及研究和开发工作人员的工资和相关费用。
截至2019年11月30日的三个月期间的研究和开发费用减少了53%,从2018年11月30日终了的三个月期间的4 347 000美元降至2 022 000美元。这一减少主要是由于我们的IIb阶段三个月临床试验的费用减少,并被与监管咨询有关的费用增加部分抵消。截至2019年11月30日的三个月期间,以股票为基础的补偿费用共计95,000美元,而2018年11月30日终了的三个月期间为39,000美元,增加的主要原因是在截至2019年11月30日的三个月内增加了新的赠款。
政府赠款
在截至11月30日、2019年和2018年的三个月期间,我们没有承认任何研究和开发赠款。截至2019年11月30日,我们向以色列经济和工业部以色列创新管理局支付了354 000美元的使用费。
一般和行政费用
一般费用和行政费用包括我们的管理人员的薪金和有关费用、咨询费用、法律和专业费用、旅费、业务发展费用、保险费用和其他一般费用。
截至2019年11月30日的三个月期间的一般开支和行政费用从2018年11月30日终了的三个月期间的932 000美元增加到1 081 000美元,增加了16%。与一般活动和行政活动有关的费用增加的主要原因是法律 费用增加。截至2019年11月30日的三个月期间,股票补偿费总额为184,000美元,而2018年11月30日终了的三个月期间为199,000美元( )。减少的主要原因是2020财政年度向雇员和董事发放的 奖励的摊销进展,并因2019年财政年度颁发的奖励增加而部分抵消。
22
财务收入净额
净财务收入减少66%,从2018年11月30日终了的三个月期间的338,000美元下降到2019年11月30日终了的三个月期间的114,000美元。减少的主要原因是,由于现金投资减少,银行存款和持有到期日 债券的收入减少,D.N.A生物医学解决方案有限公司和Entera Bio有限公司普通股的公允价值下降。
流动性和资本资源
从成立到2019年11月30日,我们总共遭受了83,646,000美元的损失。在此期间,到2020年1月9日,我们通过几次私募普通股以及公开发行普通股为我们的业务提供资金,除交易费用外,共筹集了79 521 000美元。在此期间,我们还收到 行使认股权证和期权的现金5 889 000美元。到2019年11月30日,我们有3,171,000美元的可用现金,23,755,000美元的短期银行存款和3,457,000美元的可流通证券。
管理层继续评价各种筹资备选办法,以资助今后的研究和开发活动,并通过在公共或私人股本市场筹资筹措 的一般和行政开支。虽然没有保证我们将在这些倡议中取得成功,但管理部门 认为,由于今后的第三方投资,它将能够获得必要的资金。根据我们目前的现金资源和承诺,我们认为我们将能够至少在今后12个月及以后维持我们目前计划的发展活动和相应的支出水平。
截至2019年11月30日,我们的流动资产总额为30,742,000美元,流动负债总额为4,641,000美元。2019年11月30日,我们的营运资本盈余为26,101,000美元,累计亏损83,646,000美元。截至2019年8月31日,我们的流动资产总额为33,324,000美元,流动负债总额为5,308,000美元。2019年8月31日,我们的营运资本盈余为28,016,000美元,累计亏损为81,103,000美元。流动资金从2019年8月31日至2019年11月30日的减少主要是由于业务活动中使用的现金。
在截至2019年11月30日的三个月期间,现金和现金等价物从截至2019年8月31日报告的3 329 000美元减少到3 171 000美元,原因如下:
在2019年11月30日终了的三个月期间,业务活动使用的现金为2 996 000美元,而2018年11月30日终了的三个月期间使用的现金为4 131 000美元。用于业务活动的现金主要包括研究和开发以及一般和 行政费用造成的净损失,以及由于许可证协议而引起的合同负债的变化,并由应付帐款和应计费用的变化部分抵销。
在2019年11月30日终了的三个月期间,投资活动提供了2 825 000美元的现金,而2018年11月30日终了的三个月期间提供的现金为2 995 000美元。投资活动提供的现金主要包括短期存款的到期日和持有至到期的 证券,并被购买短期存款部分抵销。
供资活动在2019年11月30日终了的三个月期间提供了13 000美元的现金,而在2018年11月30日终了的三个月期间没有提供现金。2019年11月30日终了的三个月期间的筹资活动包括由于行使期权而发行12 253股普通股的净收益总额12 253美元。
2019年9月5日,我们签订了“销售协议”,根据该协议,我们可以根据自己的选择,不时发行和出售我们普通股的股票,其总发行价最高可达15,000,000美元,通过销售代理,但须遵守某些条款和条件。任何出售的股票将根据我们在表格S-3上的有效货架登记声明出售,包括一份日期为2017年2月2日的招股说明书,并由2019年9月5日的招股说明书补充 。根据销售协议,我们将向销售代理支付销售总收益的3.0%的现金佣金。截至2019年8月31日和2020年1月9日,没有根据“销售协议”出售 股和335 163股,净收益总额分别为零和1785362美元。
23
表外安排
截至2019年11月30日,我们没有任何表外安排已经或我们预期有可能对我们的财务状况、财务状况的变化、收入或支出、经营结果、流动资金、资本支出或资本资源产生重大影响。
关键会计政策和估计数
我们的重要会计政策在截至2019年8月31日的合并财务报表附注中作了说明,并在本季度报告(表10-Q)所载的合并财务报表附注中作了说明。
计划支出
我们在研究和开发上投入了大量资金,我们预计在今后的几年里,我们的研究和开发费用将继续成为我们的主要经营费用。
项目3-关于 市场风险的定量和定性披露
在截至2019年11月30日的季度内, 我们的市场风险敞口没有显著变化。有关我们面对市场风险的讨论,请参阅年报第II部第7A项“市场风险的定量及定性披露”。
项目4-管制和程序
披露控制和程序
截至2019年11月30日,我们的管理层,包括我们的首席执行官(首席执行官)和首席财务官(首席财务官),评估了我们的披露控制和程序的有效性。基于这一评估,我们的首席执行官和首席财务官得出结论,我们的披露控制和程序是有效的。
财务报告内部控制的变化
在截至2019年11月30日的季度内,我们对财务报告的内部控制 没有发生重大影响,也没有可能对财务报告的内部控制产生重大影响。
24
第二部分-其他资料
第二项-未登记的股本证券出售及收益使用
2019年9月10日,我们向公司简介(LLC)或公司简介发行了2,500股普通股(Br},用于支付根据我们与公司概况(2018年4月8日)和公司简介({BR}或信函协议)欠公司简介的投资者关系服务咨询费的一部分。
在2019年11月1日,我们发行了2500股我们的普通股到公司简介,以支付部分投资者关系服务顾问费,根据书面协议欠 公司简介。
我们根据1933年“证券法”第4(A)(2)节所载的豁免注册发行这些股份。
项目6-展品
| 数 | 陈列品 | |
| 10.1* | 日期为2019年12月19日的“就业协定”第一修正案于2019年5月16日由Oramed有限公司和Avraham Gabay公司和Avraham Gabay公司签署。 | |
| 10.2* | Oramed制药公司赔偿协议的代表形式。以及我们的每一位董事和官员。 | |
| 31.1* | 根据经修订的1934年“证券交易法”第13a-14(A)条和第15d-14(A)条认证首席执行官。 | |
| 31.2* | 根据经修订的1934年“证券交易法”第13a-14(A)条和第15d-14(A)条认证首席财务官。 | |
| 32.1** | 根据“美国法典”第1350条认证首席执行官。 | |
| 32.2** | 根据“美国法典”第1350条认证首席财务官。 | |
| 101.1* | 以下是公司截至2019年11月30日的第10-Q号季度财务报告中以XBRL格式编制的财务报表:(1)精简的综合资产负债表;(Ii)精简的综合亏损综合报表;(Iii)股东权益变动汇总表;(Iv)现金流动合并报表;及(V)精简的综合财务报表附注。 |
| * | 随函提交 |
| ** | 随函提供 |
25
签名
根据1934年“证券交易法”的要求,登记人已正式安排由下列签署人代表其签署本报告,并经正式授权。
| 奥雷德制药公司 | ||
| 日期:2020年1月9日 | 通过: | S/Nadav Kidron |
| 纳达夫·基隆 | ||
| 总裁兼首席执行官 | ||
| 日期:2020年1月9日 | 通过: | /s/Avraham Gabay |
| 阿夫拉姆·加贝 | ||
| 首席财务官 | ||
| (首席财务及会计主任) | ||
26